青稞抗旱基因HVUL1H24632.2 的功能验证
于明寨,杨春葆,巴桑玉珍
(省部共建青稞和牦牛种质资源与遗传改良国家重点实验室/西藏自治区农牧科学院农科研究所 西藏 拉萨 850032)
青稞占西藏农作物播种面积的一半以上,是西藏最主要的粮食作物。在青藏高原上,青稞的种植约有3500年的历史,具有广泛的药用以及营养价值,是西藏四宝之首糌粑的主要原料[1]。因此提高青稞品质产量对西藏农牧民增产增收具有重要意义[2]。
干旱是威胁世界作物栽培和生产的严重问题之一,是导致农作物减产的最严重制约因素,所造成减产超过其他非生物胁迫的总和。近年来,随着全球变暖的影响,降雨不规律以及用水不当都会导致全球农作物生产面临越来越严峻的干旱威胁,严重制约全球农业生产发展[3]。因此,从西藏农业发展以及西藏粮食安全来说,研究青稞对干旱胁迫的响应及机制都有非常重要的意义。
本研究以前序研究得到的转录组数据与全基因组甲基化数据为基础[4],挖掘其中差异表达的基因,并通过BLASTP 进行比对,对候选目的基因进行注释,选择水稻为受体材料,探究干旱胁迫对其生理、生化指标表达水平的影响[5],以期明确HVUL1H24632.2基因序列的生物学功能。
1 材料与方法
1.1 材 料
1.1.1 试验仪器
试验仪器主要有:NanoDrop™One/OneC 超微量紫外分光光度计,冷冻离心机,凝胶电泳仪,PCR仪,恒温水浴锅,摇床酶标仪(450 nm),高精度微量加样器及枪头(0.5~10 uL,2~20 uL,20~200 uL,200~1000 uL),37 ℃恒温箱等。
1.1.2 试验试剂
试验试剂包括:总RNA 提取试剂盒,Taq plus DNA 聚合酶,水饱和酚,cDNA 合成的反转录试剂盒,DNA Marker DL 2000,SYBR®Premix Ex TaqTM、植物(Plant)过氧化物酶(POD)-微量测试Kit,植物(Plant)超氧化物歧化酶(SOD)-微量测试Kit,植物(Plant)脯氨酸(proline)-微量测试Kit等。
1.1.3 试验材料
青稞种子、水稻种子;载体:pBWA(V)BSCCDB。
1.2 方 法
1.2.1 目的基因筛选
通过转录组数据与全基因组甲基化数据,挖掘其中差异表达基因,并通过BLASTP 进行比对,对候选目的基因进行注释。
1.2.2 RNA提取及cDNA合成
以RNAprep Pure 植物总RNA 提取试剂盒方法的方法来提取总RNA(表1)[6]。然后以Roche 公司反转录试剂盒的操作说明反转录获得cDNA(表2)[7]。

表1 总RNA提取

表2 反转录获取cDNA
1.2.3 目的基因的扩增
按照表3、表4 中的体系和程序对cDNA 进行PCR 扩增,扩增完的PCR 产物,用琼脂糖凝胶电泳进行检测[8]。然后用QIAquick®Gel Extraction Kit试剂盒对目的条带进行切胶回收纯化[9]。

表3 PCR反应体系(20 μL)

表4 PCR的反应程序
1.2.4 表达载体构建
用Eco31I 酶切载体pBWA(V)BS-CCDB,扩增的片段用Eco31I 进行酶切,回收后连接(表5)。将连接好的重组产物转化到DH5a 感受态细胞中[10],挑取单菌落进行菌落PCR 验证(表6)[11],最后将验证结果阳性的菌液送去测序。将测序正确的重组表达载体转化农杆菌EHA105。

表5 连接反应(10 μl)

表6 菌落阳性验证(20 μl)
1.2.5 抗性水稻苗的获取
通过农杆菌EHA105 侵染水稻愈伤组织的方法转化水稻。之后用抗性基因特异引物,常规PCR法扩增检测水稻苗是否含有抗性基因。然后对水稻苗进行转基因筛选鉴定[12]。
1.2.6 转基因幼苗的抗性鉴定
经过转基因阳性筛选,对转基因水稻和对照(非转基因水稻)采用21%PEG 进行模拟干旱处理。模拟干旱处理72 h 结束后,取叶片进行POD,SOD,Pro的检测。
2 结果与分析
2.1 候选基因分析
根据青稞基因组信息对HVUL1H24632.2 基因序列进行提取,基因序列如下:ATGTCGTCGGAGA AACAGGAGACGACGGCGGCGGTGCGCGTGCTGG GCAGATGGCGGAGCCCGTTCGTGATCCGGGTGCT GATAGCCCTTGGGCTCAAGGGCGTCGACCACGAG CTCGTGGAGGAGGCGATGGGCAACAAGAGCGAG CTGCTGCTCGCCTCCAACCCGGTGCACAAGATGA TCCCCGTGCTCCTGCACCACGGCAGGCCCGTCTC CGAGTCCCTCATCATCGTCCAGTACGTCGACGAG GCCTGGTCCTCCCATGCCCCGGCGCTCCTCCCGTC CGACCCCTACGCCCGGGCGGCCGAGCGGTTCTGG GCGCAGTACGTCGACGACAAGTTTCCTACGGCGA TCAGGGTGCTGAGGGGAAGGCTGGGCGGAGACA AGGACGAAGCGGCGGTCCAGGTTCGCGCTGCTCT GCAGCGCCTGGAAGTCGCCTTGGTCGAGTGCGGC GGAGGGAAGGATTACTTCGGCGGCGACGGCGTC GGTTACCTGGACATTGCTCTGGGGTCGCACCTCG GCTGGATCAGGGCCGTCGAGAGGATCGCTGAACT CAGGCTTCTCGACGAGGCCAAGGTTCCTAAGCTG GCCGCGTGGGCGGATCGGTTCTGCGCCCACCCGG CGGTGGCGGACGCGATGCCTGGCGTGGAAAGGT TCGTGGAGTTCAGCGTCAAGAATGACGGCGTTCT GAAGGCGGCTAGTGCTAATTCCAAGTGA。对其序列进行BLAST 分析,同源比对至tauschii glutathione S-transferase(谷胱甘肽转移酶)。谷胱甘肽S-转移酶普遍参与植物体内干旱、盐、低温、重金属等多种非生物胁迫的调节,是一种植物应对逆境时产生的多功能蛋白酶。当生物体遇到逆境时,谷胱甘肽转移酶发挥其抗氧化的作用,保护生物体免受逆境的损害,从而提供生物体抗逆能力[13]。因此同源分析显示该基因对于青稞抗旱具有重要作用。
2.2 重组载体酶切和测序验证
将PCR产物与载体框架进行酶切链接,构建重组载体,转化大肠杆菌后挑取菌落经PCR鉴定为阳性重组子的单菌落,接种到含卡那霉素的LB 液体培养基内,抽提质粒进行酶切鉴定,用1%琼脂糖凝胶电泳检测,结果见图1。重组质粒经酶切后得到片段大小,均与预期大小相符,通过测序比较,序列正确,证明载体构建成功。
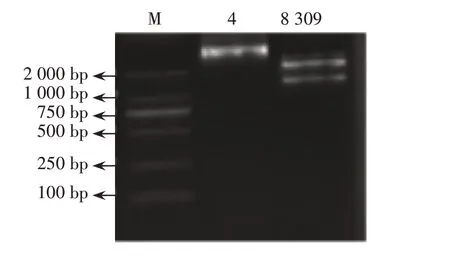
图1 琼脂糖凝胶电泳
2.3 菌落PCR检测
载体构建完成后进行农杆菌转化,对农杆菌进行菌落PCR 检测,结果如图2,结果显示已正确进行农杆菌转化。
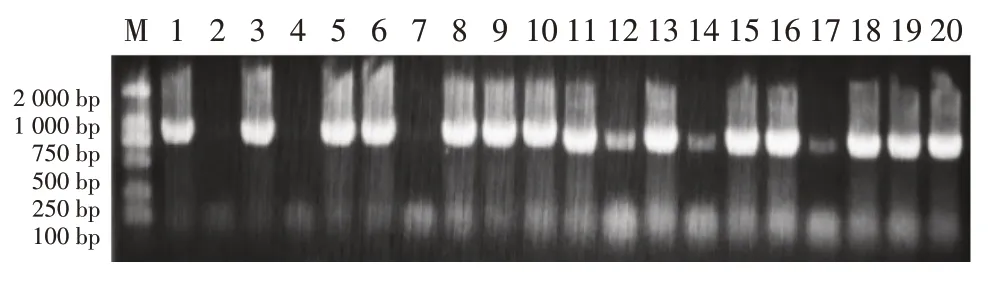
图2 菌落PCR检测结果
2.4 转基因抗性苗筛选基因鉴定
经过诱导转化的转基因株系进行抗性基因的筛选,结果显示转基因苗中都含有潮霉素抗性基因,证明转基因成功(图3)。

图3 转基因抗性苗筛选基因鉴定结果
2.5 对转基因F1检测
对转基因To进行自交,收获F1代,进行阳性检测,检测结果如图4。挑选阳性材料(有条带材料)进行模拟干旱处理。
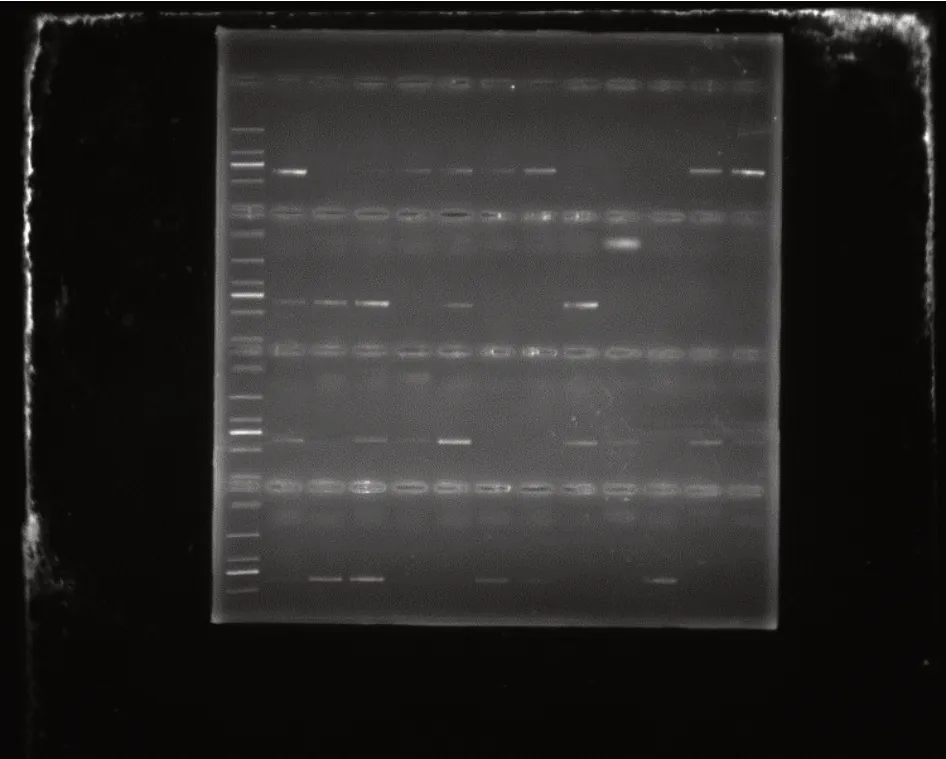
图4 F1代阳性检测结果
2.6 抗逆能力评估
试验对POD,SOD,Pro 进行测定,结果显示,对照(CK)组样品逆境处理下POD,SOD,Pro 明显上升,而转基因材料有一定程度上升,上升速度较慢,说明转基因水稻具有一定的抗逆能力(图5)。

图5 处理前后POD、SOD、Pro值的变化
3 结论
通过对HVUL1H24632.2基因的序列分析,评估其与谷胱甘肽转移酶(tauschii glutathione S-transferase)同源,初步评判其具有一定抗旱能力。随后通过载体构建与遗传转化,对获得的T0 植株进行检测,证明T0 转基因成功。随后通过繁种,对获得F1 的T1 代材料进行阳性检测,对其中阳性材料进行模拟干旱处理,结果显示POD,SOD,Pro 含量上升较慢,而对照POD,SOD,Pro 含量上升较快,表明转基因植株对干旱胁迫适应能力较强,植株对干旱胁迫具有一定抵抗能力,证明HVUL1H24632.2基因具有一定抗旱能力。

