不同贮藏温度对黄瓜花粉生活力的影响
洪嘉骏 牛欢欢 李征


摘要 首先对黄瓜花粉生活力的鉴定方法进行分析,随后对花粉管萌发检测方法进行了优化,包括最适蔗糖浓度、最适培养观察时间的筛选。结果表明不同蔗糖浓度的液体培养基对花粉生活力影响很大,以15%蔗糖+100 mg/kg硼酸效果最佳。培养时间方面,以培养1.5 h后观察花粉萌发状态最佳。随后,分析贮藏温度对黄瓜花粉生活力的影响。结果表明较于常温(25 ℃恒温贮藏)和-20 ℃恒温贮藏,4 ℃恒温贮藏能有效减缓花粉活性的下降速度。最后,比较了自交系与杂交商品种在不同贮藏条件下的花粉生活力。结果表明商品种相较于供试自交系,在相同贮藏条件下花粉萌发率较高,表明黄瓜花粉活性可能具有杂种优势效应。
关键词 黄瓜花粉;花粉生活力;花粉管萌发检测法;贮藏温度
中图分类号 S 642.2 文献标识码 A 文章编号 0517-6611(2021)20-0057-04
doi:10.3969/j.issn.0517-6611.2021.20.016
开放科学(资源服务)标识码(OSID):
Effect of Different Storage Temperatures on Viability of Cucumber Pollen
HONG Jia-jun, NIU Huan-huan, LI Zheng
(College of Horticulture, Northwest A&F Univeristy, Yangling, Shaanxi 712100)
Abstract The identification methods of cucumber pollen viability were compared and analyzed, and then the detection methods of pollen tube germination were optimized, including the selection of the optimal sucrose concentration and the optimal culture observation time. The results showed that the liquid medium with different sucrose concentration had a great influence on pollen viability, and 15% sucrose + 100 mg/kg boric acid was an optimal choice. In terms of culture time, pollen germination was the best after 1.5 h. Then, the effect of storage temperature on the viability of cucumber pollen was analyzed. The results showed that compared with normal temperature (25 ℃ storage) and -20 ℃ storage, 4 ℃ storage could effectively slow down the decline of pollen activity. Finally, the pollen viability of inbred lines and commercial hybrids under different storage conditions was compared. The results showed that the pollen germination rate of commercial varieties was higher than that of the tested inbred lines under the same storage conditions, indicating that the pollen activity of cucumber may have heterosis effect.
Key words Cucumber pollen;Pollen viability;Detection method of pollen tube germination;Storage temperature
作者簡介 洪嘉骏(1995—),男,辽宁铁岭人,硕士研究生,研究方向:黄瓜遗传育种。
*通信作者,教授,博士,博士生导师,从事黄瓜遗传育种研究。
收稿日期 2021-02-19
黄瓜是我国种植范围最广、面积最大的蔬菜之一。由于花器官发育的特殊性,黄瓜杂交制种一般使用人工授粉,父本花粉的质量是决定制种种子产量和品质的关键因素[1]。相较于其他葫芦科植物,黄瓜花粉产量较低,且活性衰减较快,花粉离体保存较为困难。生产中,黄瓜授粉能力和花粉活力与环境温度关系较大。黄瓜是喜温性植物,温度过高或过低均可以导致其授粉受精作用不良,进而影响产量和育种工作的顺利进行[2-3]。
目前对花粉萌发和授粉方面的研究,在牡丹[4]、大花蕙兰[5]等花卉植物中研究较多,相比较而言,在番茄[6-7]、西葫芦[8]、黄瓜[3]等蔬菜中研究较少。在多年生产实践中,发现进行黄瓜花粉的最适培养条件和贮藏条件的研究仍很有必要。这不仅可以用于黄瓜花粉的长期保存和远距离运输,同时也为开展如小孢子培养、花粉转染等生物技术试验提供材料保存方法的借鉴。笔者首先分析花粉生活力鉴定方法,筛选在液体培养条件下,花粉萌发率的最佳培养时长和培养基的最佳蔗糖浓度。随后选择1个黄瓜自交系和7个陕西地区主栽的杂交商品种为试材,分析不同保存温度对黄瓜花粉生活力的影响,较全面地分析影响黄瓜花粉离体保存的因素。
1 材料与方法
1.1 试验材料
黄瓜标准自交系CU 雌雄异花系,秋季雄花率较高,适于大量收集花粉,由西北农林科技大学黄瓜课题组保存。杂交黄瓜商品种选择陕西省关中地区目前主栽的商品种,包括津优1号、博耐5000、博耐35B、大宇园艺705、大宇园艺616、大宇园艺131、大宇园艺6-8。商品种由试验当地种子市场购得。
试验于2019年8—10月在西北农林科技大学泾阳蔬菜试验站进行。
1.2 试验方法
1.2.1 黄瓜花粉生活力鉴定方法比较。
黄瓜花粉的醋酸洋红染色法、亚历山大染色法、TTC( 5-氯化三苯基四氮唑)染色法和I-KI染色法分别参照Frescura等[9]、Alexander[10]、Norton[11]和Aslam等[12]的方法。花粉管萌发法采用李晓丽等[3]的方法。处理后的花粉样品置于光学显微镜观察、拍照并统计结果。
1.2.2 黄瓜花粉萌发最适蔗糖浓度液体培养基的筛选。
在含有100 mg/L硼酸水溶液中加入不同质量的蔗糖,配制蔗糖终浓度分别为0、5%、10%、15%、20%的5种液体培养基[3]。采摘当日盛开的黄瓜雄花,将花粉分别均匀散在4种液体培养基中,置于25 ℃、相对湿度80%的人工气候箱中培养2 h后,使用显微镜镜检观察。以花粉管萌发长度大于花粉粒直径为标准记录花粉萌发情况。随机选取3个视野统计花粉发芽率。
1.2.3 黄瓜花粉萌发最适观察时间的筛选。
采摘当日盛开的黄瓜雄花,将花粉均匀散在15%蔗糖浓度的液体培养基中,置于25 ℃、相对湿度80%的人工气候箱中。从处理0.5 h起,间隔0.5 h观察花粉萌发情况。随机统计3个视野并计算萌发率。
1.2.4 不同贮藏温度对黄瓜花粉生活力的影响。
采摘当日盛开的黄瓜雄花,取出花药干燥3~4 h。然后将所有干燥的花药分成3份,分别放入50 mL离心管中并贮存于-20、4和25 ℃条件下。处理开始0、3、6 h分别检测一次花粉生活力,从3种贮藏温度的花药中取出3~5颗花药,用毛笔轻刷,使花粉均匀散至培养基上。培养基配方为15%蔗糖+100 mg/L硼酸。将培养基置于25 ℃、相对湿度80%的人工气候箱中培养1.5 h后,在光学显微镜下观察3个互不重叠的视野。将花粉管萌发长度超过花粉直径的花粉粒认定为正常萌發。随后每天重复1次,观察花粉萌发情况。计算0 h的花粉平均萌发率,并以其为对照,计算其他处理时间点的相对萌发率。
1.3 数据统计与分析
数据采用Microsoft Excel进行统计,处理后的结果采用SPSS(17.0)软件按照邓肯法分析差异显著性。
2 结果与分析
2.1 黄瓜花粉生活力鉴定方法筛选
首先确定黄瓜花粉生活力的检测方法。使用I-KI、亚历山大、醋酸洋红染色法和花粉管萌发法分别检测黄瓜自交系花粉的生活力,结果见图1。I-KI溶液处理后,黄瓜花粉粒的染色情况存在明显差异,出现蓝黑色的花粉粒较少,表明黄瓜花粉的淀粉含量存在明显差异。另一方面,亚历山大和醋酸洋红溶液处理后,几乎所有黄瓜花粉粒均显现出紫红色和橘红色,表明绝大部分花粉粒的染色体成分是正常的。最后,使用花粉管萌发法检测供试黄瓜花粉,经初步条件摸索,结果发现可萌发花粉管的花粉粒约为70%,阳性花粉结果介于I-KI染色和亚历山大\醋酸洋红染色结果之间。基于此结果,认为染色法检测黄瓜花粉虽然操作简便,但结果并不准确,因此选择花粉管萌发法作为检测供试黄瓜花粉生活力的首选方法,并加以优化。
2.2 黄瓜花粉萌发的液体培养基蔗糖浓度筛选
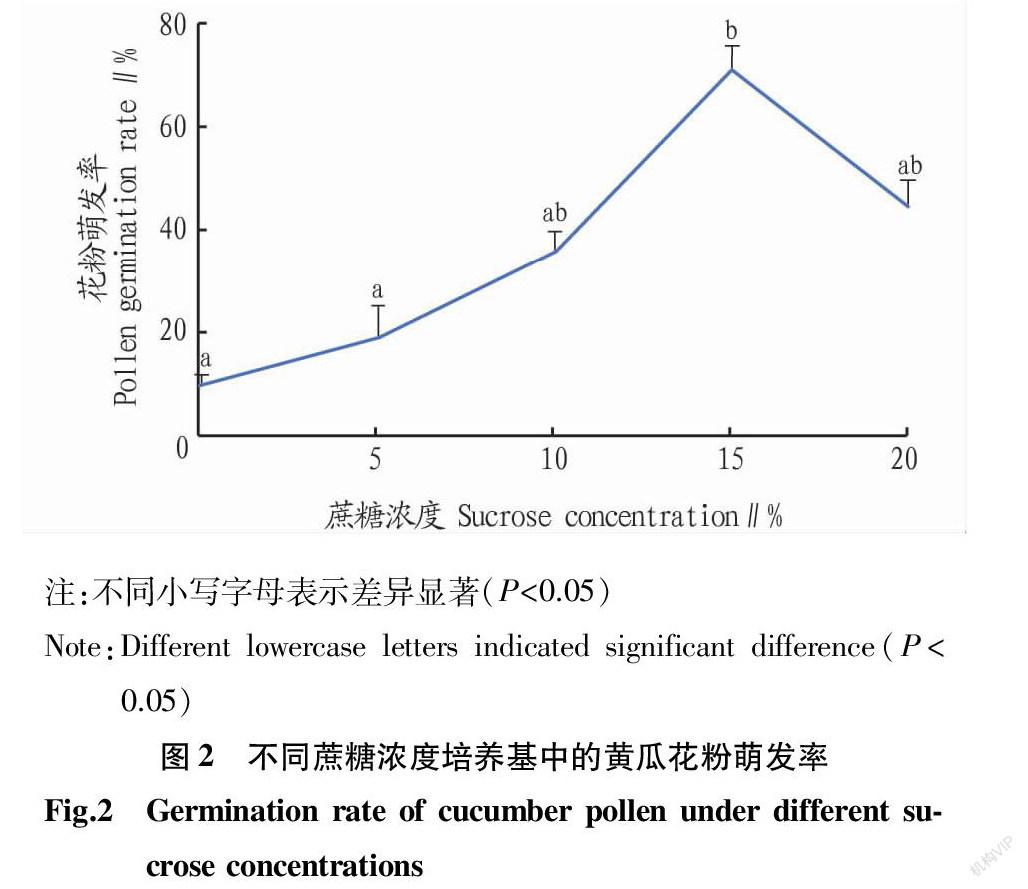
使用含有0、5%、10%、15%、20%的蔗糖培养基培养黄瓜自交系CU2的花粉,25 ℃、湿度80%的人工气候箱中培养2 h后,花粉在5种培养基中均能萌发,但萌发率差异显著(图2)。在不含蔗糖(0)的培养基中,花粉平均萌发率为10.00%。随着蔗糖浓度的提高,花粉萌发率逐渐上升,在5%和10%蔗糖浓度培养基中分别为19.20%和35.76%,在15%蔗糖浓度培养基中达到最高值71.40%。随后,花粉平均萌发率在20%蔗糖浓度培养基中出现下降,为45.00%。统计分析表明,培养基中的蔗糖浓度为15%时,花粉萌发率与无糖培养基及蔗糖浓度5%处理呈显著差异,而培养基中的蔗糖浓度为5%、10%和20%时差异不显著。同时,培养基中的蔗糖浓度为15%时,花粉萌发率高于其他处理。因此,15%蔗糖培养基是供试黄瓜材料花粉萌发的最适条件。
2.3 黄瓜花粉萌发时间的筛选
使用15%蔗糖浓度液体培养基,培养黄瓜自交系CU2的花粉,在25 ℃、湿度80%的人工气候箱中分别培养0.5、1.0、1.5和2.0 h后,观察花粉萌发情况。结果显示处理之间差异显著(图3)。培养0.5 h时花粉萌发率为0。在培养时间从0.5 h延长至1.5 h时,随着培养时间的增加花粉萌发率显著提高,分别为35.44%和66.63%。培养时间从1.5 h到2.0 h时,花粉萌发率增加并不显著,最终萌发率为67.63%。同时,发现培养2.0 h后,由于花粉管生长过长,导致数据统计时容易出现偏差。基于上述结果,认为培养1.5 h后观察花粉萌发情况是比较理想的试验条件,并在后续研究中加以应用。
2.4 不同贮藏温度对黄瓜花粉萌发的影响
采集黄瓜自交系CU2花药,经干燥处理后,贮藏于不同温度下观察其萌发率变化情况。由于干燥处理会影响花粉生活力,因此将干燥后未经贮藏的花粉萌发情况作为参照,计算其他贮藏条件下花粉相对萌发率。结果表明(表1),贮藏在25 ℃恒温下的花粉初期萌发情况最好,贮藏3 h后平均相对萌发率仍达84.68%。随后,在该温度下的萌发率快速下降,在贮藏6 h后花粉平均相对萌发率仅有40.99%,贮藏1 d后进一步下降为22.00%,三者之间有显著差异。贮藏2和3 d后花粉萌发率降为6.57%和2.87%,两者之间无显著差异。在4 ℃恒温贮藏的处理中,贮藏3 h、6 h和1 d后花粉平均相对萌发率分别为63.51%、57.34%和27.63%,前两者无显著差异,且与1 d处理有显著差异。进一步贮藏2和3 d后花粉萌发率均值分别为9.79%和4.34%,两者之间无显著差异。在-20 ℃恒温贮藏3 h、6 h、1 d、2 d和3 d后花粉平均相对萌发率分别为28.07%、19.18%、10.29%、6.11%和2.00%。
由图4可知,25 ℃恒温保存对黄瓜花粉的早期(3 h)伤害最低,但随着时间延长,该贮藏温度使得花粉生活力迅速下降。相比较而言,对于短期(1 d)保存黄瓜花粉,4 ℃恒温可以更好地保存花粉生活力。而-20 ℃恒温由于对花粉早期伤害较大,不具有明显的黄瓜花粉贮藏优势。进一步延长贮藏时间,发现无论以哪种温度保存花粉,贮藏2 d后花粉基本失去活性,表明单纯温度条件仍不足以长时间有效保存黄瓜花粉。
混合采集西安市大宇园艺系列品种、津优1号等黄瓜商品种的花粉,使用相同的贮藏温度进行处理,分析花粉平均相对萌发率的变化情况,结果表明(图5,表2),25 ℃恒温条件贮藏3 h花粉平均相对萌发率为80.69%,贮藏1 d后花粉萌发率均值为64.43%,贮藏2 d后花粉萌发率均值下降幅度较大,仅为4.23%,三者间有显著差异。而延长贮藏3和4 d后,花粉几乎完全失活。4 ℃恒温贮藏花粉萌发率下降幅度较小,同时花粉萌发率相对较高,贮藏 3 h、1 d、2 d的花粉平均相对萌发率均值分别为80.19%、77.66%、65.99%,三者之间无显著差异。贮藏时间延长至3和4 d后,花粉萌发率大幅度下降至12.84%和0.48%,两者之间无显著差异。-20 ℃恒温条件不利于花粉的贮藏,花粉萌发率下降速度较快,同时花粉活性也不高。贮藏3 h时花粉平均相对萌发率仅为42.98%,而1 d后下降至14.26%,贮藏2 d后的花粉萌发率为4.22%,三者之间有显著差异。继续贮藏3、4 d后花粉的萌发率分别为4.07%和2.33%,两者之间无显著差异。混合花粉的贮藏结果与黄瓜自交系的分析结果一致,25 ℃恒温条件有利于短时贮藏花粉,而4 ℃恒温条件长时贮藏花粉的效果相对较好。
3 讨论与结论
黄瓜是典型的单性花植物,雌雄蕊分别着生于独立的花器官中。黄瓜花器官较大,单瓜结籽率较高,又由于生产多使用穴盘育苗定植,用种量较小。这些原因促使黄瓜育种中多使用人工授粉。在授粉过程中往往涉及花期不遇、杂交父母亲本距离等问题,这是研究黄瓜花粉离体保存的一个重要原因。另外,近年来,利用花粉为媒介进行遗传转化的工作已逐渐成为研究热点[13],而花粉离体保存也是这些研究的前提条件。相较于西瓜、南瓜等其他葫芦科植物,黄瓜的花药体积较小,开裂并不充分,散粉能力较差,大量获得花粉相对困难,因此研究如何高效地保存其花粉显得更为重要[3]。
为了研究贮藏花粉生活力的变化情况,首先比较了黄瓜花粉生活力的检测方法。先后分析了I-KI、亚历山大、醋酸洋红、TTC 4种溶液的染色效果,发现其结果并不一致。其中,亚历山大、醋酸洋红溶液的染色结果阳性率非常高,I-KI溶液染色的阳性率较差。然而,令人意外的是,TTC溶液并不能获得任何阳性结果(结果未显示)。进一步使用甜瓜、西瓜、西葫芦分别进行上述溶液的染色分析,获得的结果与黄瓜中基本一致。考虑到4种溶液染色的机理,推测葫芦科花粉(包括供试的黄瓜、甜瓜、西瓜、西葫芦)中淀粉含量和呼吸活性相对较低,其花粉生活力不适宜使用I-KI和TTC染色进行检测。为了获得准确的花粉生活力结果,最后采用花粉管萌发法进行检测。经优化条件,發现供试黄瓜天然花粉的萌发率约为70%,远高于I-KI溶液的染色结果,但明显低于亚历山大、醋酸洋红溶液的染色结果。由此认为,在该研究中,花粉管萌发法是检测黄瓜花粉生活力的唯一可靠方法。
培养基中蔗糖浓度过高或过低都不利于花粉管的萌发,发现黄瓜花粉在蔗糖浓度为15%的液体培养基中具有较高的萌发能力。当然,由于所选择蔗糖浓度梯度的原因,不排除在15%左右范围内更适合的蔗糖浓度,未来需要更精细的试验检验该结果。使用液体培养基培养花粉,当培养时间在1.5 h左右时花粉萌发率较高。当培养时间继续延长时(1.5~2.0 h)花粉萌发情况增加不明显,但已萌发的花粉管伸长较为显著,对结果观察统计产生明显阻碍,因此,认为选择培养1.5 h后观察黄瓜花粉(管)萌发情况较为合适,能够有较好的观察效果。
在不同温度贮藏黄瓜花粉研究中,发现无论是自交系还是黄瓜商品种的混合花粉,25 ℃恒温贮藏均可短时保存花粉,但长时保存花粉萌发率下降较快;4 ℃恒温贮藏能较好的长时间保持花粉活性;-20 ℃恒温贮藏花粉能最大化减缓花粉萌发率的下降速度,但花粉初始萌发率较低。25 ℃处理的结果表明,在正常生理条件下,干燥黄瓜花粉活性丧失较快,与文献[1-3]和育种实践的经验观察一致。详细分析-20 ℃处理的结果可以发现,在该温度下花粉生活力的下降最缓慢,只是由于低温对花粉的初始伤害较大,导致该温度处理不能有效保存黄瓜花粉。推测该现象可能是由于花粉的干燥处理不够彻底造成的。
比较有趣的现象是,黄瓜商品种的花粉与自交系相比,虽然短时贮藏相对萌发率(25 ℃处理3 h时分别为80.69%和84.68%)差异不大,但贮藏时间延长后表现出明显的优势,25 ℃处理1 d时萌发率分别为64 .43%和22.00%,4 ℃处理1 d时萌发率分别为77.66%和27.63%。进一步延长时间,发现商品种的花粉甚至在4 ℃处理2 d时仍能保持相对理想的萌发率(65.99%)。推测黄瓜花粉的这一现象可能与商品种的杂合遗传背景有关,可能涉及杂种优势现象,需要进一步研究。
综合该研究结果,认为黄瓜花粉生活力的最适检测方法是花粉管萌发法,该方法使用的液体培养基中蔗糖的最适浓度是15%,最适培养时间是1.5 h。干燥黄瓜花粉短时(1 d以内)保存可以选择25 ℃,延长(2 d以内)保存应选择4 ℃。
参考文献
[1] 李光,邓强,魏爱民,等.贮藏温度对黄瓜花粉活力的影响[J].中国蔬菜,2007(9):22-24.
[2] 易成龙,俞源.低温保持黄瓜花粉萌发力试验初报[J].长江蔬菜,2009(15):37-38.
[3] 李晓丽,闫立英,冯志红,等.黄瓜花粉生活力的研究[J].北方园艺,2008(3):24-26.
[4] 贾文庆,张少伟,刘露颖,等.不同培养基和贮藏方法对矮牡丹花粉萌发的影响[J].西南农业学报,201 26(1):338-341.
[5] 王利民,王四清,王彩霞,等.大花蕙兰花粉离体萌发试验初报[J].中国农学通报,2005,21(4):122-12 161.
[6] 閆立英,冯志红,张慎好,等.番茄花粉生活力研究[J].种子,2005,24(6):23-26.
[7] 黄艳慧,李亚灵,温祥珍.高温下不同空气湿度对温室番茄花粉活力和坐果率的影响[J].西北农业学报,201 20(11):105-110.
[8] 许利彩,李海真,沈火林.西葫芦花粉生活力测定方法及最佳授粉时间的研究[J].河南农业科学,2009,38(8):120-124.
[9] FRESCURA V D S,LAUGHINGHOUSE H D IV,DO CANTO-DOROW T S,et al.Pollen viability of Polygala paniculata L.(Polygalaceae)using different staining methods[J].Biocell,201 36(3):143-145.
[10] ALEXANDER M P.Differential staining of aborted and nonaborted pollen[J].Stain Technol,1969,44(3):117-122.
[11] NORTON J D.Testing of plum pollen viability with tetrazolium salts[J].Proc Amer Soc Hort Sci,1966,89:132-134.
[12] ASLAM M,BROWN M S,KOHEL R J.Evaluation of seven tetrazolium salts as vital pollen stains in cotton Gossypium hirsutum L.[J].Crop Sci,196 4(5):508-510.
[13] ZHAO X,MENG Z G,WANG Y,et al.Pollen magnetofection for genetic modification with magnetic nanoparticles as gene carriers[J].Nat Plants,2017,3(12):956-964.

