绵羊BMPR2基因组织表达及其多态性与产羔数的相关性分析
文禹粱 郭晓飞 马琳 张效生 张金龙 赵生国 储明星

摘要 [目的] 為探讨骨形态发生蛋白2型受体(bone morphogenetic protein receptor BMPR2)基因在卵泡期和黄体期及单羔和多羔小尾寒羊组织表达特征及其多态性与小尾寒羊产羔数之间的关系。[方法] 采用qPCR技术检测BMPR2基因在小尾寒羊14种组织中的表达模式。同时,使用Sequenom MassARRAYSNP技术对BMPR2基因3个单核苷酸多态性(single nucleotide polymorphism,SNP)位点在6个绵羊品种中的多态性进行检测,并与小尾寒羊产羔数进行关联。[结果] BMPR2在14种组织中呈广谱表达,其中在肺脏、大脑、肝脏以及下丘脑组织高表达;BMPR2在卵泡期多羔组下丘脑-垂体-卵巢组织中的表达量均高于单羔组。BMPR2基因g.203707935A>G和g.203708072T>C位点在单、多羔绵羊品种间的等位基因频率差异显著(P<0.05)。通过相关分析发现,g.203708352A>G位点与小尾寒羊三胎产羔数显著相关(P<0.05),野生型产羔数显著高于杂合型。通过对该位点不同基因型与小尾寒羊FecB基因型复合分析发现,3种复合基因型与小尾寒羊三胎产羔数显著关联(P<0.05),AA-GG基因型产羔数显著高于AA-AG和AA-AA基因型,推测该位点突变可能削弱了FecB基因信号强度,导致产羔数下降。[结论] BMPR2基因g.203708352A>G位点与小尾寒羊产羔数呈显著负相关,为小尾寒羊产羔性状选育提供了参考依据。
关键词 绵羊;BMPR2基因;组织表达;单核苷酸多态性(SNP)
中图分类号 S 826 文献标识码 A
文章编号 0517-6611(2021)20-0098-07
doi:10.3969/j.issn.0517-6611.2021.20.026
开放科学(资源服务)标识码(OSID):
Tissue Expression of BMPR2 Gene and Correlation Analysis of Its Polymorphism with Litter Size in Ovis aries
WEN Yu-liang GUO Xiao-fei3,MA Lin1 et al (1.Key Laboratory of Animal Genetics,Breeding and Reproduction of Ministry of Agriculture and Rural Affairs,Institute of Animal Sciences,Chinese Academy of Agricultural Sciences,Beijing 100193;2.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou,Gansu 730070;3.Tianjin Institute of Animal Sciences,Tianjin 300381)
Abstract [Objective] To investigate the expression features of bone morphogenetic protein receptor 2 gene (BMPR2) in various tissues of Small Tail Han (STH) ewes during different physiological periods (follicular and luteal phases) and with different fecundity (monotocous and polytocous ewes),and analyze the correlation between its polymorphism with litter size in STH sheep.[Method] qPCR technology was used to detect the expression model of BMPR2 in 14 kinds tissues of STH sheep.Sequenom MassARRAYSNP assay was applied to detect three single nucleotide polymorphism (SNPs) of BMPR2 in six sheep breeds,and then the correlation between BMPR2 polymorphism and litter size in STH sheep was analyzed.[Result]BMPR2 gene was expressed in all selected tissues of STH sheep and highly expressed in the lung,brain,liver and hypothalamus tissues,and the expression of BMPR2 in hypothalamus,pituitary,and ovary of polytocous ewes was higher than that of monotocous ewes at follicular phase.The allele frequencies of g.203707935A>G and g.203708072T>C loci of BMPR2 were significantly different (P<0.05) between monotocous and polytocous sheep breeds.The correlation analysis showed that g.203708352A>G locus of BMPR2 had significant negative effects on litter size of STH sheep, the litter size of wild type was significantly higher than heterozygote genotype (P<0.05).The combination analysis of g.203708352A>G locus of BMPR2 and FecB (A746G) showed that the litter size of AA-GG genotype was significantly higher than that of AA-AG and AA-AA genotypes (P<0.05).Therefore,it was speculated that g.203708352A>G locus mutation might weaken the downstream signal intensity of FecB,resulting in the decrease of litter size.[Conclusion]The SNP locus of g.203708352A>G in BMPR2 might have negative significant association with the litter size of STH sheep.The present study provided the reference basis for lambing traits selection of STH sheep.
Key words Sheep;Bone morphogenetic protein receptor 2 gene;Tissue expression;Single nucleotide polymorphism (SNP)
基金项目
国家自然科学基金项目(31772580);农业农村部动物遗传育种与繁殖(家禽)重点实验室开放课题(poultrylab2019-10);天津市农业科学院青年科研人员创新研究与实验项目(201915);国家肉羊产业技术体系专项(CARS-38);中国农业科学院科技创新工程项目(ASTIP-IAS13);天津市農业科技成果转化与推广项目(201704020)。
作者简介 文禹粱(1993—),男,河南新乡人,博士研究生,研究方向:动物分子遗传学研究。*通信作者,赵生国,教授,博士,从事动物遗传资源研究;储明星,研究员,博士,从事羊优异繁殖性状的分子机理研究。
收稿日期 2020-12-16
绵羊产羔性状是重要的经济性状之一,遗传力较低,受遗传、环境和激素水平等多种因素的调控,但产羔对遗传进展的经济效益贡献高达96%,因此挖掘和鉴定绵羊产羔相关的主效基因和多态位点可给羊产业带来巨大的经济效益[1-2]。标记辅助选择(marker assisted selection,MAS)技术在低遗传力性状的选择上应用广泛,因此为标记辅助选择筛选有效的多态位点显得尤为重要。鉴于全基因组重测序技术是挖掘功能基因最有效的方式之一[3-5]。中国农业科学院北京畜牧兽医研究所肉羊遗传育种团队前期对10个绵羊品种共99个个体进行全基因组重测序,并按照单、多羔进行分组,使用Fst方法基于Oar_3.1版本筛选获得可能与绵羊产羔数相关的基因BMPR2及其g.203707935A>G、g.203708072T>C和g.203708352A>G共3个SNPs位点[6]。
BMPR2是骨形态发生蛋白(bone morphogenetic proteins,BMPs)家族成员之一,为70 ku的膜蛋白受体,具有丝氨酸/苏氨酸蛋白激酶活性[7-8]。其被定位于绵羊2号染色体,编码区全长3 117 bp,包含13个外显子,共编码1 038个氨基酸。研究发现,BMPR2通过BMP/SMAD信号通路发挥生物学作用[9-11]。该通路被广泛认为与哺乳动物卵巢颗粒细胞增殖、生殖激素的合成与分泌以及卵母细胞成熟和排卵等生理活动息息相关[12],其主要通过调节促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)诱导的垂体中相关促性腺激素基因的表达调控,影响促卵泡素(follicle-stimulating hormone,FSH)、促黄体素(luteinizing hormone,LH)以及雌二醇(estradiol,E2)等生殖激素的合成和分泌,进而调控动物的排卵活动[13-14]。BMPR2是BMP家族2型受体,而BMP家族中的骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)与小尾寒羊产羔数显著相关[15]。作为BMP家族另外一种受体,骨形态发生蛋白1型受体(bone morphogenetic protein receptor 1B,BMPR1B)基因已被鉴定为调控绵羊多羔性状的主效基因[16],其增加1个拷贝数,布鲁拉美利奴羊的排卵数和产羔数分别增加1.65个和0.67只[17]。这说明BMP家族在调控绵羊产羔性状上发挥着积极作用。Takeda等[18]对小鼠促性腺激素LβT2细胞的研究发现BMPR2参与BMP诱导的FSH转录调控,并且BMP6和BMP7的mRNA含量因BMPR2对GnRH诱导的ERK信号通路的影响而有所差异。BMPR2基因在人、小鼠、牛以及绵羊卵母细胞和颗粒细胞中表达,并且在卵巢原发性、继发性以及窦状卵泡颗粒细胞发挥积极作用[19-23]。Costa等[24]在山羊卵巢中研究发现BMPR2在直径0.2 mm的卵泡中mRNA表达水平显著高于直径0.1 mm的卵泡。综上可知,对参与BMP信号通路的BMPR2基因进行研究将有助于更好地理解绵羊的产羔机制。笔者以单羔、多羔小尾寒羊为试验材料,利用实时荧光定量 PCR(qPCR)技术检测BMPR2基因在小尾寒羊14种组织中的表达特征,并对筛选的3 个SNPs采用Sequenom MassARRAYSNP技术在6个绵羊品种中分型,再与小尾寒羊产羔数进行相关性分析,以探讨BMPR2基因表达及其多态性与绵羊产羔数之间的关系,为更好地阐释绵羊产羔机制奠定基础。
1 材料与方法
1.1 样本采集
试验羊只来自山东省郓城县小尾寒羊种羊场,在经过FecB分型(FecB++型)的3岁健康小尾寒羊母羊中,根据产羔记录随机挑选单羔和多羔母羊各6只,运输到天津市畜牧兽医研究所种羊场饲养。对上述12只小尾寒羊母羊放置阴道孕酮栓塞(controlled internal device release,CIDR)实施同期发情试验,放栓时长12 d,撤栓后用腹腔镜观察卵泡发育和排卵情况,并使用公羊试情以确定母羊发情状态和采样时间,分别在撤栓后45 h(卵泡期)和10 d(黄体期)进行屠宰。采集心、肝、脾、肺、肾、甲状腺、肾上腺、大脑、小脑、下丘脑、垂体、卵巢、子宫和输卵管共14种组织样品。将采集的新鲜组织放入2 mL的RNase-Free冻存管并迅速放入液氮罐中,然后转移至 -80 ℃冰箱中贮存备用。
1.2 血液DNA和组织RNA的提取和检测
绵羊血液DNA和组织RNA的提取方法参照DNA、RNA提取试剂盒(北京天根科技有限公司)说明书。利用Nanodrop2000微量分光光度计(Nano Drop Technologies,美国)检测提取DNA、RNA样本浓度和OD值,利用1.5%的琼脂糖凝胶电泳对DNA、RNA质量进行检测。
1.3 引物设计及cDNA合成
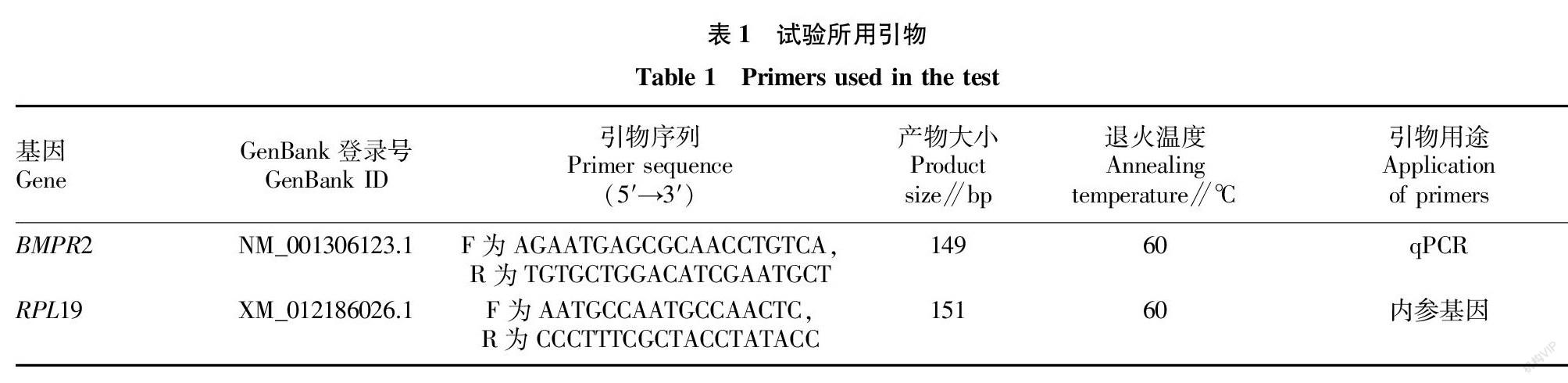
根据GenBank提供的绵羊BMPR2编码区序列,利用Primer Premier 3.0软件设计跨外显子引物,由北京天一辉远生物科技有限公司合成。引物信息详见表1。
利用反转录试剂盒(PrimeScriptTM RT Reagent Kit,TaKaRa,日本)合成cDNA,反转录反应体系(20 μL)参考文禹粱等[15],全程操作在冰上进行。反应条件如下:37 ℃ 15 min,85 ℃ 5 s,对反转录产物进行鉴定后,将符合标准的cDNA保存于-20 ℃冰箱中备用。
1.4 荧光定量PCR(qPCR)
荧光定量检测利用Roche Light Cycler480 Ⅱ 型荧光定量PCR仪进行。反应体系(20 μL)和反应程序参考文禹粱等[15]相关报道。将备用cDNA 样本5倍稀释后,以2倍梯度稀释获得稀释倍数为1~128倍共8个浓度样品,用于标准曲线的绘制;用上述cDNA作为模板,对BMPR2和RPL19分别进行qPCR分析。
1.5 基因分型
采用Sequenom MassARRAYSNP技术对BMPR2基因g.203707935A>G、g.203708072T>C和g.203708352A>G位点在不同产羔数的绵羊品种中进行分型。分型样品为704个不同品种绵羊血样,包括83只湖羊、68只策勒黑羊、23只滩羊、70只苏尼特羊和80只草原型藏羊以及有产羔数记录的380只小尾寒羊。其中,小尾寒羊、湖羊和策勒黑羊为多羔品种,其他均为单羔品种。分型的具体步骤参考马晓萌等[25]相关报道。分型样品为DNA,质量浓度为40~80 ng/μL,每个样品用量为20 μL。
1.6 数据统计与分析
采用2-△△Ct法[26]计算目的基因相对表达量。利用SPSS 22.0(IBM,美国)统计软件进行单因素方差分析,并利用最小显著差异(least significant difference,LSD)法进行多重比较。应用Microsoft Excel 2016(Microsoft Excel,美国)软件统计绵羊BMPR2基因共3个SNPs位点基因型频率、等位基因频率、多态信息含量(polymorphism information content,PIC)、杂合度(heterozygosity,He)和有效等位基因数(number of effective alleles,Ne),计算公式参考Guo等[27]相关报道,随后进行哈代-温伯格平衡(Hardy-Weinberg equilibrium,HWE)检测。BMPR2不同基因型与产羔性状的相关性分析模型参考文禹粱等[15]相关报道。
2 结果与分析
2.1 DNA检测
提取不同品种绵羊血液基因组 DNA,并进行1.5%的琼脂糖凝胶电泳检测,结果如图1所示。血液基因组DNA条带单一且无杂带,浓度与纯度均表现良好,可满足后续试验要求。
2.2 RNA检测
提取小尾寒羊14种组织的总RNA,并使用1.5%的琼脂糖凝胶电泳检测其质量。如图2A所示,提取的组织总RNA无明显降解,28S和18S条带清晰可见,灰度值约2∶1。利用Nanodrop2000微量分光光度计检测提取RNA样本浓度和OD值,OD260/OD280均在1.9~2. 说明提取的RNA纯度较高。以反转录之后的cDNA为模板对RPL19基因进行扩增,结果如图2B所示,可见RPL19基因在14种组织中扩增效果良好,满足qPCR试验要求。
2.3 BMPR2基因的组织表达
2.3.1 BMPR2基因在卵泡期不同组织间的表达模式。
作为BMP/SMAD通路唯一的2型受体,BMPR2在14种组织中广谱表达,无组织特异性(图3)。以垂体组织中的BMPR2基因mRNA的相对表达量作为参照,在肺脏、大脑、肝脏以及下丘
脑中的相对表达量较高,分别为垂体组织表达量的18.71倍、15.26倍、13.82倍和11.90倍,差异均达到极显著水平(P<0.001)。BMPR2基因在卵巢、子宫和输卵管中的表达量分别为垂体的2.73倍(P=0.48)、3.64倍(P=0.29)和3.43倍(P=0.32)。
2.3.2 BMPR2基因在性腺轴组织间的表达模式。
对BMPR2在不同生理时期单羔和多羔组的表达模式进行了研究(图4)。结果显示,多羔组BMPR2在卵泡期下丘脑、垂体和卵巢组织中的相对表达量均高于单羔组,而多羔组BMPR2在黄体期下丘脑组织中的相对表达量低于单羔组,但差异均未达到显著水平(P>0.05)。
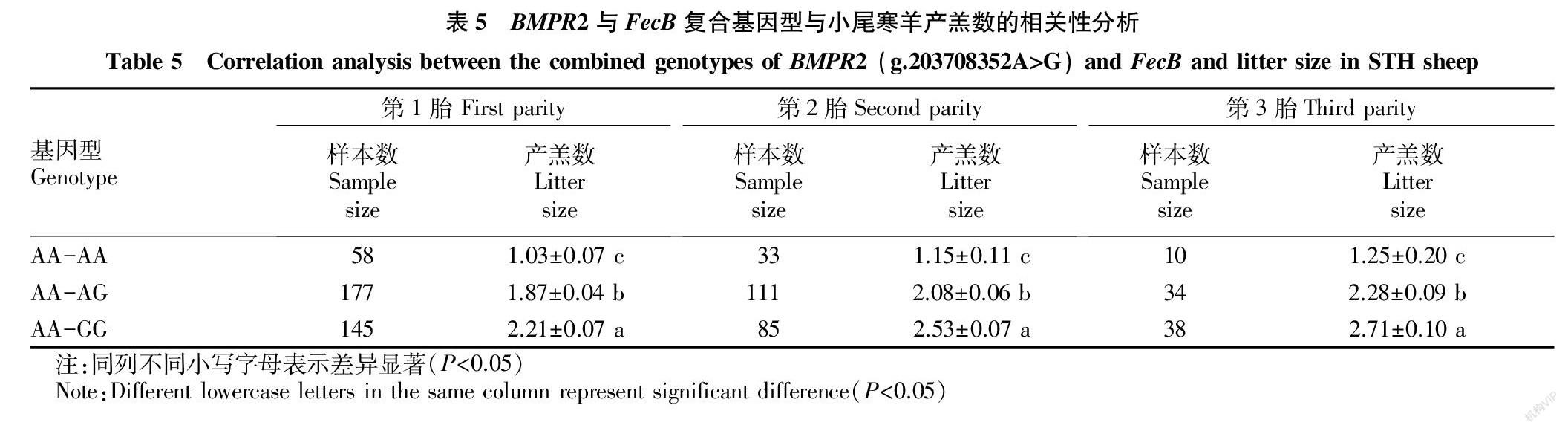
2.4 BMPR2基因多态性 BMPR2基因g.203707935A>G(a)、g.203708072T>C(b)和g.203708352A>G(c)分型结果如图5所示。
由表2可知, BMPR2基因g.203707935A>G和g.203708072T>C位点在单、多羔绵羊品种间的等位基因频率存在显著差异(P<0.05)。
由表3可知,g.203707935A>G位点除在小尾寒羊中处于中度多态(0.25 多态(PIC<0.25);g.203708072T>C位点在6个绵羊品种中均处于中度多态(0.25 2.5 BMPR2基因多态性与小尾寒羊产羔数的关系 由表4可知,BMPR2基因g.203708352A>G位点的突变与小尾寒羊三胎产羔数显著相关(P<0.05),野生型产羔数显著高于杂合型。对该位点不同基因型与小尾寒羊FecB基因型进行复合,共产生3种基因型(表5),且与小尾寒羊三胎产羔数显著关联(P<0.05)。AA-GG基因型产羔数显著高于AA-AG和AA-AA基因型。 3 讨论 为理解绵羊产多羔的分子机制,育种专家一直致力于寻找影响绵羊产羔数的关键基因。迄今为止,BMPR1B、骨形态发生蛋白15(bone morphogenetic protein 15,BMP15)、生长分化因子9(growth differentiation factor 9,GDF9)已被鉴定为影响绵羊产羔数的主效基因[28-31]。但相对于中国巨大的羊产业来说还相对较少,因此寻找影响绵羊产羔相关主效基因依然是长久且明确的目标[32]。BMPR2作为BMP通路唯一的2型受体在哺乳动物卵泡发育和卵巢颗粒细胞增殖等方面均发挥着重要作用[33-34]。目前其对绵羊产羔数的影响还尚未报道。该研究选择全基因组重测序技术筛选获得的BMPR2基因,首次对BMPR2基因在小尾寒羊各组织mRNA水平和多态性进行分析,并探讨其与绵羊产羔之间的关系。 3.1 BMPR2基因组织表达对动物繁殖活动的影响 该研究发现BMPR2基因在卵泡期小尾寒羊14种组织呈广谱表达,且在卵泡期多羔组下丘脑-垂体-卵巢组织表达均高于单羔组,表明其对小尾寒羊各项器官正常的生理功能起重要调节作用,特别是在哺乳动物卵巢发育以及性激素分泌方面。FSH、LH和E2作为衡量卵巢功能的重要激素,对卵巢功能和排卵有着重要调节作用。研究发现,BMPR2在卵泡发育的各个阶段均可以被检测到,并且在性激素的分泌、卵巢的发育、卵泡生长以及颗粒细胞增殖方面有重要促进作用[18,35]。Liu 等[30]研究发现,BMPR2作为受体,对牛卵泡生长和颗粒细胞增殖有促进作用。BMPR2在优势卵泡(d>13 mm,E2>180 ng/mL)颗粒细胞和卵泡膜细胞中的mRNA是其他卵泡类型的1.5~2.0倍[35],在牛卵泡细胞中添加BMPR2可使卵泡直径显著增加[36]。Foroughinia等[37]研究发现BMPR2在母绵羊高繁殖力组卵泡的表达量极显著高于低繁殖力组,且在卵巢组织的表达趋势与在卵泡组织中相似,但差异不显著。这与该研究在卵泡期下丘脑、垂体和卵巢组织中BMPR2的表达模式相符。Hu等[38]通过对芬兰羊进行高通量转录组学测序发现,BMPR2基因在高繁殖力组表达量显著高于低繁殖力组。由此可见,BMPR2作为配体基因,积极参与哺乳动物的生理生殖活动,在卵巢功能调控特别是激素分泌方面有一定的促进作用。 3.2 BMPR2基因多态性与小尾寒羊产羔数的相关性分析 这3个SNP位点均位于绵羊2号染色体BMPR2基因第12个外显子上,且在NCBI网站中已有报道,但与绵羊产羔数关联分析尚未见文献报道。g.203707935A>G和g.203708072T>C位点在单、多羔绵羊品种中的等位基因频率均存在显著差异,初步表明这些位点与绵羊产羔数有关。3个SNP位点在各绵羊品种中的选择潜力不尽相同,这可能是因为某些品种数量相对较少,或某些品种遗传多样性相对较低[39]。g.203708352A>G位点与小尾寒羊产羔数显著相关(P<0.05),野生型产羔数显著高于杂合型,暗示该位点突变可能在一定程度上对绵羊排卵数起抑制作用,这可能是因为该位点的错义突变使得蛋白质序列第581位异亮氨酸置换为缬氨酸所导致。FecB基因作为影响绵羊产羔数的主效基因,是由于BMPR1B编码区发生了A746G突变,导致第249位的氨基酸由谷氨酰胺变为精氨酸 (Q249R),从而提高了绵羊排卵数和产羔数[23,40]。BMPR1B为BMP的1型受体,其突变后增加了信号转导过程对下游受体的信号强度,导致卵泡早熟、排卵数增加[40]。据此可推测出g.203708352A>G位点的突变可能影响了FecB基因效应,从而导致产羔数下降。将该位点与 FecB各基因型进行复合分析发现,3种复合基因型与小尾寒羊三胎产羔数显著关联(P<0.05),AA-GG产羔数显著高于AA-AG和AA-AA基因型。据此可推测出g.203708352A>G位点突变拷贝数的增加可能对FecB基因效应有一定的抑制作用,从而削弱了BMP下游信号选择强度,进而影响卵泡发育、成熟以及排卵整个生理过程,最终导致排卵数减少、产羔数降低。 4 结论 该研究发现BMPR2基因表达与绵羊产羔数存在一定程度的负相关,基因分型发现g.203708352A>G位点的突变可显著减少小尾寒羊产羔数,推测该位点对小尾寒羊产羔数的调控可能是通过影响FecB基因效应来实现的。 参考文献 [1] BRAVO S,LARAMA G,PAZ E,et al.Polymorphism of the GDF9 gene associated with litter size in Araucana creole sheep[J].Anim Genet,2016,47(3):390-391. [2] 张军霞,乐祥鹏,王维民,等.绵羊KITLG基因的表达及其多态性与产羔性状关联分析[J].农业生物技术学报,2017,25(6):893-900. [3] 宋娜娜,钟金城,柴志欣,等.三江黄牛全基因組数据分析[J].中国农业科学,2017,50(1):183-194. [4] YANO K,YAMAMOTO E,AYA K,et al.Genome-wide association study using whole-genome sequencing rapidly identifies new genes influencing agronomic traits in rice[J].Nat Genet,2016,48(8):927-934. [5] 潘章源,贺小云,刘秋月,等.全基因组测序(WGS)在畜禽群体进化和功能基因挖掘中的应用[J].农业生物技术学报,2016,24(12):1945-1954. [6] PAN Z Y,LI S D,LIU Q Y,et al.Whole-genome sequences of 89 Chinese sheep suggest role of RXFP2 in the development of unique horn phenotype as response to semi-feralization[J].Gigascience,2018,7(4):1-15. [7] EMMERSON P J,DUFFIN K L,CHINTHARLAPALLI S,et al.GDF15 and growth control[J].Front Physiol,2018,9:1-7. [8] WOZNEY J M,ROSEN V,CELESTE A J,et al.Novel regulators of bone formation:Molecular clones and activities[J].Science,1988,242(4885):1528-1534. [9] TAN S,FENG B Y,YIN M Z,et al.Stromal Senp1 promotes mouse early folliculogenesis by regulating BMP4 expression[J].Cell Biosci,2017,7(1):1-12. [10] 徐業芬.Smad信号转导通路相关基因表达与湖羊高繁殖力关系的研究[D].南京农业大学,2010. [11] CANTY-LAIRD E,CARR G A,MANDON-PPIN B,et al.First evidence of bone morphogenetic protein 1 expression and activity in sheep ovarian follicles[J].Biol Reprod,2010,83(1):138-146. [12] 文禹粱,马琳,赵生国,等.Bmp/Smad信号通路及其在哺乳动物卵巢发育中的作用[J].中国畜牧杂志,2019,55(8):13-19. [13] REGAN S L,KNIGHT P G,YOVICH J L,et al.Infertility and ovarian follicle reserve depletion are associated with dysregulation of the FSH and LH receptor density in human antral follicles[J].Mol Cell Endocrinol,2017,446:40-51. [14] SIRARD M A.Somatic environment and germinal differentiation in antral follicle:The effect of FSH withdrawal and basal LH on oocyte competence acquisition in cattle[J].Theriogenology,2016,86(1):54-61. [15] 文禹粱,王翔宇,郭晓飞,等.不同产羔数小尾寒羊BMP4基因表达及其错义突变与产羔数关联分析[J].农业生物技术学报,2019,27(1):80-88. [16] 陶林,郭晓飞,文禹粱,等.FecB突变对小尾寒羊卵泡发育及AMH和AMHR2基因表达的影响[J].农业生物技术学报,2019,27(4):684-691. [17] FOGARTY N M.A review of the effects of the Booroola gene (FecB) on sheep production[J].Small Rumin Res,2009,85(2/3):75-84. [18] TAKEDA M,OTSUKA F,TAKAHASHI H,et al.Interaction between gonadotropin-releasing hormone and bone morphogenetic protein-6 and -7 signaling in LβT2 gonadotrope cells[J].Mol Cell Endocrinol,201 348(1):147-154. [19] SELVARAJU S,FOLGER J K,GUPTA P S,et al.Stage-specific expression and effect of bone morphogenetic protein 2 on bovine granulosa cell estradiol production:regulation by cocaine and amphetamine regulated transcript[J].Domest Anim Endocrinol,2013,44(3):115-120. [20] LIMA I M T,BRITO I R,ROSSETTO R,et al.BMPRIB and BMPRII mRNA expression levels in goat ovarian follicles and the in vitro effects of BMP-15 on preantral follicle development[J].Cell Tissue Res,201 348(1):225-238. [21] ERICKSON G F,SHIMASAKI S.The spatiotemporal expression pattern of the bone morphogenetic protein family in rat ovary cell types during the estrous cycle[J].Reprod Biol Endocrinol,2003,1(1):1-9. [22] KHALAF M,MORERA J,BOURRET A,et al.BMP system expression in GCs from polycystic ovary syndrome women and the in vitro effects of BMP4,BMP6,and BMP7 on GC steroidogenesis[J].Eur J Endocrinol,2013,168(3):437-444. [23] SOUZA C J,MACDOUGALL C,MACDOUGALL C,et al.The Booroola (FecB) phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B (BMPR1B) gene[J].J Endocrinol,200 169(2):R1-R6. [24] COSTA J J,PASSOS M J,LEITO C C,et al.Levels of mRNA for bone morphogenetic proteins,their receptors and SMADs in goat ovarian follicles grown in vivo and in vitro[J].Reprod Fertil Dev,201 24(5):723-732. [25] 馬晓萌,轩俊丽,王慧华,等.TXNRD1基因多态性与乌珠穆沁绵羊生长性状的关联分析[J].畜牧兽医学报,2016,47(5):909-921. [26] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method [J].Methods,200 25(4):402-408. [27] GUO X F,HU W P,LANG X Z,et al.Two single nucleotide polymorphisms sites in α1-AT gene and their association with somatic cell score in Chinese Holstein cows[J].J Biol Res (Thessalon),2017,24(1):1-8. [28] ORISAKA M,JIANG J Y,ORISAKA S,et al.Growth differentiation factor 9 promotes rat preantral follicle growth by up-regulating follicular androgen biosynthesis[J].Endocrinology,2009,150(6):2740-2748. [29] PAN Z Y,WANG X Y,DI R,et al.A 5-methylcytosine site of growth differentiation factor 9 (GDF9) gene affects its tissue-specific expression in sheep[J].Animals,2018,8(11):1-12. [30] LIU C,YUAN B,CHEN H,et al.Effects of MiR-375-BMPR2 as a key factor downstream of BMP15/GDF9 on the Smad1/5/8 and Smad2/3 signaling pathways[J].Cell Physiol Biochem,2018,46(1):213-225. [31] SHOKROLLAHI B,MORAMMAZI S.Polymorphism of GDF9 and BMPR1B genes and their association with litter size in Markhoz goats[J].Reprod Domest Anim,2018,53(4):971-978. [32] LIU Q Y,PAN Z Y,WANG X Y,et al.Progress on major genes for high fecundity in ewes[J].Front Agr Sci Eng,2014,1(4):282-290. [33] PULKKI M M,MOTTERSHEAD D G,PASTERNACK A H,et al.A covalently dimerized recombinant human bone morphogenetic protein-15 variant identifies bone morphogenetic protein receptor type 1B as a key cell surface receptor on ovarian granulosa cells[J].Endocrinology,201 153(3):1509-1518. [34] HIRSCHHORN T,LEVI-HOFMAN M,DANZIGER O,et al.Differential molecular regulation of processing and membrane expression of Type-I BMP receptors:Implications for signaling[J].Cell Mol Life Sci,2017,74(14):2645-2662. [35] RAJESH G,MISHRA S R,PAUL A,et al.Transcriptional and translational abundance of Bone morphogenetic protein (BMP) 4,6,7 and their receptors BMPR1A,1B and BMPR2 in buffalo ovarian follicle and the role of BMP4 and BMP7 on estrogen production and survival of cultured granulosa cells[J].Res Vet Sci,2018,118:371-388. [36] DA CUNHA E V,MELO L R F,SOUSA G B,et al.Effect of bone morphogenetic proteins 2 and 4 on survival and development of bovine secondary follicles cultured in vitro[J].Theriogenology,2018,110:44-51. [37] FOROUGHINIA G,FAZILEH A,EGHBALSAIED S.Expression of genes involved in BMP and estrogen signaling and AMPK production can be important factors affecting total number of antral follicles in ewes[J].Theriogenology,2017,91:36-43. [38] HU X,POKHAREL K,PEIPPO J,et al.Identification and characterization of miRNAs in the ovaries of a highly prolific sheep breed[J].Anim Genet,2016,47(2):234-239. [39] 周梅,曹曉涵,贺小云,等.绵羊FSTL1基因组织表达及其多态性与产羔数之间的关系[J].农业生物技术学报,2018,26(5):801-810. [40] GUO X F,WANG X Y,DI R,et al.Metabolic effects of FecB gene on follicular fluid and ovarian vein serum in sheep (Ovis aries)[J].Int J Mol Sci,2018,19(2):1-14.

