邻炔基苯基环丁酮类化合物的高效合成及其开环-环化反应
蔡润达, 高继强, 刘永盛, 郭梓腾, 王宇超, 刘 宇
(长春工业大学 化学与生命科学院, 长春 130012)
0 引 言
环丁酮作为一类重要的小环化合物, 其合成及转化具有重要意义[1-7]. 近年来已经得到了许多有关不饱和化合物参与的环丁酮开环-环化反应[8-9], 其中炔基取代的环丁酮类化合物具有独特的反应活性, 可以制备多种环状化合物. 如Deng等[10]通过“cut and sew”变换[11]实现了环丁酮与炔烃的分子内反应形成稠环-环己烯酮, 该反应中的炔基环丁酮类原料由邻炔基苯甲醇制备, 邻炔基苯甲醇由经典的Sonogashira反应[12]制备. Matsuda等[13]用炔烃取代环丁酮的扩环反应合成了苯并七元环酮类化合物, 该反应中的α-(2-乙炔基苯基)环丁酮类化合物可用邻溴苯基环丁酮与末端炔烃经Sonogashira偶联反应高效制备. 由于β-(2-乙炔基苯基)环丁酮类化合物难以通过类似方法合成, 因此限制了该类反应的研究进程. 钱艳艳等[14]将无铜参与的钯催化Sonogashira偶联反应用于上述化合物合成, 并进一步实现了Lewis酸催化的β-(2-乙炔基苯基)环丁酮类化合物的开环-复分解反应, 用一步法制备了一系列双芳基酮类化合物(图1(A))[15]. 在此基础上, 本文对该Sonogashira偶联反应体系进行优化, 得到更佳的反应条件, 反应产率更高, 底物普适性更好(图1(B)), 利用铜类催化剂可实现该反应产物的开环-复分解反应, 制备出一系列萘酮类化合物.
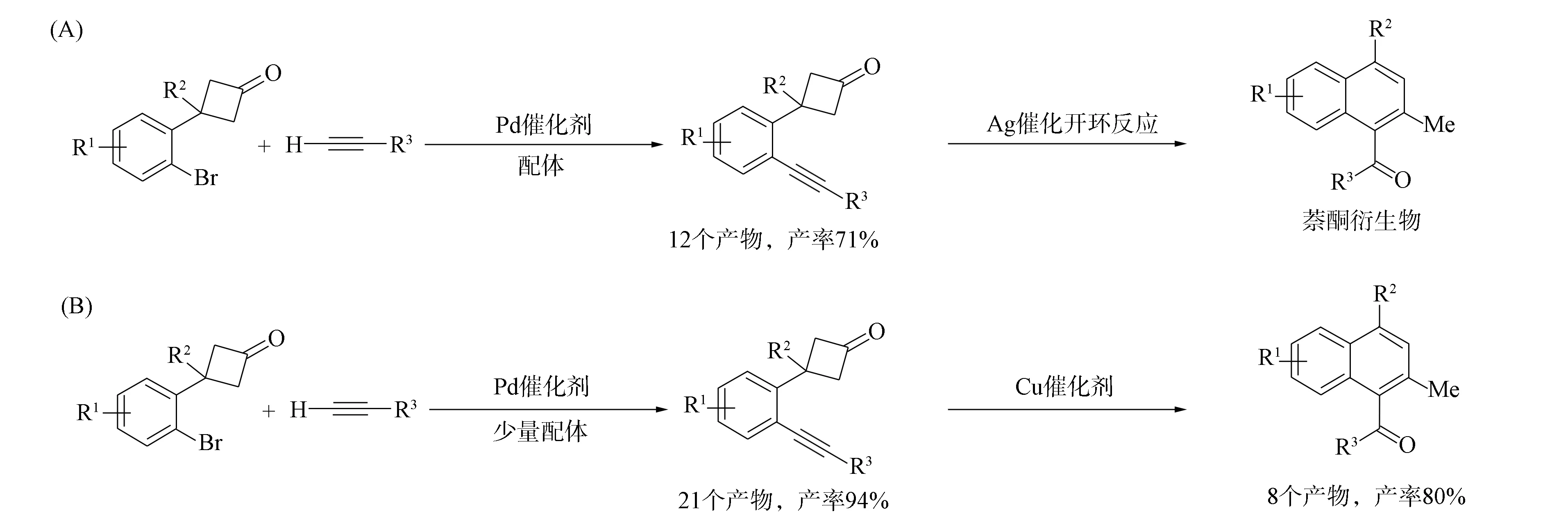
图1 β-(2-乙炔基苯基)环丁酮类化合物的制备及其开环-复分解反应Fig.1 Preparation and ring-opening-metathesis reactions of β-(2-alkynylphenyl)cyclobutanone compounds
1 实 验
1.1 试剂和仪器
4-甲氧基苯乙炔、4-甲基苯乙炔、苯乙炔、1-己炔、4-硝基苯乙炔等购自阿拉丁试剂(上海)有限公司; 碳酸钾、三氟乙酸钯(Pd(TFA)2)、三氟甲磺酸铜(Cu(OTf)2)等购自萨恩化学技术(上海)有限公司; 邻溴芳基环丁酮等底物根据文献[16-17]制备, 所用溶剂为超干溶剂或经除水处理.
RCTBS025型磁力搅拌器(德国IKA公司); 核磁共振波谱仪(AV-400型, 瑞士Bruker公司); 高分辨质谱仪(HRMS, 瑞士Bruker公司).
1.2 β-(2-乙炔基苯基)环丁酮类化合物的合成
先在干燥的封管中加入Pd(TFA)2(0.005 mmol), DPEphos(双(2-二苯基膦)苯醚, 0.01 mmol)和K2CO3(0.1 mmol), 再对体系进行氩气保护. 将邻溴芳基环丁酮1(0.2 mmol)和末端炔烃2(0.3 mmol)溶于2 mL 1,4-二氧六环中, 用注射器将其加入封管中并将封管密封. 将封管置于90 ℃油浴锅中搅拌12 h, 通过薄层色谱分析(TLC)检测反应, 待原料反应完全后将其冷却至室温, 加入5 mL 2 mol/L的稀盐酸, 搅拌3 min后加入5 mL乙酸乙酯萃取, 有机相用5 mL饱和氯化钠溶液洗涤, 无水硫酸钠干燥. 减压浓缩后用层析色谱柱分离(200~300目硅胶,V(石油醚)∶V(乙酸乙酯)=20∶1~2∶1), 得到邻炔基芳基环丁酮产物3, 反应路线如图2所示.

图2 β-(2-乙炔基苯基)环丁酮的合成Fig.2 Synthesis of β-(2-alkynylphenyl)cyclobutanones
1.3 炔基化茚满酮(4gk)的合成
用1.2的合成方法将Pd(TFA)2(0.005 mmol), DPEphos(0.01 mmol)和K2CO3(0.1 mmol), 邻溴芳基环丁酮1g(0.2 mmol)和末端炔烃2k(0.3 mmol)反应后, 用层析色谱柱分离(200~300目硅胶,V(石油醚)∶V(乙酸乙酯)=2∶1), 得到邻炔基芳基环丁酮产物3gk和炔基化茚满酮4gk, 反应路线如图3所示.

图3 炔基茚满酮(4gk)的合成Fig.3 Synthesis of alkynyl indanone (4gk)
1.4 三氟甲磺酸铜催化萘酮类化合物的合成
在干燥的封管中加入Cu(OTf)2(0.03 mmol), 对体系进行氩气保护. 将邻炔基芳基环丁酮3(0.15 mmol)溶于2 mL三氯甲烷中, 用注射器将其加入封管中并将封管密封. 将封管置于在65 ℃油浴锅中搅拌18 h, 通过TLC检测反应, 待原料反应完全后, 将反应液直接减压浓缩后用层析色谱柱分离(200~300目硅胶,V(石油醚)∶V(乙酸乙酯)=20∶1), 得到萘酮产物5, 反应路线如图4所示.

图4 萘酮类化合物的合成Fig.4 Synthesis of naphthone compounds
1.5 产物的表征
产物的1H NMR和13C NMR核磁数据由Bruker 400 MHz核磁共振仪检测, CDCl3为溶剂, 四甲基硅烷(TMS)为内标.
3-(2-(苯乙炔基)苯基)环丁-1-酮(3aa).1H NMR(400 MHz, CDCl3)δ: 7.56(d,J=7.5 Hz, 1H), 7.53~7.48(m, 2H), 7.38~7.31(m, 5H), 7.27~7.22(m, 1H), 4.09(p,J=8.4 Hz, 1H), 3.59~3.48(m, 2H), 3.43~3.33(m, 2H);13C NMR(101 MHz, CDCl3)δ: 206.7,144.6,132.9,131.4,128.7,128.51,128.46,126.6,125.5,123.1,122.7,94.5,87.8,53.6,27.7. HRMS(C18H14O, [M]+, 理论值): 246.103 8(246.103 9).
3-(2-(4-甲基苯乙炔基)苯基)环丁-1-酮(3ab).1H NMR(400 MHz, CDCl3)δ: 7.55(d,J=7.5 Hz, 1H), 7.40(d,J=8.0 Hz, 2H), 7.33(d,J=3.9 Hz, 2H), 7.27~7.22(m, 1H), 7.16(d,J=7.9 Hz, 2H), 4.08(p,J=8.4 Hz, 1H), 3.60~3.48(m, 2H), 3.45~3.34(m, 2H), 2.37(s, 3H);13C NMR(101 MHz, CDCl3)δ: 206.7,144.5,138.7,132.8,131.3,129.2,128.4,126.6,125.5,122.9,120.0,94.7,87.2,53.6,27.8,21.5. HRMS(C19H16O, [M]+, 理论值): 260.119 3(260.119 6).
3-(2-(4-甲氧基苯乙炔基)苯基)环丁-1-酮(3ac).1H NMR(400 MHz, CDCl3)δ: 7.55(d,J=7.5 Hz, 1H), 7.45(d,J=8.7 Hz, 2H), 7.33(d,J=4.0 Hz, 2H), 7.27~7.21(m, 1H), 6.89(d,J=8.7 Hz, 2H), 4.13~4.01(m, 1H), 3.82(s, 3H), 3.59~3.48(m, 2H), 3.46~3.34(m, 2H);13C NMR(101 MHz, CDCl3)δ: 207.0,159.8,144.3,132.8,132.7,128.3,126.6,125.5,122.9,115.1,114.1,94.5,86.5,55.3,53.6,27.7. HRMS(C19H16O2, [M]+, 理论值): 276.114 9(276.114 5).
3-(2-(4-硝基苯乙炔基)苯基)环丁烷-1-酮(3af).1H NMR(400 MHz, CDCl3)δ: 8.24(d,J=8.7 Hz, 2H), 7.63(dd,J=19.2, 8.1 Hz, 3H), 7.47~7.37(m, 2H), 7.34~7.25(m, 1H), 4.19~4.03(m, 1H), 3.63~3.52(m, 2H), 3.49~3.37(m, 2H);13C NMR(101 MHz, CDCl3)δ: 206.6,166.4,144.8,133.1,131.3,129.6,129.2,127.6,126.7,125.6,122.1,93.6,90.7,53.7,27.7. HRMS(C18H13NO3, [M]+, 理论值): 291.088 8(291.089 0).
3-(2-(环丙基乙炔基)苯基)环丁-1-酮(3ag).1H NMR(400 MHz, CDCl3)δ: 7.41(d,J=7.5 Hz, 1H), 7.27(d,J=4.1 Hz, 2H), 7.21~7.14(m, 1H), 3.96(p,J=8.4 Hz, 1H), 3.53~3.41(m, 2H), 3.39~3.27(m, 2H), 1.47(ddd,J=13.1,8.4,5.1 Hz, 1H), 0.93~0.86(m, 2H), 0.83~0.76(m, 2H);13C NMR(101 MHz, CDCl3)δ: 207.1,144.4,132.8,127.7,126.4,125.4,123.2,98.7,74.3,53.5,27.6,8.6,0.3. HRMS(C15H14O, [M]+, 理论值): 210.103 6(210.103 9).
3-(2-(己炔基)苯基)环丁-1-酮(3ah).1H NMR(400 MHz, CDCl3)δ: 7.43(d,J=7.5 Hz, 1H), 7.28(d,J=3.6 Hz, 2H), 7.22~7.15(m, 1H), 4.06~3.93(m, 1H), 3.54~3.41(m, 2H), 3.40~3.28(m, 2H), 2.44(t,J=7.0 Hz, 2H), 1.65~1.56(m, 2H), 1.53~1.43(m, 2H), 0.95(t,J=7.3 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 207.1,144.3,132.9,127.8,126.5,125.4,123.5,95.8,79.1,53.6,30.8,27.6,22.1,19.3,13.6. HRMS(C16H18O, [M]+, 理论值): 226.135 4(226.135 2).
3-(2-(壬炔基)苯基)环丁-1-酮(3ai).1H NMR(400 MHz, CDCl3)δ: 7.43(d,J=7.4 Hz, 1H), 7.34~7.24(m, 2H), 7.23~7.16(m, 1H), 4.09~3.93(m, 1H), 3.57~3.41(m, 2H), 3.39~3.29(m, 2H), 2.43(t,J=7.1 Hz, 2H), 1.68~1.55(m, 2H), 1.5~1.4(m, 2H), 1.38~1.26(m, 6H), 0.92~0.86(m, 3H);13C NMR(101 MHz, CDCl3)δ: 207.1,144.3,132.8,127.8,126.4,125.3,123.5,95.8,79.1,53.6,31.7,29.0,28.8,28.7,27.6,22.6,19.6,14.0. HRMS(C19H24O, [M]+, 理论值): 268.182 3(268.182 2).
3-(2-(三甲基硅基乙炔基)苯基)环丁-1-酮(3aj).1H NMR(400 MHz, CDCl3)δ: 7.50(d,J=7.6 Hz, 1H), 7.36~7.25(m, 2H), 7.23~7.18(m, 1H), 4.00(p,J=8.4 Hz, 1H), 3.55~3.44(m, 2H), 3.40~3.31(m, 2H), 0.26(s, 9H);13C NMR(101 MHz, CDCl3)δ: 206.8,144.9,133.2,128.8,126.5,125.4,122.5,103.5,99.8,53.4,27.6,-0.2. HRMS(C15H18OSi, [M]+, 理论值): 242.112 4(242.112 1).
3-(2-(3-噻吩基乙炔基)苯基)环丁-1-酮(3al).1H NMR(400 MHz, CDCl3)δ: 7.58~7.48(m, 2H), 7.39~7.29(m, 3H), 7.25(t,J=7.9 Hz, 1H), 7.18(d,J=4.8 Hz, 1H), 4.06(p,J=8.4 Hz, 1H), 3.61~3.47(m, 2H), 3.47~3.33(m, 2H);13C NMR(101 MHz, CDCl3)δ: 207.1,144.6,132.9,129.7,128.8,128.7,126.7,125.8,125.7,122.6,122.1,89.8,87.4,53.8,27.9. HRMS(C16H12OS, [M]+, 理论值): 252.060 3(252.060 8).
3-(2-(4-氯苯乙炔基)-4-甲基苯基)环丁-1-酮(3bd).1H NMR(400 MHz, CDCl3)δ: 7.46~7.37(m, 3H), 7.33(d,J=8.4 Hz, 2H), 7.26~7.21(m, 1H), 7.17(d,J=7.8 Hz, 1H), 4.10~3.95(m, 1H), 3.60~3.46(m, 2H), 3.43~3.28(m, 2H), 2.34(s, 3H);13C NMR(101 MHz, CDCl3)δ: 206.9,141.7,136.4,134.5,133.4,132.6,129.7,128.8,125.6,122.0,121.6,92.9,89.0,53.8,27.4,20.7. HRMS(C19H15ClO, [M]+, 理论值):294.080 5(294.080 6).
3-(4-甲基-2-(三甲基硅基乙炔基)苯基)环丁-1-酮(3bj).1H NMR(400 MHz, CDCl3)δ: 7.25(s, 1H), 7.07(dd,J=19.1,7.9 Hz, 2H), 3.88(p,J=8.4 Hz, 1H), 3.45~3.33(m, 2H), 3.30~3.19(m, 2H), 2.23(s, 3H), 0.17(s, 9H);13C NMR(101 MHz, CDCl3)δ: 207.1,142.0,136.1,133.7,129.6,125.4,122.2,103.7,99.2,53.4,27.3,20.6,-0.2. HRMS(C16H20OSi, [M]+, 理论值): 256.127 4(256.127 8).
3-(4-甲氧基-2-(苯乙炔基)苯基)环丁-1-酮(3ca).1H NMR(400 MHz, CDCl3)δ: 7.51(dd,J=6.5,3.0 Hz, 2H), 7.35(dd,J=4.9,1.7 Hz, 3H), 7.22(d,J=8.6 Hz, 1H), 7.10(d,J=2.6 Hz, 1H), 6.89(dd,J=8.6,2.6 Hz, 1H), 4.07~3.96(m, 1H), 3.81(s, 3H), 3.56~3.45(m, 2H), 3.41~3.27(m, 2H);13C NMR(101 MHz, CDCl3)δ: 206.8,158.0,136.9,131.4,128.5,128.4,126.6,123.4,122.9,117.5,115.1,94.2,87.8,55.4,53.8,27.0. HRMS(C19H16O2, [M]+, 理论值): 276.114 8(276.114 5).
3-(4-甲氧基-2-(4-甲苯乙炔基)苯基)环丁-1-酮(3cb).1H NMR(400 MHz, CDCl3)δ: 7.40(d,J=7.9 Hz, 2H), 7.22(d,J=8.6 Hz, 1H), 7.17(d,J=7.8 Hz, 2H), 7.09(d,J=2.6 Hz, 1H), 6.93~6.85(m, 1H), 4.01(p,J=8.4 Hz, 1H), 3.81(s, 3H), 3.56~3.46(m, 2H), 3.40~3.29(m, 2H), 2.37(s, 3H);13C NMR(101 MHz, CDCl3)δ: 207.2,158.0,138.8,136.8,131.3,129.2,126.6,123.6,119.8,117.3,114.9,94.4,87.1,55.4,53.7,27.0,21.5. HRMS(C20H18O2, [M]+, 理论值): 290.130 5(290.130 1).
3-(2-(4-氟苯乙炔基)-4-甲氧基苯基)环丁-1-酮(3ce).1H NMR(400 MHz, CDCl3)δ: 7.49(dd,J=8.6,5.4 Hz, 2H), 7.27~7.22(m, 1H), 7.11~7.03(m, 3H), 6.91(dd,J=8.6,2.6 Hz, 1H), 4.05~3.95(m, 1H), 3.83(s, 3H), 3.57~3.46(m, 2H), 3.41~3.31(m, 2H);13C NMR(101 MHz, CDCl3)δ: 207.1,162.7(d,J=250.4 Hz), 158.0,136.9,133.3(d,J=8.4 Hz), 126.8,123.2,119.0(d,J=3.6 Hz), 117.5,115.9,115.7,115.1,93.1,87.5(d,J=1.2 Hz), 55.4,53.8,27.1;19F NMR(376 MHz, CDCl3)δ: -110.28. HRMS(C19H15FO2, [M]+, 理论值): 294.105 0(294.105 1).
3-(5-甲基-2-(苯乙炔基)苯基)环丁-1-酮(3da).1H NMR(400 MHz, CDCl3)δ: 7.54~7.44(m, 3H), 7.39~7.32(m,J=5.6 Hz, 3H), 7.15(s, 1H), 7.07(d,J=7.7 Hz, 1H), 4.06(p,J=8.3 Hz, 1H), 3.60~3.48(m, 2H), 3.44~3.35(m, 2H), 2.39(s, 3H);13C NMR(101 MHz, CDCl3)δ: 207.1,144.4,138.8,132.8,131.3,128.4,128.3,127.4,126.4,123.2,119.6,93.7,88.0,53.6,27.6,21.6. HRMS(C19H16O, [M]+, 理论值): 260.119 8(260.119 6).
3-(5-甲基-2-(2,4,5-三甲氧基苯乙炔基)苯基)环丁烷-1-酮(3dk).1H NMR(400 MHz, CDCl3)δ: 7.46(d,J=7.7 Hz, 1H), 7.14(s, 1H), 7.05(d,J=7.6 Hz, 1H), 6.96(s, 1H), 6.51(s, 1H), 4.16~4.03(m, 1H), 4.00~3.81(m, 9H), 3.63~3.49(m, 2H), 3.49~3.36(m, 2H), 2.38(s, 3H);13C NMR(101 MHz, CDCl3)δ: 207.4,155.4,150.4,144.0,142.9,138.2,132.4,127.2,126.3,120.1,115.5,103.3,97.0,90.7,90.4,56.5,56.0,53.4,27.7,21.6. HRMS(C22H22O4, [M]+, 理论值): 350.151 9(350.151 3).
3-(5-甲氧基-2-(苯乙炔基)苯基)环丁-1-酮(3ea).1H NMR(400 MHz, CDCl3)δ: 7.52~7.46(m, 3H), 7.36~7.30(m, 3H), 6.87(d,J=2.1 Hz, 1H), 6.78(dd,J=8.5, 2.3 Hz, 1H), 4.11~4.00(m, 1H), 3.83(s, 3H), 3.58~3.48(m, 2H), 3.43~3.33(m, 2H);13C NMR(101 MHz, CDCl3)δ: 206.5,160.0,146.4,134.4,131.3,128.4,128.2,123.5,114.9,112.3,111.6,93.0,87.9,55.4,53.6,27.9. HRMS(C19H16O2, [M]+, 理论值):276.114 5(276.114 5).
3-甲基-3-(2-(4-甲基苯乙炔基)苯基)环丁-1-酮(3fb).1H NMR(400 MHz, CDCl3)δ: 7.56(d,J=7.1 Hz, 1H), 7.37(d,J=7.9 Hz, 2H), 7.34~7.21(m, 3H), 7.16(d,J=7.7 Hz, 2H), 3.72~3.57(m, 2H), 3.28~3.17(m, 2H), 2.37(s, 3H), 1.71(s, 3H);13C NMR(101 MHz, CDCl3)δ: 207.3,149.3,138.7,133.6,131.0,129.2,128.3,126.5,126.1,121.5,120.1,94.8,87.9,59.1,34.9,28.8,21.5. HRMS(C20H18O, [M]+, 理论值): 274.135 3(274.135 2).
3-(2-(4-甲氧基苯乙炔基)苯基)-3-苯基环丁-1-酮(3gc).1H NMR(400 MHz, CDCl3)δ: 7.51(dd,J=17.6, 7.6 Hz, 2H), 7.41~7.14(m, 9H), 6.83(d,J=14.9 Hz, 2H), 4.05~3.94(m, 2H), 3.87~3.72(m, 5H);13C NMR(101 MHz, CDCl3)δ: 206.3,159.8,147.6,146.0,133.8,132.5,128.4,128.0,127.4,126.9,126.3,122.9,115.1,114.1,95.5,87.5,60.4,55.3,42.3. HRMS(C25H20O2, [M]+, 理论值): 352.146 2(352.145 8).
3-苯基-3-(2-(2,4,5-三甲氧基苯乙炔基)苯基)环丁-1-酮(3gk).1H NMR(400 MHz, CDCl3)δ: 7.57(d,J=7.5 Hz, 1H), 7.49(d,J=7.7 Hz, 1H), 7.42(d,J=7.6 Hz, 2H), 7.36(t,J=7.5 Hz, 1H), 7.29~7.22(m, 3H), 7.19~7.13(m, 1H), 6.68(s, 1H), 6.50(s, 1H), 4.10~3.99(m, 2H), 3.96~3.78(m, 11H);13C NMR(101 MHz, CDCl3)δ: 206.9,155.4,150.6,147.6,146.3,142.9,134.0,128.3,123.0,127.4,126.7,126.5,126.1,123.0,115.7,103.2,97.1,92.3,91.3,60.6,56.5,56.4,56.0,42.4. HRMS(C27H24O4, [M]+, 理论值): 412.166 8(412.166 9).
3-(1-(苯乙炔基)-2-萘基)环丁-1-酮(3ha).1H NMR(400 MHz, CDCl3)δ: 8.46(d,J=8.4 Hz, 1H), 7.91~7.80(m, 2H), 7.69~7.56(m, 3H), 7.56~7.46(m, 2H), 7.46~7.31(m, 3H), 4.39(p,J=8.4 Hz, 1H), 3.71~3.54(m, 2H), 3.54~3.37(m, 2H);13C NMR(101 MHz, CDCl3)δ: 206.8,143.4,133.7,132.1,131.6,129.1,128.7,128.6,128.2,127.4,126.3,126.2,123.3,123.2,119.5,100.1,86.0,54.4,28.1. HRMS(C22H16O, [M]+, 理论值): 296.119 6(296.119 8).
3-苯基-3-(3-(2,4,5-三甲氧基苯基)丙-2-炔-1-基)-2,3-二氢-1H-茚-1-酮(4gk).1H NMR(400 MHz, CDCl3)δ: 7.81(d,J=7.6 Hz, 1H), 7.63(t,J=7.4 Hz, 1H), 7.50~7.42(m, 2H), 7.35~7.22(m, 5H), 6.56(s, 1H), 6.39(s, 1H), 3.85(s, 3H), 3.79(s, 3H), 3.73(s, 3H), 3.46~3.27(m, 3H), 3.01~2.94(m, 1H);13C NMR(101 MHz, CDCl3)δ: 205.0,159.6,155.2,149.9,145.5,142.8,137.1,134.9,128.5,128.1,126.7,126.6,126.2,123.0,116.0,97.4,88.8,79.8,56.6,56.4,56.0,53.1,49.9,31.9.(C27H24O4, [M]+, 理论值): 412.166 7(412.166 9).
2-甲基-1-萘基苯甲酮(5aa).1H NMR(400 MHz, CDCl3)δ: 7.81(d,J=8.4 Hz, 4H), 7.55~7.45(m, 2H), 7.41~7.30(m, 5H), 2.27(s, 3H);13C NMR(101 MHz, CDCl3)δ: 199.9,137.6,136.0,133.6,132.1,131.6,130.6,129.5,128.8,128.7,128.4,128.0,126.6,125.3,124.8,19.6. HRMS(C18H14O, [M]+, 理论值): 246.103 8(246.103 9).
(2-甲基-1-萘基)4-甲基苯甲酮(5ab).1H NMR(400 MHz, CDCl3)δ: 7.82(d,J=8.4 Hz, 2H), 7.71(d,J=7.8 Hz, 2H), 7.49(d,J=8.3 Hz, 1H), 7.42~7.30(m, 3H), 7.20(d,J=7.9 Hz, 2H), 2.37(s, 3H), 2.30(s, 3H);13C NMR(101 MHz, CDCl3)δ: 199.7,144.7,136.2,135.2,132.0,131.6,130.7,129.8,129.5,128.8,128.4,128.0,126.6,125.3,124.9,21.7,19.6. HRMS(C19H16O, [M]+, 理论值): 260.119 9(260.119 6).
(2-甲基-1-萘基)3-噻吩甲酮(5al).1H NMR(500 MHz, CDCl3)δ: 7.83(dd,J=8.2,3.1 Hz, 2H), 7.71~7.65(m, 1H), 7.59(d,J=4.7 Hz, 1H), 7.55(d,J=8.3 Hz, 1H), 7.44~7.31(m, 4H), 2.35(s, 3H);13C NMR(101 MHz, CDCl3)δ: 193.7,143.5,136.7,135.6,131.9,131.7,130.4,128.9,128.5,128.0,127.1,126.8,126.6,125.4,124.9,19.6. HRMS(C18H12OS, [M]+, 理论值): 252.060 3(252.060 6).
(7-甲氧基-2-甲基-1-萘基)4-甲基苯甲酮(5cb).1H NMR(400 MHz, CDCl3)δ: 7.80~7.69(m, 4H), 7.23(d,J=7.6 Hz, 3H), 7.08(d,J=8.9 Hz, 1H), 6.76(s, 1H), 3.67(s, 3H), 2.40(s, 3H), 2.27(s, 3H);13C NMR(101 MHz, CDCl3)δ: 200.1,158.1,144.7,135.2,135.1,132.7,131.8,129.8,129.54,129.48,128.6,127.2,126.2,118.0,103.5,55.2,21.7,19.8. HRMS(C20H18O2, [M]+, 理论值): 290.130 1(290.130 1).
(2,6-二甲基-1-萘基)苯甲酮(5da).1H NMR(400 MHz, CDCl3)δ: 7.81(d,J=7.5 Hz, 2H), 7.76(d,J=8.4 Hz, 1H), 7.61(s, 1H), 7.57(t,J=7.3 Hz, 1H), 7.46~7.31(m, 4H), 7.19(d,J=8.5 Hz, 1H), 2.47(s, 3H), 2.29(s, 3H);13C NMR(101 MHz, CDCl3)δ: 200.3,137.6,135.8,135.0,133.7,131.9,131.2,129.7,128.9,128.8,128.5,128.3,127.0,124.7,21.5,19.6. HRMS(C19H16O, [M]+, 理论值):260.119 7(260.119 6).
(2,4-二甲基-1-萘基)4-甲苯甲酮(5fb).1H NMR(400 MHz, CDCl3)δ: 8.00(d,J=8.4 Hz, 1H), 7.71(d,J=7.7 Hz, 2H), 7.50(d,J=8.3 Hz, 1H), 7.44(t,J=7.6 Hz, 1H), 7.37~7.31(m, 1H), 7.25~7.17(m, 3H), 2.71(s, 3H), 2.40(s, 3H), 2.26(s, 3H);13C NMR(101 MHz, CDCl3)δ: 200.1,144.6,135.4,135.3,134.6,131.7,130.9,130.8,129.9,129.5,129.2,126.3,125.6,125.2,124.2,21.7,19.6,19.4. HRMS(C20H18O, [M]+, 理论值): 274.135 7(274.135 2).
(2-甲基-4-苯基-1-萘基)4-甲氧基苯甲酮(5gc).1H NMR(400 MHz, CDCl3)δ: 7.93~7.83(m,J=10.9,7.8 Hz, 3H), 7.59~7.42(m, 6H), 7.40~7.29(m, 3H), 6.92(d,J=8.4 Hz, 2H), 3.85(s, 3H), 2.34(s, 3H);13C NMR(101 MHz, CDCl3)δ: 198.7,164.2,141.0,140.3,135.9,132.2,131.4,131.1,130.8,130.0,129.5,128.3,127.4,126.4,126.2,125.4,125.3,114.1,55.5,19.6. HRMS(C25H20O2, [M]+, 理论值):352.145 7(352.145 8).
3-甲基-4-菲基苯甲酮(5ha).1H NMR(400 MHz, CDCl3)δ: 8.33(d,J=8.6 Hz, 1H), 7.90(d,J=8.1 Hz, 1H), 7.81(d,J=6.9 Hz, 3H), 7.73(dd,J=19.0,8.8 Hz, 2H), 7.50(dd,J=6.9,4.8 Hz, 2H), 7.43(t,J=7.4 Hz, 1H), 7.34(t,J=7.7 Hz, 2H), 7.30~7.23(m, 1H), 2.34(s, 3H);13C NMR(101 MHz, CDCl3)δ: 202.3,137.5,136.5,133.9,133.6,133.4,131.3,129.7,129.5,129.2,129.1,128.8,128.8,128.0,127.3,127.2,127.0,126.4,126.1,20.3. HRMS(C22H16O, [M]+, 理论值): 296.124 5(296.124 0).
2 结果与讨论
2.1 反应条件优化
首先, 用3-(2-溴苯基)环丁烷-1-酮1a和苯乙炔2a为模板底物对钯催化的Sonogashira偶联反应条件进行系统研究(表1), 其合成路线如图5所示.

表1 反应条件优化

图5 化合物3aa的合成Fig.5 Synthesis of compound 3aa
在Pd(TFA)2为催化剂, 1,1′-双(二苯基膦)二茂铁(dppf)为配体, K2CO3为碱, 1,4-二氧六环作为溶剂的条件下, 以83%的核磁产率得到了产物3aa(序号 1), 比文献[14]的产率(71%)有较大提升. 分别将1,4-双(二苯基膦)丁烷(dppb)、三氟拉嗪(TFP)、2-(二环己基膦基)联苯(CyJohnphos)、DPEphos作为配体进行实验, 序号为2~5. 当DPEphos为配体时, 产率可提高到90%且以83%的分离产率得到产物3aa(序号 5). 因此以DPEphos为最优配体进行下一步筛选. 当催化剂的量降为0.005 mmol, 配体的量降为0.01 mmol时, 产物3aa的产率未明显变化(序号 6). 再对K2CO3的量以及其他碱进行筛选(序号 7~11), 当K2CO3的量降到0.1 mmol时, 能以85.3%的分离产率得到目标产物, 当降至0.05 mmol时, 只有31%的产率. 使用不同碱的反应效果有较明显的区别: 用Cs2CO3做碱时产率可达89%; 使用碱性较弱的K3PO4时, 反应产率明显降低; 有机碱三乙烯二胺(DABCO)参与反应时, 产率大幅度下降. 最后, 对钯催化剂以及溶剂的筛选表明, 其对反应结果的影响较小. 通过对配体、催化剂、碱、溶剂及其量的筛选, 确定了最优反应条件(序号7).
2.2 反应底物扩展
确定最优反应条件后, 对底物官能团的兼容性考察结果如图6所示. 首先, 考察3-(2′-溴苯基)环丁烷-1-酮1a与各类末端炔烃的反应, 供电子基团甲基和甲氧基取代的苯乙炔化合物均以较高的产率得到目标产物3ab,3ac. 但当苯乙炔底物中引入强吸电子的硝基时, 反应仅以26%的产率得到偶联产物3af. 此外, 烷基末端炔烃底物也可参与反应, 环状或直链脂肪末端炔烃均以较高的产率得到目标化合物(3ag~3aj), 噻吩基团也可在该体系中以60%的收率获得相应的产物(3al).
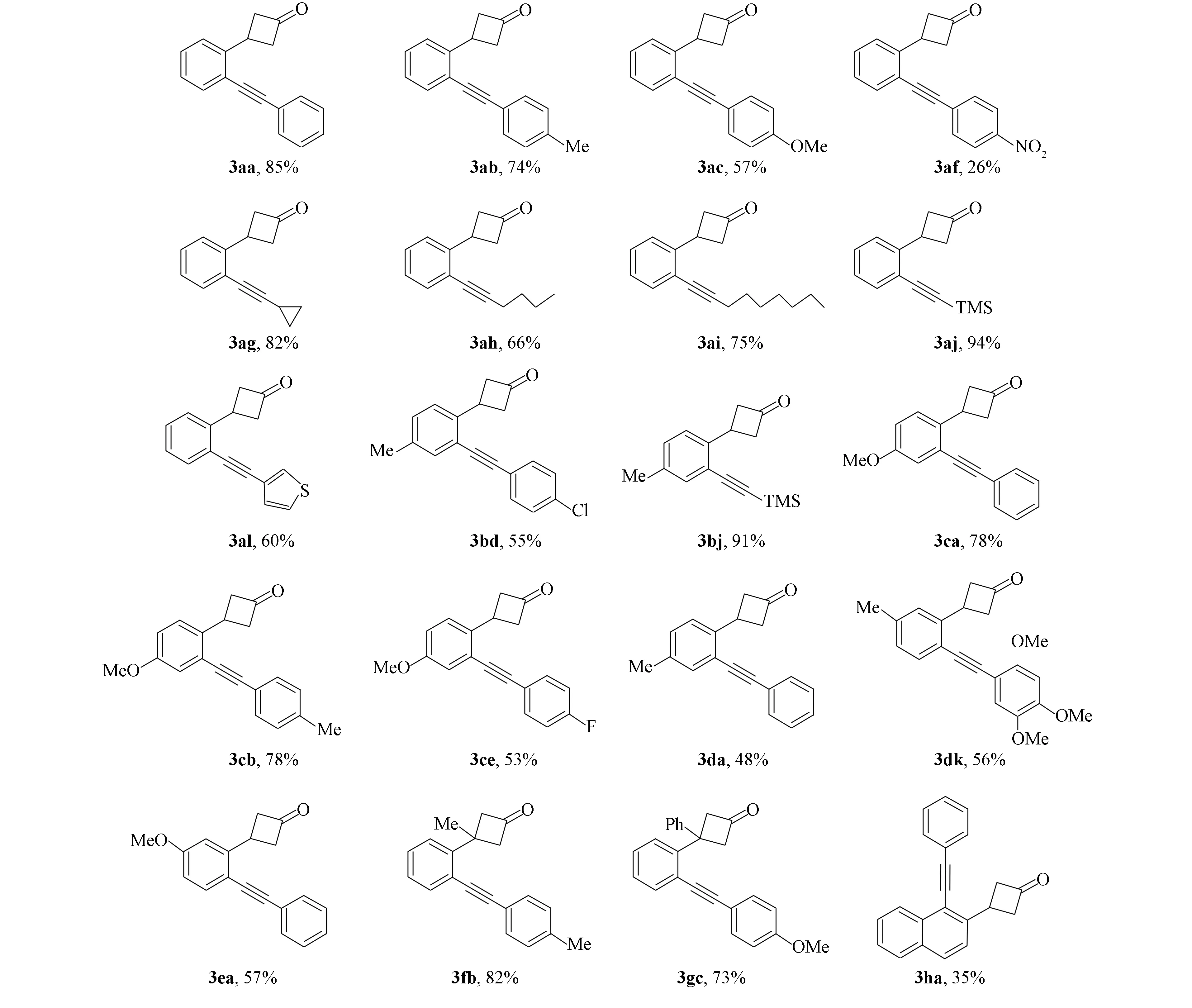
图6 反应底物扩展及产率Fig.6 Substrate expansion and yield of reaction
再将含有不同取代基的邻溴芳基环丁酮与末端炔烃用于单钯催化的Sonogashira偶联反应, 当在溴原子的间位引入甲基或甲氧基时, 以较高的产率得到产物3bj,3ca,3cb, 但苯乙炔的对位被卤素Cl或F取代时, 反应仅得到中等的产率(3bd,3ce). 溴的对位被甲基或甲氧基取代时, 产物3da,3dk,3ea的产率较低. 当环丁酮的β位被Me或Ph取代时, 底物也可完成反应, 以较高的产率得到相应的偶联产物(3fb,3gc). 此外, 含萘环结构底物也适应该反应, 但产率偏低(3ha, 35%).
环丁酮1g与2,4,5-三甲氧基苯乙炔2k在标准条件下反应时, 除生成Sonogashira偶联产物3gk外, 同时得到串联C—C键活化/Sonogashira型的交叉偶联产物炔基化茚满酮4gk[18], 如图3所示.
2.3 炔基环丁酮类化合物的开环-复分解反应
文献[15]研究了银催化的β-(2-乙炔基苯基)环丁酮类化合物的开环-复分解过程, 并提出了相应机理. 本文以此为基础, 进一步探索廉价金属催化剂在上述反应中的催化性能. 将偶联产物3aa作为原料, 以廉价Lewis酸Cu(OTf)2为催化剂, 三氯甲烷为溶剂, 水为氢源, 以63%的产率得到了萘酮产物5aa. 然后对其他底物进行尝试, 当甲基和甲氧基取代的原料参与反应时,也能以中等到较高的产率(55%~80%)得到相应的萘酮类化合物5ab,5cb. 噻吩基底物3al也适应于该反应体系. 进一步尝试在环丁酮的β位引入甲基或苯基的邻炔基芳基环丁酮, 分别能以73%和63%得到目标产物5fb,5gc. 最后, 进行稠碳环类化合物的合成, 虽然底物3ha的反应活性较低, 但仍以23%的产率得到稠碳环产物5ha. 其底物扩展及产率如图7所示.

图7 制备萘酮化合物的底物扩展及产率Fig.7 Substrate expansion and yield of preparation of naphthone compounds
综上所述, 本文优化了钯催化的无铜Sonogashira反应体系, 通过对配体、催化剂、碱、溶剂及其量的筛选, 以更高的产率和更广泛的底物普适性制备了一系列不同取代基的邻炔基苯基环丁酮类化合物, 良好的官能团耐受性为复杂目标分子的构建提供了潜在的转化途径. 此外, 实现了铜催化下该类炔基环丁酮类化合物的开环-复分解反应, 以较高的产率制备了一系列萘酮类化合物.

