环番合成酶PacB催化Xye类核糖体肽翻译后修饰研究
韩沅均,莫天录,邓子新,张琪,丁伟
(1 上海交通大学生命科学技术学院,微生物代谢国家重点实验室,上海 200240;2 复旦大学化学系,上海 200243)
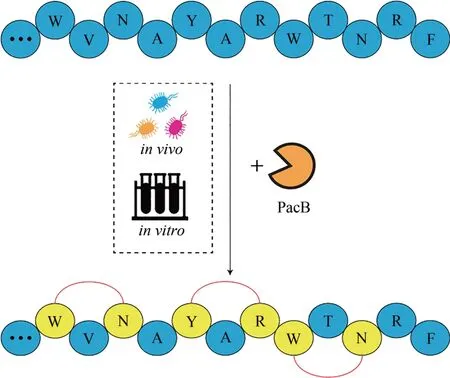
核糖体翻译后修饰肽(ribosomally synthesized and posttranslationally modified peptides,RiPPs)存在于所有的生物界中,构成了具有结构和功能多样性的一大类天然产物家族[1-2]。随着基因组数据的不断增长,分析显示大量具有结构多样和活性潜力的RiPPs以及所涉及的生物合成酶仍未被挖掘和鉴定。在大多数RiPPs的生物合成途径中,核心肽部分氨基酸残基间的环化是一种常见的后修饰方式[3]。目前为止,常见的RiPPs的环化的种类有硫醚交联(lanthipeptide[4-6]和 sactipeptide[7-9])、二硫键 (cystine knot proteins[10])、N-to-C 环化(orbitides[11-13]和 cyclotides[14-16])、噻唑和唑杂环(cyanobactins[17-19])或取代吡啶(thiopeptides[20])。通常这些环化修饰增加了RiPPs结合亲和性和蛋白水解稳定性,导致它们产生多样化的生物活性,从而具有良好的药物发展前景。
近年来,含有环番结构的RiPPs 化合物相继被发现[21-22]。这些环番结构通常是由一个氨基酸的芳香族碳与另一个氨基酸的β-碳交联成为C-C 键或C-O 键。如 Streptide[23]、Darobactin[24]和 Triceptide-Fxs[25]。它们在细菌中的生物合成途径通常涉及S-腺苷甲硫氨酸自由基(rSAM)酶,该类酶能够裂解SAM 形成5'-脱氧腺苷(5'-dA)自由基,然后攫取底物上的一个氢原子生成底物自由基,进一步生成结构多样化的最终产物[26]。Darobactin 是Ⅰmai 等发现的一种新型作用机制的优秀的抗革兰氏阴性菌抗生素,其是典型的含有环番结构的RiPP(图1)。Xye 类核糖体肽因为其主要在Xenorhabdus、Yersinia和Erwinia三 个 属 的 菌 中 被发现而得名[22]。这类RiPPs前体肽的核心肽区域和darobactin 的核心肽均富含芳香氨基酸,但是一般Xye 基因簇中的 rSAM 酶与 darobactin 的 rSAM 修饰酶序列上差异较大[22],预示着二者修饰功能上存在一定的差异,从而导致最终的成熟天然产物的结构具有更大的多样性。Darobactin 是近年来发现的最优异的抗革兰氏阴性耐药菌的药物前体分子,这些吸引着我们探究Xye家族核糖体肽化合物的结构、活性以及翻译后修饰方式。
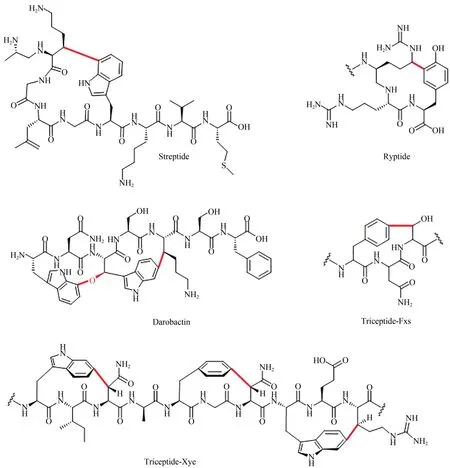
图1 含有环番结构的代表性核糖体肽Fig.1 Structures of several RiPPs with cyclophanes
1 材料与方法
1.1 材料与仪器
1.1.1 材料
基因全合成和引物合成由苏州金唯智生物有限公司(表1、表2);质粒、菌株为课题组所有(表3)。

表1 本工作中所涉及的基因Tab.1 Genes used in this study

表2 本工作中所用到的相关引物Tab.2 Primers used in this study

表3 本工作中所用到菌株和质粒Tab.3 Strains and plasmids used in this study
1.1.2 试剂和培养基
LB 培养基(1 L):酵母提取物(yeast extract)5 g,NaCl 10 g,蛋白胨(tryptone)10 g。
LanA Start Buffer:20 mmol/L NaH2PO4, pH 7.5(25 ℃),500 mmol/L NaCl,0.5 mmol/L 咪唑,20%甘油。
LanA Buffer 1∶6 mol/L 盐酸胍,20 mmol/L NaH2PO4, pH 7.5(25 ℃), 500 mmol/L NaCl,0.5 mmol/L 咪唑。
LanA Buffer 2∶4 mol/L 盐酸胍,20 mmol/L NaH2PO4, pH 7.5(25 ℃ ), 300 mmol/L NaCl,30 mmol/L 咪唑。
LanA Elution Buffer: 4 mol/L 盐 酸 胍 ,20 mmol/L Tris,pH 7.5(25 ℃),100 mmol/L NaCl,1 mmol/L 咪唑。
分子生物学用的聚合酶、内切酶、连接酶、重组酶、核酸和蛋白maker、培养基等购置于南京诺唯赞、上海生工、Sigma 和阿拉丁等公司。测序和引物合成由苏州金唯智和上海生工完成,质粒提取和凝胶回收试剂盒购置于天根生化。
1.1.3 仪器
赛默飞Q Exactive HPLC/MS液相质谱(LC-MS)联用仪,英国赛默飞Ultimate3000 高效液相色谱(HPLC)仪,美国贝克曼Avanti J-26S XP 高速冷冻离心机,美国伯乐GELDOCXRT 凝胶成像系统,美国致微GⅠ80TW 高压灭菌锅,德国Eppendorf 5424 离心机,美国伯乐T100 PCR 扩增仪,海尔-80 ℃冰箱,美国伯乐电泳仪,苏州净化有限公司SW-CJ-ⅠD超净工作台,移液枪(梅特勒),宁波新芝 UP250/JY92-ⅠⅠN 超声粉碎仪,摇床(上海知楚),上海一恒DHP-9052/DHG-9070A 电热恒温培养箱,梅特勒-托利ME204E电子天平。
1.2 未知核糖体肽成熟酶系统的大肠杆菌异源表达
Photorhabdus australisDSM 17609 前体肽PacA和rSAM 酶PacB 的氨基酸序列来源于NCBⅠ数据库,提交苏州金唯智生物有限公司进行基因全合成,要求针对于大肠杆菌表达宿主进行密码子优化,最终将基因克隆到表达质粒pRSFduet-1 的BamH1/EcoRⅠ和NdeⅠ/XhoⅠ两个位点中。
全合成的表达质粒(pacA-pacB-pRSFduet-1)和铁硫簇装配辅助质粒pDB1282 共转入表达宿主E.coliBL21(DE3)中,挑取单菌落于5 mL LB 液体培养基(Kan 50 μg/mL,Amp 100 μg/mL),37 ℃过夜培养,转入50 mL LB液体培养基(Kan 50 μg/mL,Amp 100 μg/mL),37 ℃培养3~5 h,待菌液OD600为0.5 左右时,先转入1L LB 液体培养基(Kan 50 μg/mL,Amp 100 μg/mL),37 ℃培养 2~3 h,待菌液浓度OD600为0.4 时,首先加入2g/L L-阿拉伯糖,37 ℃培养2 h左右诱导质粒pDB1282中铁硫簇装配辅助蛋白的表达;待菌液浓度OD600达到约0.6 时,加入 0.1 mmol/L ⅠPTG,温度降为 18 ℃ ,摇床速度降到80 r/min,诱导表达20 h。离心10 min 收集菌体(11 900g,4 ℃),弃去上清后,用20 mL 的LanA Start buffer 重悬菌体,然后超声30 min(频率40%,超5 s,暂停55 s),4 ℃,11 900g4 ℃离心1 h,再次弃去上清后,然后用20 mL LanA Buffer 1 重悬菌体,11 900g4 ℃离心30 min 去除不可溶的沉淀,然后上清用0.45 μm 滤器过滤去除不可溶颗粒,上清流过5 mL HiTrap-Ni树脂的亲和色谱柱,用2倍柱体积LanA Buffer 1和1 倍柱体积的LanA Buffer 2 洗去非特异性结合的蛋白后,用1~3 倍柱体积的LanA Elution Buffer洗脱目标多肽。洗脱的多肽分子量8000 左右,小量的洗脱多肽利用透析袋进行脱盐,经冷冻干燥后存储于-80 ℃备用。少量多肽溶于pH 7.6的磷酸缓冲溶液(PBS),进行高效液相色谱质谱联用仪检测目标化合物的分子量,在ESⅠ离子源下高分辨率质量分析器能捕捉到多肽的多电荷分子量。对于化合物结构的进一步鉴定采用HSEE[27]分析方法。对于化合物的Xye 预测和计算采用mMass 分析软件[28]。
1.3 rSAM 酶PacB 的表达、纯化和 [4Fe-4S]簇化学重构
将带有SAM 自由基酶基因的表达质粒电穿孔转化至大肠杆菌BL21(DE3)细胞中。挑选转化子接种在5 mL 含有相应抗生素的LB 液体培养基中,37 ℃培养12 h。随后将其全部接种到1 L含有相应抗生素的LB 液体培养基。放置在37 ℃摇床中,220 r/min 孵育至OD600到达约0.8 后,加入ⅠPTG 到终浓度为0.2~0.4 mmol/L,同时加入过滤除菌后的100 mmol/L Fe(NH4)(2SO4)2溶液至终浓度为0.1 mmol/L。在18~20 ℃和120 r/min 摇床中再孵育18 h,5000 r/min 离心15 min,弃掉上清收集菌体,4 ℃直接进行蛋白纯化或储存在-80 ℃待进一步使用。所有的SAM 自由基酶蛋白纯化及化学重构操作均在无氧手套箱中进行,氧气含量小于2 mL/m3。将上一步中异源表达目的蛋白的大肠杆菌,用lysis 缓冲液洗涤菌体并重新离心收集菌体。再使用30 mL lysis缓冲液重悬菌体,冰水浴中进行超声破碎细胞,超声工作时间30 min,超声3 s,间隔17 s,功率250 W 超声完成后,从手套箱中取出高速离心管,取出前保证离心管密封防止接触空气,4 ℃下12 000 r/min 高速离心1 h 后,放回无氧手套箱中,小心倒出上清。准备一根装有2 mL 填料的镍柱,用约3 倍柱体积lysis 缓冲液进行柱平衡后,将收集到的菌体破碎上清,流过镍柱,进行蛋白的装载。用洗脱缓冲液和lysis 缓冲液配制含有不同咪唑浓度淋洗液,一般使用含50 mmol/L 咪唑的淋洗液10~15 mL,进行杂蛋白的洗脱。最后使用洗脱缓冲液洗脱约5 mL,收集目标组分,一般为灰黑色的流出液。
对SAM 自由基酶纯化后,需要进行[4Fe-4S]簇的化学重构,一般先向体系中缓慢逐滴加入终浓度10 mmol/L DTT保证体系处于还原状态,随后加入蛋白当量5~10 倍左右的(NH4)2FeSO4,由于一般将需要重构蛋白稀释到100 μmol/L 时的重构效 果 较 好 , 因 此 一 般 (NH4)2FeSO4用 量 为100 μmol/L。加入(NH4)2FeSO4后在 4 ℃下放置30 min,再加入与(NH4)2FeSO4等物质的量浓度的Na2S(一般分2~3 次缓慢加入,一边加入一边搅拌防止蛋白沉淀),低温放置过夜,完成[4Fe-4S]簇的化学重构。在化学重构后,需要用PD-10脱盐柱(美国GE 公司)对体系脱盐,进行缓冲体系置换。PD-10脱盐柱先用5~10 mL的脱盐缓冲液进行平衡,随后根据使用说明,加入固定量2.5 mL蛋白溶液进行上样,弃掉上样时的流出液,再用3.5 mL脱盐缓冲液洗脱,收集含有SAM 自由基酶的流出液,一般为淡棕色或者棕黑色液体,每500 μL 分装为一管,-80 ℃冻存备用。
1.4 rSAM酶PacB体外活性测试
SAM 自由基酶的反应都需要在无氧手套箱中进行,氧气含量低于2 mL/m3。一个典型的PacB酶活反应,通常将200 μmol/L 的底物加入到含有50 μmol/L 纯化的 PacB 蛋白的缓冲体系(Tirs-HCl pH 8.0)中,随后加入1~2 mmol/L DTH 在室温中放置 10~15 min,最后加入 500 μmol/L SAM 到反应体系中,进行反应的引发。反应体系一般为100~200 μL,在室温孵育2~5 h 后从手套箱中取出反应,加入体积量为反应体系5%的TFA 对反应进行猝灭。12 000 r/min 高速离心10 min 后,弃掉沉淀,上清直接进行HPLC 及LC-HRMS 分析,或者-20 ℃进行冻存以便继续分析。反应中的对照组,使用煮沸失活的PacB 上清或者加入5% TFA失活的PacB上清。
2 结果与分析
2.1 前体肽基因pacA 和 rSAM 酶基因pacB 共表达
根据分析,3-CyFEs 在进化上和大多功能解析清楚的RiPPs环化合成酶的距离很远,表明其具有特殊的功能和催化机制。通过基因组挖掘,发现Photorhabdus australisDSM 17 609 基因组中含有一个尚未被报道的新型Xye类核糖体肽基因簇。为了将其与同一家族的其他基因簇区分开来,在此将其称为pac。其含有前体肽基因pacA和rSAM 酶基因pacB[图2(a)]。为了验证前体肽和修饰酶基因的功能,把前体肽基因pacA的N 端组合六组氨酸(6xHis)和麦芽糖结合蛋白(MBP)标签,并在MBP 和前体肽PacA 之间引入蛋白酶TEV 限制性位点,这样pacA和pacB共同构建入表达载体pRSFDuet 中在大肠杆菌中进行共表达。为了获得序列较短的多肽以便于后续的质谱分析,对非核心肽区域进行了突变,将-5 位点的Gln 替换为Lys从而引入胰蛋白酶酶切位点。利用镍亲和色谱纯化前体肽后,通过TEV 蛋白酶消化,获得经过PacB 修饰的一段多肽pacpeptide。对pacA+pacB共表达的纯化产物进行了高效液相色谱-质谱联用(LC-MS)分析,结果显示修饰后的PacA 与未修饰比分子量明显减少(减少了6)[图2(b)],表明可能在前体肽上形成了3 个C-C 键。进一步的串联质谱分析证实,这3 个键发生在C 端核心肽内的WVN、YAR 和 WTN 基序上,这与 Morinaka 等[22]报道的其他Xye家族的核糖体肽的翻译后修饰方式一致。胰蛋白酶消化共表达产物获得的肽pacpeptide,观察到[M+8H]8+为996.4891,分子量损失为6的片段1(残基-4至12)作为C端肽的主要片段[图2(c)]。串联质谱检测到碎片离子y12的[M+2H]2+为 789.3711,y9的[M+2H]2+为590.7846,y5的[M+2H]2+为721.3398(表4),表明分别在WVN(环A)和YAR(环B)间发生了脱氢环化,WTN(环C)之间的环化也在后续的天冬酰胺突变为丙氨酸后继续发生环化的实验中被进一步证实;同时串联质谱的检测中,未发现Arg7 和Trp8 之间的肽键水解片段,表明YAR 环烷(环B)的形成改变了肽段的拓扑结构从而干扰了胰蛋白酶的水解。在串联质谱数据中同时发现了少量的分子量损失为2 的片段2(残基-4 至7),以及分子量损失为2的片段3(残基8至12)。片段2的串联质谱发现分析y7'的[M+1H]1+为877.4315,y4'的[M+1H]1+为480.2569(表4);表明分子量损失源自WVN 环烷(环A)的形成[图2(c)]。这两个片段的存在表明PacB 对部分前体肽的后修饰中未生成环B,这也解释了胰蛋白酶对片段2 和3 之间肽键的良好水解效率的原因。
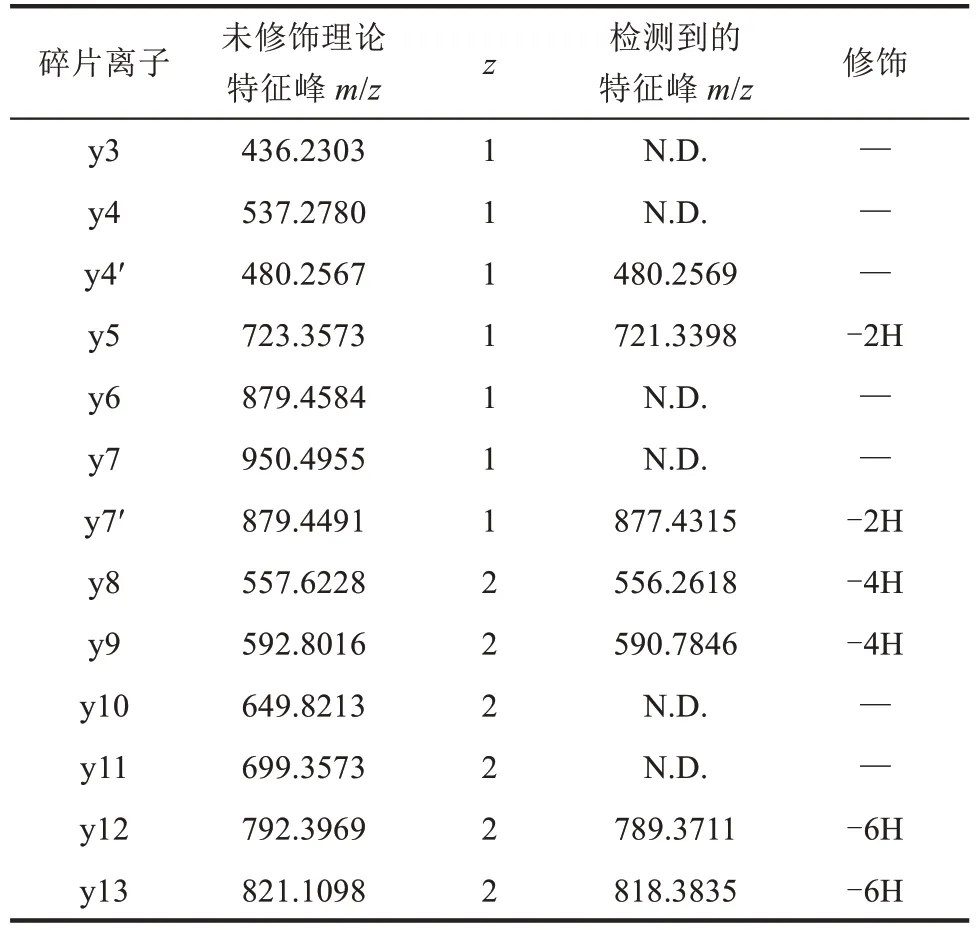
表4 修饰后产物串联质谱碎片信息Tab.4 MS/MS information of products
2.2 rSAM酶PacB的体外功能研究
为了进一步研究PacB功能和催化机制,rSAM酶PacB 在大肠杆菌中进行异源表达,在厌氧条件下纯化后进行[4Fe-4S]簇的重构,然后进行脱盐得到体外测活所用蛋白。通过表达纯化NHis6-MBP-PacA,经TEV 蛋白酶消化样品和高温热变性后,离心去除MBP 标签,得到前体肽PacA。然后进行体外活性测定,在厌氧条件下,反应体系中加入前体肽PacA、PacB酶以及还原剂和SAM情况下,未检测到PacA 的环化,可能的原因是高温可能破坏了前体肽的一些独特的空间结构,从而使PacB 不能底物识别而催化形成环化。进一步使用带有MBP 标签的前体肽作为底物。在相同的厌氧条件下与PacB 反应约2 h 后,将反应体系用TEV蛋白酶消化,加热并离心。观察到与未反应的肽相比分子量损失仅为2 的新产品[图3(a)]。在胰蛋白酶消化后观察到片段4[图3(b)],而不是片段3[图2(c)],表明没有C 环形成。同时,串联质谱证明片段2 和A 环的存在[图3(b)]。为了获得更多环化的产物,将反应时间延长至过夜。尽管几乎看不到分子量损失为4 的产物,但观察到分子量损失为6 的产物[图3(a)],揭示了PacB 酶的确具有催化3 个C-C 键形成的完整体外生物活性。
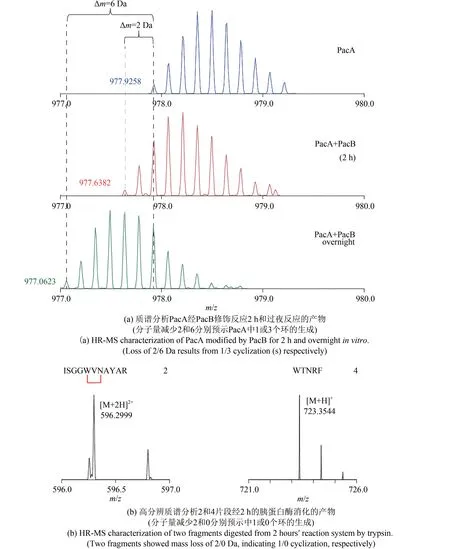
图3 PacB体外活性测定Fig.3 Characterization of the bioactivity of PacB in vitro
2.3 rSAM酶PacB的底物选择性研究
酶的底物多样性是天然产物结构多样性的源泉,PacB 催化芳香氨基酸的sp2碳和相邻第3 位氨基酸侧链的sp3碳之间形成C-C 键;首先将提供 sp3碳的 3 个氨基酸 Asn3、Arg7 和 Asn10 分别替换为侧链上只有1 个甲基的Ala;相对应的突变基因ΔpacA分别与pacB共表达。LC-MS 分析表明,与计算值相比,所有3 种产物的分子量损失仍为6[图4(a)],表明Ala 突变未能阻止任何环番的形成。这一结果揭示了PacB 对相关氨基酸残基侧链的高度底物耐受性,显示出巨大的基因工程改造的潜力。上面提到的3 个位点分别替换为Gly 后。由于侧链上没有碳原子,预测应该不能形成环化。共表达实验结果证实3 个突变位点(N3G、R7G、N10G)导致相应A、B、C 位置的环不能生成,而所有3 个突变中都观察到了4 的分子量减少[图4(b)],串联质谱也证明除了突变位点的环化受到影响,其他2 个环化未受影响,表明3 个环化是相互独立催化完成的。
2.4 PacB 介导的前体肽PacA 翻译后修饰顺序
上述的研究结果已证明PacB 的确能够催化前体肽3 个环番结构的形成,点突变实验也表明PacB对底物具有一定的宽泛性,3个位点环化可以独立催化完成,而不是互为先决条件。尽管如此,PacB 介导的前体肽PacA 翻译后修饰的体内共表达和体外活性重建实验中,均发现部分修饰的产物[图 2(c)、图 3(a)和图 4(b)],这些结果可以推断出3 种环化效率之间的明显差异,A 环的形成效率最高,B 环的形成效率最低。因此,对3 个环番结构形成顺序做了初步推定:首先形成环A,然后是形成C环,最后形成B环。
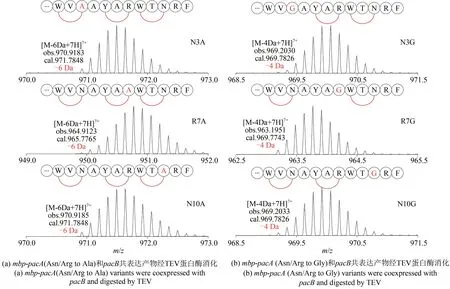
图4 高分辨质谱分析点突变前体肽ΔpacA+pacB共表达产物Fig.4 HR-MS analysis of pacA variants coexpressed with pacB
3 结 论
通过基因组挖掘方法从Photorhabdus australisDSM 17609的基因组挖掘到一个新的Xye类核糖体肽基因簇pac,通过体内外实验鉴定了rSAM 酶PacB催化前体肽后修饰过程中的3个环番结构的生成,PacB 属于一类新颖的三残基环番合成酶。将PacB底物即前体肽PacA中提供环番sp3碳的氨基酸替换为Ala的突变株能够正常发生3个环化,初步证明了PacB对底物有较高的容忍性,预示着具有通过基因工程改造核心肽氨基酸生成结构多样性的化合物的巨大潜力。前体肽中一个环番sp3碳供体氨基酸突变成Gly后,能够形成2个环的实验结果表明3个环番可以相互独立形成,不互为先决条件,但仍然能够通过这些体内外数据推断出环A和环B的形成分别具有最高和最低的形成效率,因此,初步假设首先形成环A,然后是形成C 环,最后形成B 环。与其他报道的Xye簇类似,pacA+pacB共表达产品pacpeptide对大肠杆菌或金黄色葡萄球菌没有表现出明显的抗菌活性。然而,因为近年来发现的核糖体肽类天然产物darobactin已被证明是一种针对革兰氏阴性病原体的强效抗生素,不能忽视这类酶修饰的新型RiPPs 化合物潜在的药学活性。对Xye 类核糖体肽生物合成中三残基环番合成酶催化功能的研究将为此类化合物的深入挖掘和合成生物制造奠定基础。

