基于内质网应激PERK信号通路探讨芍药汤对UC大鼠的作用机制
罗敏,杜英杰,姜燕诗,肖金银,林仁敬,李帅军


〔摘要〕 目的 通過检测内质网应激蛋白激酶R样内质网激酶(PERK)信号通路相关基因及蛋白的表达,探讨芍药汤治疗溃疡性结肠炎(UC)的作用机制。方法 100只SD大鼠建立胃肠湿热证模型后,随机抽取25只作为空白组,其余大鼠用三硝基苯磺酸法在其基础上建立UC大鼠模型后分为模型组、柳氮磺吡啶组、芍药汤组,每组25只。空白组、模型组利用生理盐水灌胃,柳氮磺吡啶组利用柳氮磺吡啶灌胃,芍药汤组利用芍药汤灌胃。在灌胃第7、14天,各组大鼠分别进行大鼠疾病活动指数(DAI)评分;同时各组随机处死数量相同的大鼠进行大鼠的结肠黏膜损伤指数(CMDI)评分;用Western blot法及RT-PCR法检测结肠组织PERK蛋白和mRNA的表达。结果 造模4 d后,各模型大鼠结肠组织可见溃疡面,并经病检证实,提示造模成功。与空白组比较,各组各时间点DAI评分、CMDI评分均增高(P<0.05)。(1)DAI评分:灌胃7、14 d时,柳氮磺吡啶组与芍药汤均低于模型组(P<0.05);灌胃14 d时,芍药汤组较柳氮磺吡啶组低(P<0.05)。(2)CMDI评分:灌胃7、14 d时,模型组、柳氮磺吡啶组均高于芍药汤组(P<0.05)。(3)p-PERK蛋白和mRNA的表达:灌胃7 d时,与空白组相比,模型组及柳氮磺吡啶组p-PERK蛋白和mRNA表达均升高(P<0.05);芍药汤组p-PERK蛋白和mRNA表达较模型组低(P<0.05);灌胃14 d时,与空白组相比,模型组及柳氮磺吡啶组p-PERK蛋白和mRNA表达均升高(P<0.05);芍药汤组p-PERK蛋白和mRNA表达较模型组及柳氮磺吡啶组低(P<0.05)。结论 芍药汤通过抑制胃肠湿热型UC大鼠结肠ESR过程中PERK信号通路的激活,从而改善UC大鼠的症状及体征,这可能是其治疗UC的作用机制。
〔关键词〕 芍药汤;溃疡性结肠炎;胃肠湿热型;内质网应激;PERK信号通路;DAI评分;CMDI评分
〔中图分类号〕R269 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.11.004
Mechanism of Shaoyao Decoction on UC Rats Based on Endoplasmic Reticulum
Stress PERK Signal Pathway
LUO Min, DU Yingjie, JIANG Yanshi, XIAO Jinyin, LIN Renjing, LI Shuaijun
(Proctology Department, The Second Affiliated Hospital of Hunan University of Chinese Medicine,
Changsha, Hunan 410005, China)
〔Abstract〕 Objective To investigate the mechanism of Shaoyao Decoction in the treatment of ulcerative colitis (UC) by detecting the expression of protein kinase R-like endoplasmic reticulum kinase (PERK) signal pathway related genes and proteins mediated by endoplasmic reticulum stress. Methods 100 SD rats were established the model of gastrointestinal dampness and heat syndrome, 25 rats from them were randomly selected as the blank group, and the rest of the rats were established with trinitrobenzene sulfolnic acid (TNBS) based on the model of gastrointestinal dampness and heat syndrome. They were divided into the model group, the sulfapyridine group and the Shaoyao Decoction group, with 25 rats in each group. The blank group and the model group were infused with saline, the sulfapyridine group was infused with sulfapyridine, and the Shaoyao Decoction group was infused with Shaoyao Decoction. On the 7th and 14th days, the rats in each group were scored with disease activity index (DAI). At the same time, the same number of rats in each group were randomly executed for scoring with colonic mucosal damage index (CMDI). Western blot method and RT-PCR method were used to detect the expression of PERK protein and mRNA in colon tissue. Results After 4 days of molding, the ulcer surface can be seen in the colon tissue of each model rat, and it was confirmed by the medical examination, indicating that the molding was successful. Compared with the blank group, the DAI score and CMDI score of each group had increased at each time period. (1) DAI score: on the 7th and 14th days, the sulfapyridine group and the Shaoyao Decoction group were lower than the model group (P<0.05); on the 14th day, the Shaoyao Decoction group was lower than the sulfapyridine group (P<0.05). (2) CMDI score: on the 7th and 14th days, the model group and the sulfapyridine group were higher than the Shaoyao Decoction group (P<0.05). (3) Expression of p-PERK protein and mRNA: on the 7th day, the model group and the sulfapyridine group were higher than the blank group (P<0.05); the Shaoyao Decoction group was lower than the model group (P<0.05); on the 14th day, the model group and the sulfapyridine group were higher than the blank group (P<0.05); the Shaoyao Decoction group was lower than the model group and the sulfapyridine group (P<0.05). Conclusion Shaoyao Decoction can improve the symptoms and signs of UC rats by inhibiting the activation of PERK signal pathway in the process of endoplasmic reticulum stress of colon in rats with UC of gastrointestinal dampness and heat syndrome, which may be the mechanism of its treatment of UC.
〔Keywords〕 Shaoyao Decoction; ulcerative colitis; gastrointestinal dampness and heat syndrome; endoplasmic reticulum stress; PERK signal pathway; DAI score; CMDI score
溃疡性结肠炎(ulcerative colitis, UC)是一种以结肠黏膜、黏膜下层病变为主,出现腹痛、腹泻、黏液脓血便、里急后重等临床表现的一种非特异炎症性肠病[1-2]。其发病机制尚不明确,目前认为可能是遗传易感性、免疫损伤和环境因素等联合引起[3]。UC在国外的发病率高达8~14/10万以上,在国内的发病率达2.05/10万以上,患病率逐年增加[4]。内质网应激(endoplasmic reticulum stress, ERS)是UC发病的重要因素,ERS出现时,机体为降解积累的未折叠肽链或错误折叠蛋白,多条通路被激活[5]。其中蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase, PERK)通路为主要通路,PERK通路被激活后引起核因子κB(nuclear factor kappa B, NF-κB)炎性通路激活,刺激促炎因子的分泌、炎性细胞的聚集,引发UC[6]。芍药汤是中医临床上治疗胃肠湿热型UC的常用方之一。本实验从UC大鼠的结肠ERS的PERK信号通路出发,对芍药汤治疗胃肠湿热型UC大鼠的作用机制进行探讨。
1 材料与方法
1.1 实验动物
SPF级SD大鼠100只,雄性,体质量(200±20) g。购自湖南斯莱克景达实验动物有限公司,动物质量合格证号:1107271911002957,饲养于湖南中医药大学动物实验中心。实验过程通过了湖南中医药大学实验动物伦理委员会审查批准(编号:LLBH-201910080002)。
1.2 主要药品
1.2.1 中药 芍药汤具体药物如下:芍药30 g,当归15 g,黄连15 g,黄芩15 g,槟榔6 g,木香6 g,炙甘草6 g,大黄9 g,肉桂5 g,由湖南中医药大学第二附属医院中药颗粒药房(华润三九)提供,使用时生理盐水冲兑,使含生药量质量浓度为1.3 g/mL。实验动物的用药剂量按照动物与人体间的等效剂量换算[7](大鼠剂量=人体剂量×换算系数=107 g/50 kg×6.17=13.20 g/kg)。
1.2.2 西药 柳氮磺吡啶片(规格0.25 g/片,批号:31020557,上海信谊天平药业有限公司)。研粉后过100目筛,使用时生理盐水冲兑,使药物浓度为0.03 g/mL[成人临床剂量0.04~0.06 g/(kg·d),大鼠等效剂量0.25~0.37 g/kg,本实验大鼠等效剂量取0.3 g/kg]。
1.3 主要试剂
P-PERK 抗体(美国Bioss公司,批号:ab229812);β-actin抗体(批号:56462);IgG抗体(批号:SAB43714)均购自美国Bioswamp公司;2,4,6-三硝基苯磺酸(美国Sigma公司,批号:SLBD631V);BCA蛋白浓度测定试剂盒(Solarbio公司,批号:20191228);Trizol(上海博耀生物科技有限公司,批号:94206);水合氯醛(天津市大茂化学试剂公司,批号:20191214)。
1.4 主要仪器
实时荧光定量PCR仪(德国艾本德公司,型号:realplex2);PCR扩增仪(型号:T100 thermal cycler)、化学发光凝胶成像系统(型号:XRS+Imager)均购自美国Bio-Rad公司;台式高速冷冻离心机(德国HERMLE公司,型号:Z32HK);核酸水平电泳仪(北京百晶生物技术有限公司,型号:BG-SUHWIDI);核酸蛋白浓度测定仪(英国BioDrop公司,型号:BD1106)。
1.5 造模与分组
适应性喂养4 d后,将大鼠编号后随机分为空白组、模型组、柳氮磺吡啶组、芍藥汤组,每组25只。参照文献[8-9]制做大鼠胃肠湿热型模型。10 d后行UC大鼠造模,造模前禁食24 h,按照3 mL/kg用10%水合氯醛进行腹腔注射麻醉,待大鼠完全麻醉后,空白组用生理盐水灌肠,其余大鼠采用三硝基苯磺酸灌肠法制作UC大鼠模型[10]。造模4 d后,各组随机抽取1只处死并解剖,观察肠管组织。距肛缘6~10 cm处肉眼可见溃疡面,病理检查发现炎性改变及典型溃疡面时,即造模成功[10]。
1.6 给药方法
造模成功第2天芍药汤组按照含生药量1.3 g/mL的芍药汤剂灌胃2 mL,每天1次;柳氮磺吡啶组按照药物浓度0.03 g/mL的柳氮磺吡啶溶液灌胃2 mL,每天1次;模型组、空白组予等体积的生理盐水灌胃,每天1次。
1.7 标本采集与处理
分别于第一次灌胃前、灌胃7、14 d时,抓取大鼠后按揉腹部诱导排便或用粪匙刮取肛门部残留粪便,观察是否有肉眼可见血便,后置于粪便瓶中。分别于灌胃7、14 d时在空白组、模型组、柳氮磺吡啶组、芍药汤组中随机取10只大鼠,脱颈椎法处死大鼠,取血后迅速剖腹,取出距肛门以上8 cm处结肠段,沿肠系膜缘剪开肠腔,用冷PBS缓冲液冲洗肠内容物,肉眼观察各组大鼠肠组织大体形态并进行评分,于病变最明显处剖取标本,所取标本均分为2份,分别用生理盐水冲洗两遍后,迅速放置于液氮中冷冻,用于Western bolt检测及RT-PCR检测。
1.8 观察指标
1.8.1 大鼠疾病活动指数(disease activity index, DAI)评分 分别于第1次灌胃前、灌胃7、14 d时观察各组大鼠大便、体质量、活动度及精神状态,进行DAI评分,DAI =(体质量下降分数+大便性状分数+便血分数)/3。积分为0~4分。0分:大便性状正常,无隐血,体质量无下降;1分:大便性状正常,大便无隐血,体质量下降1%~5%;2分:大便松散,大便隐血阳性,体质量下降5%~10%;3分:大便松散,大便隐血阳性,体质量下降10%~15%;4分:稀便,肉眼血便,體质量下降>15%[11]。
1.8.2 大鼠的结肠黏膜损伤指数(colonic mucosal
damage index, CMDI)评分 剖取结肠,将肠系膜及粘连组织彻底清理,并沿肠系膜纵轴剪开肠管,用生理盐水将其充分冲洗干净,平铺于滤纸上,肉眼观察,进行CMDI评分。积分为0~5分,0分:无损伤;1分:充血但没有溃疡;2分:充血而且肠壁变厚,但没有溃疡;3分:有一处小溃疡,直径约0~1 cm;4分:溃疡较大,直径1~2 cm,但肠管与外周脏器无粘连;5分:溃疡直径1~2 cm,肠管增厚,与周围脏器粘连严重[12]。
1.8.3 大鼠结肠组织p-PERK蛋白表达水平 采用Western blot法检测大鼠结肠组织p-PERK蛋白表达水平。将组织剪成细小的碎片,按照比例加入裂解液,匀浆器匀浆直至完全裂解。裂解完成后,取适量样品在温度4 ℃下,离心机持续离心15 min,其后取上层清亮液,进行蛋白质定量检测,随后将其贮存于冰箱中,贮存温度为-80 ℃。上述提取的蛋白经10% SDS-PAGE电泳分离后转移至PVDF膜上,5%脱脂奶粉室温封闭2 h或4 ℃过夜,p-PERK抗体随后添入封闭液中,稀释后在4 ℃模型组利用生理盐水灌胃的条件下孵育12 h,再与HRP标记的二抗进行反应。最终进行ECL化学发光检测,将膜置于全自动化学发光分析仪中检测,通过Image J软件读取相关条带灰度值。
1.8.4 大鼠结肠组织中p-PERK mRNA表达水平 Trizol法提取RNA后,采用RT-PCR法对p-PERK mRNA进行检测,PERK-反向ATGACGAGGGACACTGCT?鄄TTGAAC;PERK-正向CTCTGGGCTCTTCTTTGCTGGATG,扩增长度为135 bp;内参β-actin-反向CCAGG?鄄
TCATCACCATCGG;β-actin-正向TGTCC?鄄AGGTCGCACTTCA,扩增长度为131 bp;采用2-△△Ct值进行相对定量,表示该基因的相对表达水平,△Ct=基因Ct-内参Ct,△△Ct=实验组△Ct-对照组△Ct。
1.9 统计学方法
采用SPSS 22.0软件统计数据,计量资料以“x±s”表示,若符合正态性检验和方差齐性检验,两样本均数间的比较采用t检验,多个样本间的比较采用单因素方差分析;对于不符合正态性检验和方差齐性检验的,两样本均数间的比较采用Wilcoxon秩和检验,多个样本间的比较采用Kruskal-Wallis H检验,以P<0.05为差异有统计学意义。
2 结果
造模4 d后,造模组大鼠距离肛缘6~10 cm可见溃疡面,病理检查证实为炎性改变或典型溃疡面,空白组大鼠该部分结肠黏膜未见上述改变。造模及给药7 d内空白组死亡1只,模型组死亡3只,柳氮磺吡啶组死亡4只,芍药汤组死亡3只,给药7 d后模型组死亡1只。解剖发现腹腔有粪便,结肠肿胀,粪便堆积,与周围组织粘连,部分肠管穿孔,疑为肠梗阻导致的肠穿孔致死。最终各组大鼠数目分别为空白组23只、模型组20只、柳氮磺吡啶组20只、芍药汤组21只。
2.1 各组大鼠DAI评分比较
在灌胃7 d时,模型组、柳氮磺吡啶组、芍药汤组DAI评分均较空白组明显增高(P<0.05),柳氮磺吡啶组与芍药汤组DAI评分差异无统计学意义(P>0.05),但均低于模型组(P<0.05);在灌胃14 d时模型组、柳氮磺吡啶组、芍药汤组DAI评分均较空白组明显增高(P<0.05),模型组DAI评分高于柳氮磺吡啶组及芍药汤组(P<0.05),柳氮磺吡啶组DAI评分高于芍药汤组(P<0.05)。模型组DAI评分在灌胃14 d时明显高于灌胃7 d时(P<0.05),柳氮磺吡啶组DAI评分在灌胃14 d时与灌胃7 d时比较,差异无统计学意义(P>0.05),芍药汤组DAI评分在灌胃14 d时明显低于灌胃7 d时(P<0.05)。见表1。
2.2 各组大鼠CMDI评分比较
在灌胃7 d时,模型组、柳氮磺吡啶组、芍药汤组CMDI评分均较空白组明显增高(P<0.05),模型组CMDI评分与柳氮磺吡啶组比较,差异无统计学意义(P>0.05),但均高于芍药汤组(P<0.05);在灌胃14 d时,模型组、柳氮磺吡啶组、芍药汤组CMDI评分均较空白组明显增高(P<0.05),模型组CMDI评分与柳氮磺吡啶组差异无统计学意义(P>0.05),但均高于芍药汤组(P<0.05)。各组CMDI评分在灌胃7 d时与灌胃14 d时比较,差异均无统计学意义(P>0.05)。见表2。
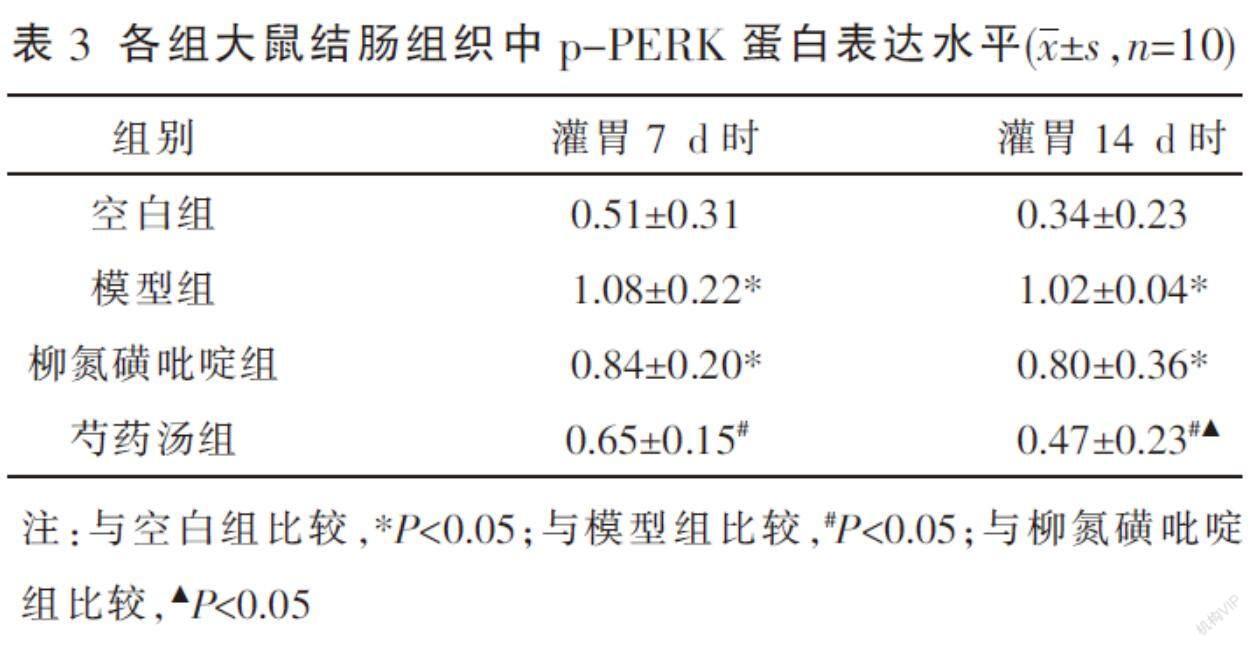
2.3 各组大鼠结肠组织中p-PERK蛋白表达水平比较
灌胃7 d时,模型组、柳氮磺吡啶组p-PERK蛋白表达水平较空白组升高(P<0.05),空白组和芍药汤组、柳氮磺吡啶组之间、模型组和柳氮磺吡啶组之间p-PERK蛋白表达水平差异无统计学意义(P>0.05),芍药汤组p-PERK蛋白表达水平较模型组低(P<0.05)。灌胃14 d时,模型组、柳氮磺吡啶组p-PERK蛋白表达水平均较空白组高(P<0.05),芍药汤组与空白组差异无统计学意义(P>0.05),但较模型组与柳氮磺吡啶组低(P<0.05),模型组和柳氮磺吡啶组差异无统计学意义(P>0.05)。各组灌胃7 d时与灌胃14 d时比较,差异无统计学意义(P>0.05)。见表3、图1。
2.4 各组大鼠结肠组织中p-PERK mRNA表达水平比较
灌胃7 d时,模型组、柳氮磺吡啶组、芍药汤组p-PERK mRNA表达水平均较空白组升高(P<0.05),模型组p-PERK mRNA表达水平较柳氮磺吡啶组、芍药汤组均高(P<0.05),柳氮磺吡啶组p-PERK mRNA表达水平较芍药汤组高(P<0.05);灌胃14 d时,模型组、柳氮磺吡啶组p-PERK mRNA表达水平较空白组均高(P<0.05),空白组和芍药汤组p-PERK mRNA表达水平差异無统计学意义(P>0.05),模型组与柳氮磺吡啶组p-PERK mRNA表达水平比较,差异无统计学意义(P>0.05),但模型组与柳氮磺吡啶组均较芍药汤组高(P<0.05)。空白组和模型组p-PERK mRNA表达水平在灌胃7 d时与灌胃14 d时比较,差异无统计学意义(P>0.05),柳氮磺吡啶组和芍药汤组p-PERK mRNA表达水平在灌胃7 d时较灌胃14 d时高(P<0.05)。见表4。
3 讨论
ERS是由于错误折叠蛋白或未折叠蛋白过多聚集等被激活后,机体通过多种信号通路及其相关的转录因子进行的一系列复杂的反应[13-14]。适度的ERS可维持细胞稳态,但过度持续的ERS可导致细胞内正常蛋白的分解,引起细胞的破坏,导致肠黏膜屏障功能受损,进而引发UC的发生[15-16]。而ERS主要通过3种信号通路来介导炎性因子的分泌,其中PERK通路与UC发病关系最为密切[17]。ERS发生时,PERK通路被激活,催化底物真核翻译起始因子2a(eukaryotic translation initiation factor 2a, eIF2a)发生磷酸化,eIF2a磷酸化后,一方面抑制蛋白质的翻译和合成,降低内质网中错误折叠蛋白的积累,减轻内质网压力;另一方面磷酸化的eIF2a可促进转录活化因子4中mRNA的选择性翻译,进而上调CHOP,可诱导细胞的凋亡和自噬,另外,还可通过细胞内信号传导引起NF-?资B的激活,然后刺激促炎因子的分泌,促进炎性细胞的聚集[6]。大量炎性细胞和炎性细胞因子作用于局部肠道黏膜,诱发UC[3]。由此可见,ERS过程中PERK信号通路通过调控炎性因子的表达在UC的发生、发展中起着重要的作用。
本研究中,在灌胃7、14 d时,芍药汤组大鼠的DAI评分及CMDI评分均较模型组低(P<0.05),灌胃14 d时,柳氮磺吡啶组的DAI评分及CMDI评分高于芍药汤组(P<0.05),说明相比于柳氮磺吡啶,芍药汤对UC治疗效果更好。模型组大鼠的p-PERK蛋白及mRNA的表达水平较空白组上升(P<0.05),说明持续存在的应激可诱导PERK高表达。与模型组相比,灌胃7、14 d时,芍药汤组的p-PERK蛋白及mRNA表达均降低(P<0.05),灌胃14 d时,芍药汤组的p-PERK蛋白及mRNA表达较柳氮磺吡啶组低(P<0.05),表明芍药汤抑制p-PERK表达的作用较明显,由此可推测芍药汤可能通过抑制PERK信号通路来调控ERS,可减少细胞破坏,达到治疗UC的目的。
UC在传统中医书籍并无特定名,其与“肠澼”“泄泻”“痢疾”等类似[18]。对于UC的发病基础,中医认为是素体脾胃虚弱,或外感邪气、或饮食不节、或情志内伤诱发UC。UC病位在大肠,且与肺、肝、脾、肾有关,其基本病理因素为湿、热、瘀、毒、虚。UC的病机多为本虚标实之证,其活动期多被认为是湿热蕴结肠道,气血经络不调;缓解期多被认为脾肾两虚的正虚邪恋[19-20]。对于胃肠湿热型UC的治疗多选用具有清热燥湿、调气和血之效的芍药汤,方中以黄芩、黄连苦寒清热燥湿解毒为君,以木香、槟榔行气导滞,芍药和血调营、柔肝缓急,当归行血活瘀,4药相合调和气血为臣,佐以大黄泻下通腑、破积除滞以通因通用的治疗法则,共奏“行血则便脓自愈,调气则后重自除”之功,在通的同时以肉桂防苦寒伤中、甘草调和气血。诸药合参,使湿热祛之有道,气血调畅通达,从而使得下痢、便脓、腹痛诸症由此得愈。
本实验研究发现,芍药汤对UC大鼠症状有明显改善,对UC大鼠结肠PERK信号通路有较为明显的抑制作用。故本研究认为芍药汤治疗胃肠湿热型UC可能是通过抑制大鼠结肠组织中PERK信号通路来调控ERS而实现的。
参考文献
[1] VARYANI F, ARGYRIOU K, PHILLIPS F, et al. Profile of tofacitinib in the treatment of ulcerative colitis: An evidence-based review of recent data[J]. Drug Design, Development and Therapy, 2019, 13: 4091-4105.
[2] 甄建华,黄光瑞.溃疡性结肠炎病因和发病机制的现代医学研究进展[J].世界华人消化杂志,2019,27(4):245-251.
[3] 崔畅婉,孙峥嵘.溃疡性结肠炎发病机制研究进展[J].现代免疫学,2019,39(1):77-81.
[4] 何 琼,李建栋.炎症性肠病流行病学研究进展[J].实用医学杂志, 2019,35(18):2962-2966.
[5] 顾思臻,窦丹波.内质网应激与溃疡性结肠炎病变机制的研究现状[J].中国中西医结合消化杂志,2017,25(2):156-159.
[6] 郑 烈,戴彦成,张亚利,等.内质网应激信号分子PERK在溃疡性结肠炎肠黏膜损伤中的研究进展[J].世界华人消化杂志,2015,23(34):5493-5498.
[7] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[8] 申 睿,刘 苗,朱向东,等.溃疡性结肠炎大鼠实验模型研究进展[J].中华中医药杂志,2018,33(9):3998-4001.
[9] 罗 毅.清肠解毒汤对溃疡性结肠炎湿热证大鼠结肠黏膜病理组织学改变及NF-κBp65表达影响[J].四川中医,2019,37(5):56-60.
[10] 周亚妮,宋 云.2,4,6-三硝基苯磺酸诱导灌肠法建立炎症性肠病模型的实验研究[J].现代中西医结合杂志,2020,29(22):2420-2423,2436.
[11] 王 宽,刘慧荣,吴焕淦,等.维生素D参与隔药灸对溃疡性结肠炎大鼠结肠的影响研究[J].世界中医药,2020,15(14):2053-2062.
[12] 王生华,朱 莹,王 霈,等.基于Nrf2通路探讨溃结宁膏穴位敷贴治疗溃疡性结肠炎的作用机制[J].中国中西医结合杂志,2021, 41(8):951-958.
[13] M?魣RTON M, KURUCZ A, LIZáK B, et al. A systems biological view of life-and-death decision with respect to endoplasmic Reticulum stress—the role of PERK pathway[J]. International Journal of Molecular Sciences, 2017, 18(1): 58.
[14] YIN S J, LI L H, TAO Y, et al. The inhibitory effect of artesunate on excessive endoplasmic Reticulum stress alleviates experimental colitis in mice[J]. Frontiers in Pharmacology, 2021, 12: 629798.
[15] 梁 君,崔梅花.内质网应激与溃疡性结肠炎[J].国际消化病杂志, 2016,36(3):133-135.
[16] 沈 雁,倪思忆,郑华君,等.甘草泻心汤调控PERK-elF2α-CHOP信号通路保护溃疡性结肠炎肠黏膜屏障的机制[J].中华中医药杂志,2021,36(5):2657-2663.
[17] MA X S, DAI Z L, SUN K J, et al. Intestinal epithelial cell endoplasmic Reticulum stress and inflammatory bowel disease pathogenesis: An update review[J]. Frontiers in Immunology, 2017, 8: 1271.
[18] 彭西兰,张洁瑜,刘远成,等.中药保留灌肠治疗湿热内蕴型溃疡性结肠炎的临床研究[J].湖南中医药大学学报,2019,39(11):1395-1398.
[19] 张声生,沈 洪,郑 凯,等.溃疡性结肠炎中医诊疗专家共识意见(2017)[J].中华中医药杂志,2017,32(8):3585-3589.
[20] 崔世超,柳越冬.潰疡性结肠炎的中医治疗思路[J].辽宁中医杂志,2017,44(7):1381-1384.
(本文编辑 匡静之 周 旦)

