大戟脂有效部位及大戟二烯醇抗炎镇痛作用研究*
刘婧,刘燕,赵军,李亚杰,顾政一
(1.石河子大学药学院,石河子 832000;2.新疆维吾尔自治区药物研究所,乌鲁木齐 830004;3.新疆医科大学药学院,乌鲁木齐 830011)
大戟脂为大戟科植物多脂大戟(EuphorbiaresiniferaBerg.)的树脂状分泌物。原产于摩洛哥中部、欧洲,非洲亦产[1]。大戟脂有两千年的药用历史,自罗马时代就被广泛使用,最早记载于阿维森纳所著的《医典》之中,是现在仍在使用的一种维吾尔传统药材[2]。目前发现大戟脂中主要含有二萜、三萜、生物碱、黄酮、酚酸等成分,其中萜类化合物含量较多[3-6]。在传统作用中,大戟脂具有强筋健骨、散寒止痛、燥湿退肿、除白内障等功效[7]。本课题组前期专利ZL201710119132.X报道了大戟脂药材中大戟二烯醇的制剂及其在治疗白内障上的应用[8]。除此之外,大戟脂在药理作用上研究相对薄弱,现有研究主要集中在化学成分分离方面。基于此,本研究通过经典的抗炎镇痛动物模型[9-13],研究了大戟脂有效部位和大戟二烯醇抗炎镇痛作用,以期为大戟脂药材的药效学研究提供基础数据支持。
1 材料与方法
1.1实验动物 昆明(KM)种小鼠,无特定病原体(SPF)级,体质量18~22 g,购自新疆医科大学动物实验中心,动物生产许可证号:SCXK(新)2018-0001,动物使用许可证号:SYXK(新)2018-0003。动物饲养于新疆维吾尔自治区药物研究所SPF级动物实验房,室温(22±2) ℃,相对湿度(50±5)%,实验前适应性喂养3 d,期间自由饮食饮水,喂养标准饲料。
1.2药物及试剂 大戟脂药材于2018年8月购自新疆济人药业有限公司(批号:201706001),经新疆维吾尔自治区药物研究所何江副研究员鉴定为大戟科植物多脂大戟E.resiniferaBerg的树脂状分泌物,使用前粉碎,过40目(425 μm)筛,备用。
吲哚美辛肠溶片(山西云鹏制药有限公司,批号:G190605。使用前去除包衣,用研钵研细);伊文思蓝(美国 Sigma 公司,批号:MKBQ3656V);福尔马林(天津市致远化学试剂有限公司,批号:20140502);注射用氨苄西林钠(四川显华动物药业有限公司,批号:20190801);水合氯醛、甲醛、冰醋酸、二甲苯,石油醚、乙酸乙酯等均为市售分析纯。
1.3仪器 DZF-6090型真空干燥箱(上海精宏实验设备有限公司);GJ-8402型热板测痛仪(浙江宁海白石电子医药仪器厂);80-2型台式低速离心机(中国江苏金坛市医疗仪器厂);DSX-30L型手提式高压蒸汽灭菌器(上海申安医疗器械厂);AL204型电子天平[梅特勒-托利多仪器(上海)有限公司,感量0.1 mg]。
1.4方法
1.4.1样品的制备 有效部位的制备:取粉碎后的大戟脂药材140 g,加20倍量的95%乙醇加热回流提取3次,每次1.5 h,合并提取液,减压浓缩至浸膏。湿法上柱(硅胶填料量为上样量的10倍),干法上样。依次用石油醚、石油醚:乙酸乙酯=19:1洗脱,收集石油醚:乙酸乙酯=19:1部分的洗脱液,减压浓缩,真空干燥,即得大戟脂有效部位14.93 g,其中大戟二烯醇含量为47.03%。取有效部位固体适量,研细,备用,记为“EPE”。
1.4.2大戟二烯醇单体的制备 按“1.4.1”项下方法操作,洗脱液为石油醚:乙酸乙酯=19:1时,每250毫升接一瓶流份,经TLC薄层鉴别后,收集纯度较高的部分,记为“Fr1”。取Fr1部分,干法上柱,过C8减压柱,用90%甲醇洗脱,经TLC薄层鉴别后收集纯度较高的部分,甲醇反复重结晶,即得大戟二烯醇单体[经碳谱(13C-NMR)和氢谱(1H-NMR)鉴别为大戟二烯醇,纯度>95%]。取大戟二烯醇单体适量,研细,备用,记为“E”。
1.4.3分组及给药方案 取KM小鼠80只,雌雄各半,体质量18~22 g,按体质量随机分为8组,每组10只,分别为模型对照组(0.5%CMC-Na溶液)、吲哚美辛组(10 mg·kg-1)、大戟脂有效部位(E)小剂量组(15 mg·kg-1)、大戟脂有效部位(E)中剂量组(30 mg·kg-1)、大戟脂有效部位(E)大剂量组(60 mg·kg-1)和大戟二烯醇(EPE)小剂量组(7.5 mg·kg-1)、大戟二烯醇(EPE)中剂量组(15 mg·kg-1)、大戟二烯醇(EPE)大剂量组(30 mg·kg-1)。阳性药吲哚美辛、大戟脂有效部位和大戟二烯醇均用0.5% CMC-Na溶液溶解,超声后得到混悬液。连续 4 d灌胃给药,每天1 次,给药量按小鼠体质量计算,每1克给药0.02 mL。
1.4.4小鼠耳肿胀实验 分组及给药同“1.4.3”。末次给药1.5 h后,在每只小鼠右耳廓正反两面均匀涂抹二甲苯25 μL,左耳不涂为正常耳对照,30 min后将小鼠处死,用打孔器(6 mm)在靠近双耳的外耳线处同一位置打下耳片,用电子分析天平称重,计算肿胀度及肿胀抑制率。肿胀度=右耳片重量-左耳片重量。肿胀抑制率(%)=(模型对照组平均肿胀度-给药组平均肿胀度)/模型对照组平均肿胀度×100%。
1.4.5毛细血管通透性实验 分组及给药同“1.4.3”。末次给药1.5 h后,在小鼠尾静脉注射0.5%依文思蓝溶液0.01 mL·g-1,随即每只小鼠腹腔注射0.8%冰醋酸溶液0.2 mL,20 min后处死小鼠,将6 mL0.9%氯化钠溶液注射进小鼠腹腔,轻揉洗涤腹腔后收集洗涤液,洗液以3000 r·min-1离心10 min(r=8 mm),取上清液在波长590 nm处测定吸光度(A)值,计算渗出抑制率。抑制率(%)=(模型对照组平均A值-给药组平均A值)/模型对照组平均A值×100%。
1.4.6棉球肉芽肿实验 经预实验得到麻醉剂量为5%水合氯醛0.006 mL·g-1。取KM小鼠85只,腹腔注射麻醉小鼠,仰卧位固定,将小鼠左右腹股沟处剃毛后消毒,在腹股沟处分别剪开皮肤小口并植入大小和形状相同的棉球(质量为5 mg,棉球经高温高压灭菌后打入浓度为10 g·L-1的注射用氨苄西林30 μL,烘干),缝合皮肤后消毒。第二天取植入棉球后苏醒的小鼠80只,按“1.4.3”项分组及给药。连续7 d灌胃给药,每天1次。第7天给药1.5 h后,处死小鼠,取出棉球,剔除脂肪组织,于60 ℃下烘干24 h。将棉球称质量,计算肉芽组织干重及肉芽肿抑制率。肉芽组织干质量=棉球肉芽干质量-棉球原质量;肉芽肿胀抑制率(%)=(模型对照组肉芽肿平均质量-给药组肉芽肿平均质量)/模型对照组肉芽肿平均质量×100% 。
1.4.7扭体实验 分组及给药同“1.4.3”项。末次给药1.5 h后腹腔注射0.8%醋酸溶液0.2 mL,观察并记录小鼠的反应潜伏期和小鼠在15 min内的扭体次数,计算抑制率。抑制率(%)=(模型对照组平均扭体次数-给药组平均扭体次数)/模型对照组平均扭体次数×100%。
1.4.8热板实验 将热板测痛仪温度调节在(55±0.5) ℃,取100只雌性KM小鼠置于热板上,痛阈值在5~30 s内为合格小鼠(测两次取平均值)。取合格雌性小鼠80只,分组及给药同“1.4.3”项。分别于末次给药后60,120 min 测小鼠痛阈值(测两次取平均值),计算痛阈提高百分率。痛阈提高百分率(%)=(给药后痛阈值-给药前痛阈值)/给药前痛阈值×100%。
1.4.9福尔马林致痛实验 分组及给药同“1.4.3”项。末次给药1.5 h后,在小鼠右后足皮下注射1.0%甲醛30 μL,立即将小鼠置于透明容器内,观察并记录小鼠在 Ⅰ 相反应(0~5 min)和 Ⅱ 相反应(15~30 min)的舔、咬足时间,以每一相的累计时间作为动物疼痛反应强度的指标。
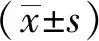
2 结果
2.1小鼠耳肿胀实验结果 与模型对照组比较,吲哚美辛组(10 mg·kg-1)和E大剂量组(30 mg·kg-1)能明显抑制二甲苯引起的小鼠耳肿胀(P<0.01),E中剂量组(15 mg·kg-1)对二甲苯引起的小鼠耳肿胀的抑制作用具有显著性(P<0.05)。EPE和E抑制作用与剂量呈正相关。E大剂量组(30 mg·kg-1)抑制率为23.41%,其值小于经典抗炎药吲哚美辛(抑制率为36.79%)。实验结果说明EPE和E具有一定的抗炎作用,但其作用小于阳性药吲哚美辛。见表1。

表1 EPE和E对小鼠耳肿胀的影响
2.2毛细血管通透性实验结果 与模型对照组比较,吲哚美辛组(10 mg·kg-1)、EPE大剂量组(60 mg·kg-1)和E大剂量组(30 mg·kg-1)对醋酸致小鼠毛细血管通透性升高具有显著的抑制作用(P<0.01,P<0.05),抑制率与剂量有关。EPE和E大剂量组的抑制率分别为20.01%、21.48%,二者抑制率小于阳性组药吲哚美辛(抑制率为29.34%)。实验结果说明EPE和E均具有抗炎作用,但其抗炎作用小于阳性药吲哚美辛。见表2。

表2 EPE和E对小鼠毛细血管通透性的影响
2.3棉球肉芽肿实验结果 与模型对照组比较,吲哚美辛组(10 mg·kg-1)、EPE大剂量组(60 mg·kg-1)和E大剂量组(30 mg·kg-1)对抑制小鼠棉球肉芽肿的质量具有极显著性(P<0.01),E中剂量组(15 mg·kg-1)也可使小鼠棉球肉芽肿质量显著下降(P<0.05),其中吲哚美辛组的抑制率为43.19%,给药组的抑制率均小于吲哚美辛组的抑制率。实验结果表明EPE和E均具有抗炎作用,但其作用弱于吲哚美辛。见表3。
2.4扭体实验结果 与模型对照组比较,吲哚美辛组(10 mg·kg-1)显著延长了小鼠扭体的潜伏期,并显著降低了小鼠扭体次数(P<0.01),EPE大剂量组(60 mg·kg-1)和E大剂量组(30 mg·kg-1)能明显减少小鼠的扭体次数(P<0.05,P<0.01),说明EPE和E具有一定的镇痛作用。见表4。
2.5热板实验结果 与模型对照组比较,给药60 min后,吲哚美辛组(10 mg·kg-1)、EPE大剂量组(60 mg·kg-1)和E中、大剂量组(30、60 mg·kg-1)对痛阈值的抑制具有极显著性(P<0.01),且E大剂量组的痛阈值抑制率与吲哚美辛相当。EPE中剂量组(30 mg·kg-1)的平均痛阈值亦具有统计学意义(P<0.05)。给药120 min后,EPE大剂量组(60 mg·kg-1)和E大剂量组(30 mg·kg-1)对痛阈值的抑制作用仍具有显著性差异(P<0.05),且阈值提高百分率均大于吲哚美辛。结果说明给药60 min和120 min后,大戟脂EPE和E对小鼠热板模型具有良好镇痛作用。见表5。

表3 EPE和E对小鼠肉芽肿的影响

表4 EPE和 E对小鼠扭体反应的影响
2.6福尔马林致痛实验结果 与模型对照组比较,吲哚美辛组(10 mg·kg-1)能明显减少福尔马林引起的小鼠 Ⅰ 相和 Ⅱ 相疼痛反应(P<0.05,P<0.01),且抑制 Ⅱ 相疼痛反应的效果优于 Ⅰ 相;EPE大剂量组(60 mg·kg-1)和E小剂量组(7.5 mg·kg-1)对缩短小鼠 Ⅰ 相舔、咬足时间差异有统计学意义(P<0.05),E中、大剂量组(15、30 mg·kg-1)能极显著的缩短小鼠 Ⅰ 相舔、咬足时间(P<0.05,P<0.001)。但EPE和E对抑制 Ⅱ 相疼痛反应效果不显著,显示出大戟脂EPE和E具有较好的 Ⅰ 相镇痛作用,能明显减轻福尔马林引起的 Ⅰ 相疼痛,但对 Ⅱ 相疼痛的镇痛效果不明显,提示其作用机制可能为中枢镇痛。见表6。

表5 EPE和E对小鼠热板模型痛阈值的影响

表6 EPE和E对福尔马林致痛的影响
3 讨论
通过二甲苯致小鼠耳肿胀实验和小鼠毛细血管通透性实验研究了大戟脂有效部位和大戟二烯醇对急性炎症的影响,采用小鼠棉球肉芽肿实验研究了大戟脂有效部位和大戟二烯醇对慢性炎症的影响[9]。实验结果表明,大戟脂有效部位和大戟二烯醇可显著减小二甲苯所致的小鼠耳肿胀度,降低醋酸导致的小鼠毛细血管通透性,并能显著抑制小鼠棉球肉芽肿的增生,表明大戟脂具有良好的抗炎作用,但其抗炎作用弱于阳性药吲哚美辛。
扭体实验是研究镇痛药的经典方法,热板实验是筛选中枢镇痛药的常用手段[10]。根据扭体实验结果,2个药物的大剂量组可明显减少醋酸导致的小鼠扭体次数,延长小鼠对热刺激产生疼痛的时间。热板实验显示,给药后60 min,大戟脂有效部位中、大剂量组和大戟二烯醇中、大剂量组对降低小鼠热板痛阈值具有显著性差异,且给药后120 min,大戟脂有效部位大剂量组和大戟二烯醇大剂量组仍具有镇痛作用。福尔马林致痛模型的Ⅰ相反应为中枢神经系统引起的疼痛,Ⅱ相反应为外周神经系统引起的疼痛,由此可初步推测药物发挥镇痛效果的作用机制。由福尔马林致痛实验结果可知,大戟脂有效部位大剂量组和大戟二烯醇低、中、大剂量组均能明显减轻福尔马林实验的Ⅰ相疼痛反应,表明大戟脂具有良好的Ⅰ相镇痛作用,提示其镇痛作用机制可能在中枢。
综上所述,通过经典的抗炎镇痛实验显示出大戟脂有效部位和大戟二烯醇具有良好的抗炎镇痛作用,且呈现一定的量效关系,其中以大戟二烯醇大剂量组效果最好。目前关于大戟脂的药效学研究相对薄弱,本实验也并未对其确切的抗炎镇痛机制进行深入研究,后续实验将进一步对大戟脂的药理作用进行探索,开发其药用价值。

