抑制miR-155对心肌缺血/再灌注模型心肌细胞凋亡及炎性反应的影响
朱新华,刘蓓蓓,侯静雯,李秋影,许慧娟,张晓阳
(新疆医科大学第五附属医院 老年病科,新疆 乌鲁木齐 830000)
心肌缺血/再灌注(myocardial ischemia-reperfusion,MI/R)损伤是心血管手术并发症(如心律失常)、心肌细胞凋亡及心功能下降等发生的重要原因[1]。目前,微小RNA(microRNA,miRNA)在心血管疾病发生发展过程中发挥重要作用[2],其中miR-155在调节免疫、炎性反应和心血管疾病的发生发展过程中具有重要作用[3]。有研究表明,抑制miR-155的表达可减轻急性心肌梗死后的炎性反应,并有利于减轻心室重构[4]。因此,本研究探讨抑制miR-155对心肌缺血再灌注模型心肌细胞凋亡及炎性反应的影响,为临床治疗心肌缺血/再灌注提供新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验主要试剂:大鼠心肌细胞系H9c2(myocardial cells of H9c2 rats);叔丁基过氧化氢(tert-Butyl hydroperoxide,TBHP);DMEM培养基(Sigma-Aldrich公司);miR-155抑制剂及NC抑制剂(广州锐博生物技术有限公司);Trizol、Lipofectamine 2000(Invitrogen公司),RT-qPCR引物[生工生物工程(上海)股份有限公司];核转录因子p65(nuclear factor-κB p65,NF-κB p65)小鼠单克隆抗体、核转录因子p50(nuclear factor-κB p50,NF-κB p50)小鼠单克隆抗体、磷酸化核转录因子p65(phospho nuclear factor-κB p65,p-NF-κB p65)小鼠单克隆抗体、磷酸化核转录因子50(phospho nuclear factor-κB p50,p-NF-κB p50)小鼠单克隆抗体、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)小鼠单克隆抗体、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)小鼠单克隆抗体、β肌动蛋白(β-actin)小鼠单克隆抗体、山羊抗小鼠二抗(Santa Cruz公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(上海贝博生物科技有限公司);白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒(武汉博士德生物工程有限公司)。
1.1.2 细胞处理及分组:将H9c2细胞分为4组:空白对照组、心肌缺血/再灌注(MI/R)组、阴性对照组、miR-155抑制剂组。TBHP用DMEM高糖培养基为溶剂进行溶解并稀释成浓度为100 μmol/L的TBHP溶液,根据参考文献[5]采用TBHP处理H9c2心肌细胞构建MI/R模型:将细胞接种于含10%胎牛血清的DMEM高糖培养基中,置于37 ℃、5% CO2的培养箱中培养。取对数生长期的细胞用胰蛋白酶消化后,800 r/min离心5 min后收集细胞。将细胞以5×104个/mL的浓度按2 mL/孔接种至6孔板中,培养48 h。吸弃上清液,用PBS洗涤2次后,加入100 μmol/L TBHP溶液500 μL,培养12 h,造成缺氧;随后换用DMEM高糖培养基,继续培养,进行再灌注。阴性对照组:在MI/R模型建立后培养24 h,采用转染试剂脂质体Lipofectamine 2000转染NC对照组(100 nmol/L);miR-155抑制剂组:在MI/R模型建立后培养24 h,采用转染试剂脂质体Lipofectamin 2000转染miR-155抑制剂(100 nmol/L)。转染后5 h更换新的DMEM高糖培养基,37 ℃、5% CO2条件下继续培养48 h后进行后续实验。空白对照组:细胞不做处理。
1.2 方法
1.2.1 采用RT-qPCR检测各组心肌细胞miR-155的表达水平:取各组细胞分别加入1 mL Trizol,提取总RNA,按照反转录试剂盒将总RNA反转录成cDNA,取1 μL cDNA作为模板进行RT-qPCR扩增。反应条件:预变性95 ℃ 5 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,40个循环后72 ℃延伸10 min。每个样本重复检测3次。以U6为内参,每组基因的相对表达量按公式(2-△△Ct法)计算。引物设计见表1。

表1 RT-qPCR检测各基因引物序列Table 1 Primer sequence of each gene detected by RT-qPCR
1.2.2 采用ELISA检测IL-8、TNF-α的含量:转染24 h后取对数生长期心肌细胞H9c2上清液,3 000×g离心10 min,取上清液按ELISA试剂盒说明书分别检测IL-8、TNF-α的含量。
1.2.3 采用流式细胞测量术检测心肌细胞凋亡率:各组细胞按1×105个/孔接种于6孔板,加PBS液2 mL,2 000 r/min,离心5 min洗涤2次后,加入300 μL结合缓冲液悬浮细胞,再加入5 μL annexin V、PI,室温避光反应10 min,流式细胞仪检测。细胞凋亡率(%)=凋亡细胞数/检测细胞总数×100%。
1.2.4 Western blot检测各组细胞NF-κB p65、NF-κB p50、p-NF-κB p65、p-NF-κB p50、Bax、Bcl-2蛋白表达:收集各组对数生长期细胞提取总蛋白,取40 μg与上样缓冲液混合,100 ℃加热5 min后通过10% SDS-PAGE分离,90 V电压转膜至PVDF膜上,5%脱脂奶粉封闭1 h,洗膜后加入一抗4 ℃过夜,以辣根过氧化物酶标记的二抗孵育2 h,用化学发光法显色,凝胶成像系统拍照。以β-actin为内参,每组实验重复3次。
1.2.5 采用RT-qPCR检测各组细胞NF-κB p65、NF-κB p50、Bax、Bcl-2 mRNA表达水平:详细步骤见1.2.1,相关基因引物设计见表1。
1.3 统计学方法

2 结果
2.1 各组细胞miR-155的表达水平
与空白对照组相比,MI/R组、阴性对照组、miR-155抑制剂组miR-155表达水平均显著升高(P<0.05);转染miR-155抑制剂后miR-155表达水平显著降低(P<0.05)(图1)。
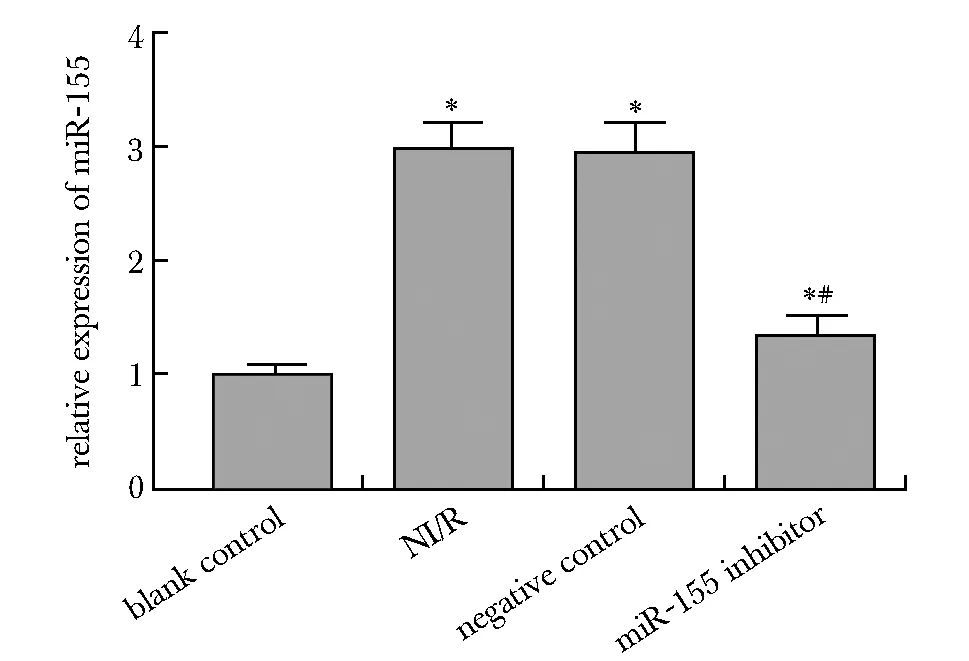
*P<0.05 compared with blank control;#P<0.05 compared with MI/R group图1 H9c2各组细胞miR-155表达水平比较Fig 1 Comparison of miR-155 expression levels in each group of H9c2 n=3)
2.2 各组心肌细胞IL-8、TNF-α的含量
与空白对照组相比,MI/R组、阴性对照组、miR-155抑制剂组的IL-8、TNF-α含量均显著升高(P<0.05);与MI/R组相比,miR-155抑制剂组的IL-8、TNF-α含量降低(P<0.05)(图2)。

*P<0.05 compared with blank control;#P<0.05 compared with MI/R group图2 H9c2各组细胞IL-8、TNF-α的含量比较Fig 2 Comparison of IL-8 and TNF-α contents in each group of H9c2 n=3)
2.3 各组心肌细胞凋亡水平比较
与空白对照组相比,MI/R组、阴性对照组心肌细胞凋亡率显著升高(P<0.05);与MI/R组相比,抑制miR-155表达后,心肌细胞凋亡率显著降低(P<0.05)(图3)。与空白对照组相比,MI/R组、阴性对照组Bax蛋白和mRNA表达水平均显著升高(P<0.05),而Bcl-2蛋白和mRNA表达水平均显著降低(P<0.05);抑制miR-155表达后,Bax蛋白和mRNA表达水平均降低(P<0.05),而Bcl-2蛋白和mRNA表达水平均升高(均P<0.05)(图4)。

图3 H9c2各组心肌细胞凋亡率比较Fig 3 Comparison of cardiomyocyte apoptosis rate in each group of H9c2 cells(n=3)

A.expression of Bax and Bcl-2 mRNA;B.expression of Bax and Bcl-2 protein;*P<0.05 compared with blank control;#P<0.05 compared with MI/R group图4 H9c2各组心肌细胞Bax、Bcl-2蛋白和mRNA表达水平比较Fig 4 Comparison of Bax,Bcl-2 protein and mRNA expression levels in cardiomyocytes of each group of
2.4 各组细胞NF-κB信号通路相关蛋白表达比较
与空白对照组相比,MI/R组、阴性对照组NF-κB p65、NF-κB p50、p-NF-κB p65、p-NF-κB p50蛋白表达均显著升高(P<0.05);与阴性对照组相比,miR-155抑制剂组NF-κB p65、NF-κB p50、p-NF-κB p65、p-NF-κB p50蛋白表达均降低(P<0.05)(图5)。

*P<0.05 compared with blank control;#P<0.05 compared with MI/R group图5 H9c2各组细胞NF-κB信号通路相关蛋白表达比较Fig 5 Comparison of the expression of NF-κB signaling pathway related proteins in each group of H9c2
2.5 各组细胞NF-κB p65、NF-κB p50 mRNA表达水平比较
与空白对照组相比,MI/R组、阴性对照组NF-κB p65、NF-κB p50 mRNA表达水平均显著升高(P<0.05);与MI/R组相比,miR-155 抑制剂组NF-κB p65、NF-κB p50 mRNA表达水平均降低(P<0.05)(图6)。

*P<0.05 compared with blank control;#P<0.05 compared with MI/R group图6 H9c2各组细胞NF-κB p65、NF-κB p50mRNA表达水平比较Fig 6 Comparison of mRNA expression levels of NF-κB p65 and NF-κB P50 in each group of H9c2
3 讨论
缺血/再灌注损伤是由氧化应激、炎性反应、细胞内Ca+超载以及凋亡和坏死发展为不可逆转的细胞死亡等事件综合所导致。心肌缺血/再灌注可加重心肌损伤,增加心血管疾病致残率和致死率,其中,细胞凋亡是心肌缺血/再灌注损伤的重要过程,抑制细胞凋亡可减少心肌梗死面积[6]。此外,炎性反应也在MI/R损伤中起着重要作用,MI/R增加炎性小体的表达,引起炎性细胞浸润,增加心脏细胞因子的表达,进而导致MI/R损伤[7]。miRNAs被认为是几乎所有细胞过程的主要调节因子,研究显示[8],miR-24-3p可通过抑制细胞凋亡及肿瘤坏死因子信号途径,从而在心肌缺血再灌注损伤中发挥心肌保护作用。研究发现[9],miR-22可以通过靶向cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)抑制心肌细胞凋亡保护大鼠免受MI/R损伤,发挥抗炎功能。本研究结果发现,MI/R组心肌细胞凋亡率、IL-8、TNF-α的含量、Bax蛋白和mRNA表达水平均较空白对照组显著升高,而Bcl-2蛋白和mRNA表达水平降低;抑制miR-155表达后,上述指标均有不同程度的改善。提示miR-155表达在MI/R中促进细胞凋亡及炎性水平;抑制miR-155表达后可降低细胞凋亡及炎性水平。
NF-κB作为一种核蛋白转录因子,在缺血/再灌注损伤病理过程中发挥重要作用[10]。miRNA可参与NF-κB的活化及功能的调控。研究发现[11],miR-21的过表达能够有效抑制TLR4/NF-κB通路,降低大鼠心肌细胞凋亡水平和炎性因子的释放。本研究结果发现,与空白对照组相比,MI/R组、阴性对照组NF-κB相关基因表达均显著升高;与MI/R组相比,miR-155抑制剂组NF-κB相关基因均降低。提示抑制miR-155表达后可抑制NF-κB信号通路的活化。
综上,抑制miR-155表达可抑制NF-κB信号通路的活化,并可降低细胞凋亡及炎性水平,从而对心肌缺血/再灌注损伤起保护作用,为临床治疗心肌缺血/再灌注损伤提供实验依据。

