淹水深度对樱桃番茄苗期生理生化特性的影响
兰超杰,刘聪聪,翟鹏飞,赵艳,梁正灏,袁赫奕,李长江


摘 要:以耐涝型‘红妃6号(HF)和敏感型‘千禧(QX)2个樱桃番茄品种为材料,以正常水分为对照(CK),设置6个淹水深度,分别为?10、?5、?2、0、2、5 cm(D10、D5、D2、W0、U2、U5),测定不同处理下樱桃番茄苗期的生长及生理生化指标,探究樱桃番茄苗期对不同淹水深度的响应。研究结果表明,淹水处理较CK能抑制株高、茎粗、干物质重及根系长度、直径、表面积和体积的增长,但差异显著性不同;随着淹水深度的升高,株高、干物质量及根系长度、直径、表面积和体积受抑制作用越明显,且W0、U2和U5处理显著低于CK,而D10、D5处理下株高、茎粗及根系平均直径与CK无显著差异。丙二醛(MDA)、可溶性糖和脯氨酸含量随淹水深度升高而逐渐增加,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性也表现出随着淹水深度的升高而逐渐升高的趋势,且从淹水后2~6 d均表现D2、W0、U2、U5处理高于CK处理;而在淹水14 d,QX品种W0、U2、U5处理SOD和CAT活性均表现出显著低于CK。从相关性分析也发现,MDA、POD、CAT、可溶性糖和脯氨酸之间存在显著正相关关系。因此,淹水深度是洪涝致害的一个重要因素,淹水深度越高,对樱桃番茄伤害越大;樱桃番茄种植面下5 cm为淹水深度阈值。
关键词:樱桃番茄;淹水深度;生理生化特性
中图分类号:S59 文献标识码:A
Effect of Flooding Depth on Physiological and Biochemical Characteristics of Cherry Tomato at Seedling Stage
LAN Chaojie1,2, LIU Congcong1,2, ZHAI Pengfei1,2, ZHAO Yan1,2, LIANG Zhenghao1,2,
YUAN Heyi1,2,
LI Changjiang1,2*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresources, Haikou, Hainan, 570228, China
Abstract: In this experiment, two cherry tomato varieties, ‘Hongfei 6 (HF) of waterlogging tolerance type and ‘Qianxi (QX) of sensitive type, were used as the materials, with normal moisture as the control (CK). Six flooding depth, respectively ?10 cm, ?5 cm, ?2 cm, 0 cm, 2 cm, 5 cm (D10, D5, D2, W0, U2, U5) was used to determine the growth, physiological and biochemical indicators of cherry tomato seedlings under different treatment to explore the response of cherry tomato at seedling stage to different flooding depths. Flooding treatment could inhibit the growth of plant height, stem thickness, dry matter weight, root length, root diameter, root surface area and root volume compared with CK. With the increase of flooding depth, plant height, dry matter mass, root length, root diameter, root surface area and root volume were inhibited more obviously, and the effects of W0, U2 and U5 were significantly lower than that of CK, while there was no significant difference in plant height, stem diameter and mean root diameter between D10, D5 and CK. The content of malondialdehyde (MDA), soluble sugar and proline gradually increased with the increase of the flooding depth. The activity of superoxide dismutase (SOD), catalase (CAT), and peroxidase (POD) also showed a tendency to gradually increase with the increase of flooding depth, and from 2 to 6 days, the effects of D2, W0, U2, and U5 were higher than that of CK. After 14 days of flooding, the activity of SOD and CAT of QX of W0, U2 and U5 were significantly lower than those of CK. Correlation analysis revealed that MDA, POD, CAT, soluble sugar and proline were significantly positively correlated. Therefore, flooding depth was also an important factor for flood damage. Higher flooding depth would lead to greater damage to cherry tomatoes. 5 cm below the cherry tomato planting surface was the flooding depth threshold.
Keywords: cherry tomatoes; depth of flooding; physiological and biochemical characteristics
DOI: 10.3969/j.issn.1000-2561.2021.10.024
随着全球气候的变化,极端降雨事件频发,洪涝灾害已成为植物所遭受的主要非生物逆境之一[1]。洪涝导致植物根系缺氧,根部厌氧代谢产生的乙醛,乙醇等物质会对细胞产生毒害作用[2],不仅会抑制碳同化和光合产物利用过程,而且会阻碍地上部和地下部物质转运途径[3]。另外,缺氧还会打破植物活性氧产生与清除的动态平衡,从而致使叶片光氧化损伤、光合速率降低、叶片失绿、发黄和萎蔫等[4-7]。在长期洪涝灾害下,植物养分吸收减少,根系逐渐死亡,植物生长受到抑制并最终导致总生物量及产量的降低[8]。由于降雨量的多少或者洪涝灾害发生程度的大小,农田表面水层深度也会有所不同。研究发现,当田间土壤含水量大于80%时,会严重影响玉米的生长发育[9]。随着淹水深度的增加,水稻茎蘖消亡速度加快,株高逐渐增加,且产量逐渐降低,当被全部淹没7 d时,水稻产量则下降46.63%[10]。同样,南荻、互叶白千层和芦苇的生物量都随淹水深度的增加而逐渐降低,且光合速率、最大光化学量子效率(Fv/Fm)、光化学淬灭系数(qP)也逐渐降低,而过氧化物酶、过氧化氢酶和超氧化物歧化酶活性逐渐增加[11-12]。可见在洪涝灾害中淹水深度也是一个重要的致灾因素。而关于淹水深度在洪涝致灾时的阈值研究还很少。
樱桃番茄(Solanum lycopersicum Mill.)属于茄科番茄属,是一年生草本植物,耐旱不耐涝,营养价值丰富,富含谷胱甘肽和番茄红素等特殊物质,现已成为热带地区瓜菜的重要代表[13-14]。为控制上市时间,热带地区露地樱桃番茄多在8~10月进行育苗和移栽,但此段时间降雨频繁并且雨量变异性大,常造成农田洪涝积水,且深度不同,造成樱桃番茄株高、干物质量及叶面积的降低,影响光合能力,并降低根系活力,严重影响樱桃番茄的生长发育[15-16]。然而,目前关于不同淹水深度对樱桃番茄幼苗影响的研究还比较少,且樱桃番茄淹水深度的阈值也未知。因此本试验选取热带地区2个对淹水敏感度不同的樱桃番茄栽培品种,研究不同淹水深度下樱桃番茄苗期对淹水胁迫的响应规律,确定热带地区樱桃番茄洪涝致灾的淹水深度阈值,为热带地区樱桃番茄洪涝灾害影响评估及抗涝栽培提供理论依据。
1 材料与方法
1.1 材料
试验材料选用耐涝型‘红妃6号(HF)和敏感型‘千禧(QX)2个海南地区普遍种植的反季节露地樱桃番茄品种。2018年10月在海南大学热带作物学院基地育苗,待到三叶一心时,选取长势一致的幼苗移栽入花盆中(直径×高度= 15 cm×15 cm),每盆1株;移栽7 d后,每盆通过水溶灌施1.5 g水溶肥(15-15-15,跟当地樱桃番茄缓苗期施肥量一致)。待幼苗长到四叶一心时开始进行试验处理。盆土为海南大学农学基地番茄农田0~20 cm土层土壤砖红壤,基础理化特性为:pH 6.75、有机质28.9 g/kg、碱解氮122.90 mg/kg、速效磷39.89 mg/kg、速效钾0.19 g/kg。
1.2 试验设计
因热带地区农田樱桃番茄栽培中多采用垄沟栽培模式,垄高10 cm,垄上种植番茄,在降雨后沟内会出现大量积水。因此,在试验中以正常水分供应(土壤最大持水量保持在75%左右)为对照(CK),每个樱桃番茄品种设置6个淹水深度处理,分别为种植土表以下10 cm(D10)、土表以下5 cm(D5)、土表以下2 cm(D2)、与种植土壤表面持平(W0)、土表以上2 cm(U2)和土表以上5 cm(U5)。其中所有淹水处理都采用双套盘法,每天严格控制水面高度。每个处理重复3次,每个重复12株。每个品种的各处理选取具有代表性的3个植株进行定株,分别于淹水后0、2、4、6、10、14 d测定各处理樱桃番茄的株高和茎粗;同时在每个重复取3株,取其第4片展开叶(由下往上计数)于–40 ℃冰箱中保存,用于抗氧化酶、渗透调节指标及丙二醛含量的测定;并且在14 d于各处理中随机选取3个植株进行根系形态指标及干物质量的测定。
1.3 测定项目与方法
株高和茎粗分别采用卷尺和游标卡尺测量;根长、根表面积、根体积和根直径利用根系扫描仪及WinRHIZO根系分析软件得出。超氧化物歧化酶(SOD)活性的測定采用氮蓝四唑光还原法,过氧化物酶(POD)活性的测定采用愈创木酚显色法,过氧化氢酶(CAT)活性的测定采用紫外吸收法,脯氨酸(Pro)含量的测定采用酸性茚三酮显色法,丙二醛(MDA)含量的测定采用硫代巴比妥酸法,可溶性糖含量的测定采用硫酸-蒽酮比色法[17-19]。干物质量的测定采用烘干称重法。
1.4 数据处理
试验数据采用Microsoft Excel(Office 2019)软件进行整理,用SPSS 22.0进行单因素方差分析与双变量相关分析,运用LSD检验法进行多重比较检验处理间的差异显著性,利用Microsoft Excel软件制图。
2 结果与分析
2.1淹水深度对樱桃番茄苗期形态特征的影响
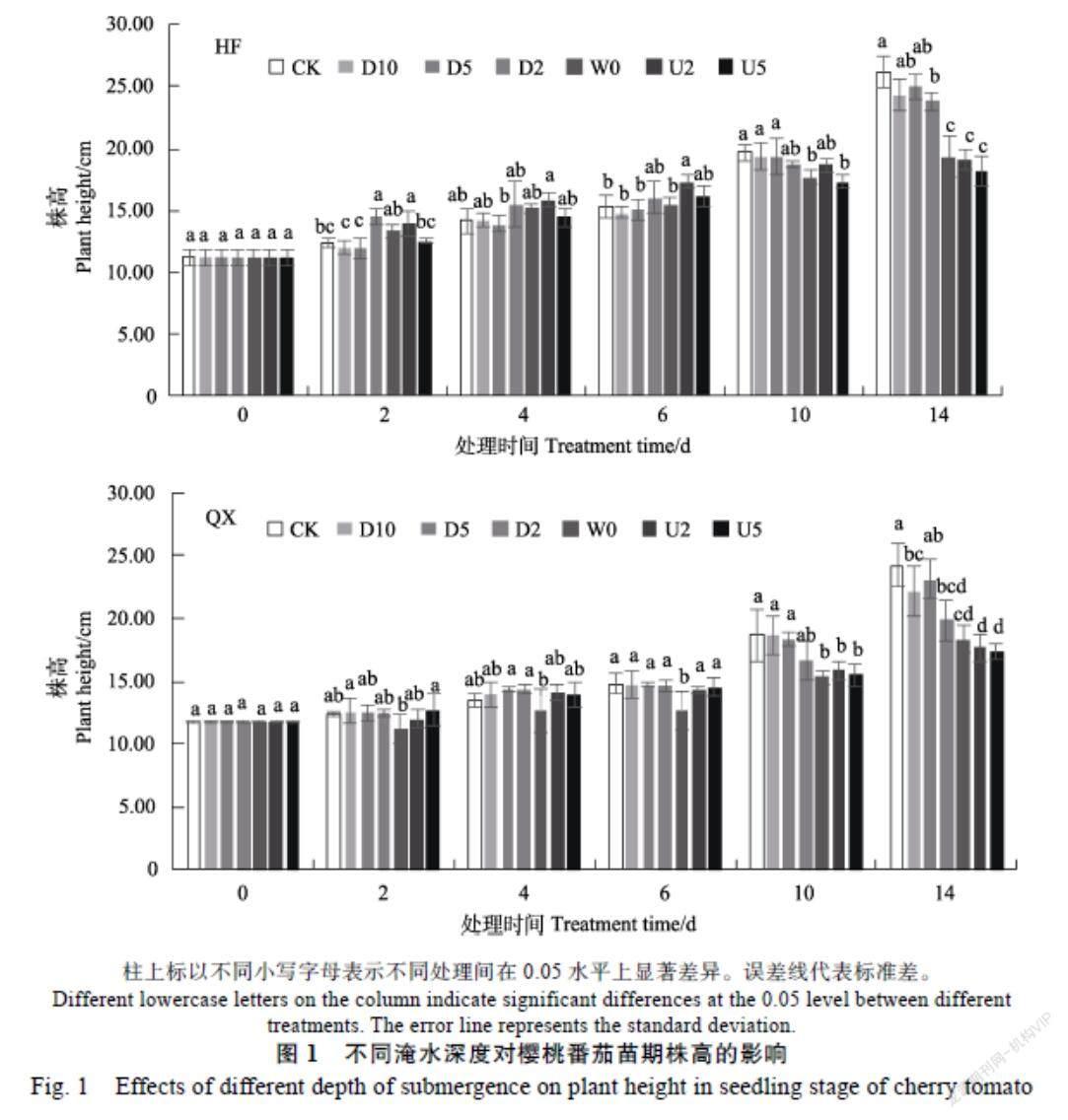
2.1.1 淹水深度对樱桃番茄苗期株高及茎粗的影响 随处理天数的延长,2个品种各处理的株高均表现出逐渐增加的趋势;而随着淹水深度的升高,株高表现出逐渐降低的趋势。HF品种,除D10和D5处理外,D2、W0、U2和U5处理的株高在2~6 d均高于CK处理,但并不总显著;从淹水10 d开始,淹水处理株高逐渐低于CK;到淹水14 d,淹水处理株高均低于对照,且D2、W0、U2和U5处理较CK分别显著降低了8.92%、25.99%、27.26%和30.57%,而D10、D5处理和CK无显著差异。同样,在淹水14 d,QX品种也表现出D2、W0、U2和U5处理较CK显著降低了26.27%、31.85%、34.32%和35.56%,而D10、D5处理与CK差异不显著。从2个品种来看,不同淹水深度下QX品种较CK下降幅度均高于HF品种,说明QX品种的株高更容易受到洪涝的影响。
<!--[if gte vml 1]>
不同淹水深度处理樱桃番茄幼苗茎粗都随天数的延长而逐渐增加(图2)。而随着淹水天数的延长,W0、U2和U5处理与CK间差异逐渐增大,并达到显著水平。HF品种,除D10和D5处理外,D2、W0、U2和U5处理的茎粗从6 d开始显著低于CK,而该4个处理间没有明显的差异;QX品种从10 d开始,W0、U2和U5开始低于CK,并逐渐达到显著,而该3个处理间也没有显著差异。淹水第14天,HF品种D10、D5、D2、W0、U2和U5处理的茎粗与CK相比,分别减少了?2.29%、?3.39%、12.47%、12.72%、12.89%、12.38%,QX品种分别减少了6.37%、?1.35%、7.72%、22.83%、24.69%、30.16%,QX淹水各处理的降低幅度高于HF,表明随淹水深度的增加,QX茎粗增长受抑制程度更明显。
2.1.2 淹水深度对樱桃番茄苗期干重的影响 淹水14 d,2个樱桃番茄品种淹水处理的干重均低于对照,并且随淹水深度的增加降低幅度逐渐增大(图3)。HF品种W0、U2和U5处理显著低于CK,而D10和D5处理与CK无显著差异,且U5显著低于其他处理;QX品种淹水组处理显著低于对照组,其中D10处理和D5处理之间无显著差异,并且显著高于其余淹水处理;且U5处理最低。HF品种D10、D5、D2、W0、U2、U5处理和CK相比,分别减少了9.21%、0.07%、18.36%、40.38%、45.23%、68.39%,QX品种则分别减少16.26%、13.09%、32.20%、40.36%、46.58%、69.58%。2个品种相比,千禧品种淹水处理干物质重下降幅度更大。由此可知,淹水深度的增加能提高淹水胁迫对干物质重的影响,且千禧品种生长更容易受淹水的影响。
<!--[if gte vml 1]>
<!--[if gte vml 1]>
2.1.3 淹水深度对樱桃番茄苗期根系形态的影响 淹水14 d,淹水各處理总根长、根表面积及根体积均显著低于CK(图4),且随着淹水深度的升高,逐渐降低。D10、D5和D2处理下总根长和根表面积显著高于U2和U5处理,但其与W0之间因品种不同而表现出不同的差异性;D10和D5之间、U2和U5之间没有显著性差异。根系体积表现出,D10和D5处理显著高于W0、U2和U5处理,而与D2处理间差异并不总显著。同样,D10和D5下根系的平均直径显著高于U5处理,且QX品种D10和D5还要显著高于其他淹水处理。可见,当淹水深度高于?5 cm时,樱桃番茄的根系生长更容易受到抑制。
2.2 淹水深度对樱桃番茄苗期叶片渗透调节物质及丙二醛含量的影响
与CK相比,淹水处理下可溶性糖含量都表现出增加的趋势。HF品种淹水处理随淹水时间的延长各处理与CK间差异逐渐达到显著(图5);且随淹水深度的增加,可溶性糖含量也逐渐呈现出增加的趋势,从淹水2 d开始,U5、U2、W0和D2处理就显著高于CK、D10和D5处理;而到淹水6 d,各淹水处理都显著高于CK处理,且D2、W0、U2、U5处理显著高于D10和D5处理。QX品种淹水处理随淹水时间延长可溶性糖表现出先升高后降低的趋势,在淹水2~6 d达到最高;且在淹水4 d和6 d,淹水处理显著高于CK,其中U5处理显著高于其它淹水处理;在淹水14 d,W0、U2、U5处理与CK相比显著增加了18.34%、38.90%和89.75%,其它处理与CK间无显著差异。相比较而言,HF能够维持较高的可溶性糖含量。
淹水处理后,脯氨酸含量总体呈现出先升高后降低的趋势,且随着淹水深度的上升,脯氨酸含量也逐渐上升(图5)。HF品种在淹水10 d,表现出U5、U2、W0和D2处理显著高于D5、D10和CK,且U5处理显著高于其他处理。D10处理脯氨酸含量在6 d显著低于CK,其他时间与CK无显著差异;D5、D2、W0、U2和U5处理呈现出先升高最终趋近于对照的趋势,在淹水14 d,D10、D5和D2处理与CK无显著性差异,而W0、U2和U5处理表现出显著高于CK。QX品种淹水处理多在4 d和6 d脯氨酸含量达到高峰,之后迅速下降;在淹水14 d W0、U2和U5处理显著低于CK,而D10和D5处理同CK无显著性差异,D2处理则显著高于CK。
淹水发生后,叶片丙二醛含量总体呈现出先升高的趋势,之后逐渐平缓或降低。随淹水深度的增加,樱桃番茄幼苗丙二醛含量整体呈现出增加的趋势。HF品种D5和D2处理在淹水6 d显著高于CK,之后趋近于CK,最终与CK无显著性差异;而W0、U2和U5处理在淹水2~6 d,MDA含量急剧上升,6 d后开始下降,到淹水14 d仍显著高于CK。QX品种D10、D5和D2处理在0~2 d急剧上升,之后开始降低,至淹水14 d,D10和D5处理与CK差异不显著,D2处理显著高于CK;W0、U2和U5处理则随淹水时间的延长一直呈增加的趋势。
<!--[if gte vml 1]>
<!--[if gte vml 1]>
2.3 淹水深度对樱桃番茄叶片抗氧化酶的影响
随淹水时间的延长,各处理SOD、POD和CAT的活性都呈现出先上升后下降的趋势;且一般表现出随着淹水深度的升高,3种酶的活性也逐渐升高(图6)。HF品种D10、D2和W0处理SOD活性在2 d取得最大值,而U2和U5在4 d达到最大值,且在淹水4 d后,U5、U2、W0和D2显著高于D5、D10和CK处理,而D5和D10与CK间无显著性差异。同样,QX品种U5在4 d达到最大值,而D2、W0和U2处理则在6 d达到最大值,之后迅速下降;在淹水14 d,W0、U2和U5处理均表现出显著低于CK,其他处理与对照间无显著性差异。对于CAT活性,HF品种淹水处理均在4 d达到高峰,并且显著高于CK,之后缓慢下降;到14 d,W0、U2、U5仍然显著高于CK,而其他处理与CK无显著差异。QX品种表现出,D2、W0、U2、U5处理则在10 d达到最大值,之后急速下降;到14 d,D10和D5处理显著高于CK,而其它处理显著低于CK。淹水后HF品种W0、U2和U5处理POD活性在整个淹水时期均显著高于CK;QX也有相似的规律,但其在淹水14 d,W0、U2和U5则显著低于CK。2个品种D10、D5和D2处理在淹水14 d均表现出与CK无显著差异。
<!--[if gte vml 1]>![]() <!--[endif]--><!--[if gte vml 1]>
<!--[endif]--><!--[if gte vml 1]>![]() <!--[endif]--><!--[if gte vml 1]>
<!--[endif]--><!--[if gte vml 1]>
2.4各生理生化指标之间的相关性统计分析
樱桃番茄叶片生理生化指标相关性分析发现(表1),脯氨酸含量与可溶性糖含量及抗氧化酶(SOD、POD、CAT)活性间呈极显著正相关,且脯氨酸含量、可溶性糖含量、POD、CAT与MDA间也呈显著正相关,而SOD与MDA间没有显著差异。
3 讨论
3.1 淹水胁迫对樱桃番茄形态特征的影响
淹水条件下,植物供氧不足,有氧呼吸减弱,碳同化和光合产物利用过程被抑制,地上部和根系间的功能关系受到影响,最终使植物生长受到抑制并且导致总生物量的降低[3]。大多数研究表明,在一定条件下植物遭受的胁迫越强,生长速度越慢,总生物量也越少[11-12, 20]。本试验中,淹水对樱桃番茄的生长有明显的抑制作用,且樱桃番茄的株高、茎粗、干物质量及根长、根表面积、根系直径和根体积都随着淹水深度的升高而逐渐降低;D2、W0、U2和U5处理下株高、茎粗、干物质量及根系形态指标都表现出显著低于CK,且该4个处理间也多表现出显著差异;这也表明淹水深度是洪涝灾害中一个重要的致灾因素,且淹水深度升高,樱桃番茄所受胁迫越强,受到的影响越大。纪欣圣等[11]和刘瑞仙等[12]在研究中也有相似的发现,随着淹水深度升高,南荻和白千层株高、根系形态指标都逐渐降低。这主要是因为淹水深度的增加逐渐降低植物根系与外界环境间的气体交换,进而逐渐增加了对植物根系的破坏,降低了植物体内的物质合成与运输,从而使植物生长变缓。在淹水后,D10和D5处理与CK在株高、茎粗、干物质及根系平均直径间多表现出差异不显著,可能是因为种植面以下5 cm及以下淹水深度较低,对根系造成的氧胁迫程度较小,且作为其对逆境胁迫的一种辅助机制,能在根系上生出一定的侧根,减少对根系呼吸、养分吸收等功能的影响,从而能够维持正常生长发育[21-22]。而当淹水深度高于种植面以下5 cm时(D2、W0、U2、U5处理),2个品种的株高、茎粗、干物质及根系形态指标多表现出显著低于CK,并且随淹水深度的增加,下降幅度也越来越大,说明胁迫程度越强,淹水对植物生长的抑制作用也越明显,这与灰化薹草和白菜上的研究结果相似[23]。这也表明,在垄沟栽培过程中,沟内积水在5 cm及以下时对樱桃番茄苗期生长影响不大;而当积水深度超过5 cm之后就会对其生长产生抑制作用,并且随着积水深度的增加,对植株的抑制作用也增加,直到植株生长停滞、烂根和死亡。
3.2 淹水深度对樱桃番茄叶片渗透调节物质及丙二醛含量的影响
可溶性糖是一种重要的渗透调节物质,对于维持细胞膨压,稳定生物体内大分子构象具有重要作用,其对环境胁迫变化敏感,是反应植物受胁迫程度的重要指标[24-25]。本试验中随淹水时间的增加,淹水各处理可溶性糖含量一直维持在较高的水平,用于提高樱桃番茄在淹水胁迫下的存活能力[26],刘雪等[27]在湖北海棠上也有相同的规律。随淹水深度的增加,各处理同时期可溶性糖含量也逐渐表现出增加的趋势,这与圆齿野鸦椿上的研究结果相似[28],其发现水涝下可溶性糖含量要显著高于水渍,都要显著高于正常处理。
脯氨酸作为植物体内重要的一种渗透调节物质,当植物受到胁迫后,脯氨酸大量积累用于维持细胞液的渗透平衡,从而缓解胁迫所造成的伤害,除渗透调节作用外,脯氨酸还具有维持膜稳定性及清除活性氧等作用[29-31]。大多数研究认为环境胁迫能提高植物叶片脯氨酸的含量[29-31];本试验中也发现,淹水发生初期,樱桃番茄叶片脯氨酸含量迅速上升,但随着淹水的持续,脯氨酸含量逐渐下降,到淹水14 d,HF品种淹水处理依然高于CK,而QX品种W0、U2和U5处理显著低于CK,可能是因为耐涝型的HF品种并未受到不可逆的伤害,淹水后期脯氨酸更多的用于蛋白质的合成[24],而QX品种自身渗透调节能力有限,在淹水后期膜系统遭到破坏,植物受到不可逆损伤,脯氨酸含量降低[26]。这也表明沟内积水与种植面齐平时,在淹水后期严重抑制QX品种脯氨酸含量积累,会对植物造成不可逆损伤。
丙二醛是植物细胞膜脂过氧化产物之一,其含量的高低可以用来反映植物所受伤害程度的大小[32]。在本试验中,随淹水深度的增加,2个樱桃番茄品种MDA含量均呈现出增加的趋势,说明胁迫程度越强植物受到的伤害越大,这与前人在滴水观音上的研究相似[33]。当淹水深度高于种植面时(W0、U2和U5处理),HF品种丙二醛含量从6 d开始降低,这主要因为HF品种具有较强的活性氧清除能力并且其积累的渗透调节物质在一定程度上能够缓解植物所受的伤害;而QX品种在淹水深度高于种植面后,MDA含量一直呈现出增加的趋势,说明其膜脂过氧化程度较高,植物受伤严重[34]。淹水14 d,HF和QX品种D10和D5处理与CK无显著性差异,说明淹水深度超过?5 cm时,植物细胞受伤严重。
可溶性糖含量與脯氨酸含量呈极显著正相关,且二者与MDA含量均达到显著正相关水平,说明淹水胁迫对植物造成伤害后启动了植物自身的保护系统,通过合成渗透调节物质等来维持细胞膨压,从而在一定程度上缓解植物所受到的伤害,程淑娟在黄花忍冬盐胁迫上的研究也呈现出相似的规律[35]。但是随着淹水胁迫的加重,可溶性糖含量和脯氨酸含量的增加并不能完全缓解胁迫对植物造成的伤害。
3.3淹水深度对樱桃番茄抗氧化酶的影响
植物遭受淹水胁迫后,活性氧大量积累,容易造成细胞内的脂质过氧化、蛋白质降解和DNA损伤等[36-37]。为了缓解淹水胁迫,植物超氧化物歧化酶(SOD)将超氧根阴离子歧化为H2O2和O2,过氧化物酶(POD)、过氧化氢酶(CAT)等来清除过量的H2O2[38]。本试验中,SOD活性和CAT活性变化规律相似,随淹水时间的增加淹水组各处理均呈现出先升高后降低的趋势,Candan等[39]在紫茎兰上的研究也有相似的规律。淹水14 d,HF品种淹水处理SOD和CAT活性均高于CK,说明耐涝型的HF品种在淹水后期依然能够清除活性氧,从而在一定程度上缓解胁迫所造成的伤害[40]。赵旭等[41]在番茄上的研究表明随着根际氧气浓度的减少,叶片SOD和CAT活性均呈现出增加的趋势,本试验中HF品种叶片SOD活性和CAT活性也表现出相似的规律。QX品种D2、W0、U2和U5处理在淹水后期SOD和CAT活性均急剧下降,并且最终显著低于CK,说明QX品种自身调节能力有限,当淹水深度大于?5 cm时,抗氧化酶系统遭到破坏,QX品种受到伤害加重[42]。2个品种各淹水处理的POD活性整体上呈现出先升高后降低的趋势,这与黄万勇等[43]在水稻上的研究相似,但是在淹水14 d,HF品种W0、U2和U5处理显著高于CK,说明当沟内积水与种植面齐平时,HF品种依然能够维持较高的POD活性来清除H2O2,这与前人在牡丹上[44]的研究相似,而QX品种W0、U2和U5处理显著低于CK,说明QX品种氧化损伤加重,POD活性受到抑制,严重影响了植物的正常生长[11]。
樱桃番茄各生理指标相关性统计分析表明,MDA含量与部分抗氧化酶活性和渗透调节物质含量呈显著或者极显著正相关,说明细胞膜遭到破坏后,启动了植物的抗氧化系统和渗透调节系统。并且SOD、POD和CAT活性之间均呈极显著正相关,且其与脯氨酸含量和可溶性糖含量具有显著的相关性,说明樱桃番茄遭受淹水胁迫后,抗氧化酶系统与渗透调节物质之间具有一定的协同作用,共同抵御淹水胁迫对植物造成的伤害[35]。
4 结论
本研究以‘红妃6号(耐涝型)和‘千禧(敏感型)2个樱桃番茄品种为材料,研究发现,随着淹水深度的升高,株高、茎粗、干物质量及根系长度、直径、表面积和体积受抑制程度明显;丙二醛含量、可溶性糖含量、脯氨酸含量、超氧化物歧化酶活性、过氧化氢酶活性、过氧化物酶活性在淹水前期(2~6 d)随淹水深度的升高呈增加趋势;综合分析表明,淹水深度在低于种植土表以下5 cm(参考文献
<!--[if !supportLists]-->[1] <!--[endif]-->Yin D, Chen S, Chen F, et al. Morpho-anatomical and physiological responses of two Dendranthema species to waterlogging[J]. Environmental and Experimental Botany, 2010, 68(2): 122-130.
<!--[if !supportLists]-->[2] <!--[endif]-->Mohanty B, Ong B L. Contrasting effects of submergence in light and dark on pyruvate decarboxylase activity in roots of rice lines differing in submergence tolerance[J]. Annals of Botany, 2003, 91(2): 291-300.
<!--[if !supportLists]-->[3] <!--[endif]-->Wei W, Li D, Wang L, et al. Morpho-anatomical and physiological responses to waterlogging of sesame (Sesamum indicum L.)[J]. Plant Science, 2013, 208: 102-111.
<!--[if !supportLists]-->[4] <!--[endif]-->Yordanova R Y, Alexieva V S, Popova L P. Influence of root oxygen deficiency on photosynthesis and antioxidant status in barley plants1[J]. Russian Journal of Plant Physiology, 2003, 50(2): 163-167.
<!--[if !supportLists]-->[5] <!--[endif]-->孙乃东, 李 航, 齐 飞, 等. 淹水条件下不同pH值对2种丁香叶绿素荧光特性的影响[J]. 中南林业科技大学学报, 2014, 34(9): 44-48, 75.
<!--[if !supportLists]-->[6] <!--[endif]-->张雪芹, 谢志南, 欧阳海波, 等. 淹水对番木瓜光合和叶绿素荧光特性的影响[J]. 中国南方果树, 2011, 40(3): 29-32.
<!--[if !supportLists]-->[7] <!--[endif]-->宋 釗, 张白鸽, 李 颖,等. 辣椒形态学耐涝评价体系的建立与应用[J]. 热带作物学报, 2017, 38(10): 1815-1822.
<!--[if !supportLists]-->[8] <!--[endif]-->Kuai J, Zhou Z, Wang Y, et al. The effects of short-term waterlogging on the lint yield and yield components of cotton with respect to boll position[J]. European Journal of Agronomy, 2015, 67: 61-74.
<!--[if !supportLists]-->[9] <!--[endif]-->Tian L X, Bi W S, Ren X S, et al. Flooding has more adverse effects on the stem structure and yield of spring maize (Zea mays L.) than waterlogging in Northeast China[J]. European Journal of Agronomy, 2020, 117: 126054.
<!--[if !supportLists]-->[10] <!--[endif]-->于艳梅, 李芳花, 姜丽霞, 等. 不同淹水处理对寒地水稻生长规律及产量影响的研究[J]. 水资源与水工程学报, 2018, 29(3): 249-253.
<!--[if !supportLists]-->[11] <!--[endif]-->纪欣圣, 曹 昀, 汤思文, 等. 不同深度淹水下南荻幼苗生长和生理特性室内模拟研究[J]. 湿地科学, 2019, 17(1): 112-118.
<!--[if !supportLists]-->[12] <!--[endif]-->刘瑞仙, 靖元孝, 肖 林, 等. 淹水深度对互叶白千层幼苗气体交换、叶绿素荧光和生长的影响[J]. 生态学报, 2010, 30(19): 5113-5120.
<!--[if !supportLists]-->[13] <!--[endif]-->Nicola S, Tibaldi G, Fontana E. Tomato production systems and their application to the tropics[J]. Acta Horticulturae, 2009, 821(821): 27-34.
<!--[if !supportLists]-->[14] <!--[endif]-->Zhan B H, Cao N, Wang K N, et al. Detection and characterization of an isolate of Tomato mottle mosaic virus infecting tomato in China[J]. Journal of Integrative Agriculture, 2018, 17(5): 1207-1212.
<!--[if !supportLists]-->[15] <!--[endif]-->刘聪聪, 兰超杰, 李 欢, 等. 樱桃番茄苗期对淹水胁迫的响应及其耐涝性评价[J]. 核农学报, 2020, 34(3): 650-660.
<!--[if !supportLists]-->[16] <!--[endif]-->童梦莹, 黄家权, 李长江, 等. 淹水胁迫对樱桃番茄苗期形态特征及叶绿素荧光特性的影响[J]. 灌溉排水学报, 2019, 38(11): 8-15.
<!--[if !supportLists]-->[17] <!--[endif]-->李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
<!--[if !supportLists]-->[18] <!--[endif]-->王学奎, 黄见良. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2015.
<!--[if !supportLists]-->[19] <!--[endif]-->邹 琦. 植物生理生化实验指导[M]. 北京: 中国农业出版社, 1995.
<!--[if !supportLists]-->[20] <!--[endif]-->張洪鹏, 张盼盼, 李 冰, 等. 烯效唑对淹水胁迫下大豆农艺性状及生理生化指标的影响[J]. 中国油料作物学报, 2017, 39(5): 655-663.
<!--[if !supportLists]-->[21] <!--[endif]-->Malik A I, Colmer T D, Lambers H, et al. Changes in physiological and morphological traits of roots and shoots of wheat in response to different depths of waterlogging[J]. Functional Plant Biology, 2001, 28(11): 1121-1131.
<!--[if !supportLists]-->[22] <!--[endif]-->王哲宇. 九种木本植物幼苗的淹水胁迫生理特征研究[D]. 南京: 南京林业大学, 2014.
<!--[if !supportLists]-->[23] <!--[endif]-->李 文, 王 鑫, 潘艺雯, 等. 不同水淹深度对鄱阳湖洲滩湿地植物生长及营养繁殖的影响[J]. 生态学报, 2018, 38(9): 3014-3021.
<!--[if !supportLists]-->[24] <!--[endif]-->陈敏旗. 涝渍胁迫对山乌桕、乌桕生理生化特性影响的研究[D]. 杭州: 浙江农林大学, 2017.
<!--[if !supportLists]-->[25] <!--[endif]-->王 华. 淹水胁迫对不结球白菜形态特征及生理生化特性的影响[D]. 南京: 南京农业大学, 2013.
<!--[if !supportLists]-->[26] <!--[endif]-->Shimamura S, Yamamoto R, Nakamura T, et al. Stem hypertrophic lenticels and secondary aerenchyma enable oxygen transport to roots of soybean in flooded soil[J]. Annals of Botany, 2010, 106(2): 277-284.
<!--[if !supportLists]-->[27] <!--[endif]-->刘 雪, 彭 冶, 范俊俊, 等. 淹水胁迫对湖北海棠生长和生理特性的影响[J]. 经济林研究, 2018, 36(1): 35-42.
<!--[if !supportLists]-->[28] <!--[endif]-->支丽燕, 胡松竹, 余 林, 等. 涝渍胁迫对圆齿野鸦椿苗期生长及其叶片生理的影响[J]. 江西农业大学学报, 2008, 30(2): 279-282.
<!--[if !supportLists]-->[29] <!--[endif]-->Edreva A. Generation and scavenging of reactive oxygen species in chloroplasts: a submolecular approach[J]. Agriculture, Ecosystems & Environment, 2005, 106(2): 119-133.
<!--[if !supportLists]-->[30] <!--[endif]-->Rajendrakumar C S V, Reddy B V B, Reddy A R. Proline-protein interactions: Protection of structural and functional integrity of M4 lactate dehydrogenase[J]. Biochemical and Biophysical Research Communications, 1994, 201(2): 957-963.
<!--[if !supportLists]-->[31] <!--[endif]-->Smirnoff N. The role of active oxygen in the response of plants to water deficit and desiccation[J]. New Phytologist, 2010, 125(1): 27-58.
<!--[if !supportLists]-->[32] <!--[endif]-->張志远, 郭巧生, 邵清松. 淹水胁迫对药用菊花苗期生理生化指标的影响[J]. 中国中药杂志, 2009, 34(18): 2285-2289.
<!--[if !supportLists]-->[33] <!--[endif]-->夏红霞, 朱启红. 淹水对滴水观音抗氧化系统和丙二醛的影响[J]. 三峡生态环境监测, 2016, 1(3): 40-44.
<!--[if !supportLists]-->[34] <!--[endif]-->蔡思琪, 廖飞勇. 淹水胁迫对双荚决明生长及生理特性的影响[J]. 北方园艺, 2017(3): 71-75.
<!--[if !supportLists]-->[35] <!--[endif]-->程淑娟. 鹽胁迫下三种藤本忍冬的生理特性研究[D]. 南京: 南京林业大学, 2012.
<!--[if !supportLists]-->[36] <!--[endif]-->Fridovich. The biology of oxygen radicals[J]. Science, 201(4359): 875-880.
<!--[if !supportLists]-->[37] <!--[endif]-->Halliwell B, Gutteridge J M C. Oxygen free radicals and iron in relation to biology and medicine: Some problems and concepts[J]. Archives of Biochemistry and Biophysics, 1986, 246(2): 501-514.
<!--[if !supportLists]-->[38] <!--[endif]-->Wu Q S, Zou Y N, Huang Y M. The arbuscular mycorrhizal fungus Diversispora spurca ameliorates effects of waterlogging on growth, root system architecture and antioxidant enzyme activities of citrus seedlings[J]. Fungal Ecology, 2013, 6(1): 37-43.
<!--[if !supportLists]-->[39] <!--[endif]-->Candan N, Tarhan L. Tolerance or sensitivity responses of Mentha pulegium to osmotic and waterlogging stress in terms of antioxidant defense systems and membrane lipid peroxidation[J]. Environmental and Experimental Botany, 2012, 75: 83-88.
<!--[if !supportLists]-->[40] <!--[endif]-->郭欣欣. 淹水胁迫对不结球白菜光合特性及根系生长的影响[D]. 南京: 南京农业大学, 2015.
<!--[if !supportLists]-->[41] <!--[endif]-->赵 旭, 姚慧敏, 杨 洁. 长期不同根际O2浓度处理对雾培番茄植株抗氧化酶系统的影响[J]. 北方园艺, 2020(17): 1-7.
<!--[if !supportLists]-->[42] <!--[endif]-->梁哲军, 陶洪斌, 王 璞. 淹水解除后玉米幼苗形态及光合生理特征恢复[J]. 生态学报, 2009, 29(7): 3977-3986.
<!--[if !supportLists]-->[43] <!--[endif]-->黄万勇, 卢 成, 郑世宗, 等. 淹水胁迫对水稻植株抗氧化酶变化的影响[J]. 排灌机械工程学报, 2017, 35(11): 1008-1012.
<!--[if !supportLists]-->[44] <!--[endif]-->王 娟. 淹水对牡丹生理特性的影响[J]. 生态学杂志, 2015, 34(12): 3341-3347.
责任编辑:白 净

