橡胶树炭疽病生防内生菌的分离鉴定及抑菌作用研究
李岚岚,戴利铭,蒋桂芝,刘一贤,施玉萍,蔡志英


摘 要:目前化学农药的缺点日益突显,研发环保的生防菌剂是当前绿色安全的一种方法,筛选具有抑制橡胶樹炭疽病的生防菌株,为研发新型生防菌剂储备资源。本文采用组织培养法分离纯化橡胶树内生菌,平板对峙筛选拮抗菌株;通过菌株培养特征、生理生化、根据16S rRNA和gyrA基因序列构建系统发育树确定其分类地位;采用平板对峙法研究内生菌株的抗菌持久性、稳定性、广谱性;采用牛津杯法研究拮抗内生菌对杀菌剂的敏感性。从橡胶树健康的根组织中分离得到4株对橡胶树炭疽病具有抑制作用的细菌(Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4),系统发育树分析结果显示这4株细菌与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)亲缘关系很近,且培养性状和生理生化特征也与解淀粉芽孢杆菌相似。这4株内生菌的抗菌持久性强,抗菌稳定性好;对尖孢炭疽菌(Colletotrichum acutatum)DFMP1E和MLZZP3、小孢拟盘多毛孢(Pestalotiopsis microspora)MF375898均有较强的抑菌能力,对茄类镰刀菌(Fusarium solani)XJ160901的抑制作用较弱;对多菌灵、异菌脲、百菌清、苯醚甲环唑4种杀菌剂均不敏感,有望开发为生防菌剂。
关键词:橡胶树炭疽病;解淀粉芽孢杆菌;生防内生菌;分离鉴定
中图分类号:S763.7;S794.1 文献标识码:A
Isolation, Identification and Bacteriostasis Study of Endophytic Bacteria to Control Colletotrichum Leaf Disease on Rubber Tree
LI Lanlan, DAI Liming, JIANG Guizhi, LIU Yixian, SHI Yuping, CAI Zhiying*
Yunnan Institute of Tropical Crops, Jinghong, Yunnan 666100, China
Abstract: At present, the disadvantages of chemical pesticides are prominent and the development of environmental friendly biocontrol agent is needed. The screening of biocontrol strains with inhibition of rubber anthracnose can reserve resources for the development of new biocontrol agents. The endophyte bacteria of rubber trees were isolated and purified by tissue culture, and growth plate-confrontation was used to screen antagonistic strains. Strain Bac RZS3D4-1, Bac RZS3D4-2, Bac RZS3D4-3, Bac RZS3D4-4 were identified based on morphological, physiological, biochemical characteristics and the phylogenetic tree was constructed with 16S rRNA and gyrA gene sequence. The growth plate-confrontation was used to study the antimicrobial persistence, stability and broad spectrum of endophytic bacteria. The Oxford cup method was used to study the sensitivity of antagonistic endophytic bacteria to fungicides. Four strains of bacteria (Bac RZS3D4-1, Bac RZS3D4-2, Bac RZS3D4-3, Bac RZS3D4-4) were isolated from the healthy root tissues of rubber trees. Phylogenetic tree analysis showed that the four strains were closely related to Bacillus amyloliquefaciens, and the culture traits and physiological and biochemical characteristics were similar to those of B. amyloliquefaciens. The results showed the strains had strong antibacterial persistence and good antibacterial stability, strong antibacterial activity against Colletotrichum acutatum (DFMP1E and Mlzzp3) and Pestalotiopsis microspora (MF375898), and weak inhibitory effect on Fusarium solani (XJ160901). They were not sensitive to carbendazim, isocarb, chlorothalonil and difenoconazole, so it is expected to be developed as a biocontrol agent.
Keywords: Colletotrichum leaf disease on rubber tree; Bacillus amyloliquefaciens; biocontrol endophytic microorganism; isolated identification
DOI: 10.3969/j.issn.1000-2561.2021.10.028
炭疽病是橡膠树上的重要病害,严重发生时会导致橡胶树叶片落光,胶乳产量下降[1]。橡胶树炭疽病在世界各国植胶区均有发生,广泛分布于南美洲、非洲中部、亚洲南部和东南部等地[2]。主要是由胶孢炭疽菌(Colletotrichum gloeosporioides)和尖孢炭疽菌(Colletotrichum acutatum)引起的,近年来在国内外广泛流行,发病趋势日益严重,导致橡胶产业损失逐年增加[3-5]。橡胶树炭疽病危害胶苗、大田幼树和开割胶树,侵染嫩叶、叶柄、嫩梢和果实等多个部位,引起嫩叶脱落、嫩梢回枯和果实腐烂等,严重时引起胶树重复落叶和嫩梢回枯,导致开割时间推迟[2-4]。橡胶树炭疽病在西双版纳地区胶苗苗圃中每年均有发生,1963—1964年,景洪农场的实生苗和芽接苗上就发生了此病,造成严重落叶、嫩梢回枯,之后每年该病在橡胶苗圃均有不同程度的发生[3-8]。
目前,橡胶树炭疽病的防治主要以化学药剂结合农业防治措施为主。农业防治措施包括改善苗圃阴湿环境、合理施肥,提高胶苗抗病能力;开割胶林,清理枯枝落叶及林间杂草,修剪枝叶,改善胶林通风和光照条件等。通过改善胶树生长环境,提高胶树的抗病能力[1, 9-10]。农业防治措施难以大面积推广,且只能在短期内局部控制病情的蔓延。选用以多菌灵为代表的苯并咪唑类农药和以咪鲜胺为代表的麦角甾醇类生物合成制剂及其复配剂作为化学防治的主要药剂[5, 10-13]。然而如果不科学使用化学农药,或是长期大量使用单一化学农药进行病害防治,容易造成防效下降及抗药性等问题,并且大量使用化学农药也会对土壤和水资源造成严重污染,对当地生态环境造成破坏[14-15]。目前,已报道的防治炭疽病的生防菌种类较多,以芽孢杆菌和放线菌研究最为广泛,芽孢杆菌中又以枯草芽孢杆菌为主,已经在病害防治上得到广泛应用,多应用于蔬菜瓜果及粮食作物病害的防治[16-19]。梁艳琼等[20]发现枯草芽孢杆菌Czk1产生的挥发性物质对橡胶树根病病菌和橡胶树炭疽病菌具有一定的抑制效果,樊兰艳[19]发现枯草芽孢杆菌Czk1产生的脂肽类粗提物对橡胶树炭疽病有抑制作用;刘一贤等[21]发现桑树链霉菌对橡胶树褐根病、白根病等具有抑制作用。
随着人们环保意识的逐渐增强和生产需求的不断发展,化学农药的缺点日益突显,寻求高效、环保且行之有效的防治方法势在必行[14-15]。因此对橡胶树炭疽病生防菌的开发利用显得尤为重要,植物内生菌是生防菌的重要来源,所以研究橡胶树内生菌具有重要意义。本研究从橡胶树组织中筛选具有生防作用的内生菌,并对筛选出的菌株进行形态学、生理生化和分子生物学鉴定;同时研究拮抗菌对尖孢炭疽菌的抗菌持久性、稳定性、抑菌谱和对杀菌剂的敏感性,为研发新型生防菌剂储备资源。
1 材料与方法
1.1 材料
1.1.1 供试样品 从云南省红河(河口、金平)、景洪等植胶区采集橡胶树茎干、根等组织(选取成年老橡胶树),使用打孔器在树干和根上钻孔获取组织样品,装入自封袋,填写标签,封好袋子,带回实验室分离。
1.1.2 培养基 Luria-Bertani培养基、马铃薯葡萄糖琼脂培养基(potato dextrose agar)、高氏一号培养基、营养琼脂培养基(nutrient agar)、NYD培养基、BPY培养基、PGY培养基、TGE培养基[22-24]。
1.1.3 主要试剂 细菌基因组提取试剂盒(Bacteria Genomic Kit):北京康为世纪生物科技有限公司;PCR引物:北京六合华大基因科技有限公司合成;葡萄糖、酵母膏、胰蛋白胨、琼脂等分析纯试剂:生工生物工程(上海)股份有限公司;50%多菌灵可湿性粉剂:江苏蓝丰生物化工股份有限公司,75%百菌清可湿性粉剂:先正达(苏州)作物保护有限公司,50%异菌脲可湿性粉剂:苏州富美实植物保护剂有限公司,10%苯醚甲环唑水分散粒剂:先正达南通作物保护有限公司。
1.1.4 供试菌株 尖孢炭疽病菌株(C. acutatum):菌株编号DFMP1E和MLZZP3,胶孢炭疽病菌(C. gloeosporioides):菌株编号NPS1a-2,棒孢霉落叶病菌(Corynespora cassiicola):菌株编号JCMP7A,橡胶树褐根病菌(Phellinus noxius):菌株编号JPNC4,小孢拟盘多毛孢(Pestalotiopsis microspora):菌株编号MF375898,橡胶疫霉(Phytophthora heveae):菌株编号OJ20180523,五隔大无性孢丽赤壳菌(Calonectria pentaseptata):菌株编号OJ20180629,茄类镰刀菌(Fusarium solani):菌株编号XJ160901,以上靶标病原菌均由本实验室分离保存。
1.2 方法
1.2.1 内生菌的分离与纯化 将从植胶区采集的健康橡胶树组织洗净,用0.1%升汞溶液和75%酒精表面消毒,用灭菌水反复冲洗,吸干表面水份,去掉植物组织最外层,切成小块,分别放入LB、PDA和高氏1号平板培养基中培养,以最后一次清洗植物组织的灭菌水作为对照[25-28]。将平板放入28 ℃培养箱培养,1~2 d后取出LB平板,挑取单菌落划线接种到新的LB平板,并编号;4~5 d后取出PDA和高氏1号平板,挑取单菌落分别接种到相应的培养基上,并编号。纯化后分别于斜面4 ℃保存、甘油管–80 ℃保存[29]。
1.2.2 拮抗内生菌初筛和复筛 以尖孢炭疽菌株MLZZP3和胶孢炭疽菌株NPS1a-2作为指示菌,采用平板对峙培养法进行初筛,观察有无抑菌带,筛选出具有拮抗作用的内生细菌[30-31]。
对初筛得到的有拮抗作用的内生细菌进行复筛,采用平板对峙法,以只接病原菌作为对照,培养7 d后,计算指示菌抑菌率。抑制率=(对照组菌落生长直径–处理组菌落生长直径)/(对照组菌落生长直径–接种菌块直径)×100%[15, 30-32]
1.2.3 拮抗内生菌的鉴定 菌落形态特征:将拮抗内生菌Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4分别接种在LB、NA、PDA、NYD、BPY、PGY、TGE等培养基上,28 ℃恒温培养1 d,观察4株内生菌的菌落形态。参考《常见细菌系统鉴定手册》[33]和《伯杰细菌鉴定手册》[34]的方法,对拮抗菌进行革兰氏染色,并在光学显微镜下观察染色结果和菌株形态。
生理生化指标:参考《常见细菌系统鉴定手册》[33]和《伯杰细菌鉴定手册》[34]的方法,对拮抗菌的M.R试验、V-P试验、接触酶试验、淀粉水解、硝酸盐还原、脂酶试验、明胶水解、反硝化、柠檬酸盐利用等生理生化指标进行测定。
系统发育学特征:提取菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4的基因组总DNA,采用16S rRNA基因的通用引物对提取的基因组DNA分别进行PCR扩增,同时采用引物gyrA-F(5-CAGTCAGGAAA TGCGTACGTCCTT-3)和gyrA-R(5-CAAGGTA ATGCTCCAGGCATTGCT-3)对gyrA基因进行扩增[35-37]。
1.2.4 拮抗内生菌的抗菌持久性研究 以尖孢炭疽菌株DFMP1E为指示菌,采用平板对峙法,以只接种指示菌作为对照,28 ℃恒温培养,培养5、10、15、20、25、30 d后,测量指示菌菌落直径,计算指示菌的抑菌率[38-39]。
1.2.5 拮抗内生菌的抗菌稳定性研究 以尖孢炭疽菌株DFMP1E为指示菌,采用平板对峙法,将拮抗菌在培养基上连续转接多代,以不同代的拮抗菌作为处理,以只接种指示菌的处理作为对照,28 ℃恒温培养7 d后,计算指示菌的抑菌率[40-41]。
1.2.6 拮抗内生菌抗菌谱研究 以菌株编号为DFMP1E、MLZZP3、NPS1a-2、JCMP7A、JPNC4、MF375898、OJ20180523、OJ20180629、XJ160901的9个病原菌作为指示菌,采用平板对峙法,计算指示菌的抑菌率,评价拮抗菌的抗菌广谱性[38, 42-43]。
1.2.7 拮抗内生菌对杀菌剂的敏感性 牛津杯法测4株拮抗内生细菌对多菌灵(1388.9 mg/kg)、异菌脲(694.4 mg/kg)、百菌清(2777.8 mg/kg)、苯醚甲环唑(200 mg/kg)的敏感性,每个处理重复3次,以加无菌水的处理作为对照,28 ℃恒温培养1~2 d后,观察是否产生抑菌圈[44-45]。
2 结果与分析
2.1 内生菌的分离与纯化
从云南省植胶区红河(河口、金平)、景洪等地采集橡胶树根、茎干组织样品共25份,分离得到156株菌,其中64株真菌,92株细菌。
2.2 拮抗内生菌的初筛和复筛
通过平板对峙法对分离得到的156株内生菌进行初筛和复筛,筛选得到4株对炭疽病菌有较好抑制作用的细菌菌株(图1),分别编号为:Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4。结果显示4株菌对供试病原真菌都具有抑制作用,对尖孢炭疽病菌MLZZP3(C. acutatum)的抑菌率分别为74.80%、62.59%、75.47%、74.35%,对胶孢炭疽病菌NPS1a-2(C. gloeosporioides)的抑菌率分别为59.52%、47.48%、61.87%、60.78%。
2.3 拮抗内生菌的鉴定
2.3.1 菌落形态特征 拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4在LB、NA、PDA、NYD、BPY、PGY、TGE 7种供试培养基中均能良好生长,但在不同的培养基上菌落形态有差异(表1)。4株菌革兰氏染色均为阳性,菌体呈杆状,两端钝圆。
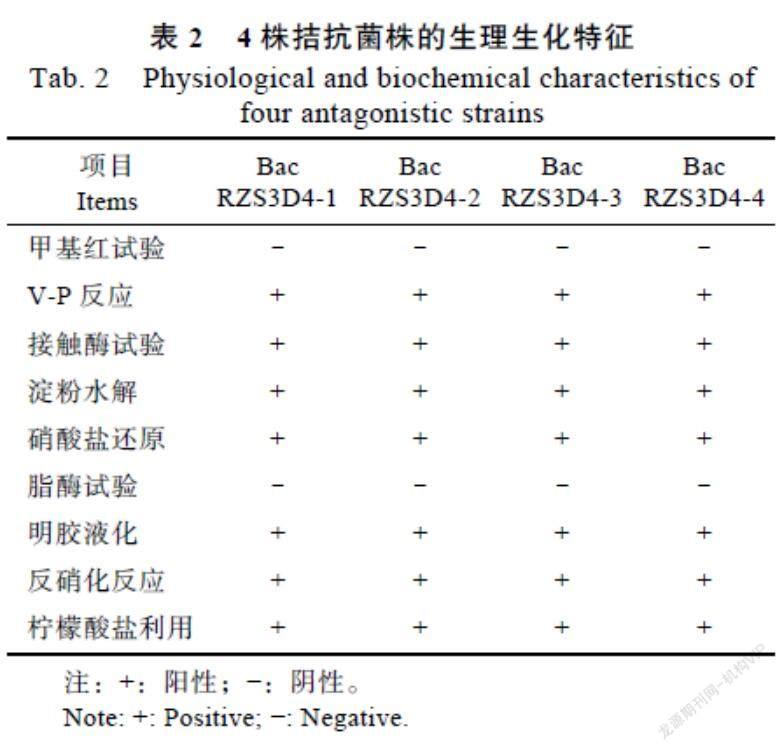
2.3.2 生理生化特征 菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4的生理生化特征如表2所示,4株菌的甲基红试验均为阴性,V-P试验均为阳性,均能产生过氧化氢酶、淀粉水解酶,均能使硝酸盐还原、明胶水解,均不产生脂酶,均能够利用柠檬酸盐,反硝化反应均为阳性。
2.3.3 系统发育学特征 用16S rRNA基因通用引物对4株拮抗菌株进行序列扩增并测序,得到1400 bp左右的序列,将序列提交到GenBank,获得登录号分别为MT747964、MT747965、MT747966、MT747967,经BLAST比对,选取覆蓋度和相似性较高且有效发表的菌株进行16SrRNA基因序列的系统发育分析,通过构建系统发育树发现,从聚类结果可以看出4株拮抗菌株与芽孢杆菌属的枯草芽孢杆菌(Bacillus subtilis)和解淀粉芽孢杆菌(B. amyloliquefaciens)聚在同一个分支上。16S rRNA基因序列比对结果显示4株菌株均属于芽孢杆菌。
gyrA基因序列提交到GenBank,获得登录号分别为MW041644、MW041643、MW041642、MW041641。菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4的gyrA基因序列与解淀粉芽孢杆菌L-1、X-L、TN0501、10A18的gyrA基因序列同源性较高,与解淀粉芽孢杆菌L-1、X-L、TN0501、10A18属同一分支(图2)。
综合拮抗菌株Bac RZS3D4-1、Bac RZS3D4- 2、Bac RZS3D4-3、Bac RZS3D4-4的菌落形态特征、革兰氏染色、生理生化指标与16S rRNA基因序列和gyrA基因序列系统发育树分析,将拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4鉴定为解淀粉芽孢杆菌(B. amyloliquefaciens)。
2.4 拮抗内生菌的抗菌持久性研究
培养30 d,对照组病原菌菌落直径从5 mm增长到86.10 mm,接种拮抗菌株Bac RZS3D4-1的处理病原菌菌落直径从5 mm增长到27.06 mm,接种Bac RZS3D4-2的处理病原菌菌落直径从5 mm增长到35.34 mm,接种Bac RZS3D4-3的处理病原菌菌落直径从5 mm增长到24.91 mm,接种Bac RZS3D4-4的处理病原菌菌落直径从5 mm增长到27.43 mm。以上数据表明,培养30 d后接种拮抗菌株的处理病原菌菌落的增长速度明显小于对照组,表明4株拮抗菌株均能持久抑制病原菌的生长。
拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4不同培養时间对病原菌的抑制率见表3,随着培养时间的延长,抑菌率呈先升后降的趋势,而且前期增长趋势明显,后期下降趋势不明显,后期抑制率无显著性差异,表明拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4对病原菌的抑制作用较持久。
2.5 拮抗内生菌的抗菌稳定性研究
拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4的不同世代对尖孢炭疽病菌DFMP1E均有较高的抑制作用。4株拮抗菌株从第1代到第10代对尖孢炭疽病菌DFMP1E的抑制率有一定波动,分别为:菌株Bac RZS3D4-1的抑制率为(69.24%±0.03%)~(72.95%± 0.09%),菌株Bac RZS3D4-2抑制率为(56.69%± 0.58%)~(60.63%±0.21%),Bac RZS3D4-3的抑制率为(68.81%±0.23%)~(71.64%±0.33%),Bac RZS3D4-4的抑制率为(68.94%±0.60%)~(70.43%± 0.02%)。虽然抑制率有所波动,但波动范围较小,表明拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4对尖孢炭疽病菌DFMP1E的拮抗作用比较稳定。
2.6 拮抗内生菌抗菌谱研究
拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4对9种供试病原真菌均有抑制作用(表4),表明4株拮抗菌株的抗菌谱较广,且菌株Bac RZS3D4-1、Bac RZS3D4-3、Bac RZS3D4-4的抑菌能力较菌株Bac RZS3D4-2强。4株拮抗菌株对尖孢炭疽病菌DFMP1E、MLZZP3和小孢拟盘多毛孢MF375898三种病原菌的抑菌能力较强,对茄类镰刀菌XJ160901的抑制作用最弱。
2.7 拮抗内生菌对杀菌剂的敏感性
通过拮抗菌对杀菌剂的敏感性试验,处理组和对照组的拮抗菌都正常生长,没有产生抑菌圈,表明拮抗菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4对供试的多菌灵、异菌脲、百菌清、苯醚甲环唑在生产上使用的最高浓度不敏感。
3 讨论
本研究采用菌落形态学、生理生化指标和分子生物学鉴定相结合的方法对分离得到的内生菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4- 3、Bac RZS3D4-4进行鉴定,结果表明4株菌株的菌落形态和生理生化指标与解淀粉芽孢杆菌(B. amyloliquefaciens)基本一致,且对4株菌的16S rRNA基因序列和gyrA基因序列扩增测序并构建系统发育树,16S rRNA基因序列比对结果仅显示4株菌株属于芽孢杆菌,无法确定其分类地位;通过gyrA基因序列构建系统发育树,发现4株菌株与解淀粉芽孢杆菌(B. amyloliquefaciens)的相似度极高,综上所述初步鉴定菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4为解淀粉芽孢杆菌(B. amyloliquefaciens)[35-37, 46-49]。
4株拮抗菌株对尖孢炭疽病菌DFMP1E(C. acutatum)的抑制作用呈现先升后降的趋势,而且前期增长趋势明显,后期下降趋势不明显。前期处理组因拮抗菌的抑制作用,指示菌的生长速度较对照组慢,所以抑制率逐渐增加,且增幅明显。后期由于培养皿、培养基营养等因素的限制,抑菌率有微弱下降,但是下降趋势不明显,4株拮抗菌株对尖孢炭疽病菌DFMP1E的抑菌持久性较好。
4株拮抗菌株的不同世代对尖孢炭疽病菌DFMP1E均有较高的抑制作用,且抗菌稳定性较好。4株拮抗菌株对9种供试病原真菌均有不同程度的抑制作用,抗菌谱较广,菌株Bac RZS3D4-1、Bac RZS3D4-3、Bac RZS3D4-4的抑制能力较菌株Bac RZS3D4-2强。4株拮抗菌株对常用的4种杀菌剂(多菌灵、异菌脲、百菌清、苯醚甲环唑)不敏感。
菌株Bac RZS3D4-1、Bac RZS3D4-2、Bac RZS3D4-3、Bac RZS3D4-4相较于土壤分离等其他来源的菌株具有一定优势:(1)来源于植物组织内,与宿主长期进化,已经适应了宿主的内环境,能够迅速在植物体内定殖,并且稳定生存;(2)属于解淀粉芽孢杆菌(B. amyloliquefaciens),已有研究表明,解淀粉芽孢杆菌具备快速在植物体内稳定高效地定殖,占据病原菌的生态位点,达到抑制植物病原菌的侵入和定殖的能力[50-58],能够长期稳定的达到抑制病害发生发展的作用;(3)4株菌株对杀菌剂不敏感,在开展生防菌剂的研发时,可以考虑与某些杀菌剂混配。前期杀菌剂快速杀灭植物病原菌以控制病害的发生发展,但化学药剂有效期较短,后期拮抗菌能夠在植物体内定殖,长期稳定地抑制病害的发生发展;并且拮抗菌定殖后,使用该菌不敏感的杀菌剂对定殖的拮抗菌也没有影响。
目前,虽然生防菌剂在生产上已经得到广泛应用,多用于蔬菜、瓜果、粮食作物类,而对于高大林木如橡胶树等的生防菌剂的研发多停留在实验室阶段,因环境、宿主、防效缓慢,防治时效短等因素使生防菌剂的田间应用受到局限[16-19]。本研究主要是以离体实验为主,为以后的大田试验提供数据参考,后期将逐步把研究重点放在发酵菌液大田试验应用和生防菌株在植物体内的定殖等方面。
参考文献
[1] 赵璐璐. 枯草芽孢杆菌Czk1发酵工艺的优化及其对橡胶树炭疽病、根病生防效果初步研究[D]. 海口: 海南大学, 2011.
[2] 古 鑫. 22种植物提取物防治橡胶树炭疽病的研究[D]. 海口: 海南大学, 2012.
[3] 蔡志英, 黄贵修. 巴西橡胶树炭疽病研究进展[J]. 西南林业大学学报, 2011, 31(1): 89-93.
[4] 李加智, 张春霞, 何明霞. 云南橡胶树叶炭疽病病状及发生近况[J]. 热带农业科技, 2008(3): 13-16.
[5] 蔡志英, 李加智, 何明霞, 等. 三种热雾剂对橡胶树炭疽病大田防治试验[J]. 热带农业科技, 2009, 32(3): 10-11.
[6] 张春霞, 何明霞, 李加智, 等. 云南西双版纳地区橡胶炭疽病病原鉴定[J]. 植物保护, 2008(1): 103-106.
[7] 陈荃英. 橡胶炭疽菌生物学特性观察[J]. 云南热作科技, 1982(3): 25-27, 29.
[8] 史学群. 橡胶树对炭疽病抗病机制的研究[D]. 儋州: 华南热带农业大学, 2001.
[9] 郑 鹏, 何 静, 常凯军, 等. 橡胶树枝条内生真菌的分离及其拮抗性的测定[J]. 热带作物学报, 2009, 30(6): 832-837.
[10] 李 兵, 韩开伦, 张 云, 等. 景洪农场橡胶树炭疽病的发生及防治措施[J]. 农业科技通讯, 2012(3): 200-201.
[11] 曹学仁, 车海彦, 杨 毅, 等. 2014年海南省橡胶炭疽病菌对多菌灵和咪鲜胺的敏感性测定[J]. 植物病理学报, 2015, 45(6): 626-631
[12] 殷永涛. 一种混合物对橡胶树白粉病、炭疽病防控作用研究[D]. 海口: 海南大学, 2012.
[13] 郑行恺. 海南省橡胶树炭疽病监测及其防治药剂施用技术研究[D]. 海口: 海南大学, 2019.
[14] 张 凯, 吴曼莉, 辜柳霜, 等. 胶孢炭疽菌生防放线菌gz-8的鉴定及生物活性初步评价[J]. 农药学学报, 2017, 19(6): 708-715.
[15] 辜柳霜, 张月凤, 张 凯, 等. 胶孢炭疽菌生防放线菌SD-29的鉴定及抗菌活性评价[J]. 微生物学通报, 2019, 46(4): 770-779.
[16] 程欢欢, 余 水, 姚伟伟, 等. 辣椒炭疽病生防芽孢杆菌的筛选及田间防效[J]. 河南农业大学学报, 2019, 53(4): 568-573.
[17] 赵璐璐, 贺春萍, 郑肖兰, 等. 枯草芽孢杆菌Czk1菌株对橡胶树根病菌的抑制作用及对炭疽病生防效果研究初报[J].南方农业学报, 2011, 42(7): 740-743.
[18] 谢 立, 贺春萍, 梁艳琼, 等. 枯草芽孢杆菌Czk1与化学杀菌剂协同防治橡胶树根病[J]. 热带作物学报, 2020, 41(8): 1625-1633.
[19] 樊兰艳. 橡胶树内生枯草芽孢杆菌(Bacillus subtilis)Czk1抗菌活性物质的初步研究[D]. 海口: 海南大学, 2013.
[20] 梁艳琼, 唐 文, 董文敏, 等. 枯草芽孢杆菌菌株Czk1挥发性物质的抑菌活性及其组分分析[J]. 南方农业学报, 2019, 50(11): 2465-2474.
[21] 刘一贤, 施玉萍, 戴利铭, 等. 橡胶褐根病拮抗放线菌17-7的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2020, 47(1): 118-129.
[22] 安俊莹. 海洋源解淀粉芽孢杆菌细菌素CAMT2发酵优化、分离及抗菌机理研究[D]. 湛江: 广东海洋大学, 2014.
[23] 牛世全, 耿 晖, 阎薇如, 等. 黄芪根腐病生防放线菌筛选鉴定及其优化培养[J]. 植物保护学报, 2016, 43(6): 943-950.
[24] 郭晓平, 刘兴飞, 李晓楠, 等. 泰山黄精内生细菌的抗菌活性研究[J]. 生物技术通报, 2020, 36(11): 48-54.
[25] 陈建英, 陈肖学, 罗旭璐, 等. 香竹箐栽培型古茶树内生真菌对植物病原真菌的拮抗活性[J]. 云南农业大学学报(自然科学), 2020, 35(3): 422-429.
[26] 郑 旭. 马铃薯内生菌的分离鉴定及抑龙葵碱功能研究[D]. 北京: 中国农业科学院, 2019.
[27] 褚衍亮, 刘宇佳, 姚 婷, 等. 一株产蛋白酶植物内生菌的分离、鉴定及产酶条件研究[J]. 江苏科技大学学报(自然科学版), 2019, 33(1): 93-99, 120.
[28] 汤冰雪. 竹叶兰内生菌的分离鉴定及生物活性研究[D]. 广州: 华南理工大学, 2018.
[29] 孙爱琴. 基层微生物实验室标准菌株的制备和保藏方法[J]. 医学动物防制, 2015, 31(8): 942, 945.
[30] 常 栋, 顾建国, 贾方方, 等. 烟草黑胫病不同植物源生防菌的筛选及防效测定[J]. 中国烟草学报, 26(3): 84-90.
[31] 谢林艳, 狄义宁, 何丽莲, 等. 甘蔗赤腐病内生拮抗菌YC89的筛选及鉴定[J]. 微生物学报, 2020, 60(4): 739-748.
[32] 于地美, 黄华毅, 梁小文, 等. 一株生防真菌TRCC27001的鉴定及其抑菌特性[J]. 福建农林大学学报(自然科学版), 2019, 48(2): 148-154.
[33] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-387.
[34] Krieg N R, Staley J T, Brown D R, et al. Bergeys Manual of Systematic Bacteriology[M]. Baltimore: Williams &Wilkins, 1986.
[35] 荆卓琼, 郭致杰, 徐生军, 等. 解淀粉芽孢杆菌HZ-6-3的筛选鉴定及其防治番茄灰霉病效果的评价[J]. 草业学报, 2020, 29(2): 31-41.
[36] 卢钰升, 顾文杰, 蒋瑞萍, 等. 一株生防细菌GB58的鉴定与抑菌能力测定[J]. 中国农学通报, 2016, 32(6): 198-204.
[37] 戴利铭, 李岚岚, 刘一贤, 等. 解淀粉芽孢杆菌生防菌BS-3全基因组测序及生物信息分析[J]. 微生物学通报, 2021, 48(6): 2073-2088.
[38] 付红梅. 大豆疫霉拮抗菌株的筛选、鉴定及拮抗物质的初步分析[D]. 合肥: 安徽农业大学, 2011.
[39] 赵旖森, 张 亮, 盛 浩, 等. 辣椒疫霉病生防细菌的筛选鉴定及其防效[J]. 中国蔬菜, 2019(1): 65-69.
[40] 黄明媛. 番茄青枯病拮抗菌筛选鉴定及发酵条件研究[D]. 哈尔滨: 东北农业大学, 2011.
[41] 代 鹏, 张 霞, 杨腊英, 等. 抗生素产生菌Streptomyces albogriseus发酵液的抗菌谱及稳定性测定[J]. 热带作物学报, 2009, 30(1): 86-89.
[42] 胡晓丹. 禾谷镰刀菌拮抗菌的筛选鉴定及拮抗特性研究[D]. 南京: 南京农业大学, 2014.
[43] 汪汉成, 王茂胜, 黄艳飞, 等. 烟草青枯病拮抗菌株X-60的分离鉴定及其表型组学分析[J]. 植物病理学报, 2016, 46(3): 409-419.
[44] 闫建芳, 刘 秋, 赵柏霞, 等. 番茄溃疡病生防菌YH23的发酵条件优化及菌种鉴定[J]. 沈陽农业大学学报, 2019, 50(5): 608-613.
[45] 孙 露, 单潇潇, 蒋建兰, 等. 一株对稻瘟病菌有抗菌活性的特基拉芽孢杆菌 WRN032的筛选及发酵条件优化[J].天然产物研究与开发, 2020, 32(5): 860-866, 881.
[46] 穆晓雅, 谭志琼, 刘 铜, 等. 一种新的黄瓜细菌性叶斑病拮抗细菌的筛选鉴定及其发酵条件的初步研究[J]. 西南农业学报, 2019, 32(4): 837-842.
[47] 符可芯, 杨 叶, 曾耿狄. 热带土壤中解淀粉芽孢杆菌HNU1的鉴定及发酵条件优化[J]. 中国农业科技导报, 2020, 22(6): 49-59.
[48] 司世飞, 宋莉莎, 任 静, 等. 一株抗烟草赤星病解淀粉芽孢杆菌的筛选及鉴定[J]. 河北大学学报(自然科学版), 2018, 38(4): 410-415.
[49] 李晓宇. 解淀粉芽孢杆菌LXY-6-2筛选、鉴定、诱变与发酵条件优化及其对辣椒根腐病的生物防治研究[D]. 杨凌:西北农林科技大学, 2018.
[50] Tan S Y, Jiang Y, Song S, et al. Two Bacillus amyloliquefaciens strains isolated using the competitive tomato root enrichment method and their effects on suppressing Ralstonia solanacearum and promoting tomato plant growth[J]. Crop Protection, 2013, 43: 134-140.
[51] Weng J, Wang Y, Li J, et al. Enhanced root colonization and biocontrol activity of Bacillus amyloliquefaciens SQR9 by abrB gene disruption[J]. Applied Microbiology & Biotechnology, 2013, 97(19): 8823-8830.
[52] 谯天敏, 张 静, 冉晓潇, 等. 解淀粉芽孢杆菌在山茶叶中的定殖及对山茶灰斑病的防效[J]. 西北农林科技大学学报(自然科学版), 2015, 43(10): 77-84.
[53] 杨洪凤, 薛雅蓉, 余向阳, 等. 内生解淀粉芽孢杆菌CC09菌株在小麦叶部的定殖能力及其防治白粉病效果研究[J].中国生物防治学报, 2014, 30(4): 481-488.
[54] 张 楠, 吴 凯, 沈怡斐, 等. 根际益生菌解淀粉芽孢杆菌SQR9在香蕉根表的定殖行为研究[J]. 南京农业大学学报, 2014, 37(6): 59-65.
[55] 胡 伟, 赵兰凤, 张 亮, 等. 香蕉枯萎病生防菌AF11的鉴定及其定殖研究[J]. 中国生物防治学报, 2012, 28(3): 387-393.
[56] 王 雪, 张丹妮, 王春伟, 等. 解淀粉芽孢杆菌FS6在人参体内的定殖特性及对人参诱导抗病性[J]. 西北农林科技大学学报(自然科学版), 2019, 47(7): 125-130, 138.
[57] 崔 晓, 徐艳霞, 刘俊杰, 等. 芽孢杆菌在农业生产中的应用[J]. 土壤与作物, 2019, 8(1): 32-42.
[58] 祁 超, 寸海春, 何鹏飞, 等. 生防菌YN201490在黄瓜植株体内的定殖能力及防病机制的初步研究[J]. 云南大学学报(自然科学版), 2019, 41(1): 172-180.
责任编辑:谢龙莲

