不同沉淀剂对酚抽法提取植物蛋白质效果比较分析
霍玉鑫,甘番露,王玉晶,张雪妍,王旭初,谢全亮

摘 要:酚抽法已經逐渐成为植物蛋白质组研究中通用的蛋白质提取方法,但在各种改进酚抽法中,应用到的沉淀试剂各不相同,致使蛋白沉淀得率、纯度和沉淀时间也各异,本研究以热带植物橡胶树叶片、胶乳和海马齿叶片为研究材料,在过饱和硫酸铵甲醇溶液、醋酸氨甲醇溶液和丙酮溶液沉淀剂下对比蛋白提取的效果,通过单向电泳检测、胶图质量分析、质谱鉴定、蛋白沉淀时间和得率比较,发现3种沉淀剂提取的蛋白样品1-DE图谱显示的蛋白条带数量均较多,但醋酸铵沉淀法提取蛋白图谱有条纹不清晰现象。得出结论:丙酮沉淀法对橡胶树叶片和胶乳蛋白质的提取率较高,硫酸铵沉淀法对海马齿叶片蛋白质提取率较高。过饱和硫酸铵甲醇溶液和丙酮沉淀剂提取的蛋白质质量较高,所得蛋白图谱背景清晰,质谱鉴定蛋白质信息量大。研究结果可优化提取高质量植物蛋白质的方法,并有望为顽拗类植物蛋白质组学研究提供参考。
关键词:蛋白提取;橡胶树;海马齿;沉淀剂;聚丙烯凝胶电泳;质谱
中图分类号:TQ936 文献标识码:A
Comparative Analysis of the Effects of Different Precipitation Agents on Extraction of Plant Protein by Phenol Extract
HUO Yuxin1, GAN Panlu1, WANG Yujing1, ZHANG Xueyan1, WANG Xuchu1,2*, XIE Quanliang1,2*
1. Hainan Normal University / Key Laboratory of Tropical Island Ecology, Ministry of Education, College of Life Sciences, Haikou, Hainan 571158, China; 2. College of Life Science and Agricultural, Shihezi University, Shihezi, Xinjiang 832003, China
Abstract: The borax/PVPP/phenol (BPP) protocol is a widespread protein extraction method in plant proteome research. However, BPP extraction of plant protein, combined with different precipitation agents, the precipitation time, yield and purity of extracted protein is strikingly different. In this study, Sesuvium portulacastrum and Para-rubber tree leaves, and rubber latex were used as the research materials. The plant protein was extracted and analyzed with precipitating agents of supersaturated potassium ammonium sulfate alcohol solution, ammonium acetate methanol solution and acetone solution. Using the methods of SDS-PAGE, gel electrophoresis image quality, mass spectrum identification, settling duration and comparative analysis of protein yield, it was showed that the protein bands extracted by the ammonium acetate precipitation method were not evident. Hevea leaves and latex showed a higher yield of protein in acetone solution. S. portulacastrum leaves had a higher yield of protein in supersaturated potassium ammonium sulfate alcohol solution. The clear background of gel electrophoresis figures was found for the supersaturated potassium ammonium sulfate ethanol solution and acetone solution. The comprehensive protein sequence information identified by mass spectrometry had a higher quality of precipitated protein. The research results can optimize the method of extracting high-quality plant protein, and it will be expected to provide references for recalcitrant plant taxa proteomics research in the future.
Keywords: protein extraction; Hevea brasiliensis; Sesuvium portulacastrum; precipitant; polypropylene gel electrophoresis; mass spectrometry
DOI: 10.3969/j.issn.1000-2561.2021.10.035
從植物组织中制备高质量的蛋白质样品用于蛋白质组学分析是一个巨大的挑战,而蛋白质组学已经发展成为研究植物蛋白功能的重要技术手段[1-2],是一种检测植物基因在转录后是否被翻译和修饰等较新颖且有效的研究植物蛋白的方法,从而填补了从转录组到代谢组的中间空缺[3-5]。目前,蛋白组学的研究技术方法有很多,例如2-DE[6]、MALDI[7]、Label-free[8]和iTRAQ/TMT[9]等技术,被广泛用于研究某种特定生理环境下动植物的全蛋白、差异表达水平以及互作分析等。但由于植物各种组织细胞中含有特定的物质能够降低提取蛋白的质量及产率,所以无法提取固定得率的蛋白质,需要针对特定的材料采取特定的提取处理方法[10-11],从而提高提取植物蛋白质的质量,这也是决定蛋白质组学后续比较分析的关键因素。
由于植物组织的特殊特性,通常因坚固的细胞壁、蛋白酶、大的液泡、高浓度的有机酸和次级代谢产物(酚类化合物和色素)等物质,严重干扰蛋白质的提取、分离和鉴定,致使从植物各组织中分离蛋白质组分具有很大的挑战性,也是影响植物蛋白组学研究最关键因素[12-14]。利用酚抽法可用于顽拗类植物组织中蛋白质提取[15],但提取蛋白的得率还需进一步提升。针对木本植物橡树、松树和杨树的次生木质部总蛋白提取,发现使用优化的TCA-丙酮方法,提取蛋白质效果最佳[16]。在挪威针云杉和欧洲山毛榉的叶和根中分离蛋白质,发现在包含7 mol/L尿素和2 mol/L硫脲的分离液剂下提取和分离蛋白质最佳[17],但提取方法中并未涉及沉淀剂的深入讨论。在谷物种子中用不同缓冲液可以分离出种子内不同蛋白质用于蛋白质组学研究[18],其在沉淀剂选择上并未改进。以三氯乙酸、丙酮沉淀和苯酚提取黄连木的雄性和雌性植物蛋白质比较研究,详细描述了这3种提取方法的优缺点和应用,使研究者能为特定的物种、组织或细胞类型选择合适的方法[19],但是在沉淀剂的选择方面也未深入研究。在模式植物拟南芥中提取总蛋白时,可用常规溶解剂就能溶解一系列蛋白质,并实现其高效定量的回收,使用这种方法可用于试剂盒直接定量[20],但并非绿色植物都可以使用该方法。随后,Flengsrud[21]在大麦叶、马铃薯叶和云杉针叶组织中提取蛋白质,克服了绿色植物中固有的蛋白质组学分析障碍,但在蛋白质的产率和纯化方面还有待优化。综上所述,在植物蛋白提取方法不断更新过程中,蛋白得率和质量是影响蛋白组学深入研究的主要因素,针对这方面的困难应着眼于在提取不同植物组织蛋白质过程中,如何选取最佳沉淀剂,从而获得纯度较高的蛋白质。
在笔者前期的研究中,发现利用本实验室改进酚抽法(Borax/PVPP/Phenol,BPP)提取橡胶树以及海马齿组织蛋白的得率以及质谱鉴定结果相差都非常大,难以进行后续蛋白质组学分析研究。因此,为了克服上述困难,我们选择了巴西橡胶树(Hevea brasiliensis)的叶片和胶乳(含多糖多酚类物质)以及高含盐海岸植物海马齿(Sesuvium portulacastrum L.)的叶片材料特殊性,提供了一种辅助蛋白质提取方法,首次针对这3种材料在BPP提取缓冲液结合过饱和硫酸铵甲醇溶液、醋酸铵溶液和丙酮溶液3种沉淀剂展开了蛋白提取方法的研究,在蛋白得率、凝胶图谱和质谱鉴定等方面系统分析。通过实验表明,针对不同植物材料选择不同沉淀剂的方法,确实对植物蛋白质提取很有效,并且同时适用于聚丙烯凝胶电泳及质谱分析的2种蛋白组学分析手段。为采用BPP法提取不同植物蛋白时选择合适的沉淀剂提供理论支持,也为今后植物蛋白质组学研究提供技术参考。
1 材料与方法
1.1 材料
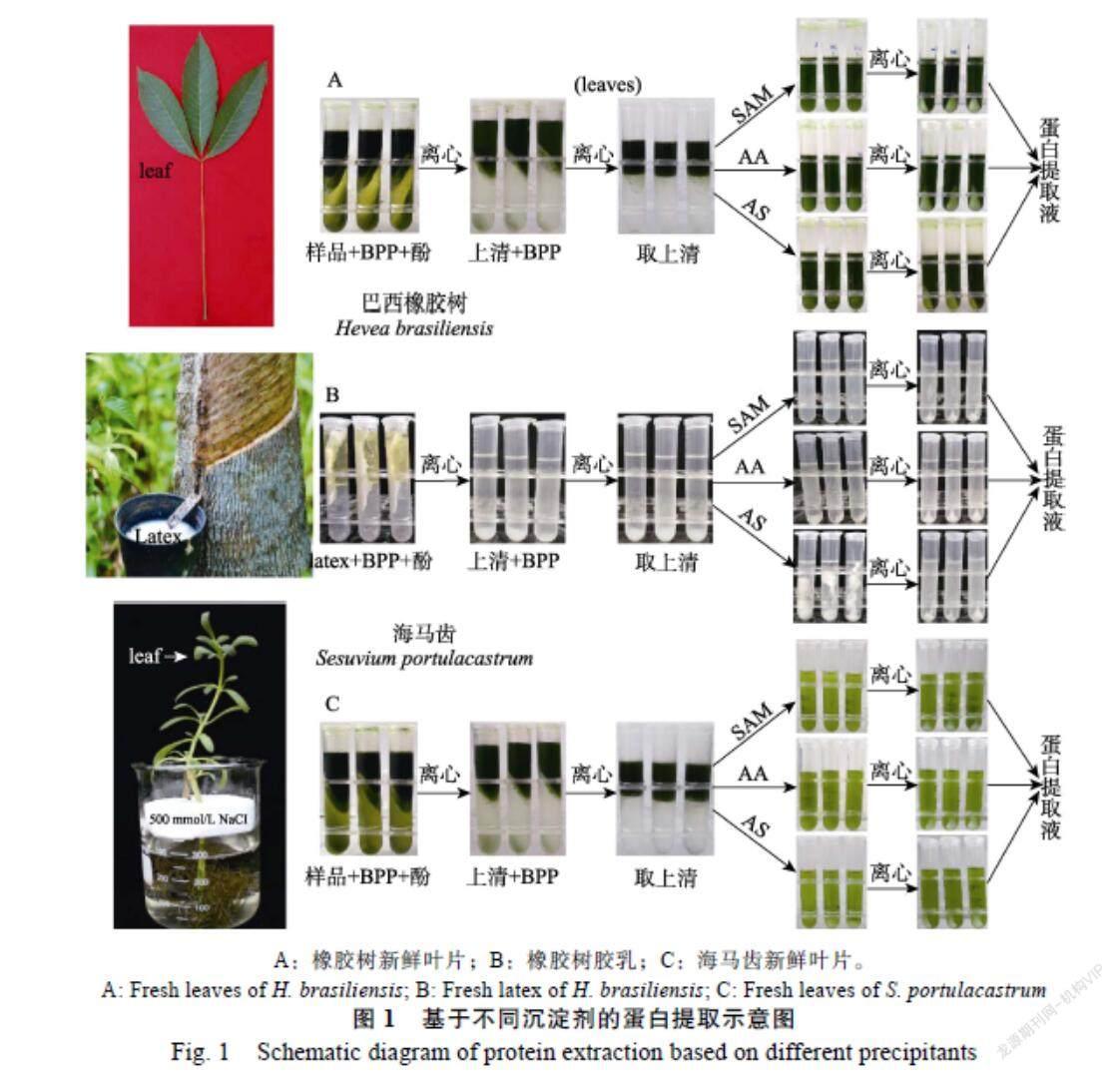
以中国热带农业科学院实验田内橡胶树(‘热研73-3-97)新鲜叶片(Hevea leaves,HL)、橡胶树新鲜胶乳(latex,LA)以及番杏科多年生匍匐草本植物海马齿新鲜叶片(Sesuvium leaves,SL)为实验材料。橡胶树切割先让胶乳流25滴以上,流尽树皮表面的杂质后开始取样,取样用的割刀需要高温灼烧消毒灭菌后使用,以免引起H. brasiliensis死皮病。用植物蛋白质BPP法(Borax/PVPP/Phenol)提取蛋白。BPP蛋白提取缓冲液配置:100 mmol/L EDTA,100 mmol/L Tris, 50 mmol/L维生素C,50 mmol/L硼砂,1%(V/V)Triton X-100,1 g(W/V)PVPP,30%(W/V)蔗糖和2%(V/V)β-巯基乙醇,pH 8.0;蛋白裂解液:1%(V/V)IPG buffer,2 mol/L硫脲,2%(W/V)CHAPS,7 mol/L尿素,13 mmol/L DTT;标准Laemmli buffer:0.001%(W/V)溴酚蓝,2%(W/V)SDS,5%(V/V)β-巯基乙醇,10%甘油,62.5 mmol/L Tris-HCl;胶条平衡液:0.002%(W/V)溴酚蓝,2%(W/V)SDS,30%(V/V)甘油,50 mmol/L Tris-HCl,6 mol/L尿素;GAP凝胶染色液:0.125%(W/V)考马斯亮蓝G-250,5%(V/V)磷酸,10% (W/V)硫酸铵,10%(V/V)甲醇,30%(V/V)乙醇;凝胶脱色液:5%(V/V)乙酸,30%(V/V)乙醇;胰蛋白酶缓冲液;25 mmol/L碳酸氢铵,1 mmol/L氯化钙,pH 8.5。
1.2 方法
1.2.1 植物蛋白的提取 采集植物组织后,立即浸入液氮预冷研钵中速冻,并加入1% PVPP粉末防止氧化,充分研磨成干粉后,称取3 g植物组织粉末,加入盛有10 mL预冷BPP提取缓冲液50 mL离心管中,室温涡旋震荡10 min。加入等体积Tris饱和酚,室温涡旋震荡10 min。用BPP提取缓冲液配平,4 ℃,16 000 ×g,离心15 min。吸取上清液于新的50 mL离心管中,再次加入等体积BPP提取缓冲液,4 ℃涡旋震荡5 min。再次加入BPP提取缓冲液配平,4 ℃,16 000 ×g,离心15 min。取上清液1 mL,分装入含有5 mL不同沉淀剂的10 mL离心管中,不同沉淀剂为:(1)预冷的过饱和硫酸铵甲醇溶液(supersaturated ammonium sulfate methanol,SAM)可使蛋白质溶解性变小产生物理沉淀,称为蛋白质“盐析”现象。(2)丙酮溶液(acetone solution, AS)通过有机溶剂丙酮溶液破坏蛋白质的水化层,降低介电常数,从而增强带电蛋白质分子之间的相互作用,促进蛋白颗粒聚集沉淀。为避免蛋白变性,丙酮溶液需要低温且操作时间尽量缩短;(3)预冷0.1 mm/L的乙酸铵溶液(ammonium acetate solution,AA)中性盐减少蛋白质变性,但可破坏蛋白质的水化膜,暴露出憎水区域,使蛋白质聚集沉淀,憎水区的多少决定沉淀量。沉淀剂均为上清液体积的5倍即:蛋白提取上清液/沉淀剂= 1/5,置于?20 ℃过夜沉淀。
1.2.2 蛋白定量 采用Bradford方法蛋白定量,Bradford定量液:0.05 g CBB G-250,95%乙醇25 mL,50 mL 85%磷酸,超纯水定容至500 mL,滤纸过滤使用。在测定样品浓度前,先制作标准蛋白的标准曲线。样品要置于冰上保持低温,准备牛血清标准蛋白(bull serum albumin,BSA)作为标准样品,裂解液lysis buffer(LB),紫外分光度仪器设定测样品蛋白OD595,测定每个样品至少重复3次。
1.2.3 SDS-PAGE凝胶电泳染色和图像采集 使用不连续胶聚丙烯酰胺凝胶电泳(SDS-PAGE)法根据分子量大小对蛋白质进行分离。分离胶浓度为12.5%,浓缩胶浓度为5%。25 μL蛋白质样品上样体积:20 μL(V样品+VLB)+5 μL蛋白loading buffer,marker:10 μL,蛋白质量约为30 μg,与Laemmli buffer混匀后上样。电泳在16 ℃恒温水浴下进行,电泳程序设定:10 W、40 min,20 W、1.2 h。
凝胶染色:考马斯亮蓝G-250染色液按照标准化配方提前一天配制。漂洗后的凝胶转入染色液中,摇床低速30 r/min染色过夜。
脱色:脱色液标准化配方现用现配。取出染色好的凝胶放入蒸馏水漂洗5 min,转入脱色液中,按照标准化试剂配方中的方法进行脱色过程。
凝胶分析:脱色后的凝胶用ImageScanner Ⅲ扫描仪(GE Healthcare)进行扫描和图像采集扫描凝胶,扫描时保证图片分辨率,并保存。利用ImageMaster 5.0软件分析蛋白电泳图谱条带数。
1.2.4 凝胶胶内蛋白酶解 选取目标差异蛋白,进行胶内酶解,胰蛋白酶液与含有蛋白的凝胶粒混合后,在37 ℃恒温水浴,酶解15 h。酶解后收集酶解上清液直接用于质谱鉴定。
1.2.5 质谱鉴定及蛋白数据库搜索 将上述酶解产物进行质谱鉴定,采用的是布鲁克公司基质辅助激光解析电离飞行时间质谱仪(5800 MALDI- TOF Bruker),进行一级和二级质谱分析。所获得的蛋白数据通过Mascot Distiller软件分析肽的指纹图谱(peptide mass fingerprinting,PMF)得出结果,再利用Matrix Science网站(http://www. matrixscience.com)进行蛋白肽段匹配和数据库搜索鉴定。
2 结果与分析
2.1 橡胶树叶片、胶乳和海马齿叶片的总蛋白提取
酚抽法是植物蛋白提取的常用方法,而BPP法是本实验室在此法的基础上进一步优化改良的一种高效蛋白提取方法,既适于从多糖多酚类及高盐分含量的植物材料的蛋白质提取,还可用于顽拗植物获得较高产量蛋白。利用BPP法可在橡胶树新鲜叶片、新鲜胶乳和海马齿新鲜叶片中提取到3~10 mg/g不等的总蛋白,针对这3种材料,我们设计3种蛋白质沉淀剂,蛋白质提取过程(图1)。
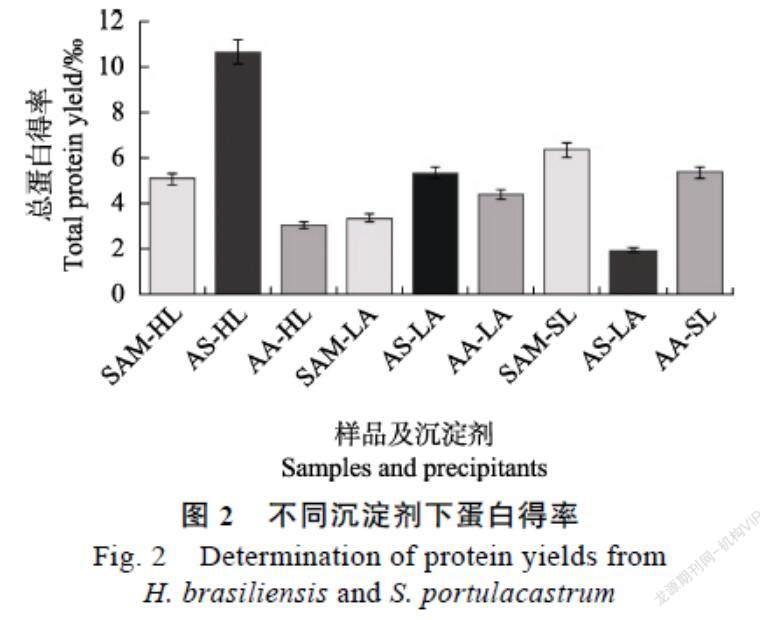
在不同沉淀剂下提取总蛋白得率结果显示,每克材料的蛋白得率偏差比较大,其中HL在不同沉淀剂下的得率大小顺序为:AS-HL(10.64± 0.06 mg/g)> SAM-HL(5.10±0.06 mg/g)>AA-HL(3.09±0.01 mg/g);LA的總蛋白得率在不同沉淀剂下的大小顺序为:AS-LA(5.35±0.02 mg/g)> AA-LA(4.43±0.02 mg/g)>SAM-LA(3.386± 0.08 mg/g);SL总蛋白得率大小顺序为:SAM-SL(6.385±0.06 mg/g)>AA-SL(5.371±0.04 mg/g)> AS-SL(1.959±0.04 mg/g)。比较结果显示,HL总蛋白得率在AS得率最高;LA在AS沉淀时总蛋白得率最高,SL在SAM沉淀剂下蛋白得率最高(图2)。
2.2 聚丙烯酰氨凝胶电泳分析
从SDS-PAGE的结果可以看出,经过除杂后的蛋白条带边界轮廓清晰,凝胶图背景干净,分离效果好,并未出现条带拖尾和弥散不均的现象(图3)。
在高分子量(>100 kDa)区域和较低分子量(<20 kDa)区域均可监测到明显的蛋白条带。应用ImageMaster 5.0软件对1-DE图谱进行蛋白的条带统计分析,不同沉淀剂下的结果检测出不同数目的蛋白条带(表1)。经过统计蛋白条带结果显示,SAM沉淀剂下的平均条带较多(39±1.41), 其次,AS沉淀剂下的平均蛋白条带(36±1.41),蛋白条带最少的是AA的1-DE平均蛋白条带较少(29±2.42)。而且橡胶树叶片和海马齿叶片组织的蛋白条带具有相似的图谱,在条带数和个别条带在丰度上出现一定的差异。
2.3 蛋白胶内酶解及MALDI TOF质谱分析
挖取凝胶上各选取12个重复性好、分离性好、相对丰度较高且是已知具有代表性蛋白进行胶内酶解,其中包括二磷酸核酮糖羧化 (ribulose bisphosphate carboxylase,RubisCO)、小橡胶粒子(small rubber particle protein,SRPP)和橡胶延伸因子(rubber elongation factor,REF),利用本实验室改进后报道的蛋白酶解方法进行胶内酶解,随后进行MALDI TOF 5800质谱仪进行一级质谱和二级质谱鉴定,经鉴定获得了较好的PFF和PMF质谱图谱(图4)。鉴定到的蛋白数据进行数据搜库,由于热带植物海马齿还未发表基因组及转录组数据专有的蛋白数据库,因此将质谱鉴定结果通过Mascot Distiller软件分析,随后用Matrix Science在NCBInr中的(NCBI-National center for biotechnology information non-redundant database)绿色植物蛋白总库,利用在线引擎(http://www.matrixscience.com/ search)进行搜索,经一级和二级质谱鉴定特定标记性蛋白,共鉴定了36个蛋白质,从所得的PMF一级质谱图谱上看,主要肽段质谱离子峰集中范围在800~ 2500 m/s之间,这说明在这个酶切片段更加有利于下一步二级质谱分析。并说明提取蛋白中含杂质少,无其他蛋白污染。这些特定蛋白的总肽段数在10~62左右,最高可达到62条(表2),并且Trypsin的自切峰强度较低,该方法中酶切充分,不易自切。由于热带典型海岸植物海马齿没有发表基因组及对应的蛋白数据库,因此,质谱鉴定结果通过Mascot Distiller分析,鉴定后统计了蛋白理论等电点和分子量,蛋白实验等电点和分子量,匹配肽段的数量,覆盖率和得分等情况。
利用Matrix Science 搜索引擎对鉴定的蛋白及肽段搜库匹配,36个蛋白点相关信息,统计可信蛋白理论等电点和蛋白分子量与实验测定的蛋白等电点和蛋白分子量进行统计比较,结果显示实验测定值和理论值基本一致,有小部分蛋白的实验等电点与分子量和理论值有偏差,例如A4-1,鉴定结果发现蛋白的分子量有偏差,经理论分析这些蛋白可能是某些蛋白的亚基结构,在生物学功能的蛋白组成中,通常都是由多个亚基组合而成,这些蛋白主要参与翻译后修饰无机离子和氨基酸转运代谢,分子伴侣和信号转导等代谢通路的作用产生了蛋白结构变化。通过变性凝胶电泳将蛋白亚基结构分离,因此,鉴定蛋白的实验等电点和分子量会出现一定范围内的偏移现象。根据蛋白搜库结果显示,HL和SL在SAM沉淀劑下肽段匹配数和覆盖率质量高于AA和AS沉淀剂的质量;LA蛋白提取在AA沉淀剂下的蛋白质量优于SAM和AS沉淀剂提取的蛋白质量。
3 讨论
几十年来,已在许多植物物种中进行了大量的蛋白质组学研究,但是植物蛋白质提取的质量高低仍然是影响蛋白质组学研究最重要因素[19]。
聚丙烯凝胶电泳一直是一种最广泛用于分离总蛋白的工具提取物以及从各种途径获得的蛋白质级分预分馏程序[12]。为了获得高质量高纯度的植物蛋白质,我们基于BPP缓冲液结合3种沉淀剂,提取了橡胶树和海马齿等组织的蛋白质,相比较两者的蛋白得率和质量差异较大,但是蛋白质图谱与前期橡胶树和海马齿蛋白图谱非常不同。与前期研究中的凝胶图谱相比[22-24],我们的凝胶图谱更清晰,并且包含更多的蛋白条带。在鉴定代表性蛋白质中,相同蛋白质包含不同的蛋白质同工型,在凝胶图谱上也具有不同的实验Mr和pI值,分析原因可能是由于修饰蛋白质变形后所致。
在过去的植物蛋白提取方法的研究中,针对提取缓冲液的改进优化研究较多,例如在植物叶片[13, 15-17, 20, 25-26]、种子[18, 21, 27]、根[28]以及花器官[12, 19]等,但是着眼于研究植物蛋白提取过程中沉淀剂的选择方面涉及内容较少。我们比较3种沉淀剂的蛋白得率和质谱鉴定结果发现,HL和SL在SAM沉淀剂提取蛋白质量优于其他2种沉淀剂;LA的蛋白提取在AA的蛋白质量优于其它两个沉淀剂提取的蛋白质质量。而通过硫酸铵和醋酸铵比例的优化,可以限制蛋白变性并能提高蛋白质提取的质量[22],这一结果与前人研究结果保持一致,但该方法并未在高盐生植物蛋白提取中应用。聚丙烯酰胺凝胶电泳可比较3种沉淀剂提取蛋白质的质量[29-30],虽然3种沉淀剂的蛋白质图谱在较高和较低的Mr区域均可观察到了明显的蛋白条带,且大部分相似,但是标记性蛋白条带的清晰度和灰度有明显的差异。李肖芳等[31]利用3种方法对盐生植物盐角草的蛋白提取,其中丙酮沉淀和三氯乙酸沉淀提取的蛋白杂质较多,在蛋白凝胶图中有严重拖尾或横向纹理现象。而本研究的凝胶图谱结果可见更清晰的蛋白条带,说明选取合适的蛋白沉淀剂可以获得更高纯度的蛋白质。从总体上看,BPP方法可以收集到低浓度的蛋白质,并且获得的蛋白质可以成功用于蛋白质组学分析。本研究结果也说明,BPP方法结合不同沉淀剂可获得更多多糖多酚植物和高盐盐生植物高质量的蛋白质,保证能够提取低浓度溶液中的蛋白质。迄今为止,这3种沉淀剂之间蛋白得率及提取蛋白质量进行比较研究还尚未报道,本研究是首次提出BPP方法结合不同沉淀剂进行蛋白提取分析的研究。
綜上所述,BPP方法结合3种沉淀剂的使用,具有被广泛应用的潜力,还可用于低蛋白浓度溶液的植物蛋白质组学分析。学者可根据研究材料选择最适沉淀剂提取蛋白,这对于不同植物提取高纯度和高质量的蛋白质极其重要,也为植物蛋白组学获取高质量蛋白提供一定的理论基础。
参考文献
[1] Thiellement H, Bahrman N, Damerval C, et al. Proteomics for genetic and physiological studies in plants[J]. Electrophoresis, 1999, 20: 2013-2026.
[2] Wang X. Protein and proteome atlas for plants under stresses: New highlights and ways for integrated omics in post-geno?m?ics era[J]. International Journal of Molecule Sciences, 2019, 20(20): 5222.
[3] Parkhey S, Chandrakar V, Naithani S C, et al. Efficient extraction of proteins from recalcitrant plant tissue for subsequent analysis by two-dimensional gel electrophoresis[J]. Journal of Separation Science, 2015, 38: 3622-3628.
[4] Gallardo K, Job C, Groot S P, et al. Proteomic analysis of Arabidopsis seed germination and priming[J]. Plant Physiology, 2001, 126: 835-848.
[5] Hoa le T P, Nomura M, Kajiwara H, et al. Proteomic analysis on symbiotic differentiation of mitochondria in soybean nodules[J]. Plant Cell Physiology, 2020, 45: 300-308.
[6] Rabilloud T. How to use 2D gel electrophoresis in plant proteomics[J]. Methods Molecule Biology, 2014, 1072: 43-50.
[7] Yang H, Liu N, Liu S. Determination of peptide and protein disulfide linkages by MALDI mass spectrometry[J]. Topics in Current Chemistry, 2013, 331: 79-116.
[8] Nahnsen S, Bielow C, Reinert K, et al. Tools for label-free peptide quantification[J]. Molecular and Cellular Proteomics, 2013, 12: 549-556.
[9] Merrill A E, Coon J J. Quantifying proteomes and their post-translational modifications by stable isotope label-based mass spectrometry[J]. Current Opinion in Chemical Biology, 2013, 17: 779-786.
[10] Righetti P G, Boschetti E. Low-abundance plant protein enrichment with peptide libraries to enlarge proteome coverage and related applications[J]. Plant Science, 2020, 290: 110302.
[11] Potin F, Lubbers S, Husson F, et al. Hemp (Cannabis sativa L.) protein extraction conditions affect extraction yield and protein quality[J]. Journal of Food Science, 2019, 84(12): 3682-3690.
[12] Wang W, Tai F, Chen S. Optimizing protein extraction from plant tissues for enhanced proteomics analysis[J]. Journal of Separation Science, 2008, 31(11): 2032-2039.
[13] Chapman B, Castellana N, Apffel A, et al. Plant proteogenomics: from protein extraction to improved gene predictions[J]. Methods in Molecular Biology, 2013, 1002: 267-294.
[14] Rode C, Winkelmann T, Braun H P, et al. DIGE analysis of plant tissue proteomes using a phenolic protein extraction method[J]. Methods in Molecular Biology, 2012, 854: 335-342.
[15] Wang W, Vignani R, Scali M, et al. A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J]. Electrophoresis, 2006, 27(13): 2782-2786.
[16] Plomion C, Lalanne C. Protein extraction from woody plants[J]. Methods in Molecular Biology, 2007, 355: 37-41.
[17] V?lcu C M, Schlink K. Efficient extraction of proteins from woody plant samples for two-dimensional electrophoresis[J]. Proteomics, 2006, 6(14): 4166-4175.
[18] Branlard G, Bancel E. Protein extraction from cereal seeds[J]. Methods in Molecular Biology, 2007, 355:15-25.
[19] Wu X, Gong F, Wang W. Protein extraction from plant tissues for 2DE and its application in proteomic analysis[J]. Proteomics, 2014, 14(6): 645-658.
[20] Conlon H E, Salter M G. Plant protein extraction[J]. Methods in Molecular Biology, 2007, 362: 379-383.
[21] Flengsrud R. Protein extraction from green plant tissue[J]. Methods in Molecular Biology, 2008, 425: 149-152.
[22] Wang X C, Shi M J, Lu X L, et al. A method for protein extraction from different subcellular fractions of laticifer latex in Hevea brasiliensis compatible with 2-DE and MS[J]. Proteome Science, 2010, 8(1): 35.
[23] Wang D Y, Wang H Y, Han B, et al. Sodium instead of potassium and chloride is an important macronutrient to improve leaf succulence and shoot development for halophyte Sesuvium portulacastrum[J]. Plant Physiology and Biochemistry, 2012, 51(1): 53-62.
[24] Yi X, Sun Y, Yang Q, et al. Quantitative proteomics of Sesuvium portulacastrum leaves revealed that ion transportation by V-ATPase and sugar accumulation in chloroplast played crucial roles in halophyte salt tolerance[J]. Journal of Proteomics, 2014, 99: 84-100.
[25] Wang W, Scali M, Vignani R, et al. Protein extraction for two-dimensional electrophoresis from olive leaf, a plant tissue containing high levels of interfering compounds[J]. Electrophoresis, 2003, 24(14): 2369-2375.
[26] Jin X, Zhu L, Tao C, et al. An improved protein extraction method applied to cotton leaves is compatible with 2-DE and LC-MS[J]. BMC Genomics, 2019, 20(1): 285.
[27] Delgado E, Valverde-Quiroz L, Lopez D, et al. Characterization of soluble glandless cottonseed meal proteins based on electrophoresis, functional properties, and microscopic structure[J]. Journal of Food Science, 2019, 84(10): 2820-2830.
[28] Akyüz A, Ersus S. Optimization of enzyme assisted extraction of protein from the sugar beet (Beta vulgaris L.) leaves for alternative plant protein concentrate production[J]. Food Chemistry, 2021, 335: 127673.
[29] Wang X C, Chang L L, Wang B C, et al. Comparative proteomics of Thellungiella halophila leaves from plants subjected to salinity reveals the importance of chloroplastic starch and soluble sugars in halophyte salt tolerance[J]. Molecular and Cellular Proteomics, 2013, 12: 2174-2195.
[30] Aiello D, Siciliano C, Mazzotti F, et al. Protein extraction, enrichment and MALDI MS and MS/MS analysis from bitter orange leaves (Citrus aurantium)[J]. Molecules, 2020, 25(7): 1485.
[31] 李肖芳, 韓和平, 王旭初, 等. 适用于盐生植物的双向电泳样品制备方法[J]. 生态学报, 2006, 26(6): 1848-1853.
责任编辑:崔丽虹

