链霉菌和壳聚糖对淮山土壤微生物活性与群落的影响
陆建明,黄小龙,吴文嫱,许云,夏薇,张荣萍

摘 要:为探究链霉菌30702和壳聚糖对淮山土壤微生物活性与群落的影响,采用比色法和滴定法观测土壤酶活性的变化,采用高通量测序技术和Trimmomatic等软件,分析土壤微生物群落中细菌和真菌的发展变化。结果表明,链霉菌、壳聚糖、土壤原始微生物和培养时间等4个因素对淮山土壤的脲酶和过氧化氢酶活性均有显著影响,壳聚糖浓度在0~10.0 g/kg内,土壤酶活性随壳聚糖浓度的增大而提高;随时间的延长,先升再降;壳聚糖与链霉菌之间存在交互效应。链霉菌和壳聚糖能增加淮山土壤细菌的物种丰度,减少细菌的多样性,增加艾德昂菌属(Ideonella)和纤维弧菌(Cellvibrio)等有益菌属的相对丰度,而对真菌的物种丰度和多样性的影响较小,与对照之间的差异不显著,土壤优势菌属为腐质霉属(Humicola)、枝孢属(Cladosporium)、鞘氨醇单胞菌属(Sphingomonas)和uncultured_bacterium_ c_Subgroup_6。其中,链霉菌与2.5 g/kg壳聚糖复合处理的细菌物种丰度最大,細菌多样性最少。
关键词:链霉菌;壳聚糖;淮山;土壤微生物活性;微生物群落;交互效应
中图分类号:S156 文献标识码:A
Effect of Streptomyces and Chitosan on the Soil Microbial Activities and Microbiome in Dioscorea oppositifolia L.
LU Jianming, HUANG Xiaolong, WU Wenqiang, XU Yun, XIA Wei, ZHANG Rongping*
Hainan University, Haikou, Hainan 570228, China
Abstract: In order to explore the effect of Streptomyces 30702 and chitosan on the soil microbial activity and microbiome in Dioscorea oppositifolia L., the soil enzyme activity development was measured by colorimetric and titration methods, the change of the bacteria and fungi in soil microbiome was detected using the high-throughput sequencing technology and softwares such as Trimmomatic. The results showed that Streptomyces, chitosan, soil original microorganisms and culture time all affected the activity of urease and catalase in the soil significantly. The soil enzyme activity increased as chitosan concentration rose from 0 to 10.0 g/kg. As growing time went on, the soil enzyme activity increased first and then decreased obviously. Chitosan and Streptomyces interacted obviously. Streptomyces and chitosan increased the species abundance of soil bacteria and reduced the diversity of bacteria, increased the relative abundance of beneficial bacteria such as Ideonella and Cellvibrio, but had little effect on the species abundance and diversity of fungi and there was no significant difference between them and CK, the dominant bacteria genera in the soil were Humicola, Cladosporium, Sphingomonas and uncultured_bacterium_c_subgroup_6. Among them, the species abundance of bacteria in the Streptomyces 30702 2.5 g/kg treatment combined with chitosan was the largest, and the diversity of bacteria in the treatment was the least.
Keywords: Streptomyces sp.; chitosan; Dioscorea oppositifolia L.; soil microbial activity; soil microbiome; interaction effect
DOI: 10.3969/j.issn.1000-2561.2021.10.038
淮山(Dioscorea oppositifolia L.),又名薯蓣,为薯蓣科薯蓣属作物,单子叶缠绕性藤本植物[1],多产于河南、山西、广东、海南等地。淮山块茎富含淀粉和各种营养成分以及Fe、Mn、Zn、Cu等丰富的微量元素及18种氨基酸,具有较高的食用和药用价值[2]。近年来随着各地政府的大力支持,我国淮山栽培面积越来越大,但淮山是忌连作作物,连作后产量下降、品质降低、病虫害加重[3],连作第2年,一般减产20%~30%,重者甚至枯死[4],制约了淮山产业的健康持续发展。研究表明,大豆和双孢蘑菇的连作促使土壤微生物区系从高肥的“细菌型”土壤向低肥的“真菌型”土壤转化,且土壤微生物总数减少[5-6],重茬根际土壤真菌的优势种群对作物根系的生长发育和养分吸收起不良作用,这是重茬作物生长发育障碍的重要原因。
鏈霉菌属(Streptomyces)是产生抗生素最多的放线菌菌属,链霉菌30702为课题组从药用植物海南粗榧(Cephalotaxus hainanensis)根际分离得到[7],属于紫黑链霉菌(Streptomyces viol-aceusniger)。该分枝的放线菌普遍可产生丰富的活性物质,已大量应用于农用抗生素等方面。王玉[8]研究发现,在增加菌剂的番茄结果后期,土壤真菌较对照减少,而细菌数量增多,与连作0 a土壤微生物结构相似;马云艳等[9]研究发现生防放线菌改变了土壤中优势微生物的数量和比例,但是在实验室有明显抑菌作用的生防菌盆栽和田间处理时,受生防菌本身、病原菌和环境因子(如土壤中营养源、温度、渗透性、pH)等影响较大,从而导致生防菌在土壤中的定殖能力和防病效果不稳定[10]。经试验证明,链霉菌30702不仅产生抗真菌作用的抗生素,还产生抑制病菌生长发育的蛋白酶、几丁质酶、纤维素酶和β-葡聚糖苷酶等水解酶[11],在防治山药炭疽病方面也表现出良好的效果,有广谱的抗菌效果[12-13],为本研究抑制土传病害、改善土壤微生物群落结构奠定了基础。
壳聚糖(chitosan, CTS)是一种高分子量的阳性多糖,为线性β-(1→4)-N-乙酰-D-葡萄糖胺聚合物[14],是由几丁质脱乙酰所得。在农业中,壳聚糖可增加土壤中有益的微生物放线菌[15],减少镰刀菌、立枯丝核菌等病原菌,并可抑制根结线虫,增加作物产量,提高品质等[16],减少蔬菜土传病害的发生[17]。而壳聚糖和微生物制剂对淮山土壤的调节研究较少报道,本试验采用光照培养箱的离体栽培方式,研究壳聚糖与链霉菌30702不同施用量处理下,淮山土壤微生物活性和微生物群落结构的发展变化,为壳聚糖与链霉菌30702对淮山病害及其土壤的调控作用与机理研究奠定基础。
1 材料与方法
1.1 材料
供试土壤为海南大学基地连作淮山5 a以上土壤(砖红壤土,pH 5.38,有机质3.4%,全氮0.12%),采用五点取样法,采集距表层7~10 cm的连作淮山土壤,粉碎过10目(2 mm)筛,风干,将150 g连作土装入500 mL锥形瓶中,共30瓶,采用蒸汽蒸压法,在121 ℃下连续3 d分3次对风干土壤进行蒸压,获得无菌土壤,待用。
壳聚糖(CTS,沪试,脱乙酰度80.0%~95.0%)、链霉菌30702(LM,薯蓣课题组提供)、ISP2培养基(酵母浸粉4 g、麦芽糖10 g、葡萄糖4 g、琼脂20 g、蒸馏水1 L、pH 7.3)。将菌株30702接种在ISP2培养基中,28 ℃培养箱中培养14 d。将培养好的菌株接种于装有150 mL无菌水的锥形瓶(500 mL)中,采用平板稀释计数法制备浓度为4.2×106 CFU/mL的紫黑链霉菌30702菌悬液,待用。
1.2 试验设计
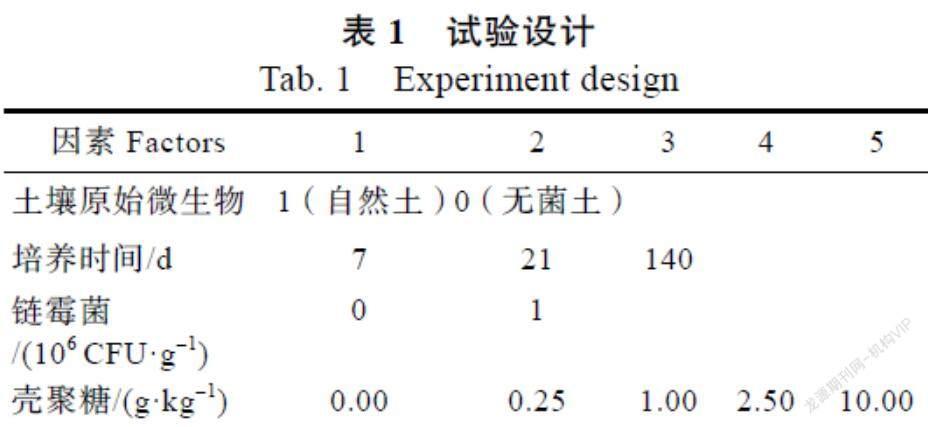
试验土壤分成灭菌和不灭菌2组,壳聚糖浓度设为0、0.25、1.00、2.50、10.00 g/kg(干土)5个梯度,链霉菌浓度设0和1.0×106 CFU/g(干土)2个梯度,以清水处理为对照(CK),完全设计共20个处理,每个处理3个重复共60瓶(表1)。采用称重法控制土壤含水量为20%,处理后置于智能光照培养箱中于30 ℃下16 h和20 ℃下8 h孵育[18]。
1.3 土壤微生物群落结构的测定
于处理后的第21天,取自然土试验组中清水(CK)、链霉菌30702(LM)和链霉菌与不同浓度壳聚糖复合处理(LM+CTS 0.25简称F1,LM+CTS 1简称F2,LM+CTS 2.5简称F3,LM+CTS 10简称F4)的15~20 g新鲜土样,进行高通量测序。高通量测序由北京百迈客生物科技有限公司代为完成。
1.3.1 土壤总DNA提取 使用MN NucleoSpin 96 Soil试剂盒/PowerSoil DNA Isolation kit强力土壤DNA提取试剂盒。
1.3.2 PCR扩增 采用AB9902 96 well PCR仪,对真菌ITS1区进行PCR扩增,引物为ITS1F(5-CTTGGTCATTTAGAGGAAGTAA-3)和ITS1R(5-GCTGCGTTCTTCATCGATGC-3);对细菌16S rRNA V3-V4区进行PCR扩增,引物序列采用341F(5-ACTCCTACGGGAGG?CA?GCA- 3)和806R(5-GGACTACHVGGGTWTCTAAT- 3)。PCR反应体系:基因组DNA 50 ng ± 20%,*Vn F(10 μmol/L)0.3 μL,*Vn R(10 μmol/L)0.3 μL,KOD FX Neo Buffer 5 μL,dNTP(2 mmol/L each)2 μL,KOD FX Neo 0.2 μL,用ddH2O补至10 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s;50 ℃ 30 s;72 ℃ 40 s;72 ℃ 7 min,20个循环;72 ℃最后延伸5 min。Soleax PCR反应体系:目的区域PCR纯化产物2 μL,浓度为2 μmol/L的★MPPI-a 2.5 μL,浓度为2 μmol/L的★MPPI-b 2.5 μL,2×Q5 HF MM 10 μL(★根据上机安排进行选择index)。Soleax PCR反应条件:98 ℃ 30 s;98 ℃ 10 s;65 ℃ 30 s;72 ℃ 30 s,20个循环;72 ℃最后延伸5 min,1.8%的琼脂糖凝胶,电压120 V,40 min。
1.3.3 PCR产物的混样和纯化 将Soleax PCR产物根据电泳定量(ImageJ软件)结果,按照质量比1∶1进行混样。混样后,采用OMEGA DNA纯化柱进行过柱纯化。电泳后,切目的片段,并回收。
1.3.4 上机测序 土壤DNA提取、PCR扩增及测序均由北京百迈客生物科技有限公司协助完成。
1.4 土壤酶活性的测定
于处理后的第7天、21天和140天取30 g土,风干,进行土壤脲酶、过氧化物酶活性测定。脲酶使用比色法,过氧化氢酶使用高锰酸钾滴定法进行测定[19]。
1.5 数据处理
采用Trimmomatic软件对原始测序序列进行过滤、使用FLASH进行双端拼接,得到优化序列(Tags);将优化序列进行聚类,利用CD-HIT方法划分OTU,并根据OTU的序列组成得到其物种分类;细菌和真菌分别运用Silva和UNITE数据库进行比对,对样品在各个分类水平上进行分类学分析,获得各样品在门、纲、目、科、属、种分类学水平上的物种聚类热图;运用QIIME软件分析单个样品内部的物种多样性,统计各样品在97%相似度水平下的Ace指数、Chao1指数、Shannon指数及Simpson指数;通过Beta多样性分析比较不同样品在物种多样性方面(群落组成及结构)存在的差异。运用R软件基于Uni Frac距离算法获得相应距离下的PCoA图(有分组信息);通过16S功能基因预测分析,对样品进行基因功能预测并计算功能基因丰度,高通量数据分析由北京百迈客生物科技有限公司协助完成。不同处理土壤酶活性使用SAS 9.4统计软件进行多因素方差分析,采用邓肯氏新复极差法进行显著性检验。
2 结果与分析
2.1 链霉菌与壳聚糖对淮山土壤酶活性的影响
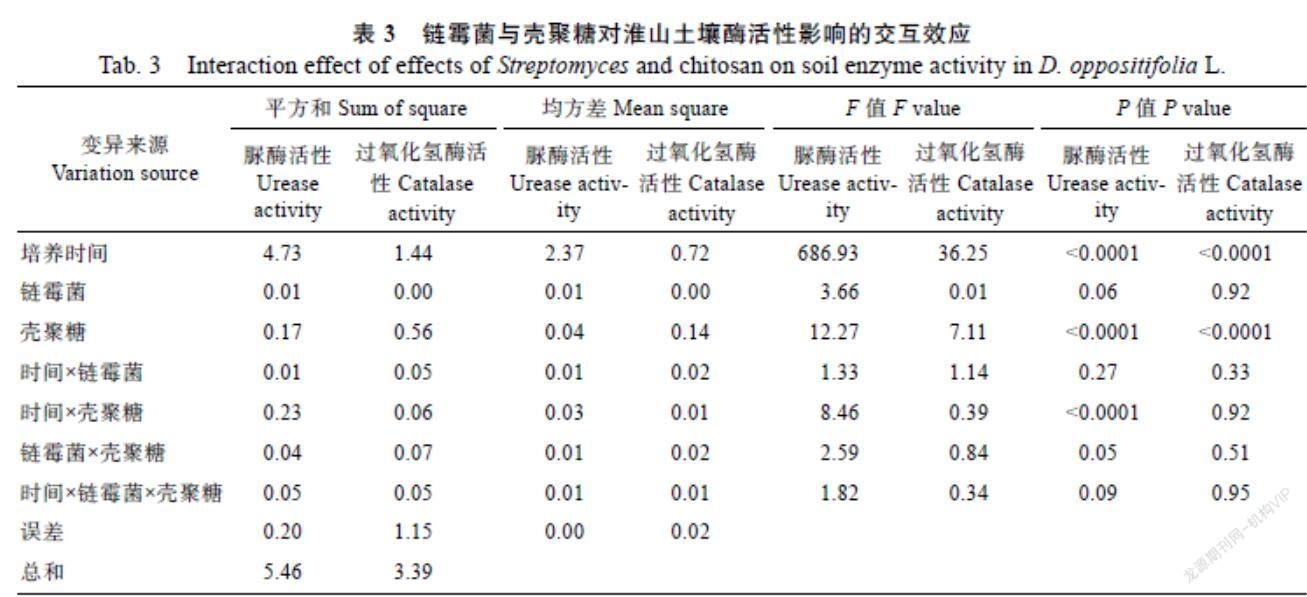
由表2、表3可以看出,土壤微生物、壳聚糖、链霉菌和培养时间均对土壤脲酶及过氧化氢酶活性有较大影响。其中,土壤微生物和培养时间对土壤酶活性的影响最大,淮山土壤中原始微生物和培养第21天时土壤酶活性最高,不同水平之间的差异极显著;脲酶及过氧化氢酶活性均随壳聚糖浓度的增大而升高;链霉菌对土壤脲酶活性有极显著影响,而对过氧化氢酶活性的影响差异不显著;壳聚糖与链霉菌之间有正交互效应,说明这2个因素之间存在互相促进的关系,复合处理可增强生物酶活性的提升效果。
2.2 壳聚糖与链霉菌对淮山土壤微生物群落的影响
2.2.1 基于土壤ITS高通量测序的真菌多样性分析 Alpha多样性反映的是单个样品物种丰度及
物种多样性,有多种衡量指标:Chao1指数、Ace指数、Shannon指数、Simpson指数。Chao1指数和Ace指数可以衡量物种丰度即物种数量的多少,Shannon指数和Simpson指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响。相同物种丰度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性,Shannon指数越大,Simpson指数越小,说明样品的物种多样性越高。由表4可知,链霉菌和壳聚糖对淮山土壤真菌的物种丰度和多样性均无影响,与CK之间的差异均不显著。
根据物种注释结果,选取每组样本在属上最大丰度排名前10的物种,生成物种相对丰度柱形图(图1)。链霉菌和壳聚糖对土壤真菌的种类及其相对丰度均有一定影响。CK处理中,腐质霉属(Humicola)相对丰度较大,达21.55%,枝孢属(Cladosporium)占11.4%,镰刀菌属(Fusarium)占2.48%,头束霉属(Cephalotrichum)占8.72%;链霉菌处理后与清水处理相比,腐质霉属下降了6.48%,而枝孢属相对丰度上升了2.11%,头束霉属下降明显,占1.3%,而曲霉菌属(Aspergillus)有所增加;链霉菌与壳聚糖复合处理后,与链霉菌处理相比,枝孢属相对丰度下降了4.46%~ 6.01%,镰刀菌属相对丰度上升0.94%~6.99%,均随着壳聚糖浓度的增加而减少,而腐质霉属相对丰度随壳聚糖浓度的增加而先增加后减少,其中链霉菌+1.00 g/kg壳聚糖处理中的腐质霉属相对丰度最高,链霉菌+0.25 g/kg壳聚糖处理的链格孢属(Alternaria)最多,达8.55%。初步说明,链霉菌和壳聚糖处理改变了土壤真菌群落结构,但优势菌属仍为腐质霉属(Humicola)、枝孢属(Cladosporium)、Tausonia等。
CK为清水,LM为链霉菌菌悬液,F1为链霉菌+0.25 g/kg壳聚糖,F2为链霉菌+1.00 g/kg壳聚糖,F3为链霉菌+2.50 g/kg壳聚糖,F4為链霉菌+10.00 g/kg壳聚糖。
网络图是相关性分析的一种表现形式,可以直观地体现各个分类水平(门、纲、目、科、属、种)的物种在所选择样品之间含有的相关性关系。根据属分类水平各个物种在各个样品中的丰度以及变化情况进行相关分析,计算物种间的相关性,并进行统计检验,基于Python绘制共表达分析网络图(图2)。根据图2可得,枝孢属与被孢霉属(Mortierella)正相关且相关性最强,Occultifur与角菌属(Angulomyces)、Pyrenochaetopsis与梭孢壳属(Thielavia)、轮枝孢属(Verticillium)与Vishniacozyma正相关且相关性较强;嗜热真菌属(Thermomyces)与淡紫紫孢菌(Purpureocillium)负相关且相关性最强,元胞菌(Metacordyceps)与Cladorrhhinum、佐菲拉菌属(Zopfiella)与丝孢菌属(Scedosporium)、黑团孢属(Periconia)与茎点霉属(Phoma)负相关且相关性较强。其中,腐质霉属丰度最高,其次为枝孢属、Tausonia、头束霉属。
2.2.2 基于土壤16S高通量测序的细菌多样性分析 根据Alpha多样性分析结果(表5)可得,链霉菌和壳聚糖处理后,土壤中的细菌物种丰度大于清水处理,以F3处理最高。清水处理的土壤细菌多样性大于链霉菌和壳聚糖处理,即链霉菌和壳聚糖处理使土壤细菌的物种多样性减少,F1、F2、F3和F4均显著少于CK和LM处理,而LM与CK之间差异不显著。结果表明,链霉菌对土壤细菌的物种丰度和多样性的影响不大,链霉菌与壳聚糖复合处理,可增加土壤细菌的物种丰度,而减少细菌的多样性。
图3为各处理以属为分类级别的相对丰度图,由图3可以看出,链霉菌和壳聚糖对土壤的细菌及其相对丰度有一定影响。CK清水处理中,uncultured_bacterium_c_Subgroup_6相对丰度较高,达10.44%,鞘氨醇单胞菌属(Sphingomonas)占8.72%;LM处理与CK相比,Jatropha_curcas相对丰度较清水处理有上升,占1.27%,其他与CK处理相似;链霉菌与壳聚糖复合处理后,uncultured_bacterium_c_Subgroup_6和鞘氨醇单胞菌属(Sphingomonas)相对丰度分别下降1.46%~ 4.26%和2.36%~4.23%;艾德昂菌属(Ideonella)的相对丰度整体上升3.55%~24.14%,随着壳聚糖浓度的增加,先升高后下降,其中,F3最高,占24.49%;纤维弧菌属(Cellvibrio)的相对丰度升高,其中,F2最高,占19.4%。Jatropha_curcas相对丰度在F1处理中最高,占15.68%。
由图4可知,JGI_00010001-H03与别生根瘤菌-新生根瘤菌-寄生根瘤菌-根瘤菌(Allorhiz?ob-ium-Neorhizobium-Pararhizobium-Rhizobium)正相关且相关性最强,uncultured_bac?te?rium_c_ Alphaproteobacteria与Pelomonas和Ellin6067、uncultured_bacterium_o_Elsterales与嗜红杆菌(Altererythrobacter)、uncultured_bacterium_o_ IMCC26256与uncultured_bacterium_o_Rokuba-cteriales正相关且相关性较强;Gaiella与链霉菌属(Streptomyces)负相关且相关性最强,Jatropha_curcas与uncultured_bacterium_o_Rok-uba?cteriales、uncultured_bacterium_c_Alph?aprot?eo-bacteria与uncultured_bacterium_c_Acidim?icro?biia、滋养层杆菌(Stenotrophobacter)与诺卡氏菌属(Nocardioides)、硝化螺菌属(Nitrospira)与uncultured_bacterium_o_Saccharimonadales负相关且相关性较强。其中,艾德昂菌属(Ideonella)丰度最高,其次为纤维弧菌属(Cellvibrio)、鞘氨醇单胞菌属(Sphingomonas)和Jatropha_curcas。
3 讨论
本研究结果表明,链霉菌、壳聚糖、土壤原始微生物和培养时间等4个因素对淮山土壤的脲酶和过氧化氢酶活性均有显著影响,壳聚糖浓度在0~10.0 g/kg范围内,土壤酶活性随壳聚糖浓度的增大而提高;随培养时间的延长,土壤酶活性先升再降;壳聚糖与链霉菌之间存在交互效应。链霉菌和壳聚糖处理增加淮山土壤细菌的物种丰度,而减少细菌的多样性,增加了艾德昂菌属(Ideonella)和纤维弧菌(Cellvibrio)等有益菌属的相对丰度,而对真菌的物种丰度和多样性的影响较小,土壤优势菌属为腐质霉属(Humicola)、枝孢属(Cladosporium)、鞘氨醇单胞菌属(Sphingomonas)和uncultured_bacte?rium_c_Su-bgroup_6。其中,链霉菌与2.5 g/kg壳聚糖复合处理的细菌物种丰度最大,细菌的多样性最少。
土壤酶是重要的土壤微生态环境指示因子,土壤脲酶可以水解土壤中尿素生成氨、二氧化碳和水[20],能部分反映土壤的生产力,土壤过氧化氢酶可以反映有机质的转化速度和土壤腐殖质化的强度大小[21]。尹淑丽[22]研究发现,单一生防菌株对土壤脲酶及过氧化氢酶活性有促进作用,与本研究结果一致。王艳芳等[23]使用1.0 g/kg甲壳素提高了土壤脲酶及过氧化氢酶活性,分别提高了40.5%和18.7%,与本研究结果相似。
抑制植物土传病害在一定程度上是土壤微生物的群体作用,土壤微生物群落结构越丰富,物种越均匀,抑制病原菌的综合能力增强[24]。研究表明,土壤微生物多样性与土壤肥力、土传病害密切相关[25]。在设施蔬菜种植过程中,土壤微生物群落结构与土壤质量同步变化,进而反映土壤质量受损程度[26],可以作为土壤质量变化的重要预警指标之一[27]。Tripathi等[28]研究表明,在脅迫条件下,腐质霉属(Humicola)对植物生长有促进作用。枝孢属(Cladosporium)是一种可用于抗植物源的真菌,对由种子传播的病原引起的水稻病害有较高的防效,可作为生防菌剂、酶和生物活性肽的潜在来源已被广泛研究[29]。鞘氨醇单胞菌属(Sphingomonas)能增强拟南芥的抗旱性,通过释放挥发性有机化合物促进植物生长[30]。枝孢属(Cladosporium)与被孢霉属(Mortierella)正相关且相关性最强,枝孢属可引起牡丹叶斑病[31],同时也是番茄叶霉的病原菌。本研究发现,链霉菌和壳聚糖处理后,淮山土壤中腐质霉属(Humicola)、枝孢属(Cladosporium)、鞘氨醇单胞菌属(Sphingomonas)和uncult?ured_bac?-terium_c_Subgroup_6均为优势菌属,这些真菌或细菌可能在淮山根际土壤中发挥重要的作用。
本研究表明,链霉菌30702与壳聚糖复合处理与清水处理对比,土壤中镰刀菌属(Fusarium)和艾德昂菌属(Ideonella)、纤维弧菌(Cellvibrio)相对丰度均有不同程度的增加。艾德昂菌属中的一种细菌使用聚对苯二甲酸乙二醇酯(PET)作为能量源,能够在30 ℃温度条件下经过6周完全降解PET薄膜[32];革兰氏阴性腐生植物纤维弧菌对纤维素、木聚糖和果胶底物具有显著降解能力,纤维弧菌作为纤维素降解细菌,具有强降解多糖的能力[33-34],也是广东博罗普通野生水稻主要内生固氮菌属之一[35],因此纤维弧菌丰度的增高有助于更有效地分解有机物,使作物更有效地利用物质和能量。推测链霉菌30702与壳聚糖的交互作用可通过丰富土壤微生物多样性实现抑制病原菌的作用。
本研究发现,链霉菌和壳聚糖处理后,淮山土壤的细菌物种丰度增加,多样性减少,真菌物种丰度和多样性影响较小,土壤微生物区系从低肥的“真菌型”土壤向高肥的“细菌型”土壤转化。Phillips等[36]的研究结果表明,施用微生物菌剂后,增加了土壤微生物的多样性。马海滨等[37]、陈红丽等[38]研究得出,壳聚糖可以丰富连作烟草土壤的微生物多样性,与本研究结果相似。
4 结论
研究表明,链霉菌30702和壳聚糖能促进淮山土壤酶活性,增加土壤细菌的物种丰度,降低细菌的多样性,对真菌的物种丰度和多样性影响小,土壤优势菌属为腐质霉属(Humicola)、枝孢属(Cladosporium)、鞘氨醇单胞菌属(Sphi?ngo-monas)和uncultured_bac?terium_c_Sub?g?roup_6,增加了艾德昂菌属(Ideonella)和纤维弧菌(Cellvibrio)等有益菌属的相对丰度。本研究结果为链霉菌和壳聚糖防治淮山病害和调节土壤的研究奠定了理论基础。
参考文献
[1] 汤 洁, 戴兴临, 涂玉琴, 等. 淮山药高效栽培技术研究[J]. 安徽农业科学, 2017, 45(4): 122-127.
[2] 李月仙, 黄东益, 黄小龙, 等. 山药的研究进展[J]. 中国农学通报, 2009, 25(9): 91-96.
[3] 岑家兰, 王雪芳, 黎祖文, 等. 广西八步区淮山生产连作障碍的影响及解决措施[J]. 长江蔬菜, 2016(7): 3-4.
[4] 陈伟益, 黄东益, 吴文嫱, 等. 壳聚糖及其衍生物对连作淮山炭疽病的影响[J]. 海南大学学报(自然科学版), 2020, 38(2): 141-146.
[5] 邹 莉, 袁晓颖, 李 玲, 等. 连作对大豆根部土壤微生物的影响研究[J]. 微生物学杂志, 2005(2): 27-30.
[6] 黄 敏. 大田双孢蘑菇连作障碍的土壤微生物学特性研究[D]. 雅安: 四川农业大学, 2006.
[7] 黄小龙, 陈吉良, 李建平, 等. 热带药用植物根际放线菌的分离、鉴定及生物活性分析[J]. 生物技术通报, 2012(2): 121-127.
[8] 王 玉. 放线菌剂对连作番茄生理生态及土壤微环境的影响[D]. 杨凌: 西北农林科技大学, 2012.
[9] 马云艳, 徐万里, 唐光木, 等. 生防链霉菌配施棉秆炭对连作棉田土壤微生物区系的影响[J]. 中国生态农业学报, 2017, 25(3): 400-409.
[10] 张炳欣, 张 平, 陈晓斌. 影响引入微生物根部定殖的因素[J]. 应用生态学报, 2000(6): 951-953.
[11] 丛子文, 焦敬华, 周双清, 等. 链霉菌30702的鉴定及其生防特性[J]. 生物技术通报, 2018, 34(6): 190-198.
[12] 焦敬华. 山药炭疽病生防菌30702的生防特性及分类鉴定[D]. 海口: 海南大学, 2016.
[13] 焦敬华, 黄东益, 吴文嫱, 等. 山药炭疽病菌拮抗放线菌30702菌株的初步鉴定及发酵培养基优化[J]. 热带作物学报, 2016, 37(4): 775-783.
[14] Chien P J, Chou C C. Antifungal activity of chitosan and its application to control post-harvest quality and fungal rotting of Tankan citrus fruit (Citrus tankan Hayata)[J]. Journal of the Science of Food and Agriculture, 2006, 86: 1964-1969.
[15] 刘清玮, 宋宇鹏. 有机肥对三年生农田栽培人参根际微生态及产量的影响[J]. 吉林农业大学学报, 2020, 42(4): 409-414.
[16] Bol J F, Linthorst H, Cornelissen B. Plant pathogenesis-related proteins induced by virus infection[J]. Annual Review of Phytopathology, 1990, 28(1): 113-138.
[17] 李宝英. 壳聚糖制剂控制蔬菜土传病害的研究[J]. 中国农学通报, 2005(1): 275-277.
[18] Yuan W M, Crawford D L. Characterization of streptomyces lydicus WYEC108 as a potential biocontrol agent against fungal root and seed rots[J]. Applied and Environmental Microbiology, 1995, 61(8): 3119-3128.
[19] 關松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
[20] 刘宇彤, 霍璐阳, 李志国, 等. 不同处理方式对土壤酶活性的影响[J]. 森林工程, 2019, 35(2): 21-26.
[21] 曾宪军, 刘登魁, 朱世民, 等. 不同浓度阿特拉津对三种肥力条件土壤过氧化氢酶的影响[J]. 湖南农业科学, 2005(6): 33-35.
[22] 尹淑丽, 麻耀华, 张丽萍, 等. 不同生防菌对黄瓜根际土壤微生物数量及土壤酶活性的影响[J]. 北方园艺, 2012(1): 10-14.
[23] 王艳芳, 付风云, 李家家, 等. 甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响[J]. 生态学报, 2016, 36(19): 6218-6225.
[24] 蔡燕飞, 廖宗文, 章家恩, 等. 生态有机肥对番茄青枯病及土壤微生物多样性的影响[J]. 应用生态学报, 2003(3): 349-353.
[25] 章家恩, 廖宗文. 试论土壤的生态肥力及其培育[J]. 生态环境, 2004, 9(3): 253-256.
[26] 杨 红, 徐唱唱, 曹丽花, 等. 米林县不同种植年限蔬菜大棚土壤pH和无机氮变化特征研究[J]. 农业环境科学学报, 2016, 35(12): 2397-2404.
[27] Zhang J, Wang P C, Tian H M, et al. Pyrosequencing-based assessment of soil microbial community structure and analysis of soil properties with vegetable planted at different years under greenhouse conditions[J]. Soil and Tillage Research, 2019, 187: 1-10.
[28] Tripathi P, Khare P, Barnawal D, et al. Bioremediation of arsenic by soil methylating fungi: Role of Humicola sp. strain 2WS1 in amelioration of arsenic phytotoxicity in Bacopa monnieri L.[J]. Science of the Total Environment, 2020, 716: 136758.
[29] Ren J, Xue C, Tian L, et al. Asperelines A-F, peptaibols from the marine-derived fungus Trichoderma asperellum[J]. Journal of Natural Products, 2009, 72(6): 1036-1044.
[30] Luo Y, Zhou M, Zhao Q, et al. Complete genome sequence of Sphingomonas sp. Cra20, a drought resistant and plant growth promoting rhizobacteria[J]. Genomics, 2020, 112(5): 3648-3657.
[31] 段亚冰. 牡丹叶斑病病原真菌鉴定及生物学特性研究[D]. 洛阳: 河南科技大学, 2009.
[32] Voets J P, Van Hove J K. Purification and cellulolytic activity of Cellvibrio[J]. Nature, 1953, 171(4363): 1073-1074.
[33] Gardner J G. Polysaccharide degradation systems of the saprophytic bacterium Cellvibrio japonicus[J]. World Journal of Microbiology and Biotechnology, 2016, 32(7): 1-12.
[34] Voets J P, Van Hove J K. Purification and cellulolytic activity of Cellvibrio.[J]. Nature, 1953, 171(4363): 1073-1074.
[35] 譚志远, 彭桂香, 徐培智, 等. 普通野生稻(Oryza rufipogon)内生固氮菌多样性及高固氮酶活性[J]. 科学通报, 2009, 54(13): 1885-1893.
[36] Phillips R P, Fahey T J. Tree species and mycorrhizal associations influence the magnitude of rhizosphere effects[J]. Ecology, 2006, 87(5): 1302-1313.
[37] 马海宾, 翟婵婵, 王胜坤, 等. 不同分子量壳聚糖抑菌作用的研究[J]. 中国农学通报, 2014, 30(31): 267-271.
[38] 陈红丽. 腐熟麦秸对植烟土壤的营养效应及其机理研究[D]. 郑州: 河南农业大学, 2013.
责任编辑:谢龙莲

