管花苷B对肝癌细胞增殖侵袭转移的影响及机制
欧鹏程 姚杰 吴敏娜 杨智 谢帆慈

摘 要:目的 探讨分析管花苷B对肝癌细胞增殖侵袭转移的影响及作用机制。方法 取人肝癌细胞株HepG2,随机分为对照组和管花苷B不同浓度组,对照组中仅加入细胞培养液,管花苷B不同浓度组中分别加入1 mg/L、10 mg/L、100 mg/L的管花苷B和细胞培养液。采用MTT法测算细胞增殖抑制率;采用Transwell小室实验检测HepG2细胞的体外侵袭、转移能力;采用流式细胞仪检测细胞周期,Westem blot法检测RCD44的表达。结果 细胞增殖抑制率随管花苷B浓度的升高而增大;细胞侵袭和转移能力均随管花苷B浓度的升高而降低;与对照组相比,各浓度的管花苷B均可显著增加GO/G1期肝癌细胞的比例,减少S期与G2/M期肝癌细胞的比例;肝癌细胞CD44蛋白表达量随管花苷B浓度和作用时间的增加而减少。结论 管花苷可明显抑制肝癌细胞增殖侵袭转移,且具有明显的浓度依赖性,其机制可能与管花苷B可影响细胞周期进程和下调CD44蛋白表达有关。
关键词:管花苷B;肝癌细胞;增殖;侵袭;转移;作用机制
中图分类号:R725.6 文献标识码:A 文章编号:1009-8011(2021)-17-0157-03
肝癌是常见的恶性肿瘤之一,全球发病率呈逐年上升趋势,跃居全球癌症发病率第5位,病死率为恶性肿瘤致死病因的第2位[1]。外科手术是治疗肝癌最有效的方法,但肝癌起病隐匿,多数患者就诊时已为中晚期,出现肿瘤的远处侵袭和转移,已失去根治性切除的机会,部分患者即使可局部切除病灶,但术后复发、转移是导致治疗效果不理想、预后差的主要原因,因此寻找有效抑制肝癌转移的药物对提高患者预后具有重要的临床意义。管花苷B是从肉苁蓉属植物管花肉苁蓉中分离得到的一种苯乙醇苷类化合物,近年来大多学者对管花苷B的药理学研究主要集中在抗氧化、抗衰老、抗炎、神经保护、保肝等方面[2]。然而其抗肿瘤作用的研究鲜少报道,本研究以人肝癌细胞株HepG2为研究对象,通过观察管花苷B对肝癌HepG2细胞增殖侵袭转移的影响,探讨管花苷B抗肝癌作用的可能机制,为抗肝癌的药物研究提供理论依据。
1 资料与方法
1.1 材料与仪器
人肝癌细胞株HepG2(中科院上海细胞生物研究所),管花苷B(生产企业:成都格普特生物科技有限公司,CAS号112516-
04-8),DMEM培养液(生产企业:武汉纯度生物科技有限公司)、胎牛血清(生产企业:上海麦克林生化科技有限公司),胰酶、青霉素-链霉素(生产企业:北京索莱宝科技有限公司),二甲基亚砜(DMSO,生产企业:上海吉至生化科技有限公司),Transwell(生产企业:上海惠研生物科技有限公司),Matrigel基质胶(生产企业:BD公司),细胞周期试剂盒(生产企业:碧云天生物技术有限公司),流式细胞仪(生产企业:广州济恒医药科技有限公司),CD44、抗肌动蛋白(β-actin)(生产企业:南京善本生物科技有限公司),BCA蛋白浓度检测试剂盒、辣根标记山羊抗兔IgG二抗(生产企业:武汉科斯坦生物科技有限公司)。
1.2 方法
1.2.1 細胞培养及分组
将HepG2细胞培养于含有10%胎牛血清、青霉素-链霉素各100 μg/mL的DMEM培养液中,置于37 ℃的培养箱内培养,待细胞生长贴壁达90%融合状态时进行细胞传代,取对数生长期细胞用于后续实验。
1.2.2 细胞增殖抑制率测算
采用MTT法测算细胞增殖抑制率。将HepG2细胞按2×105/mL接种于96孔板,每组5孔。待细胞贴壁后吸净上清液,并分为两组,对照组仅加入细胞培养液,管花苷B组中分别加入1 mg/L、10 mg/L、100 mg/L的管花苷B和细胞培养液,培养24 h后,分别加入5 g/L的MTT20 μL,继续培养4 h,弃上清液后加入200 μL的DMSO,震荡15 min,采用酶联免疫检测仪测波长为490 mm时各组吸光密度(OD)值,计算各组细胞增殖抑制率。计算公式如下:细胞增殖抑制率=(1-给药组OD/对照组OD)×100%。
1.2.3 细胞侵袭能力实验
采用Transwell小室法检测细胞细胞侵袭能力。在预冷的Transwell小室中加入稀释好的Matrigel基质胶50 μL,37 ℃培养2 h待其凝固。取各组HepG2细胞制成细胞密度为4×104/mL的悬液待用。在Transwell小室上室中加入用DMEM培养液(含0.1%胎牛血清)稀释的HepG2细胞悬液200 μL,下室中加入500 μLDMEM培养液(含20%胎牛血清),继续培养24 h后使用4%多聚甲醛固定,0.1%结晶紫染色,在显微镜下拍照,并观察穿模细胞数,记录5个高倍镜下视野细胞数,取平均值。
1.2.4 细胞转移能力
操作步骤同细胞侵袭能力实验,但实验中未加入Matrigel基质胶。
1.2.5 细胞周期检测
收集经不同条件处理后的细胞悬液,置于1000 r/min的离心机内离心5 min,弃培养液,PBS洗涤2次,再次离心去除PBS后使用70%乙醇固定,4 ℃保存过夜后离心去上清液,采用流式细胞仪检测细胞周期,用FlowJo软件处理数据,并分析不同周期细胞的数量。
1.2.6 细胞中CD44蛋白表达检测
采用Westem blot法检测细胞中CD44蛋白表达。取各组处理24 h、48 h后的细胞,分别加入细胞裂解液提取细胞总蛋白,严格按照BCA试剂盒说明测定蛋白浓度。取50 μL总蛋白进行SDS-PAGE凝胶电泳,转膜,封闭2 h后孵育一抗(CD44抗体,β-actin抗体);4 ℃孵育过夜,TBST洗涤后加入二抗(辣根标记山羊抗兔IgG),室温孵育1.5 h,TBST洗涤后加入ECL发光液曝光,利用Image J软件分析CD44蛋白表达灰度值。
1.3 统计学分析
采用SPSS 19.0统计学软件进行处理数据,计量资料采用(x±s)表示,组间比较行t检验、单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
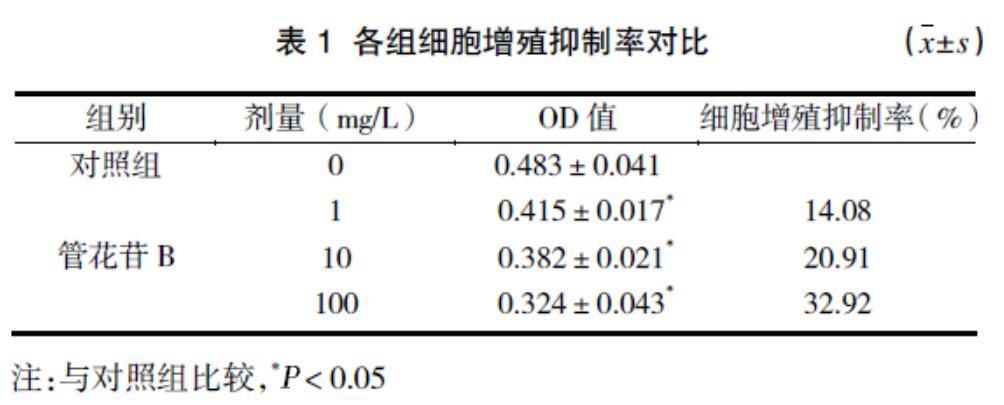
2.1 各组细胞增殖抑制率对比
细胞增殖抑制率随管花苷B浓度的升高而增大。见表1。
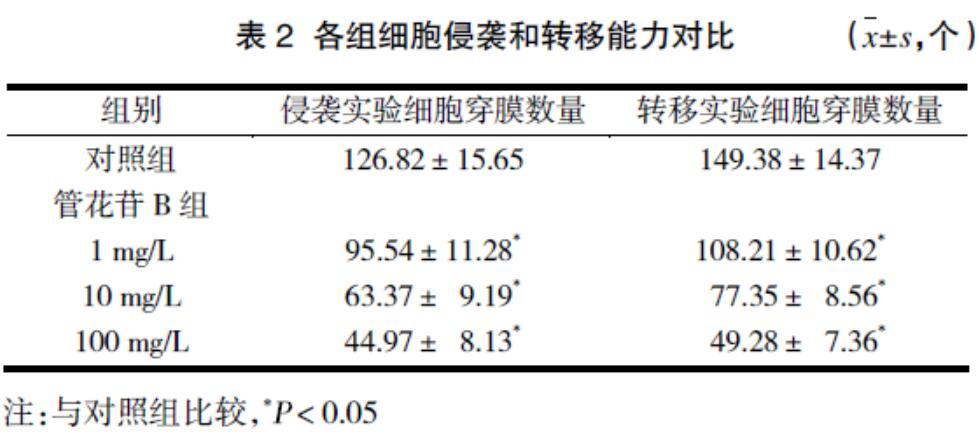
2.2 各组细胞侵袭和转移能力对比
细胞侵袭和转移能力均随管花苷B浓度的升高而降低。见表2。
2.3 管花苷B对肝癌细胞周期的影响
与对照组相比,各浓度的管花苷B均可显著增加GO/G1期肝癌细胞的比例,减少S期与G2/M期肝癌细胞的比例。见表3。
2.4 管花苷B对肝癌细胞CD44蛋白表达的影响
肝癌细胞CD44蛋白表达量随管花苷B浓度和作用时间的增加而减少。见表4。
3 讨论
肝癌是临床常见的具有较高发病率和死亡率的恶性肿瘤之一,肝癌治疗效果不理想的主要原因是早期临床症状不明显,且易发生侵袭和转移。调查[3]显示,超过90%的癌症患者死于肿瘤转移,肿瘤转移提示癌细胞恶性程度提高,治疗难度增大,寻找抗肝癌转移作用的药物对肿瘤研究领域及癌症患者具有重大意义。肝癌的转移涉及多基因、多阶段相互作用,逐渐造成细胞表型的改变以提高肿瘤恶性程度,最终实现肿瘤细胞脱离原发部位,并在转移部位增殖。肿瘤细胞转移的复杂过程包括肿瘤细胞脱落和黏附、细胞增殖侵袭转移、细胞外基质降解、肿瘤血管形成等[4]。研究[5]发现,在肝癌转移的过程中,作为介导细胞黏附作用的CD44细胞黏附分子出现明显的异常表达。CD44细胞黏附分子具有高度異质性,主要分为两个亚型,CD44s标准型和CD44v变异型,参与机体炎症反应、伤口愈合、血管生成、癌症的发展等多种生理、病理过程[6]。增生的上皮细胞、淋巴细胞中均可检测到CD44s标准型,而CD44v变异型与肿瘤细胞的发生、转移密切相关。相关研究[7]表明,肝癌、肺癌、大肠癌、喉癌、宫颈癌等多种肿瘤细胞的侵袭、转移与CD44高表达密切相关,且CD44表达程度与患者临床分期、分化程度存在一定的相关性。研究[8]报道,CD44v变异型高度表达的肝癌患者中多伴有肝内转移。
本研究通过MTT法、Transwell细胞侵袭和转移实验测定了管花苷B对肝癌细胞增殖侵袭转移的影响,结果显示,细胞增殖抑制率随管花苷B浓度的升高而增大,表明管花苷B对肝癌细胞增殖具有明显抑制作用,且具有明显的浓度依赖性;细胞侵袭和转移能力均随管花苷B浓度的升高而降低,表明1 mg/L、10 mg/L、100 mg/L的管花苷B均对肝癌细胞的侵袭和转移具有明显的抑制作用,且管花苷B浓度越高抑制作用越明显。与对照组相比,各浓度的管花苷B均可显著增加GO/G1期肝癌细胞比例,减少S期与G2/M期肝癌细胞比例,提示管花苷B可能对细胞周期进程具有一定的影响作用。为进一步探讨管花苷B抗肝癌转移作用机制,我们蛋白表达水平验证了管花苷B对肝癌细胞中CD44表达的影响,结果显示,肝癌细胞CD44蛋白表达量随管花苷B浓度和作用时间的增加而减少,推测管花苷B抑制肝癌细胞的增殖侵袭转移作用可能通过降低CD44表达而起作用。
综上所述,管花苷可明显抑制肝癌细胞增殖侵袭转移,且具有明显的浓度依赖性,其机制可能与管花苷B可影响细胞周期进程和下调CD44蛋白表达有关。
参考文献
[1]姚兴梅,郭丹,姚帅.绿茶富硒蛋白对肝癌HepG2细胞的抑制作用[J].现代食品科技,2021,37(4):44-49.
[2]丁艳霞,王晓琴,张英.基于高效液相色谱的肉苁蓉属药材6个主要苯乙醇苷类成分的含量测定[J].时珍国医国药,2020,31(4):813-816.
[3]刘少儒,许磊波.肝癌肝移植术后复发转移的免疫治疗[J].器官移植,2021,12(3):272-279.
[4]刘云鹤,蔡金保,张德重,等.T淋巴瘤侵袭转移诱导因子1对肝癌细胞迁移和黏附的影响及其机制[J].中华实验外科杂志,2020,37(6):1122-1125.
[5]邓通元,黄桂柳,黄赞松,等.苦参素对肝癌细胞增殖、侵袭和迁移能力的影响及机制[J].山东医药,2018,58(10):5-8.
[6]沙娅·玛哈提,肖蕾,迪娜·艾尼瓦尔,等.CLDN1影响放疗后肝癌侵袭转移潜能变化的机制研究[J].中国中西医结合消化杂志,2019,27(4):251-255,259.
[7]王瑜玲,段媛媛,闫会敏,等.厄洛替尼通过下调CD44表达抑制非小细胞肺癌转移的机制研究[J].河北医药,2017,39(6):826-830.
[8]王霖沛,马筱秋,黄卫锋,等.微小RNA-145对CD44表达以及肝癌细胞影响[J].中华肝胆外科杂志,2019,25(3):179-183.

