两个Co/Ni含氮配体配合物的合成、结构及荧光性质
陈贤,柳畅,王莹,关磊,尹鹏鹏,熊学佳,金红哲
(辽宁石油化工大学石油化工学院,辽宁抚顺 113001)
近年来,对配合物的研究越来越受到研究者们的广泛关注,因其具有多维和多样的空间结构,在诸多领域具有潜在的应用价值,包括吸附、催化、电化学以及光学和磁学材料等[1-7]。众所周知,配体结构变化以及与金属原子间的配位方式可以较大程度地影响配合物的物理性质,利用多种官能团配体的结构和尺寸变化以及金属离子的配位构型调节配合物的拓扑结构。辅助配体的引入及其配位点的位置起到封端或者桥连作用,有效地调节配合物的维度。磺酸基阴离子电荷较低,具有较强的连接能力,易于形成水合化合物。磺酸基具有三个氧原子,配位度可调,与金属离子配位形成结构多变的磺酸基配合物[8];亦可以在不同方向上形成氢键,构筑结构丰富的超分子化合物[9]。与羧基相比,磺酸基配位能力较弱,与较硬的过渡金属阳离子共存时不参与配位,只能与碱金属和碱土金属离子直接配位[10-12]。但是,引入含氮配体以及其他辅助官能团均可以促进其与金属离子的配位,构筑结构多样的配合物[13-15],其中含氮配体包括1,10-邻菲罗啉、联吡啶、1,3-二-4-吡啶基丙烷(DPP)等。例如,Q.Y.Liu等[15]利用5-磺基邻苯二甲酸盐(SIP)和含氮配体DPP,采用水热合成法得到一个新型三维配位聚合物[Zn2(OH)(SIP)(DPP)]n。研究表明,其具有三维扭曲的左/右手螺旋拓扑网络结构。测量结果表明,该材料具有很强的倍频响应和相位匹配性质,是磷酸二氢钾的2.5倍。至今,对磺酸基配合物的合成与性质研究仍是一项面临诸多挑战的课题。NaH2L是一个多官能团配体,含有一个磺酸基和两个酚羟基。其中,磺酸基和酚羟基的协同作用有助于构筑结构复杂的配合物,并且结构中的氢键有助于形成结构更复杂的超分子化合物。
本文以1,4-二羟基苯-2-磺酸钠(NaH2L)、4,4′-联 吡啶(bipy)、Co(NO3)2·6H2O和NiSO4·6H2O为原料,采用加热回流的合成方法得到两个结构相似的单核含氮配体配合物M(bipy)(H2O)4·(2H2L)·4H2O(M=Co(1),Ni(2))。利用单晶X-射线衍射、元素分析、热重分析表征了其结构和组成,并且考察了其荧光发射性质。
1 实验部分
1.1 试剂与仪器
试剂:全部试剂购买于天津市大茂化学试剂厂,分析纯,未做进一步处理,直接使用。
仪器:D8-QUEST型单晶X-射线衍射仪,德国布鲁克公司;2400-型元素分析仪,美国珀金·艾默尔公司;Q-600型热重分析仪,美国TA公司;Cary Eclipse型荧光分光光度计,中国安捷伦公司。
1.2 配合物1的合成方法
将21.2 mg(0.1 mmol)NaH2L和18.3 mg(0.1 mmol)Co(NO3)3·6H2O溶 解 于20 mL去 离 子 水 中,在上述溶液中加入15.6 mg(0.1 mmol)bipy搅拌2 h,然后装入圆底烧瓶中加热4 h后,冷却至室温过滤,放置5 d得到红色块状晶体,用去离子水和乙醇洗涤,在干燥箱中烘干。元素分析:C22H34CoN2O18S2(质量分数,%),理论值C 35.79,H 4.61,N 3.80;实测值C 35.89,H 4.73,N 3.85。
1.3 配合物2的合成方法
将15.6 mg(0.1 mmol)bipy和26.3 mg(0.1 mmol)NiSO4·6H2O溶 解 于20 mL去离子 水 中,在上述溶液中加入21.2 mg(0.1 mmol)NaH2L搅拌1 h,然后装入圆底烧瓶中加热2 h后,冷却至室温过滤,放置3 d得到红色块状晶体,用去离子水和乙醇洗涤,在干燥箱中烘干。元素分析:C22H34NiN2O18S2(质量分数,%),理论值C 35.80,H 4.61,N 3.80;实测值C 35.97,H 4.82,N 3.82。
1.4 晶体测试
选择尺寸适中的配合物1和配合物2块状晶体颗粒,利用单晶X-射线衍射仪在296 K下测试其晶体结构。采用ω/2θ扫描方式,单色化的Mo-Kα射线(λ=0.071 073 nm)收集衍射数据。采用SADABS程序对数据进行吸收校正,SHELXL-2014程序直接法解析配合物1和配合物2的结构[16],SHELXTL程序的全矩阵最小二乘法进行结构精修。利用差值Fourier映射以及理论加氢的方法分别确定非氢原子和氢原子的位置。配合物1和配合物2的晶体学参数、键长和键角分别列于表1-4。
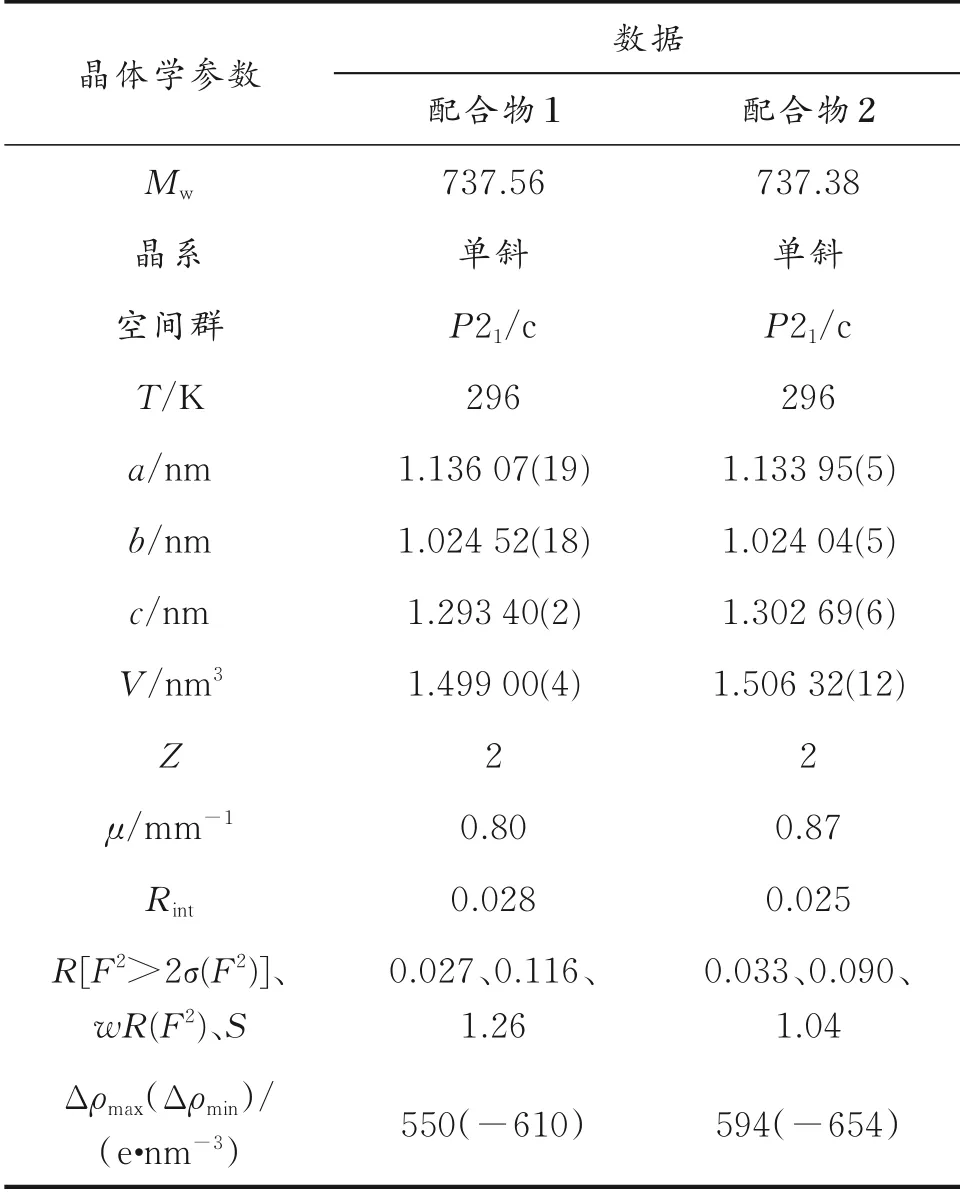
表1 配合物1和配合物2的晶体学参数
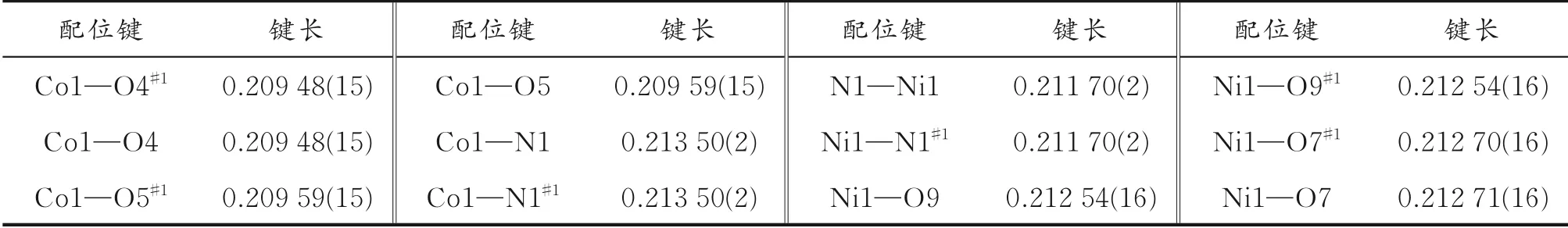
表2 配合物1和配合物2的键长 nm

表3 配合物1的键角 (°)
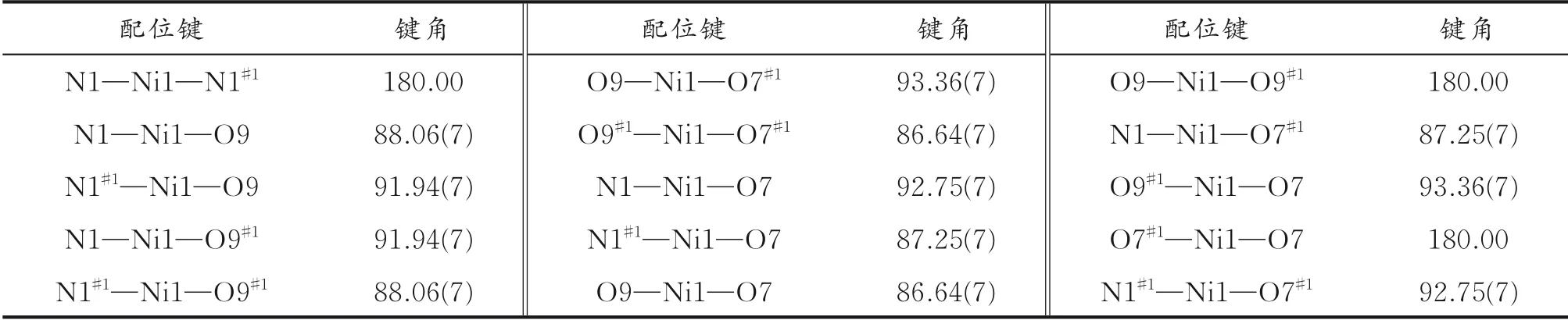
表4 配合物2的键角 (°)
2 结果与讨论
2.1 配合物1和配合物2晶体结构
配合物1和配合物2的结构和晶胞参数相似,晶系和空间群相同,因此以配合物1为例进行详细的结构分析。配合物1结晶于单斜晶系,P21/c空间群(见表1)。配合物1的一个非对称结构单元包含0.5个Co离子、0.5个bipy分子、一个未配位的H2L-、两个配位水分子和两个游离的水分子,如图1(a)所示。每个Co离子是六配位的,处于一个扭曲的八面体配位构型中,如图1(b)所示,分别与两个bipy分子的两个氮原子(N1和N1#1)、四个水分子配位(O4、O4#1、O5和O5#1)。Co-N的键长为0.213 50(2)nm,Co-O的键长为0.209 48(15)~0.209 59(15)nm。O-Co-O和O-Co-N键 角 分 别 为87.24(6)°~180.00°和87.28(6)°~92.72(6)°,N1—Ni1—N1#1键角为180.00°。这些键长和键角数值与文献[17]报道的含氮配体Co配合物的数值相似。含氮辅助配体的引入起到桥连和封端的作用,进而影响配合物的结构。Q.Y.Liu等[18]利用SIP为第一配体,与Cu2+反应形成一个SIP桥连的配位聚合物{[Cu4(OH)2(SIP)2(H2O)2](H2O)4}n。Cu4和SIP配体分别被看作是8连接和4连接的节点,因此该配位聚合物具有(411·614·83)(45·6)2型拓扑结构的三维网络。如果在反应体系中引入2,2ˊ-联吡啶(2,2ˊ-bipy)作为辅助配体,反应可以得到两个配位聚合 物[Cu2(OH)(SIP)(2,2ˊ-bipy)(H2O)]n和[Cu4(OH)2(SIP)2(2,2ˊ-bipy)3(H2O)]n。在这两个配位聚合物中,2,2ˊ-bipy配体采用螯合配位模式,起到封端作用,因此两个配位聚合物没有形成三维结构,而是形成二维的层状结构。在Cd2+与SIP反应体系中引入4,4ˊ-bipy辅助配体,反应得到一个配位聚合物{[Cd3(SIP)2(4,4ˊ-bipy)4(H2O)2]·3H2O}n。研究表 明,该配合物具有三维的自穿插框架结构,4,4ˊ-bipy配体起到桥连作用[19]。
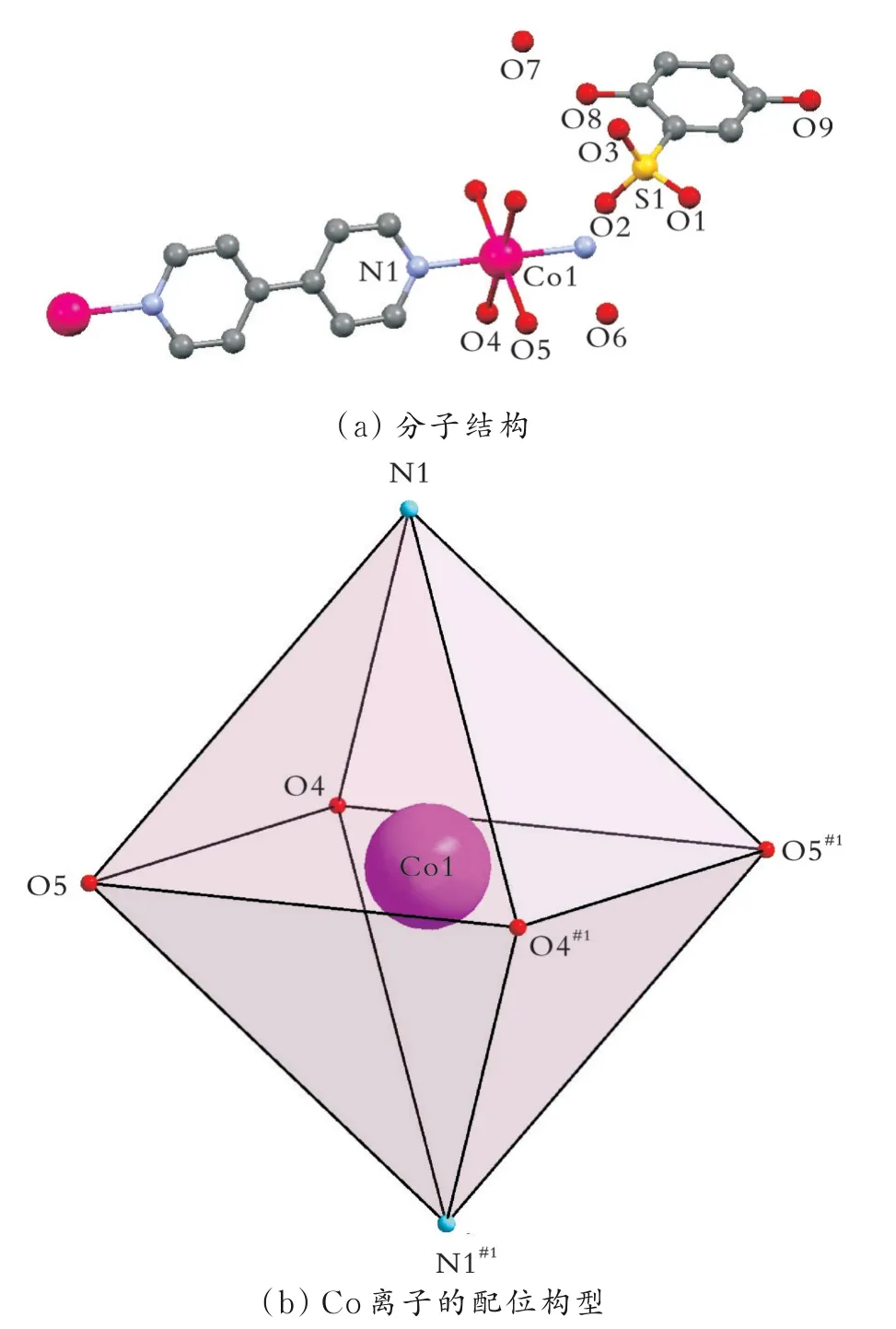
图1 配合物1的分子结构和Co离子的配位构型
酚羟基与自由水分子和磺酸基氧原子形成氢键,包 括O9-H9···O1和O8-H8···O7。自 由 水 分子与磺酸基和酚羟基氧原子形成氢键O7-H7A···O3、O6-H6A···O2和O6-H6B···O9。配位水分子与自由水和磺酸基氧原子形成氢键,例如O5-H5A···O3、O5-H5B···O6、O4-H4A···O2和O4-H4B···O6,上述形成的氢键将配合物1连接成网状结构(见图2),较大幅度地增加了配合物自身的热稳定性。配合物1的氢键键长和键角数据列于表5。
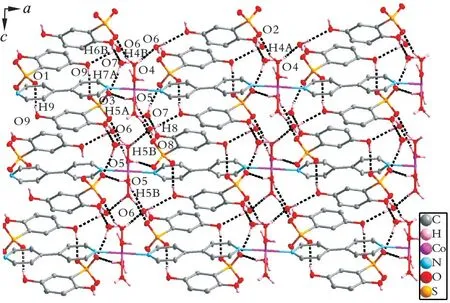
图2 配合物1通过氢键相连形成的网状结构

表5 配合物1的氢键键长和键角
2.2 热重分析
为了考察配合物1和配合物2的热稳定性质,在N2气氛、升温速率为10 K/min的条件下,室温至900℃测试了配合物1和配合物2的热重曲线,结果见图3。
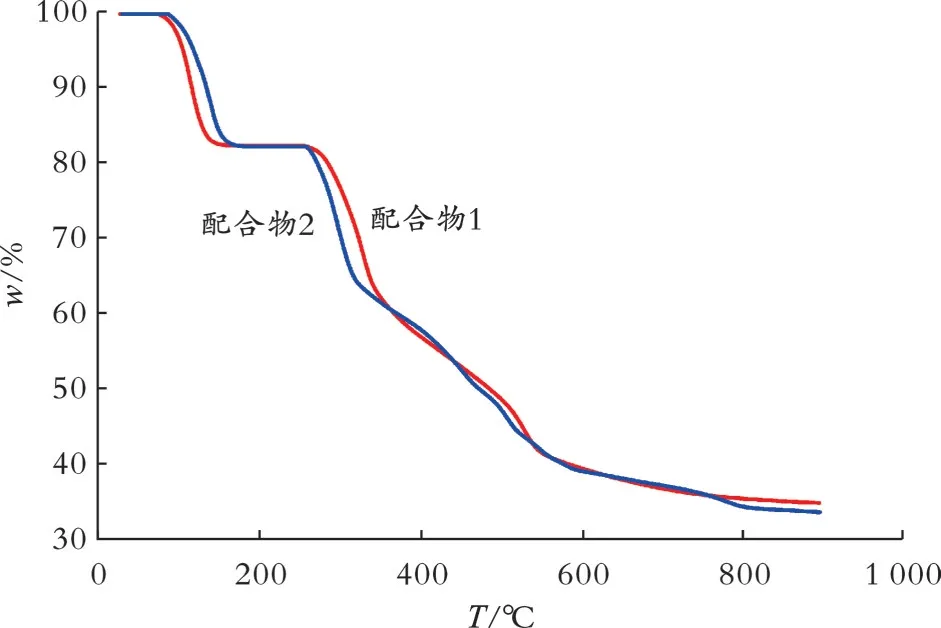
图3 配合物1和配合物2的热重曲线
从图3可以看出,配合物1和配合物2的第一个失重台阶均在25~172℃,失重率为18.6%,是失去四个配位水分子和四个自由水分子造成的(理论值为19.5%)。由于配合物1和配合物2的自由水分子和配位水分子均形成了丰富的氢键(见表5),使其更加稳定,因此在172℃时才完全失去。第二个失重台阶均在172~442℃,失重率为26.8%,是失去一个H2L-造成的(理论值为25.6%)。继续增加温度,配合物1和配合物2逐渐分解,直到900℃时质量损失放缓,但是仍有下降趋势,说明其没有完全分解[20-21]。
2.3 荧光性质
为了考察和对比配合物1和配合物2的荧光性质,测试了NaH2L、配合物1和配合物2的室温固体荧光发射光谱,结果见图4。从图4可以看出,在315 nm激发条件下,NaH2L的最大荧光发射峰在347 nm,其归因于NaH2L的苯环π-π*和n-π*跃迁[22]。在315 nm激发条件下,配合物1和配合物2的最大荧光发射峰分别在380 nm和390 nm,其峰型与NaH2L的相似,均来源于NaH2L的荧光发射,是芳环π-π*和n-π*跃迁产生的。配合物1和配合物2的荧光发射峰相比于NaH2L分别红移了33 nm和43 nm,可能是电荷在金属和bipy配体之间跃迁造成的[23-24]。
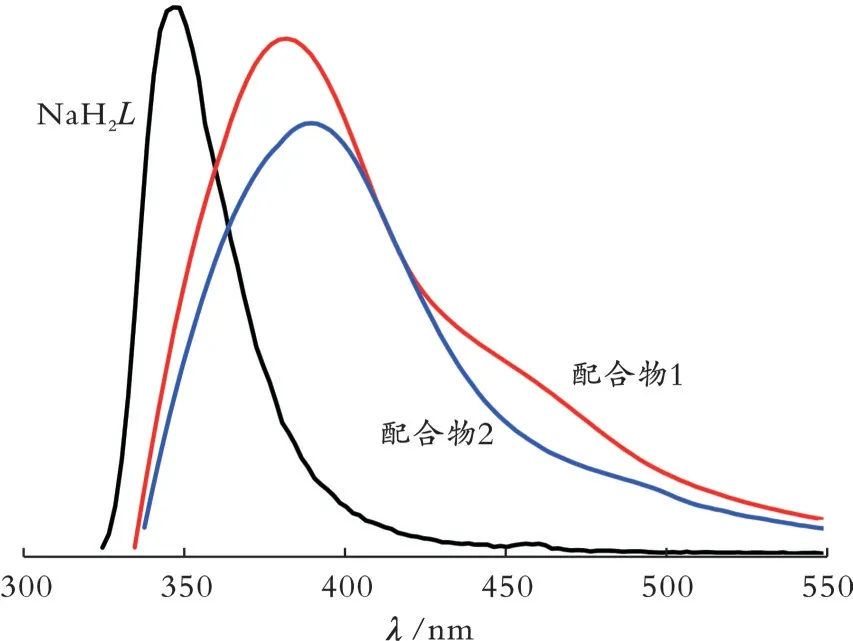
图4 NaH2L、配合物1和配合物2的室温固态荧光发射光谱
3 结论
(1)利用回流法合成得到两个含氮配体单核配合 物M(bipy)(H2O)4·(2H2L)·4H2O(M=Co(1),Ni(2))。两个配合物结构相似,金属离子均是六配位的,分别与bipy和水分子配位,呈现八面体配位构型,H2L-没有参与配位,起到平衡电荷作用。
(2)H2L-的酚羟基、磺酸基、自由水分子之间由氢键相连,形成网状结构,增加了配合物的热稳定性,使水分子的失重温度高达172℃。
(3)配合物1和配合物2的最大荧光发射峰分别在380 nm和390 nm,主要归因于NaH2L内芳环n-π*和π-π*跃迁;荧光发射红移主要来源于配体和金属之间的电荷转移。

