禽腺病毒血清4型Fiber-2蛋白在毕赤酵母中的优化表达及其免疫原性分析
袁 枫 宋慧琦 侯 磊 韦 莉 朱珊珊 全 荣 王 菁 王 丹 姜海军 刘 浩 刘 爵*
(1.天津科技大学 生物工程学院,天津 300222;2.北京市农林科学院 畜牧兽医研究所,北京 100097;3.扬州大学 兽医学院,江苏 扬州 225009;4.扬州大学 江苏省重大动物传染病与人畜共患病防控合作创新中心,江苏 扬州 225009)
禽腺病毒血清4型(FAdV-4)的主要感染对象为3~5周龄的雏鸡,感染后在一周内会发病死亡。病死鸡剖检表现出心包积液-肝炎综合征(Hydropericardium-hepatitis syndrome,HHS)的典型症状,心包内积聚大量的液体,肝脏出现明显的病毒包涵体,死亡率达到30%~80%[1-2]。2013 HHS传入我国后只见散发性流行[3-4],直到2015后,超强毒力的禽腺病毒血清4型(hvFAdV-4)已成为国内HHS的主要的病原体,导致鸡群的死亡率节节攀升,给国内外的养禽业带来极大威胁[5]。
自2010年以来,研究者们采用细胞培养系统相继地研发出禽腺病毒血清4型的灭活疫苗和弱毒疫苗[6-10],其中部分疫苗保护率可高达100%[8]。但是这类疫苗产量有限、成本较高,而且容易出现病毒灭活不完全或毒力返强的现象,存在着很大的生物安全隐患。近年来,随着生物技术的不断发展,亚单位疫苗作为新一代疫苗凭借着成本低、产量高、安全可靠和保护效果好等优点,在传染性疾病预防方面已广泛应用。
在FAdV-4的亚单位疫苗研究中,主要应用的表达系统有大肠杆菌[11-13]、昆虫细胞[14-15]和哺乳动物细胞[16]等。研究人员利用不同的表达系统进行了病毒结构蛋白(Fiber-1、Fiber-2[17]、Hexon和Penton)和非结构蛋白(100 K)的外源表达。结果发现不同的蛋白保护效率差异性较大,这些系统表达的结构蛋白Fiber-1、Penton和Hexon虽然都能提供一定程度的保护,但是无法完全抵御FAdV-4的感染,而非结构蛋白(100 K)几乎不能刺激机体产生有效的免疫反应[18]。Fiber-2是FAdV-4特有的结构蛋白,在病毒感染过程中的吸附和进入中发挥重要作用[19]。研究表明,不同系统表达的Fiber-2蛋白均可激发机体产生高效的免疫保护力[20-21]。
目前,为制备FAdV-4 Fiber-2蛋白的亚单位疫苗,很多研究采用了原核表达系统(大肠杆菌)和真核表达系统(昆虫细胞和毕赤酵母)对Fiber-2蛋白进行了表达[11-13,15,22]。虽然,大肠杆菌生长繁殖快、培养简单,但是表达的蛋白无法进行有效折叠和修饰,导致不能激发机体产生高效免疫应答。真核表达系统表达的病毒蛋白与活病毒更为接近,更有利于刺激机体产生高效的免疫应答。在所有的真核表达系统中,毕赤酵母(Pichiapastoris)表达系统由于其具有菌体繁殖快、培养基廉价,而且还能对目的蛋白进行折叠和修饰并以外分泌的形式表达的优势。同时,经过优化后的毕赤酵母表达系统有着很高的产量,外分泌的目的蛋白可以达到g/L。如此高的产量是其他原核和真核表达系统都无法做到的,因此,近年来毕赤酵母表达系统被研究者广泛用于亚单位疫苗的制备。
虽然先前有关研究已经发现FAdV-4 Fiber-2蛋白可在毕赤酵母表达系统进行表达[22],然而其表达量及蛋白纯度较低,无法满足批量化生产的需求。在实际生产实践中,通常未经优化的毕赤酵母表达系统表达的蛋白量较低,并达不到应用于工业化发酵生产的需求。因此,通过酵母发酵工艺的优化来提高外源蛋白的表达,对亚单位疫苗的制备至关重要[23-25]。本研究旨为提高Fiber-2蛋白在毕赤酵母(P.pastoris)表达系统中的外分泌表达,将病毒的Fiber-2基因按照酵母密码子偏好进行了优化,然后通过不同浓度的G418选取高拷贝的重组菌株后,采用摇瓶优化诱导温度、时间和甲醇浓度。并采用动物试验评估了优化后的毕赤酵母表达Fiber-2蛋白制备的亚单位疫苗对高致病性FAdV-4毒株(GD616)的免疫保护作用。该研究成果为FAdV-4亚单位疫苗进行大规模发酵生产提供基础资料。
1 材料与方法
1.1 材料与试剂
禽腺病毒血清4型(FAdV-4)GD616毒株和Fiber-2豚鼠多克隆抗体由研究室保存;酵母真核载体pPIC9K和毕赤酵母菌(P.pastoris)GS115株由苏州泓迅生物公司提供;限制性内切酶EcoRⅠ、NotⅠ和SacⅠ购自NEB公司;HRP标记的羊抗豚鼠IgG和羊抗鸡IgG购自Sigma公司;氨苄霉素(Amp+)购自Invitrogen公司;增强型HRP底物显色试剂盒购自Thermo公司;ISA-201-VG免疫油佐剂购自SEPPIC公司;纯化所用的镍柱(HisTrapTM FF,5 mL)购买于GE公司;PierceTMBCA蛋白定量试剂盒购自Thermo Scientific;SPF鸡购自购自北京维通利华实验动物技术有限公司。BMGY培养基和BMMY培养基自配。
1.2 Fiber-2基因序列的密码子优化和pPIC9K-Fiber-2载体构建
根据研究室测得FAdV-4-GD616毒株的Fiber-2基因序列,对该基因序列进行酵母密码子偏好性优化,全序列由苏州泓迅生物合成。优化后序列连接至酵母真核载体pPIC9K载体上,命名为pPIC9K-Fiber-2。优化过的全序列编码485个氨基酸,包括Fiber-2蛋白以及His标签(6-His)。
利用网络公共平台提供(http:∥www.cbs.dtu.dk/)的软件TMHMM和SignalP 3.0 Server,预测Fiber-2蛋白质的信号肽和跨膜结构。
根据对优化后的Fiber-2基因全序列设计检测引物,F1:5’-ATGTTGAGAGCCCCAAAGAGAAGAC-3’;R1:5’-GTGATGGTGGTGATGATGTGGAAC T-3’,由生工生物工程(上海)股份有限公司合成。
1.3 毕赤酵母的电转化
将重组质粒pPIC9K-Fiber-2导入大肠埃希菌TOP10进行大量扩增后提取质粒。取部分质粒进行EcoRⅠ和NotⅠ双酶切分析。随后取5 μg重组质粒pPIC9K-Fiber-2用SacⅠ酶对其进行线性化单酶切,并用2倍体积无水乙醇沉淀回收,30 μL ddH2O溶解。取100 μL酵母感受态细胞加入30 μL 线性化的质粒,混合后转入电转杯(d=0.2 cm)中,冰上放置数分钟后,放入电转仪中电击(电压:1680 V,电击时间:5 ms),电击后,立刻加入1 mL 1 mol/L的D-山梨醇,冰上放置数分钟。随后放置28 ℃培温摇床内培养1 h。分别取pPIC9K-Fiber-2和pPIC9K(对照)转化菌液100~200 μL涂布于MD平板。48 h后观察平板菌落长势。
1.4 高拷贝阳性转化子的筛选及PCR鉴定
用无菌ddH2O将MD平板上的酵母菌落洗脱至无菌的离心管中,按每平皿1×105个细胞涂于含G418不同质量浓度的YPD平皿,其中G418质量浓度分别为1、3和5 mg/mL。经3~5 d培养后,G418抗性克隆长出。从3 mg/mL的YPD-G418平板上挑取8个单克隆至4 mL YPD液体培养基中28 ℃培养36 h。取500 μL菌液至1.5 mL EP管中,离心收集菌体,使用酵母基因组DNA提取试剂盒提取酵母菌的基因组。用引物F1和R1进行PCR扩增验证。
1.5 毕赤酵母诱导表达及其优化
1.5.1摇瓶接种菌的制备
取出-80 ℃保存的酵母菌种,接种2 mL发酵种于100 mL的BMGY培养基中,放置摇床并将参数设置为300 r/min和28 ℃进行培养,最终OD600至3~6(约16~24 h)。离心收集菌体。
1.5.2诱导温度的优化
将准备好的重组菌放在BMMY培养基中分别以不同温度(24、26、28和30 ℃)进行诱导表达,接下来每24 h向培养基中添加总体积的1.0%甲醇,在96 h后将菌液离心取上清放在-80 ℃ 保存。先用BCA检测上清中蛋白含量,再将剩余的上清液进行三氯乙酸蛋白沉淀,采用SDS-PAGE和Western Blot检测,以确定最适的诱导温度。
1.5.3诱导时间的优化
将准备好的菌体用100 mL的BMMY培养基重悬。放在摇床上并将参数设置为30 ℃ 250 r/min继续生长。每24 h加入培养液总体积1.0%的甲醇并培养120 h。开始诱导后每天将部分菌液离心取上清用BCA检测上清中蛋白含量,并将上清浓缩后进行SDS-PAGE和Western Blot检测,以确定最适的诱导时间。
1.5.4甲醇诱导浓度的优化
根据确定好的最佳诱导时间和温度,每24 h添加的甲醇分别为(0.5%、1.0%、2.0%和3.0%)。在30 ℃诱导72 h后取上清检测蛋白表达及含量,以确定最适的甲醇诱导浓度。
1.5.5发酵液蛋白浓缩及检测
取出900 μL上清加入三氯乙酸置于冰上10 min。离心后弃上清液加入1 mL丙酮震荡涡旋在-20 ℃冰柜中过夜进行沉淀。12 000 r/min离心10 min,收取沉淀并加入20 μL ddH2O和4 μL上样缓冲液,100 ℃煮沸10 min,进行SDS-PAGE和Western Blot检测。
Western Blot检测,在进行SDS-PAGE后将蛋白转移至硝酸纤维素膜(NC膜)上,5%脱脂奶封闭NC膜过夜。TBST洗膜1次,加Fiber-2蛋白豚鼠多克隆抗体孵育2 h;PBST洗膜4次(10 min/次),加HRP标记的羊抗豚鼠IgG二抗孵育1 h。TBST洗膜3次(10 min/次),加增强型HRP底物显色液避光反应5 min后成像检测。
1.6 Fiber-2重组蛋白的纯化和检测
在摇瓶中诱导表达72 h后,收取菌液12 000 rmp/min 离心10 min,收取发酵上清液用0.22 μm水系滤膜过滤,利用BCA试剂盒检测上清液中的总蛋白含量。随后将过滤后的上清液过镍柱纯化,按照HisTrapTMHP的使用说明书进行,最终用500 mmol/L浓度的咪唑洗脱缓冲液洗脱目标蛋白,并用透析进行脱盐处理,再用BCA试剂盒检测Fiber-2蛋白含量。
1.7 毕赤酵母表达的重组 Fiber-2蛋白的免疫保护效力评估
1.7.1动物试验设计
先将纯化后的Fiber-2蛋白分为0、20和 50 μg,然后与ISA-201-VG免疫油佐剂等体积混合(1∶1)。将35只21日龄SPF鸡分成4组(PBS对照组、Fiber2-20 μg组和Fiber2-50 μg组(每组10只),空白组(Sham)5只),分别胸肌多点注射重组Fiber-2蛋白,对照组注射PBS,空白组不做处理。共免疫2次,免疫间隔时间为一周,二免后7天将FAdV-4-GD616病毒液稀释至103.5TCID50/0.1 mL,肌肉接种感染3组鸡(0 μg、20 μg和50 μg/只/组),每只0.2 mL。
1.7.2免疫后的血清ELISA抗体检测
分别于免疫后7 d和二免后7 d后翅静脉采血,收集血清。用ELISA进行抗体检测,采用浓度为5 μg/mL 的Fiber-2蛋白包被过夜,用 5%的脱脂奶粉在37 ℃封闭2 h,漂洗后将稀释200倍后的血清加入,孵育2 h;漂洗后加入5 000倍稀释的羊抗鸡IgG-HRP酶标抗体,37 ℃反应50 min;漂洗后加TMB避光反应15 min,在终止后读取OD450吸光度值。
1.7.3攻毒后鸡群保护率
攻毒后每天观察鸡的健康状况,记录死亡和存活的数量,并进行保护率的计算。
1.7.4攻毒后鸡群病理组织观察
PBS组随机选取病死鸡进行剖检并收集肝脏;空白组(Sham)和50 μg组在攻毒后第7天随机选取鸡进行剖检并收集肝脏;将收集的肝脏用4%的多聚甲醛固定,在石蜡包埋后切片,并对切片进行HE和免疫组化染色(HIC)。HIC选取课题组制备的Fiber-2豚鼠多克隆抗体。
2 结果与分析
2.1 Fiber-2基因密码子优化
禽腺病毒血清4型(FAdV-4)的Fiber-2基因长为1 440 bp,按照酵母密码子的偏好,将Fiber-2基因序列按进行了优化(图1)。优化的过程中选择性避开EcoRⅠ、NotⅠ和SacⅠ酶切序列的出现。将EcoRⅠ和NotⅠ酶切位点在优化时加在CDS序列两端,以便插入载体的多克隆位点。在Fiber-2蛋白的N端添加了6×His标签和2个终止密码子(TGA),序列最终长度为1 475 bp。最后对Fiber-2氨基酸序列分析显示蛋白不存在跨膜区和信号肽。

*为终止密码子序列。* represent the termination codon sequence.图1 根据酵母密码子偏好优化后的Fiber-2基因和氨基酸序列Fig.1 Fiber-2 gene and amino acid sequence optimized according to yeast codon preference
2.2 高拷贝阳性转化子筛选及PCR鉴定
高拷贝阳性转化子筛选结果显示,含有5 mg/mL G418的YPD平板上并未发现菌落生长,含3 mg/mL G418的YPD平板上有8个高拷贝阳性转化子(图2(a))。挑取上述阳性转化子,用优化序列的Fiber-2引物F1和R1进行PCR扩增。结果显示所有转化子均出现了约为1 500 bp的目的条带(图2(b))。

(a)Ⅰ是G418浓度为1 mg/mL的MD培养基;Ⅱ是G418浓度为3 mg/mL的MD培养基;Ⅲ是G418浓度为3 mg/mL的MD培养基;(b)1~8为G418浓度为3 mg/mL的MD培养基中的8个高拷贝阳性转化子。(a)Ⅰ indicates MD medium with 1 mg/mL of G418,Ⅱ indicates MD medium with 3 mg/mL of G418,and Ⅲ was MD medium with 3 mg/mL of G418.(b)1-8 indicate 8 high copy positive transformants in MD medium with 3 mg/mL of G418.图2 高拷贝阳性转化子的筛选(a)及PCR鉴定(b)Fig.2 Screening (a)and PCR identification (b)of high copy positive transformants
2.3 诱导温度的优化
诱导温度在28 ℃以上时重组蛋白表达显著增加,在30 ℃时到达峰值。因此最佳温度为30 ℃。根据图3(a)和(b)结果显示,培养液中的杂蛋白虽然会随温度增加而变多,但是并没有影响Fiber-2蛋白的表达。
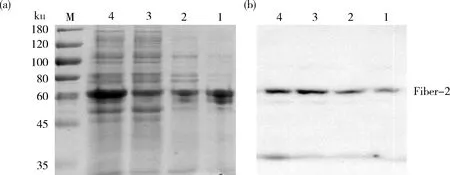
1~4:分别为诱导温度为24、26、28和30 ℃时蛋白的浓缩液。M:蛋白分子量标准。1-4:the protein concentrate was induced at 24,26,28,and 30 ℃,respectively.M:Protein molecular weight standard.图3 不同诱导温度表达产物的SDS-PAGE (a)和Western blot (b)鉴定Fig.3 SDS-PAGE (a)and Western blot (b)identification of products expressed at different induction temperatures
2.4 诱导时间的优化
分别收取诱导后24、48、72、96和120 h的发酵上清液进行浓缩,检测发现上清液中杂质蛋白会随着诱导时间逐渐的增多(图4(a))。根据Western结果显示,这些增多的杂质蛋白并不是重组Fiber-2蛋白的片段(图4(b))。上清液的总蛋白含量在72 h 达到表达峰值,此后的时间点没显著增加。PAGE和Western结果显示诱导72 h的Fiber-2蛋白表达最高,即使延长发酵也无法提高表达量。综上,在72 h停止发酵并回收目的蛋白最为适宜。

1~5:分别为诱导24、48、72、96和120 h培养基的蛋白浓缩液。6:空白酵母诱导96 h后培养基的蛋白浓缩液。M:蛋白分子量标准。1-5:the protein concentrate of induction medium for 24,48,72,96,and 120 h,respectively.6:the protein concentration of the culture medium was induced by blank yeast for 96 hours.M:Protein molecular weight standard.图4 不同诱导时间表达产物的SDS-PAGE(a)和Western blot鉴定Fig.4 SDS-PAGE (a)and Western blot (b)identification of expression products with different induction time

1~4:甲醇诱导浓度分别为0.5%、1.0%、2.0% 和3%时的蛋白浓缩液。M:蛋白分子量标准。1-4:the protein concentrate was induced by methanol at concentrations of 0.5%,1.0%,2.0% and 3.0%,respectively.M:Protein molecular weight standard.图5 不同甲醇诱导浓度表达产物的SDS-PAGE(a)和Western blot(b)鉴定Fig.5 SDS-PAGE (a)and Western blot (b)detection of expressed products at different methanol induced concentrations
2.5 甲醇诱导浓度的优化
诱导表达开始后,每隔24 h分别添加不同体积分数的甲醇,体积为发酵液总量的0.5%、1.0%、2.0%和3.0%,72 h后收取各组上清液进行检测。结果显示Fiber-2蛋白的表达量在甲醇浓度为1.0%时最高,添加量过大反而抑制了Fiber-2蛋白的表达。所以将最佳的甲醇诱导浓度确定为1.0%。
2.6 Fiber-2蛋白纯化及检测
优化后发酵上清中总蛋白含量达到约50 mg/L,同时重组蛋白Fiber-2的产量为8.7 mg/L。上清液经过镍柱亲和层析纯化后的蛋白条带单一,说明重组蛋白Fiber-2可以通过镍柱亲和层析的方法纯化(图6(a))。Western blot检测结果显示的蛋白在60 ku左右,与预期结果相符(图6(b))。

纯化后的Fiber-2蛋白进行PAGE (a)和Western (b)检测。M:蛋白分子量标准;1:纯化后的Fiber-2蛋白。The purified Fiber-2 protein was detected by PAGE (a)and Western blot (b)M:Protein molecular weight standard;1:Purified Fiber-2 protein.图6 Fiber-2蛋白纯化后的检测Fig.6 Detection of purified Fiber-2 protein
2.7 免疫攻毒保护试验
ELISA抗体检测结果显示,20和50 μg免疫组在首免后1周出现特异性抗体,之后抗体水平持续上升,二免疫后1周达到高峰期。同时发现疫苗免疫剂量越大,特异性抗体水平也越高,PBS对照组在动物试验期间未产生Fiber-2的特异性抗体(图7(a))。超强致病性FAdV-4毒株GD616感染后,PBS免疫组的死亡率为100%(10/10),20 μg重组Fiber-2蛋白组为10%(1/10),50 μg重组Fiber-2蛋白组并没有鸡出现死亡(图7(b))。结果说明重组Fiber-2蛋白免疫组较PBS对照组有明显的保护作用,并且50 μg的免疫对超强毒株的感染可起到100%的保护。

图7 免疫后的抗体水平(a)和攻毒后的生存曲线(b)Fig.7 Antibody level (a)after immunization and survival curve (b)after challenge
2.8 动物试验病理学分析
对空白组、PBS组和50 μg组中的鸡进行剖检,随后取肝脏切片并进行HE和病毒Fiber-2蛋白的免疫组化检测(图8)。结果显示,PBS免疫组在GD616后出现典型的HHS的病变,而50 μg免疫组中并没发现病变。随后切片的HE和免疫组化(HIC)染色结果显示,PBS组的肝脏出现了典型的病毒包涵体,脂肪变性和炎性细胞沁润的病理学变化。而在空白组和50 μg组中并没有发现病理变化和病毒的Fiber-2蛋白阳性着色。表明50 μg重组蛋白免疫对肝脏有很好的免疫保护效果。

箭头a:FAdV-4病毒包涵体;箭头b:脂肪空泡;c:炎性细胞浸润。Arrow a:FAdV-4 virus inclusion body;Arrow b:Fat vacuoles;c:Inflammatory cell infiltration.图8 肝脏病理组织切片观察(HE和HIC(Fiber-2),20×)Fig.8 Observation of pathological sections of liver (HE and HIC (Fiber-2),20×)
3 讨 论
3.1 Fiber-2蛋白在毕赤酵母中的优化表达
毕赤酵母(P.pastoris)表达系统生长迅速,产量高,价格便宜易,可以进行高密度发酵,且不具有原核表达的内毒素污染问题。同时该系统已经有现成的工业化发酵平台,技术成熟。因此综合“量”与“质”两方面的考虑,选取毕赤酵母表达系统开发FAdV-4的亚单位疫苗具有广阔的应用前景。尽管毕赤酵母表达系统具有完善的表达调控机制和对表达产物的加工修饰能力,但由于外源基因及表达条件等诸多的因素影响,仍然会有外源蛋白表达量很低,甚至无法表达的问题存在。因此,外源基因的优化、毕赤酵母菌种筛选和诱导条件的改进已成为推进毕赤酵母表达系统成为强有力的外源蛋白表达工具的重要环节[26]。李思齐[22]研究虽然在毕赤酵母中对Fiber-2蛋白进行了外分泌表达,但侧重点在于Fiber-2蛋白的成功表达和保护效果的评价。其研究并未对发酵的工艺进行优化,同时也未能对Fiber-2蛋白的表达量进行准确定量,这限制了毕赤酵母表达的Fiber-2蛋白作为FAdV-4亚单位疫苗的发展。
本研究首先对Fiber-2基因按照酵母密码子进行优化,因为在采用毕赤酵母进行的羟腈裂解酶表达研究中发现,羟腈裂解酶基因在按照酵母密码子进行优化后,可以使表达量提高约140倍[27]。血纤维蛋白溶解酶、乙肝表面抗原(HBsAg)和碱性果胶酸裂合酶的研究结果表明,提高外源基因在酵母基因组中的拷贝数有很的大概率增加外源蛋白的表达水平[28-30]。所以本研究通过不同质量浓度的G418(1、3和5 mg/mL)筛选了高拷贝菌株。接下来本研究通过诱导条件的优化,将培养基上清液中的总蛋白含量从最初的30 mg/L提升到了50 mg/L,最终上清中的重组Fiber-2蛋白含量达到了8.7 mg/L。本文旨在通过发酵工艺的初步优化来提高重组Fiber-2蛋白的产量,以推动毕赤酵母表达系统在FAdV-4亚单位疫苗中的工业化发展进程。
3.2 毕赤酵母优化表达的重组Fiber-2蛋白对国内超强毒力毒株(GD616)的攻击保护效果
本研究中采用的超强毒力的FAdV-4毒株(GD616)是由本研究室分离鉴定的。根据先前的研究结果,该毒株以101.5TCID50接种21日龄的SPF鸡群的死亡率可达90%,并且可以造成肝脏明显的脂肪变性[31]。感染180日龄的SPF鸡可造成60%的发病率和20%的死亡率。本研究采用酵母表达的Fiber-2蛋白亚单位疫苗50 μg免疫的保护率为100%,为进一步验证保护效果,本研究对免疫攻毒后雏鸡进行病理学检测,发现50 μg免疫鸡群可以完全预防心包积液-肝炎综合征(HHS)的发生,同时可以有效阻止超强毒株对于鸡群肝脏的感染和损伤。
大量的研究表明,成功表达Fiber-2蛋白的系统还有很多,如大肠杆菌[11-13]、杆状病毒[14]和293T[16]等,这些表达系统制备的亚单位疫苗免疫鸡群后均可以抵抗2015年国内不同地区的FAdV-4流行毒株,保护率均可达100%,但是对攻毒毒株的强弱程度没有进一步说明。在本研究中,毕赤酵母优化表达的重组Fiber-2蛋白免疫鸡群后使用的是2015年后中国的流行毒株—超强毒力毒株GD616,保护率也可达到100%,充分表明毕赤酵母优化表达的重组Fiber-2蛋白对超强毒株也具有很强的攻击保护力。本研究确定了Fiber-2蛋白对超强FAdV-4毒株攻击保护的高效性,为采用Fiber-2亚单位疫苗对国内流行超强FAdV-4毒株进行有效的防控奠定了基础。

