猪肚菌不同部位的营养评价及风味特征分析
杜佳馨,席嘉佩,方东路,孙海斓,胡秋辉,赵立艳
(南京农业大学食品科技学院,农业农村部食用菌加工重点实验室,南京 210095)
猪肚菌风味独特,因口感如猪肚滑腻而得名,又名大杯伞[Clitocybe maxima(Gaertn. et G. Mey.Fr.)Quél.]或大杯蕈[1],是近年来国内人工驯化的一种珍稀食用菌。猪肚菌具有独特的香味和浓郁的鲜味,而且营养丰富,蛋白质含量高,氨基酸种类齐全,必需氨基酸(essential amino acid, EAA)的数量及组成比一般食用菌更接近模式蛋白,亮氨酸和异亮氨酸含量也为食用菌之首[2]。它还含有多种人体必需的矿质元素,如锌、钼、钴等,另外,猪肚菌中含有的多糖类及三萜类物质还具有增强免疫力、抗氧化和抗肿瘤功效[3]。
猪肚菌是适生于夏季高温季节的木腐性珍稀食用菌,对于解决食用菌生产淡季中菌类缺乏和调节鲜菇市场供应很有意义,其商业化和产业化发展前景广阔。目前对猪肚菌的研究较少,多集中于猪肚菌的人工栽培技术,多糖、凝集素等活性成分的提取和性质的探索等研究:董洪新等[2]、彭智华等[3]对猪肚菌子实体的营养价值和生物学特性与其他食用菌进行了比较研究,结果表明猪肚菌的蛋白质含量较高,更具营养优势与商业开发价值;崔文浩等[4]分别从出菇房搭建、栽培时间、基质配方、菌丝培养等方面总结了猪肚菌的栽培技术;唐青等[5]和胡国元等[6]分别探讨了用不同方法提取水溶性大杯蕈多糖的工艺条件等。除此之外,还包括开发烘干全粉制作菇粉纤维营养饼干、菇纤营养片、菌柄脆片等食品[7],而关于猪肚菌风味的研究鲜有报道。
近年来,食用菌的加工利用可分为3个阶段:第1阶段是食用菌以干鲜蔬菜的形式出售或消费;第2阶段是将食用菌加工成方便食品,如酱料、罐头、腌制食品等;第3 阶段是食用菌类保健食品、功能食品、药品的生产,以及食用菌的菌茎、菌根等副产物的综合利用[8]。猪肚菌作为近年来被开发的珍稀食用菌,除了对子实体直接食用或加工外,对其菌伞、菌柄和菌根的营养成分和风味特性的研究极少,副产物的利用率较低,绝大部分菌根被丢弃或焚烧,不仅浪费资源,而且污染环境。郑若男等[9]对金针菇根进行研究,发现其蛋白质含量达20.51%,略低于子实体部分,根中多酚类物质和麦角硫因含量高于子实体;林忠宁等[10]研究发现真姬菇菇脚的蛋白质含量可达71.50%,氨基酸种类齐全,与子实体一样具有较高的蛋白质含量。这证明了食用菌菌根也具有较高的研究价值。因此,本文通过对猪肚菌3个部位(菌伞、菌柄、菌根)的营养和风味特性进行初步研究,旨在为合理利用猪肚菌提供理论支撑。
近年来,电子舌、电子鼻以及气相色谱-离子迁移谱(gas chromatography-ion mobility spectroscopy,GC-IMS)联用技术在食品风味物质研究方面得到广泛应用。电子舌技术是通过传感器阵列收集样品的特征电信号,以获得样品的感官特性。赵静等[11]利用电子舌分析了香菇菌汤、酶解液及复水原液中滋味成分及呈味特性的变化,发现香菇菌汤与酶解液及复水原液的整体滋味有显著差异。电子鼻可通过特异性电化学传感器分析被测样品的整体气味信息,具有无损、简单、快速的特点[12]。GCIMS 技术是近年来新兴的挥发性物质分析方法,可分析出样品的具体香气成分,具有分辨率高、分析速度快、检测灵敏度高等优点[13]。刘常园等[14]利用电子鼻和GC-IMS 技术对蒸汽复热和微波复热的香菇菌汤挥发性风味化合物的组成及品质进行了分析,发现复热后香菇菌汤气味特征变化显著,并鉴定出56种挥发性物质。因此,通过电子舌和电子鼻对食用菌的滋味和气味轮廓进行分析,进一步采用GC-IMS 对挥发性风味成分进行测定,可以对猪肚菌的风味研究起到验证及补充作用。
为探究猪肚菌中的营养成分、矿质元素、风味轮廓及重要挥发性化合物在菌伞、菌柄和菌根部位的区别,本研究参照国家标准对样品中的基本营养成分、矿物质进行测定和分析,并通过GC-IMS、电子鼻和电子舌分别探讨猪肚菌不同部位的气味和滋味轮廓的区别,为猪肚菌的营养与风味研究、产业化应用提供理论基础和科学依据。
1 材料与方法
1.1 材料与试剂
新鲜猪肚菌:购于贵州剑荣菌业有限公司。
石油醚(petroleum ether,AR),南京化学试剂股份有限公司;苯酚(≥98.0%)、浓硫酸、浓盐酸、无水葡萄糖、硼酸、硫酸钾、硫酸铜、氢氧化钠,乙醇、甲基红、溴甲酚绿均为分析纯,南京晚晴化玻仪器有限公司。
1 000µg/mL铅(Pb)单元素标准储备溶液(产品编号:GBW08619)、1 000µg/mL镉(Cd)单元素标准储备溶液(GBW08612)、1 000µg/mL 砷(As)单元素标准储备溶液(GBW08611),国家标准物质中心;硝酸(优级纯),上海国药集团化学试剂有限公司;质谱调谐液(10µg/L钇)、内标液(100µg/mL钪、铋、铑),美国Agilent 公司。实验用水为用Millipore-Q 纯水仪(美国Millipore公司)制备的超纯水(电阻率≥18.2 MΩ·cm)。C4~C9N-酮类化合物混标液,上海西格玛奥德里奇贸易有限公司。
1.2 仪器与设备
Multiwave Pro微波消解仪(附有聚四氟乙烯消解罐),奥地利Anton Paar 公司;iCAP Qc 电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometer,ICP-MS),美国Thermo Fisher Scientific公司;Millipore-Q纯水仪,美国Millipore公司;配有FlavourSpec®风味分析仪的H1-00053型气相色谱-离子迁移谱仪,德国GAS 公司;PEN3 电子鼻系统,德国AIRSENSE公司;SA-402B味觉分析系统(电子舌),日本Insent 公司;70-2 型切片机,加拿大MSC International 有限公司;JYL-C022E 匀浆机,山东省九阳股份有限公司;DM-4型电子天平,上海精天电子仪器有限公司;L-8900 型氨基酸自动分析仪,日本日立公司。
1.3 实验方法
1.3.1 样品制备
新鲜猪肚菌:将新鲜猪肚菌的菌伞、菌柄、菌根(即猪肚菌的根部位置)制备成0.5 cm×0.5 cm×2.0 mm 的颗粒。分别称取2.0 g 上述3 个部位样品于20 mL 顶空瓶中,用于GC-IMS 检测和电子鼻检测;分别称取2.0 g 新鲜样品,加入50 mL 蒸馏水后打浆,以5 500 r/min 离心15 min 后,取上清液定容至100 mL容量瓶中,用于电子舌检测。
1.3.2 营养成分检测
猪肚菌营养成分检测按照国家标准中的方法进行。蛋白质含量按照GB 5009.5—2016 检测,水分含量按照GB 5009.3—2016 检测,灰分含量按照GB 5009.4—2016 检测,总糖含量按照GB/T 15672—2009 检测,粗脂肪含量按照GB 5009.6—2016检测。
1.3.3 矿质元素含量检测
称取固体样品0.2 g(精确至0.001 g)于微波消解罐内杯中,加入5 mL 硝酸,加盖放置1 h,旋紧罐盖,按照微波消解仪标准操作步骤(表1)进行消解。冷却后取出,缓慢打开罐盖排气,用少量水冲洗内盖,将消解罐放在控温电热板上,于100 ℃条件下加热30 min,用水定容至25 mL,混匀后备用,同时做空白实验。
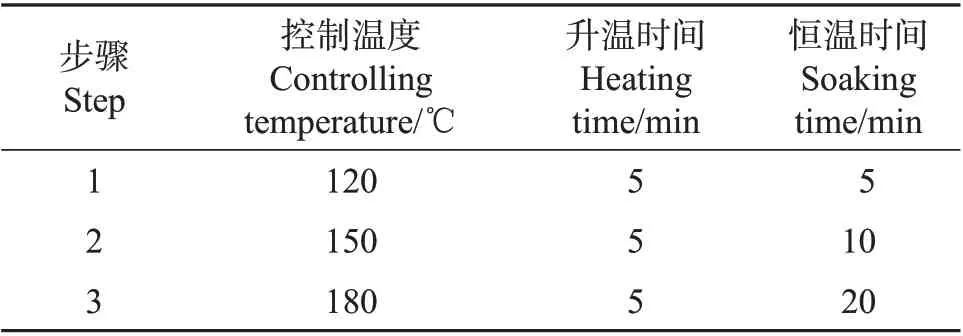
表1 微波消解仪操作步骤Table 1 Operating steps of the microwave digester
设置电感耦合等离子体质谱仪操作条件(表2),将空白溶液和试样溶液分别注入电感耦合等离子体质谱仪中,测定待测元素和内标元素的信号响应值,根据标准曲线得到消解液中待测元素的浓度。

表2 电感耦合等离子体质谱仪操作条件Table 2 Operating conditions of ICP-MS
1.3.4 GC-IMS 检测
GC-IMS条件:色谱柱温度60 ℃,以纯氮气(纯度为99.999%)为载气;反应程序为初始载气流量2 mL/min 并保持2 min,将流量在8 min 内增加到20 mL/min,然后以18 mL/min 将流量上升至100 mL/min,最后,以5 mL/min 继续上升到150 mL/min,总运行时间31 min,分析时间为30 min。
经GC-IMS 检测得到的挥发性化合物,结合保留时间和离子迁移时间,通过质谱(mass spectrum,MS)与美国国家标准与技术研究所(National Institute of Standards and Technology,NIST)(2014)的数据库进行比对,鉴定和确认挥发性化合物种类。基于C4~C9N-酮类化合物混标的保留时间和迁移时间,建立拟合曲线,用于挥发性物质的定性分析。
1.3.5 电子舌检测
采集温度25 ℃,基准液包括30 mmol/L 氯化钾、0.3 mmol/L 酒石酸;正极清洗液(混合7.46 g 氯化钾、500 mL蒸馏水、300 mL乙醇、0.56 g氢氧化钾后定容至1 L);负极清洗液(混合500 mL 蒸馏水、300 mL乙醇、8.3 mL盐酸后定容至1 L)。设置样品测试循环5次,每次测量样品前清洗传感器10 s。
取20 mL样品溶液于特定容器内进行测定。传感器在3 组基准液中分别清洗90、120、120 s,平衡位置归零30 s,达到平衡后进样测试30 s,在另外2组基准液中再清洗3 s,传感器在新的基准液中测试回味30 s。循环测试5次,取用后4次检测结果。
1.3.6 电子鼻检测
准确称取2.000 0 g样品于顶空瓶中,在50 ℃水浴中加热10 min后用于电子鼻检测。
检测参数:室温25 ℃,吸气速率300 mL/min,数据获取持续时间120 s,清洗时间95 s。样品重复测定4次。
(3)新规则成套动作评判要素突出成套总体设计、舞蹈编排内容的创新性、原创性和队形变化的多样性和流动性。
PEN3 电子鼻10 个传感器的性能描述如表3所示。
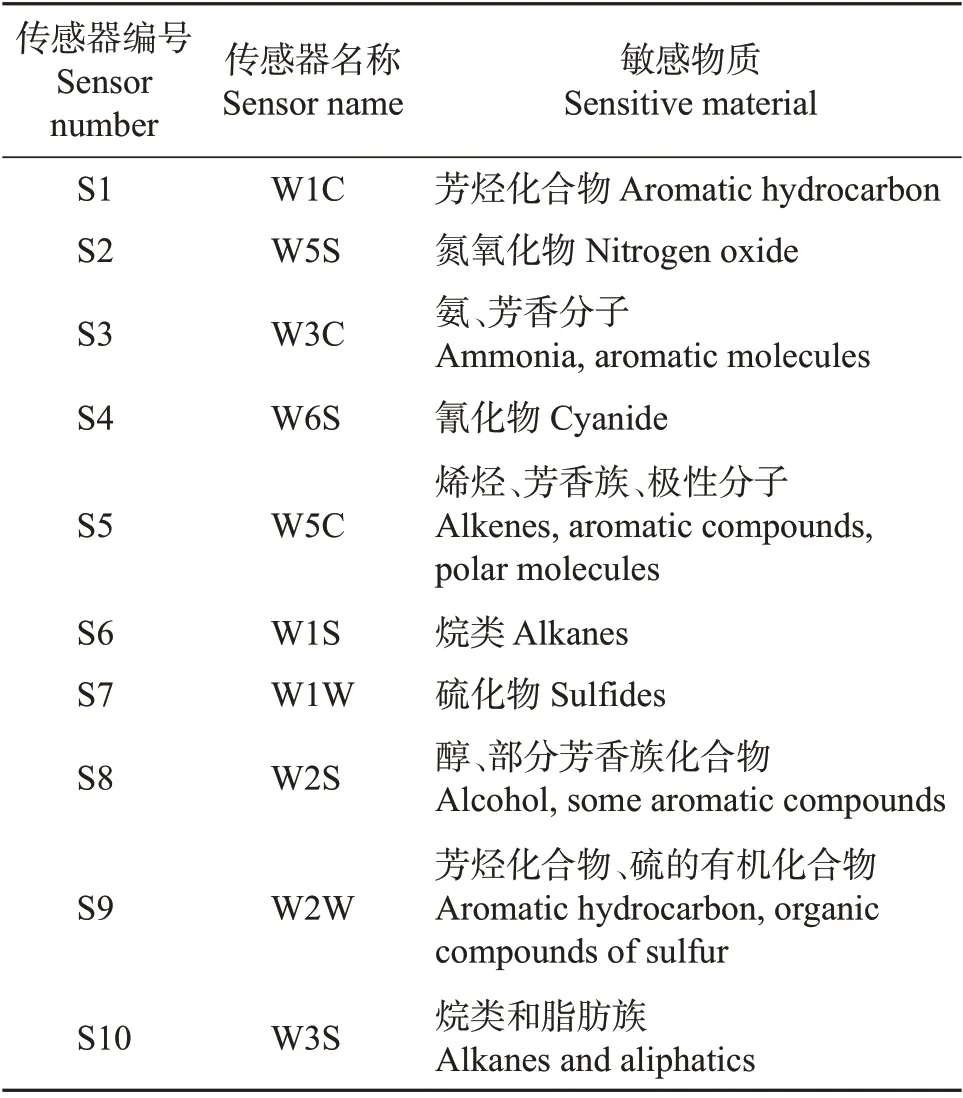
表3 PEN3电子鼻传感器性能描述Table 3 Performance descriptions of PEN3 electronic nose sensor
1.3.7 总氨基酸(total amino acid,TAA)含量的测定
准确称取研磨充分的新鲜猪肚菌0.200 0 g(以干质量计)到水解管中,加入15 mL 6 mol/L 的浓盐酸溶液充分混匀,充氮气后封管,在(110±1)℃的电热鼓风恒温箱中水解22 h,取出后冷却至室温。打开水解管过滤至50 mL 容量瓶中,用少量水多次冲洗水解管,最后用蒸馏水定容至刻度线,混匀后备用。准确吸取10 mL 滤液,置于旋转蒸发器中,在60 ℃条件下抽真空蒸发至干,再用10 mL 0.02 mol/L稀盐酸复溶,振荡均匀,经0.22µm有机滤膜过滤至样品瓶中,通过氨基酸自动分析仪进行氨基酸含量测定。每个样品重复检测3次,测定结果取平均值。
1.4 数据分析
利用SPSS 23.0 软件对实验数据进行显著性分析和多重比较等,以P<0.05 表示差异有统计学意义;采用Origin 2019 对实验结果绘图。采用LAV(Laboratory Analytical Viewer)软件中的Reporter、GalleryPlot 插件以及GC-IMS 库搜索软件,对GCIMS结果进行化学计量学分析。
2 结果与分析
2.1 猪肚菌不同部位的营养物质分析结果
由表4的测定结果可知,猪肚菌营养丰富,含有40.81%~50.84%的总糖、19.60%~26.69%的蛋白质和2.84%~5.03%的粗脂肪。对其不同部位进行分析发现,猪肚菌的菌伞、菌柄、菌根3部位的灰分含量差异不显著;菌根的水分含量比菌伞少7.85%;菌柄的总糖含量最高,向莹等[15]通过对比金针菇子实体和菇柄的营养组成,发现金针菇菌柄中粗纤维含量比子实体高42.13%,故推测猪肚菌菌柄中也含有丰富的膳食纤维;菌伞、菌根的脂肪含量显著大于菌柄,菌伞、菌根的脂肪含量无显著性差异;猪肚菌的菌伞、菌柄和菌根的蛋白质含量差异明显,含量呈递减趋势,其中菌伞的蛋白质含量比菌根多52.78%。
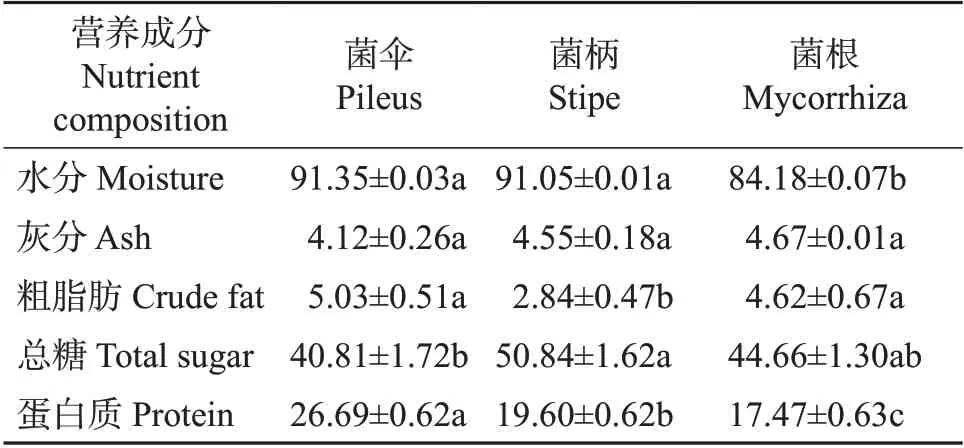
表4 新鲜猪肚菌不同部位的营养成分Table 4 Nutrient compositions in different parts of fresh C.maxima%
2.2 猪肚菌不同部位的矿质元素测定结果
采用ICP-MS 法对新鲜猪肚菌不同部位的13种矿质元素含量进行了系统检测,其中包括4 种人体必需的常量元素钾(K)、镁(Mg)、钙(Ca)、钠(Na),5 种微量元素锌(Zn)、铁(Fe)、铜(Cu)、硒(Se)、锡(Sn)以及4 种有害重金属元素Cd、Pb、铬(Cr)、汞(Hg),检测结果如表5所示。从中可知,猪肚菌菌伞、菌柄和菌根均含上述13 种矿质元素,但不同部位的各元素含量不同。在4 种常量元素中,K平均含量最高,此外依次为Na、Ca、Mg;菌柄的K含量明显低于菌伞和菌根,但菌柄中Ca 和Na 的含量却明显高于其他2部位;Mg的含量由菌伞到菌根依次降低。5 种微量元素的平均含量由高到低为Fe>Zn>Sn>Se>Cu,其中Cu 在猪肚菌不同部位分布较均匀,Zn、Se 在菌伞中含量较高,与DOWLATI 等[16]对食用菌中有毒重金属浓度的系统综述一致。通过与刘仙金[17]对常见的14 种食用菌中矿质元素含量的检测结果进行对比发现,猪肚菌菌伞中的Zn 含量比大部分食用菌高;菌根中的Fe含量最高,高于银耳、杏鲍菇、猴头菇、黄金菇子实体,这些差异可能与种植食用菌的基质配方和不同部位富集元素的能力有关。
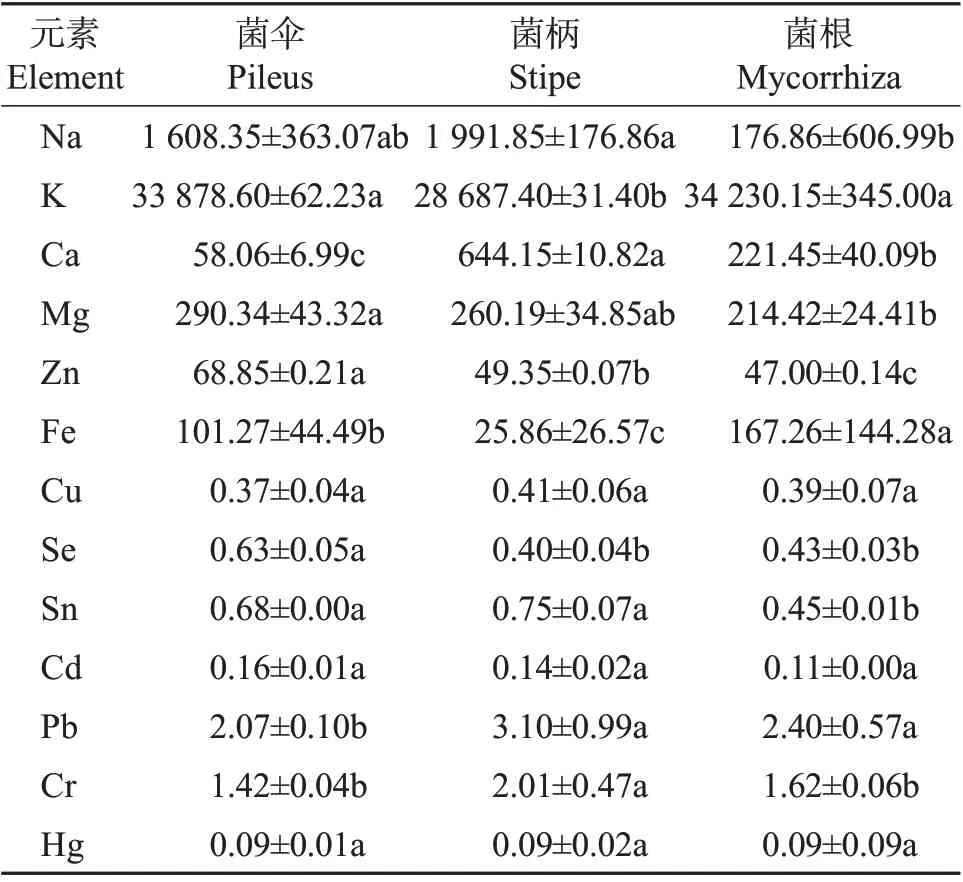
表5 新鲜猪肚菌不同部位矿质元素含量Table 5 Contents of mineral elements in different parts of fresh C.maximamg/kg
根据GB 2762—2017[18],食用菌及其制品中重金属元素质量分数需符合w(Cd)≤0.5 mg/kg、w(Hg)≤0.1 mg/kg、w(Pb)≤1.0 mg/kg以及w(Cr)≤0.5 mg/kg。比较猪肚菌3个部位的4种重金属元素后发现,Pb、Cr含量出现不同程度超标,推测可能有2方面原因:一是土壤中Pb、Cr重金属含量较高;二是食用菌对Pb、Cr的富集能力较其他元素强。而Cr分为有害铬(六价)和有益铬(三价)2 种形态,多数以三价铬的形态存在[19],二者可以相互转化。三价铬是人体必需的微量元素,是葡萄糖耐量因子的主要组成部分;六价铬由于其氧化性和对皮肤的高渗透性,对人体危害很大,具有较强的致癌作用。采用ICP-MS 法所得结果仅可获得总铬含量,无法区分不同形态铬的含量[20]。猪肚菌中Cd和Hg含量均未超标,且在猪肚菌3个部位之间分布均匀。
2.3 猪肚菌不同部位的总氨基酸测定结果
采用氨基酸自动分析仪对新鲜猪肚菌不同部位样品的氨基酸含量进行测定,结果如表6所示,新鲜猪肚菌所含氨基酸种类丰富,且各部位氨基酸含量间均存在显著性差异(P<0.05)。菌伞含有16种氨基酸,其中必需氨基酸8 种,非必需氨基酸(nonessential amino acid, NEAA)8 种,氨基酸总量达到358.64 mg/g;菌柄和菌根含有15 种氨基酸,蛋氨酸(甲硫氨酸)仅存在于菌伞中,是影响猪肚菌蛋白质评价的第一限制氨基酸;菌根中含有的必需氨基酸和非必需氨基酸的量均为最低,分别是36.22 和50.19 mg/g,约是菌伞的1/4、菌柄的1/2。此外,新鲜猪肚菌各个部位样品中含量最高的氨基酸是谷氨酸,与马长中等[21]在林芝地区采集到的2 种橙黄疣柄牛肝菌样品中的结果一致。
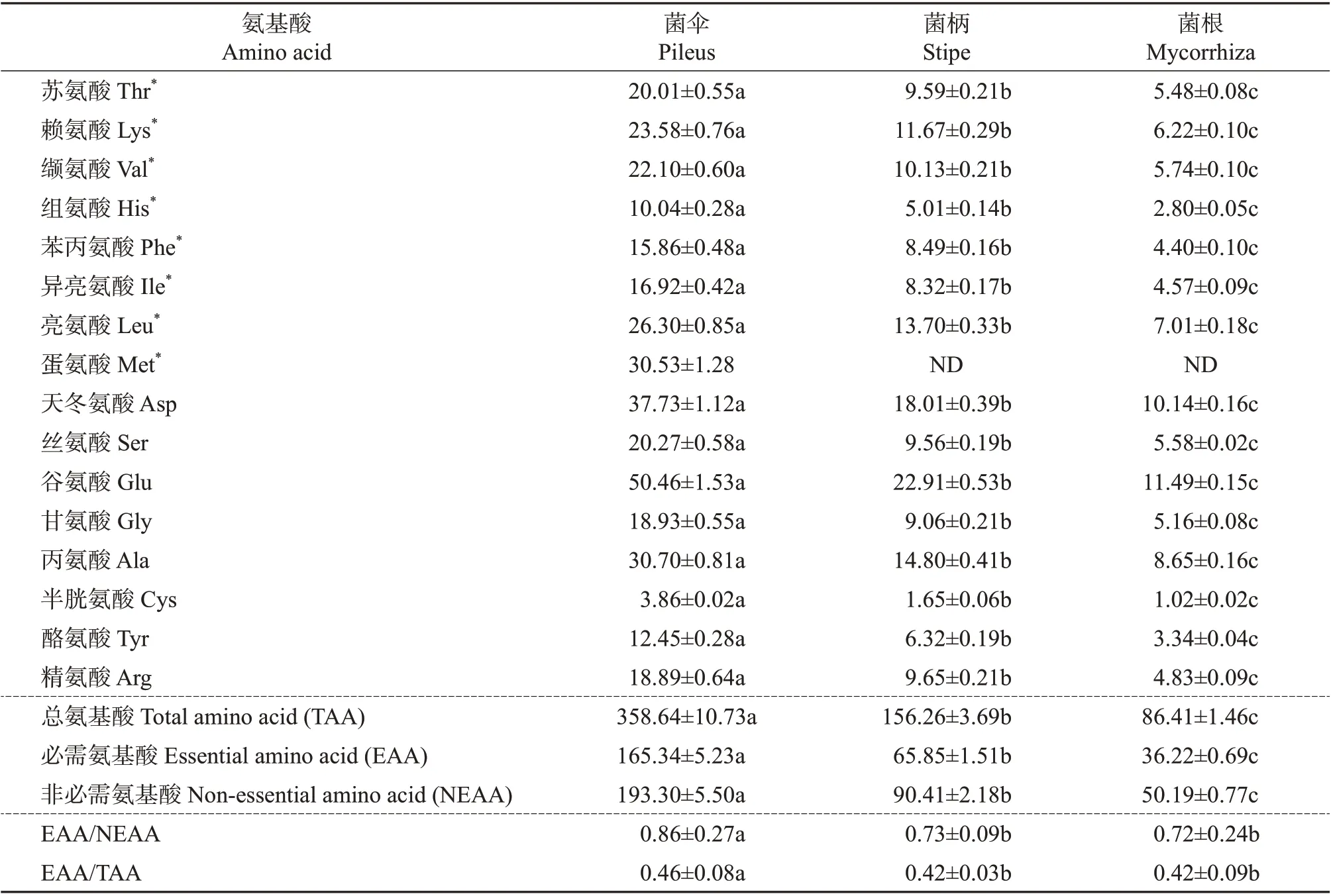
表6 猪肚菌不同部位酸水解氨基酸分析结果(以干质量计)Table 6 Analysis results of acid hydrolyzed amino acids in different parts of C.maxima(by dry mass)mg/g
根据联合国粮农组织/世界卫生组织(Food and Agriculture Organization of the United Nations,FAO/World Health Organization, WHO)提出的理想蛋白模式中EAA/TAA 为0.40 左右,EAA/NEAA 在0.60以上时蛋白质质量较好[22]的原则判断,表7 中新鲜猪肚菌菌伞、菌柄和菌根的氨基酸组成均大于理想蛋白均衡值,其中菌伞的EAA/NEAA 达到0.86,EAA/TAA达到0.46,最符合理想蛋白标准;此外,根据猪肚菌的生长形态特征,其较长的菌柄也是优质蛋白质的来源。
食用菌中蛋白质的营养价值,不仅与蛋白质的含量、氨基酸的种类有关,还与必需氨基酸的组成有关。氨基酸比值系数法是食品中氨基酸营养评价的常用方法[23],食用菌中蛋白质的氨基酸组成与WHO/FAO 模式谱越接近,人体越容易吸收该类营养物质。由表7 可知,菌伞的各必需氨基酸组成比例均高于对应的WHO/FAO 模式谱,其中半胱氨酸+蛋氨酸(Cys+Met)的占比最高,可达9.59%,而菌柄和菌根中Cys+Met 占比低于WHO/FAO 模式谱,与菌伞有显著性差异。
2.4 猪肚菌不同部位的电子鼻分析结果
电子鼻利用气体传感器阵列对特殊气体分子的敏感性来识别样品中简单和复杂的气味成分,可以客观地判断不同样品间的挥发性气味是否具有差异性。为了探讨猪肚菌不同部位挥发性风味物质的异同,采用电子鼻对其风味进行分析。图1 为电子鼻10 个传感器对猪肚菌不同部位的挥发性气味响应值的雷达图,每个坐标轴代表一种金属传感器类型,坐标轴上的点代表样品在该轴上的香气响应强度,并与相邻的点连接形成闭环[24]。
由图1 和表3 可知,每组样品的挥发性气味轮廓图除了对W5S、W6S、W2S 这3 个传感器的响应不显著外,对剩余的7 个传感器的响应都具有差异性。菌柄和菌根在W1W、W2W、W1S这3个传感器上均得到了较大的感应值,其次是菌伞,说明W1W、W2W、W1S对新鲜猪肚菌不同部位顶空气体的信号响应最敏感,推测可能是含硫氧化合物、芳香成分和有机硫化物对样品的各部位风味起重要作用;而在W1C、W3C、W5C 这3 个传感器上,菌伞的响应值明显大于菌柄和菌根,说明菌伞的挥发性风味物质中可能含有更多的烯烃、极性分子和芳香类化合物。

图1 新鲜猪肚菌菌伞、菌柄、菌根的电子鼻响应值雷达图Fig.1 Radar diagram of electronic nose response values of pileus,stipe and mycorrhiza in fresh C.maxima
为进一步分析猪肚菌不同部位样品间的差异,基于电子鼻雷达图反映出的评价结果,选择样品中10 种传感器所测的电子鼻响应值进行主成分分析(principal component analysis, PCA)和线性判别分析(linear discriminant analysis, LDA)。由图2A 可知:主成分1(principal component 1,PC1)和主成分2(PC2)的贡献率分别为88.30%和8.28%,累积贡献率为96.58%,超过了85%,表明PC1和PC2这2种主成分包含了猪肚菌气味物质的大部分信息,可以充分反映样品的整体气味特征。其中,菌柄和菌根主成分图之间有部分重叠,说明菌柄和菌根之间香气组成较为相似,与菌伞的香气特征略有不同。由图2B可知:第一线性判别因子(LD1)和第二线性判别因子(LD2)的贡献率分别为87.36%和3.50%,总贡献率为90.86%,表明电子鼻的LDA 能有效识别不同样品间的气味差异,可以对猪肚菌不同部位挥发性成分进行较好区分。其中,菌伞分布在图的最左侧,距离菌柄和菌根较远,说明菌伞与其他部位的挥发性风味物质差异最大,区分最显著;同时,代表菌柄和菌根的分类集之间间隔较远且彼此无重叠,说明菌柄和菌根之间的挥发性风味物质也有显著差异。综上所述,通过LDA对电子鼻分析的结果进行降维处理后,猪肚菌不同部位的气味特征可以被清楚区分。
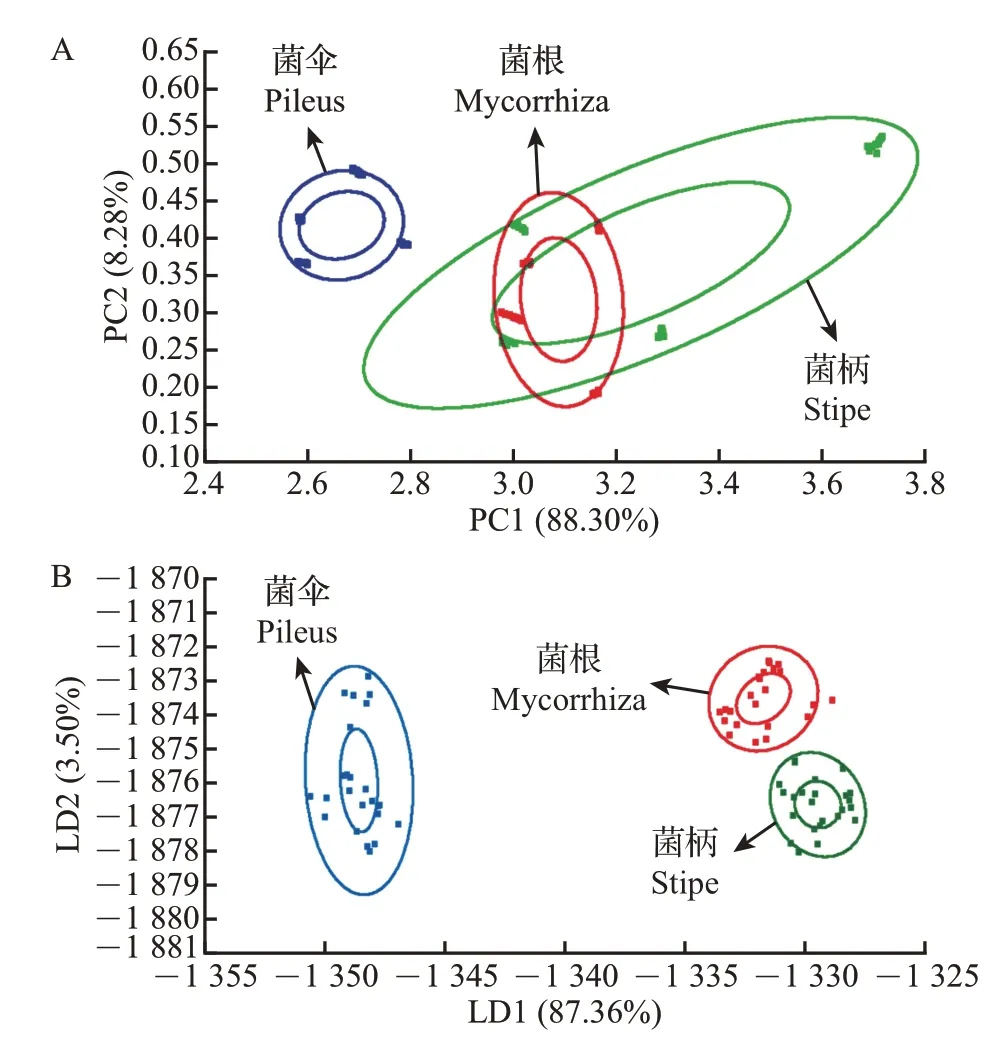
图2 基于电子鼻的猪肚菌菌伞、菌柄、菌根的整体风味分析Fig.2 Analysis of the overall flavors of pileus, stipe and mycorrhiza in C.maxima based on the electronic nose
2.5 猪肚菌不同部位的电子舌滋味分析结果
电子舌是根据生物味觉模式建立起来的一种基于化学传感器和模式识别的液体分析仪器,由5个味觉传感器组成,能够检测酸味、苦味、涩味、鲜味和咸味物质[25]。利用SA-402B 电子舌系统评价新鲜猪肚菌不同部位样品之间的滋味特征差异,结果如图3 所示。从中可知:新鲜猪肚菌的菌伞、菌柄、菌根的滋味轮廓比较接近,说明猪肚菌所含的非挥发性化合物在各部位均匀分布,每一个样品均对苦味传感器的响应值最大,然后依次是丰富度、苦味回味、涩味回味、涩味、鲜味、咸味,最低的是酸味。推测可能是猪肚菌中某些苦味萜类物质、生物碱类物质或酚类物质发挥了作用,并且含有较少的有机酸等酸性成分,而高丰富度可能是因为各味觉物质之间存在一定的相互作用,例如可溶性糖醇的种类及含量、不同游离氨基酸共同作用或氨基酸与核苷酸协同增效作用等。
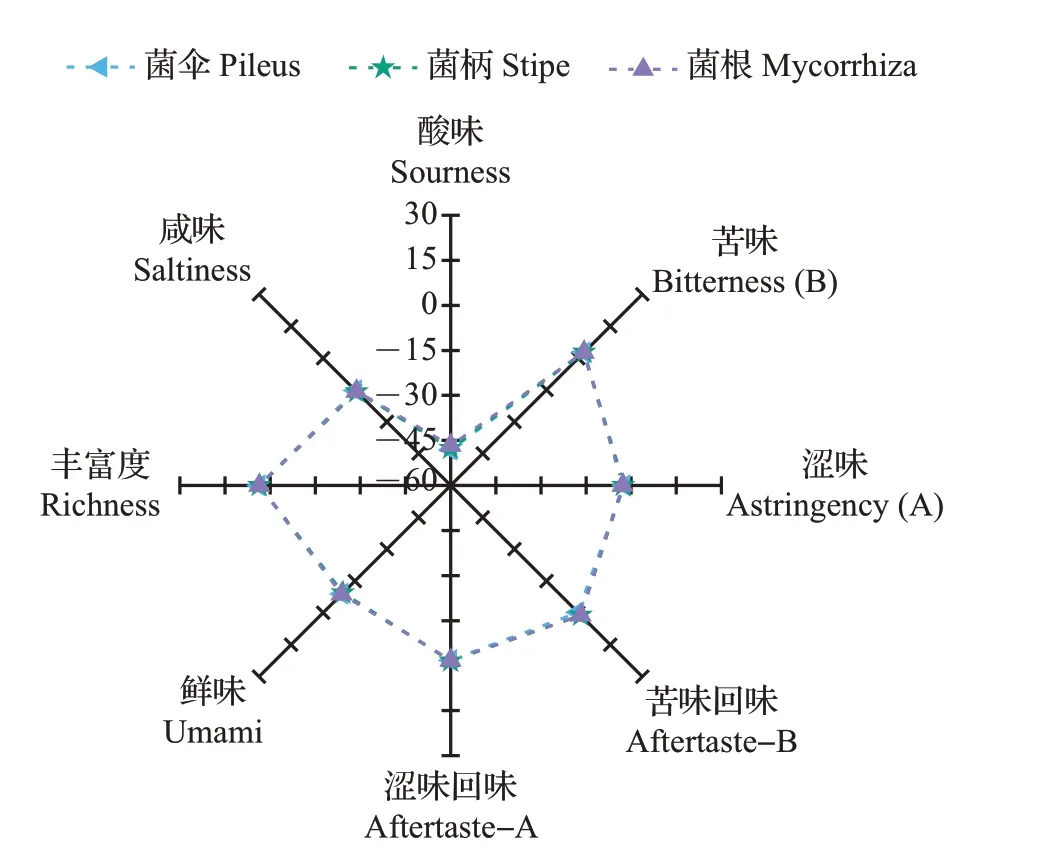
图3 基于电子舌的新鲜猪肚菌菌伞、菌柄、菌根的整体滋味轮廓分析Fig.3 Analysis of the overall taste profiles of pileus, stipe and mycorrhiza in fresh C. maxima based on the electronic tongue
2.6 猪肚菌不同部位氨基酸含量分析结果
野生食用菌的蛋白质含量高、风味化合物组成丰富,烹饪等加工方式可使食用菌中蛋白质降解为短肽和游离氨基酸,这些氨基酸由于本身不同的呈味特征,可呈现出鲜味、甜味、苦味和无味4大类[26]。呈鲜味氨基酸包括天冬氨酸(Asp)和谷氨酸(Glu),呈甜味氨基酸包括丝氨酸(Ser)、甘氨酸(Gly)、苏氨酸(Thr)、丙氨酸(Ala)和脯氨酸(Pro),呈苦味氨基酸包括异亮氨酸(Ile)、酪氨酸(Tyr)、组氨酸(His)、亮氨酸(Leu)、苯丙氨酸(Phe)、缬氨酸(Val)、蛋氨酸(Met)、赖氨酸(Lys)和精氨酸(Arg)。新鲜猪肚菌不同部位样品中呈味氨基酸含量见图4。从中可知,菌伞、菌柄和菌根所含的3种呈味氨基酸含量存在显著差异(P<0.05),菌伞的呈味氨基酸含量最高,其次是菌柄和菌根。猪肚菌3 个部位样品的苦味氨基酸含量均较高,和图3 中电子舌的检测结果一致,其中菌伞的苦味氨基酸含量最高,达到176.68 mg/g;菌伞的鲜味氨基酸和甜味氨基酸的含量之间无显著差异;菌根中鲜味氨基酸的含量最低。由此可见,菌伞整体的呈味氨基酸含量较高,食用品质更好。
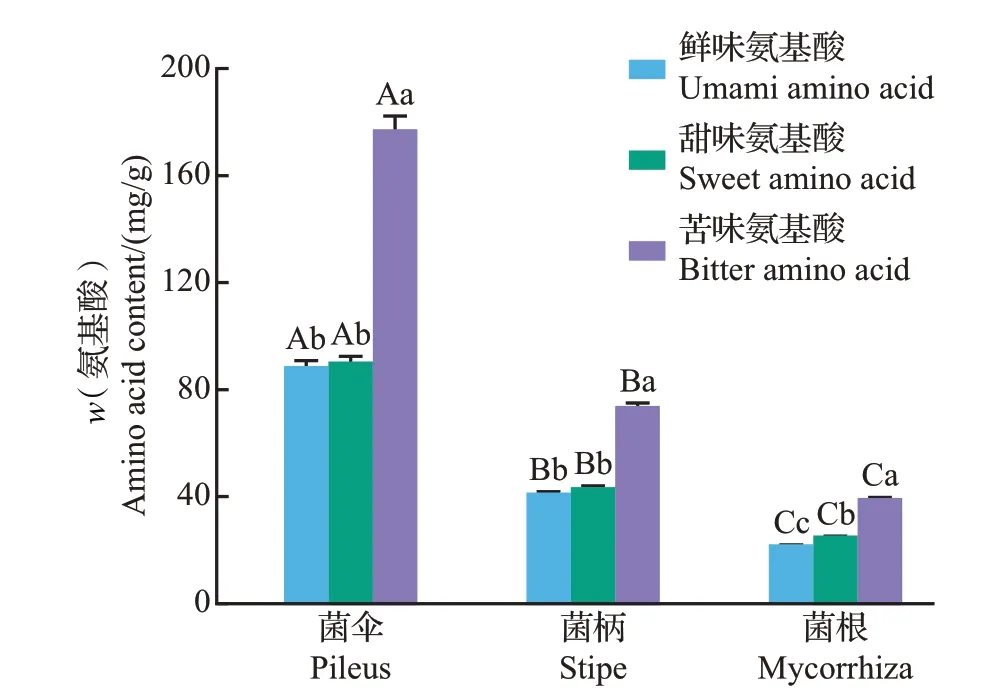
图4 新鲜猪肚菌菌伞、菌柄、菌根中呈味氨基酸含量分析Fig.4 Analysis of flavor amino acid contents of pileus, stipe and mycorrhiza in fresh C.maxima
2.7 猪肚菌不同部位的GC-IMS 分析
为了更加清晰地比较样品间的差异,采用差异对比模式,建立猪肚菌菌伞、菌柄、菌根中特征风味的GC-IMS二维谱图(图5):当选取猪肚菌菌伞作为参比时,其他样品的谱图扣减参比,若二者挥发性有机物一致,则扣减后的背景为白色,若为红色则代表该物质的浓度高于参比,若为蓝色则代表该物质的浓度低于参比。从中可知,在保留时间500~700 s、离子迁移时间1.2~1.7 ms 范围(图中黄色框区域)以及保留时间100~300 s、离子迁移时间1.4~1.6 ms范围(图中红色框区域)内,猪肚菌菌伞、菌柄、菌根的挥发性物质的种类和浓度存在明显差异,推测可能存在对新鲜猪肚菌的菌伞、菌柄和菌根3 部分样品的区分起重要作用的关键气味活性化合物。
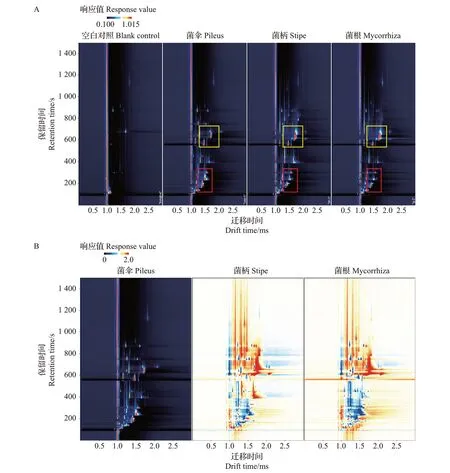
图5 新鲜猪肚菌菌伞、菌柄、菌根特征风味的GC-IMS二维谱图Fig.5 GC-IMS two-dimensional spectrograms of characteristic flavor of pileus,stipe and mycorrhiza in fresh C.maxima
为了直观地获取猪肚菌3个不同部位样品的挥发性风味组分的信息,利用GC-IMS Library Search插件对标记的离子峰进行检索,可以定性检出84种挥发性风味物质,结果如附表1(http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2021.05.111)所示。其中部分浓度高的化合物会产生二聚体,它们的保留时间与单体相近,因迁移时间不同而被区分开。84种已定性物质中包含24种醛类、25 种醇类、13 种酮类、7 种酯类、8 种烯类、1 种酸类以及6种其他类。
为更直观且定量地比较猪肚菌不同部位样品中的挥发性化合物差异,采用GC-IMS 设备内置LAV 软件的GalleryPlot 插件,自动生成新鲜猪肚菌不同部位的指纹图谱,结果如图6所示:图中每一行代表猪肚菌同一个部位样品中所含的挥发性化合物种类,每一列代表不同部位样品之间同一种挥发性化合物的差异,颜色的深浅代表挥发性化合物含量的高低,颜色越深,则含量越高,反义亦然。图7是采用GC-IMS 中检测到的各类物质的色谱峰面积来定量描述猪肚菌不同部位样品中挥发性物质的分布,色谱峰面积越大,代表该类物质含量越高。
由图6 和图7 可知,猪肚菌各部位样品中醛类和醇类化合物的含量占总体挥发性风味化合物的比例较大,菌根中的醛类、醇类、酯类及其他物质的含量都显著高于菌伞和菌柄,菌柄中只有酮类物质含量比菌伞和菌根高。

图6 基于GC-IMS的猪肚菌不同部位样品中挥发性物质的指纹图谱Fig.6 Fingerprints of volatile substances in different parts of C.maxima samples based on GC-IMS
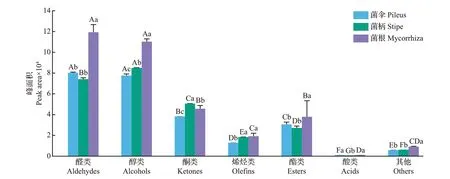
图7 基于GC-IMS的猪肚菌不同部位样品中挥发性物质的分布Fig.7 Distributions of volatile substances in different parts of C.maxima samples based on GC-IMS
有研究表明,食用菌中重要的风味物质多为八碳化合物和含硫化合物[27]。本研究发现,1-辛烯-3-醇(D)、1-辛烯-3-醇(M)、1,3-辛二烯(M)、1,3-辛二烯(D)、苯乙烯、1-辛烯-3-酮(M)、1-辛烯-3-酮(D)、3-辛酮(M)、3-辛酮(D)、己酸乙酯、2,4-二甲基己烷这11种物质属于八碳化合物,3-甲硫基丙醛(M)和3-甲硫基丙醛(D)是含硫化合物,而醛、酮、酯、酸类等与它们互补调和,使猪肚菌呈现出特殊的香味。
1-辛烯-3-醇(D)在菌伞样品中含量偏高,说明菌伞可呈现出更浓郁的蘑菇味[28]和泥土的清香味;1,3-辛二烯(M)、1,3-辛二烯(D)和苯乙烯在菌伞中含量较高,说明菌伞中这3 种烯烃类物质对风味的贡献率较大;3-甲硫基丙醛(M)、3-甲硫基丙醛(D)仅在菌伞中被检测出来,由于醛类化合物风味阈值比较低且存在叠加效应,风味特征明显[29],所以二者是猪肚菌菌伞的重要挥发性风味成分;此外,脂类物质中己酸乙酯、2-甲基丁酸异戊酯(M)、2-甲基丁酸异戊酯(D)、2-甲基丁酸甲酯这4 种酯类化合物会赋予菌伞甜香气味和轻微油脂气味[30]。
菌柄风味主要以2-丁氧基乙醇(M)、3-甲基-1-戊醇、1-丁醇(D)等醇类物质为主,且菌柄中庚醛(M)的含量也高于菌伞和菌根,而庚醛具有强烈的油脂气味[31]。
菌根中3-甲基-1-戊醇、1-丁醇(D)、1-辛烯-3-酮(D)、E-2-壬烯醛、庚醛(D)、3-甲基丁醛(M)、E-2-辛烯醛(D)、2-庚酮(D)和环己酮(D)含量高于菌伞和菌柄,其中1-辛烯-3-酮(D)属于八碳化合物,是菌根的主要风味物质,其气味阈值较低,对风味影响较大,IGLESIAS 等[32]研究表明,该物质多通过不饱和脂肪酸或微生物的氧化以及氨基酸降解生成,具有花果香气;E-2-壬烯醛、3-甲基丁醛(M)等有着浓烈的气味,低、中和高碳位数的醛类分别赋予菌根刺激性气味、油脂味和柑橘皮的香味[33]。
各类物质中,2-己醇(M)、2-己醇(D)、3-甲基-1-戊醇(M)、3-甲基-1-戊醇(D)、正己醇(M)、正己醇(D)、3-甲基-1-戊醇(M)、5-甲基-2-呋喃甲醇、1-辛烯-3-醇(M)、戊醛(D)和E-2-辛烯醛(M)是猪肚菌3个部位样品的共有物质。各类杂环化合物在猪肚菌3个部位样品中无显著差异,包括3-甲基吡啶、1,2-二甲氧基乙烷等物质。研究表明,杂环化合物(如呋喃和吡嗪类)是食用菌独特香气的来源,气味强度较高[34],而LDA 结果表明猪肚菌不同部位的挥发性风味物质可以被明显区分开,说明三者的共有物质对风味的贡献度较低,不属于特征风味物质。
综上所述,猪肚菌菌伞中的风味化合物的种类最多,其中3-甲硫基丙醛的单体和二聚体是菌伞的特征风味化合物;菌根中的1-辛烯-3-酮(D)和醛类物质含量较高,共同赋予菌根独特的风味;而菌柄中的风味化合物以醇类物质为主,其对菌柄的风味贡献度较低。
3 结论
在营养成分方面,猪肚菌含有40.81%~50.84%的总糖、19.60%~26.69%的蛋白质和2.84%~5.03%的粗脂肪。其中,菌伞中水分、脂肪、蛋白质含量更高,最符合理想蛋白标准,且蛋氨酸仅存在于菌伞中。另外,猪肚菌中富含K、Mg、Ca、Na、Zn、Fe等多种矿质元素,且不同部位的元素含量不同。
在风味特性方面,猪肚菌的不同部位均苦味明显而酸味值较低,但不同部位的挥发性风味有所不同。通过GC-IMS 可以定性检出84 种挥发性风味物质,其中菌伞中有23种风味化合物的含量相对较高,3-甲硫基丙醛的单体和二聚体是菌伞独有的特征风味化合物,同时1,3-辛二烯(M)、1,3-辛二烯(D)和苯乙烯这3种烯烃类物质也对菌伞风味的贡献度较大。菌根中有11 种风味化合物含量相对较高,1-辛烯-3-酮(D)和醛类物质是菌根的特征风味化合物。菌柄中相对含量较高的风味化合物种类最少。
该研究还建立了新鲜猪肚菌不同部位的挥发性气味物质指纹图谱,可视化地呈现了猪肚菌不同部位的挥发性物质轮廓,为猪肚菌的深度开发和产业化应用提供了科学依据。

