常见有毒气体实验演示仪
——以SO2气体为例
湖北省十堰市房县第一高级中学(442100) 闻 奎
1 教材实验的不足
人教版高中化学必修教材第2册第5章第1节安排了2个实验,具体如下:
实验1:如图1所示,把充满SO2气体、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验2使用)。

图1 二氧化硫溶于水
实验2:如图2所示,用试管取2 mL实验1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液颜色的变化。
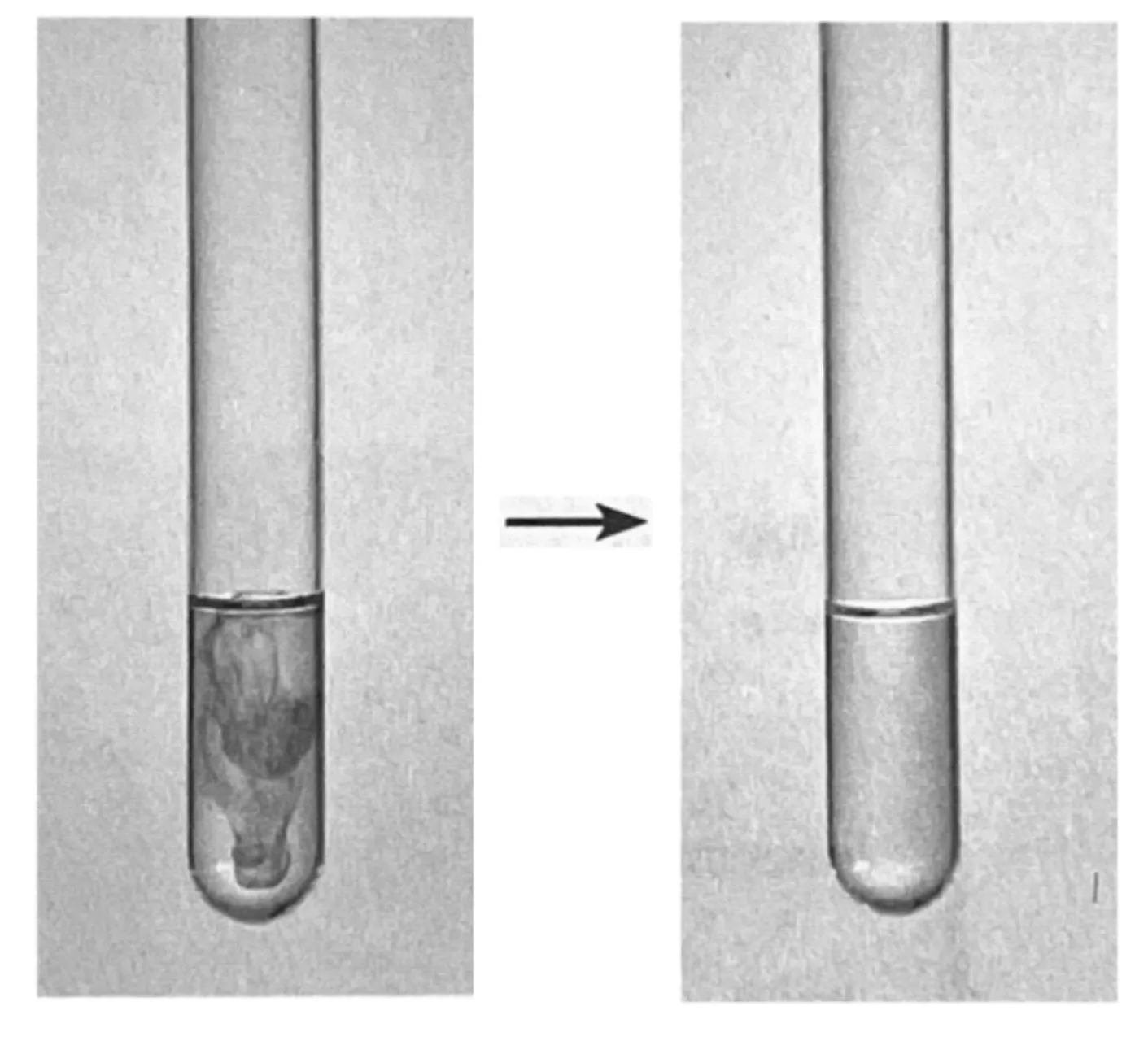
图2 二氧化硫的漂白作用
上述两个实验在实际教学过程中存在以下3点不足:①SO2气体有毒,用试管收集干燥的SO2时操作难度大,若未集满,溶于水时液面上升不多,液体变色不明显;②从水中取出试管和加热褪色后的品红溶液时均会释放出SO2气体,污染空气;③没有SO2气体的氧化性和还原性实验,不利于学生从化合价的角度认识物质的性质,不利于建构物质性质知识模型。
2 实验装置的制作
2.1 实验用品
输液管5根、双头输液管1根、250 mL输液袋1个、输液袋改装的750 mL储气袋1个、20 mL一次性注射器3支、固定水管的水管夹7个、螺钉7个、45 cm×30 cm耐力板(附底座)1块、试管4支、压差计、酒精灯、50 mL三颈烧瓶各1个、电脑1台、Na2SO3固体、70%浓H2SO4、饱和Na2CO3溶液、品红溶液、KMnO4溶液、新制Na2S溶液、石蕊试液。
2.2 组装实验装置
如图3所示,将耐力板固定于底座上并贴上蓝色版纸制成演示板,把水管夹用螺钉固定在演示板上用于夹持实验器材,用输液管改装的导气管连接各仪器,所有废气均通入储气袋中,并通过开关控制各部分反应的发生与停止,注射器移取液体试剂,空试管另接压差计,压差计接电脑。

图3 实验装置
3 实验装置的使用方法
(1)将导气管末端的针头浸入水中,把最左侧试管倾斜一定角度,用酒精灯加热试管,通过控制开关检查各部分装置的气密性。
(2)在试管、三颈烧瓶和注射器中加入指定的试剂。把70%浓硫酸注入三颈烧瓶与亚硫酸钠反应产生SO2气体。通过控制开关让SO2气体依次通过品红溶液(褪色)、高锰酸钾溶液(褪色)、硫化钠溶液(产生淡黄色沉淀)验证SO2气体的漂白性、还原性和氧化性。硫化钠溶液还充当了对其右侧空试管收集SO2气体进行验满的角色。
(3)关闭K2和K6,打开K7构成恒容体系,将注射器中的紫色石蕊试液部分注入试管,SO2气体溶于水产生的负压会将剩余的石蕊试液吸入试管,且试管中的红色溶液与注射器中的紫色溶液形成鲜明对比,证明SO2气体与水反应生成了酸;并将针管迅速回拉至初始位置(注射器中的紫色石蕊试液占用了原有气体的空间),同时通过压差计在电脑上读取实时负压并绘出实时压力图像(见图4),证明SO2气体易溶于水。
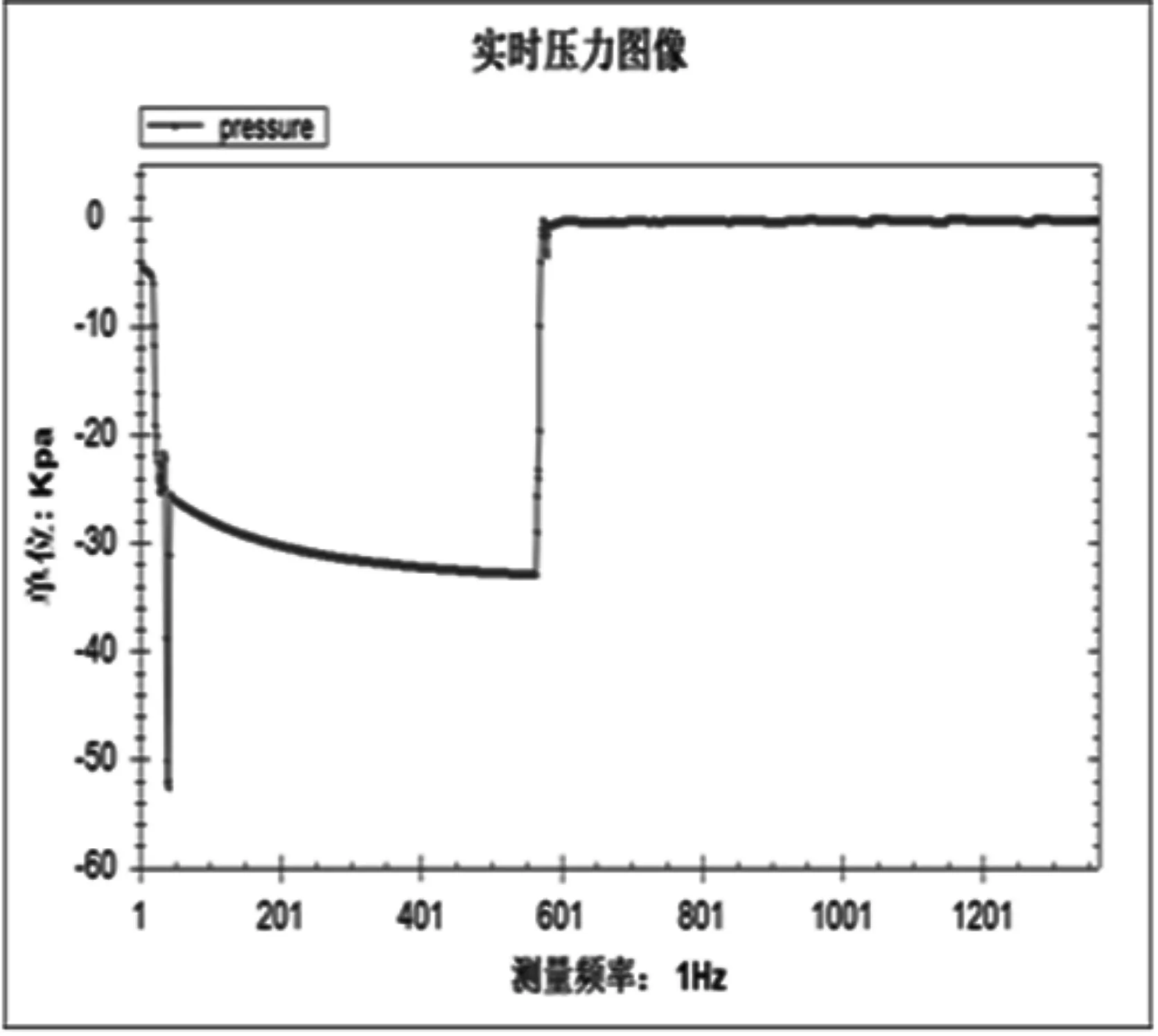
图4 SO2溶于水产生的实时压力图像
(4)关闭K1和K4,打开K5,扭动固定品红溶液试管的水管夹使试管倾斜一定角度,用酒精灯加热,溶液释放出SO2气体进入输液袋,输液袋变鼓了,褪色后的品红溶液恢复了红色;停止加热,试管冷却,释放出的SO2气体又溶于品红溶液中,输液袋变瘪,品红溶液又褪色了,该过程可反复实验以证明SO2气体漂白的可逆性。
(5)将饱和碳酸钠溶液注入三颈烧瓶与剩余的硫酸反应产生CO2,通过控制开关依次将装置中残留的SO2气体排入储气袋中。
4 实验装置的优点
(1)用材简单易得,实验现象明显,安全可靠,可多次使用,实用推广性强。
(2)压差计用于测定SO2气体溶于水时产生的负压,从定量的角度认识化学现象,使结论更可靠,高效达成教学目标。
(3)增加了二氧化硫的氧化性和还原性实验,有利于学生建构完整的物质性质知识模型(见图5)。

图5 SO2的物质性质知识模型
(4)该装置将有毒气体SO2的制取及性质实验巧妙地整合于一体,且在封闭体系中完成实验,实现了化学实验的绿色化。
5 实验装置的拓展应用
5.1 Cl2的制备及性质实验
把Na2SO3固体换成KMnO4固体,浓H2SO4换成浓盐酸(少量多次注入三颈烧瓶)制备Cl2。品红溶液换成一小粒钠块,倾斜试管并加热验证Na和Cl2反应。把KMnO4溶液换成淀粉碘化钾溶液验证Cl2与KI反应。最右侧空试管中装入浓硫酸干燥Cl2,Na2S溶液换成干燥的有色布条,通入Cl2后不褪色,用注射器注入蒸馏水有色布条褪色验证Cl2的漂白性。实验结束时利用CO2把残留的Cl2排入储气袋。
5.2 H2S的制备及性质实验
把Na2SO3固体换成FeS固体,浓H2SO4换成稀硫酸可以制备H2S气体。气体依次通入:石蕊试液证明H2S的水溶液呈酸性;Na2SO3溶液产生淡黄色沉淀验证H2S的还原性;CuSO4溶液产生黑色沉淀,用来去除H2S。实验结束时利用CO2气体把残留H2S气体排入储气袋。
5.3 NH3的制备及性质实验
把Na2SO3固体换成CaO固体,浓H2SO4换成浓氨水制备NH3。石蕊试液换成酚酞试液验证氨水呈碱性;同时压差计和电脑读取实时负压及实时压力图像说明NH3极易溶于水。NH3通过Al2(SO4)3溶液(NH3通入溶液时导管口要套上多孔球泡,以防倒吸)制备Al(OH)3。通过AgNO3溶液、CuSO4溶液均会先产生沉淀,然后沉淀溶解生成配合物。

