结核分枝杆菌Rv1886c 蛋白的表达、纯化及其多克隆抗体的制备
刘琼,李慧,罗鹏征,马国荣,张炜,万巧凤
宁夏医科大学基础医学院病原生物学与免疫学系,宁夏 银川 750004
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,M. tb)感染所致的一种慢性传染病,是当今世界由单一致病菌感染引起的死亡率最高的疾病[1]。据WHO 统计,全球结核潜伏感染人群接近20 亿,仅2019 年全球约有患者1 000万人,140 万人死于 TB[2]。我国新发 TB 患者约占全球第3 位(8. 4%),仅次于印度(26%)和印度尼西亚(8. 5%)[2]。因此,尽早发现 TB 患者并给予有效治疗是控制TB 播散的关键。
目前,用于TB 诊断的方法有X 光检查、病原学检测(痰液抗酸染色法及细菌培养法)、结核菌素(purified protein derivative,PPD)皮肤试验及 TB 核酸序列扩增技术等。病原学检测是TB 诊断的金标准,我国的M. tb 病原学诊断率较低,2020 年WHO报告显示,我国TB 病原学阳性率为47%,低于全世界57%的检出率[2],仅靠此法会延误对患者的治疗[3];PPD 皮试是一种免疫学检测方法,具有操作简单的优势,但难以区分卡介苗的免疫效果及致病性 M. tb 的感染,因此诊断价值不高[4];在 TB 早期诊断中,核酸扩增技术是病原学诊断的重要补充,但因其成本高及对检测环境的严格要求,限制了其在基层医院的应用[5]。血清学检测具有操作简便、灵敏度高、适用于肺外结核和肺结核等优势[6]。因此,获得高灵敏度、高特异性的M. tb 抗原或抗体,并将其应用于血清学检测TB,是早期诊断TB 的理想方法。
本研究通过构建表达M. tb 早期分泌性蛋白Rv1886c 基因的重组质粒,转化E.coli 后诱导高表达Rv1886c 蛋白(Ag85B),并免疫小鼠制备多克隆抗体,旨在为采用血清学方法早期诊断TB 奠定基础。
1 材料与方法
1. 1 菌株、质粒及基因组 克隆和表达菌株E. coli DH5α 和 BL21(DE3)、pET-28a 质粒及 M. tb(H37Rv)基因组均由马国荣老师惠赠。
1. 2 实验动物 SPF 级 BALB / c 小鼠,雄性,7 ~ 8周龄,体重(21 ± 1. 6)g,共 10 只,购自北京维通利华实验动物科技有限公司,动物合格证号:SCXK(京)2016-0006。本实验对BALB / c 小鼠的所有处理均以科研为目的进行养殖和使用,且按照宁夏医科大学动物伦理相关规定进行(2021-N019)。
1. 3 主要试剂 TaqDNA 聚合酶和T4 DNA 连接酶购自日本TaKaRa 公司;限制性内切酶 HindⅢ和BamHⅠ购自美国NEB 公司;硫酸卡那霉素(Kan)、IPTG、琼脂糖、胰化蛋白胨及酵母提取物均购自宁夏科博生物科技有限公司;质粒小量抽提试剂盒和胶回收试剂盒购自天根生化科技(北京)有限公司;鼠抗Ag85B 单克隆抗体购自北京博奥森生物技术有限公司;HRP 标记的兔抗鼠IgG 购自北京中杉金桥生物技术有限公司;含Ni+螯合剂的Ni-NTA His纯化试剂盒购自美国Invintrogen 公司;其他化学试剂均为国产分析纯。
1. 4 目的基因 Rv1886c 的扩增 以 M. tb(H37Rv)的DNA 为模板,根据GenBank 中注册的M. tb Rv1886c基因(Gene ID:885785)序列设计引物,P1:5′-CCCAAGCTTATGACAGACGTGAGCCGAAAGA-3′(下 划线部分为 Hind Ⅲ酶切位点),P2:5′-CGGGATCCTCAGCCGGCGCCTAACGAA-3(′下划线部分为BamHⅠ酶切位点),基因全长为977 bp。PCR 反应体系:Premix Taq 25 μL,DNA 2 μL,P1、P2 引物各 1 μL,加水至 50 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃30 s,72 ℃ 1 min,共 35 个循环;最后 72 ℃延伸 10 min。回收PCR 产物,经1%琼脂糖凝胶电泳鉴定。
1. 5 重组表达质粒的构建 用T4 DNA 连接酶将PCR 产物与 pET-28a 质粒连接,转化 E. coli DH5α。随机挑取 5 个菌落,接种于含 50 μg / mL 硫酸卡那霉素的LB 培养液中,37 ℃振荡培养12 h 后提取质粒DNA,用Hind Ⅲ和BamHⅠ双酶切鉴定,阳性克隆送北京睿博兴科生物技术有限公司测序。将获得的含有Rv1886c 基因的表达质粒命名为pET-28a-Rv1886c。
1. 6 重组蛋白表达菌株的构建 将重组表达质粒pET-28a-Rv1886c 通过热激法转化入E. coli BL21(DE3)中,命名为 BL-Rv1886c,于-80 ℃保存。
1. 7 重组Rv1886c 蛋白诱导表达条件的优化
1. 7. 1 诱导剂浓度 将冻存的BL-Rv1886c 菌株接种于 20 mL 含 100 μg / mL Amp 的 LB 液体培养基中,恒温摇床 200 r / min,37 ℃培养过夜;再按 2%比例转种至200 mL LB 培养基中,振荡培养至菌液A600为 0. 4 ~ 0. 6 时,分别加入 0. 2、0. 5、1. 0、1. 5、2. 0、2. 5 和 3. 0 mmol / L IPTG,37 ℃诱导 4 h。各取 2 mL菌液制备蛋白样品,进行12% SDS-PAGE 分析,确定最佳诱导剂浓度。
1. 7. 2 诱导时间 BL-Rv1886c 表达菌培养至菌液A600为 0.4 ~ 0.6 时,加入 0.5 mmol/L IPTG,37 ℃分别诱导 2、4、6、8 h。各取 2 mL 菌液制备蛋白样品,进行12% SDS-PAGE 分析,确定最佳诱导时间。
1. 7. 3 诱导温度 BL-Rv1886c 表达菌培养至菌液A600为 0. 4 ~ 0. 6 时,加入 0. 5 mmol / L IPTG,分别于27、30、37 ℃诱导4 h。收集菌液制备蛋白样品,进行12% SDS-PAGE 分析,确定最佳诱导温度。
1. 8 重组蛋白的分离纯化 采用Ni-NTA His 纯化试剂盒纯化目的蛋白。将诱导后的菌液离心、制备上柱样品,按照说明书中的方法进行亲和色谱纯化。收集洗脱液,加入透析袋中,于4 ℃低温下进行梯度透析复性,每4 ~8 h 换液1 次,透析48 h 后回收复性蛋白,BCA 定量法测定蛋白浓度。保存于-20 ℃备用。
1. 9 重组蛋白的Western blot 分析 分别取重组蛋白 10 和 40 μg,按 1 ∶4 体积比加入 5 × 样品缓冲液,沸水浴5 min 后上样,经12% SDS-PAGE 分离后,半干电转膜仪转移至PVDF 膜上,以5%脱脂奶粉 4 ℃封闭过夜;TBST 洗膜 10 min,共 3 次,加入鼠抗 Ag85B 单克隆抗体(1 ∶1 000 稀释),37 ℃孵育l h;加入 HRP 标记的兔抗鼠 IgG(1 ∶1 000 稀释),37 ℃振荡 60 min;加入 ECL 发光液,X 线胶片曝光,经显影、定影后分析结果。
1. 10 抗小鼠血清的制备 将纯化的Ag85B 蛋白与等体积弗氏完全佐剂充分混合形成油包水乳化剂,经小鼠背部皮下注射,300 μL / 只,共 7 只;对照组 3只小鼠注射0. 9%氯化钠溶液与等体积弗氏完全佐剂充分混合的乳化剂。每周免疫1 次,共4 次,除初次免疫外,其余3 次使用弗氏不完全佐剂,于第4 次免疫后1 周经眼框后静脉丛采血,分离血清。
1. 11 抗体滴度检测 采用间接ELISA 法。将纯化的 Ag85B 蛋白配制成 2 μg / mL 的溶液包被 96 孔酶标板,0. 1 mL / 孔,4 ℃过夜;加入 2% BSA 封闭液,0. 1 mL / 孔,37 ℃静置 2 h;TBST 洗板 4 次,加入 2 倍稀释的免疫血清(终浓度为 1 ∶200、1 ∶400、1 ∶800、1 ∶1 600、1 ∶3 200、1 ∶6 400、1 ∶12 800、1 ∶25 600、1 ∶51 200、1 ∶102 400),第 1 列设 PBS 阴性对照,37 ℃孵育l h;加入HRP 标记的羊抗鼠IgG(1 ∶1 000 稀释),0. 1 mL / 孔,37 ℃温育 40 min;PBST 洗板,加入底物,0. 1 mL / 孔,37 ℃避光孵育15 min;每孔加入 50 μL 2 mol / L H2SO4终止反应,于酶标仪上测定A450值。以试验孔A450值 / 阴性对照A450值>2. 1 倍的最高样品稀释度定义为抗体滴度[1]。
1. 12 抗体特异性鉴定 采用Western blot 法。取纯化的Ag85B 蛋白,经12% SDS-PAGE 分离后,电转移至PVDF 膜上,以5%脱脂奶粉4 ℃封闭过夜;TBST 洗膜3 次,加入制备的鼠抗血清(稀释梯度依次为 1 ∶1 000、1 ∶5 000、1 ∶25 000),室温孵育 2 h;TBST 洗膜 3 次,加入 HRP 标记的兔抗鼠 IgG(1 ∶1 000 稀释),室温孵育 1 h;TBST 洗膜 3 次,采用 ECL显色观察。
2 结 果
2. 1 Rv1886c 基因扩增产物的鉴定 Rv1886c 基因扩增产物经1%琼脂糖凝胶电泳分析,在约1 000 bp处可见特异性条带,大小与预期(977 bp)相符,见图1。
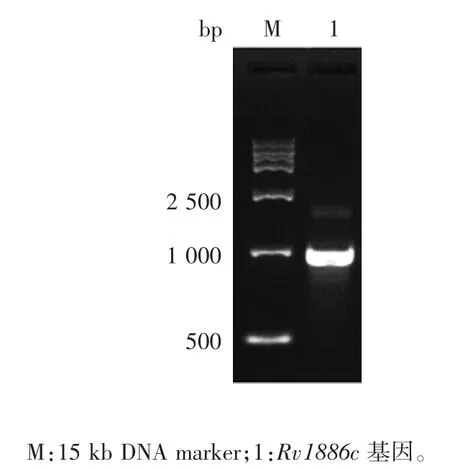
图1 Rv1886c 基因扩增产物电泳图Fig. 1 PCR amplification of Rv1886c gene
2. 2 重组表达质粒的酶切鉴定 重组表达质粒pET-28a-Rv1886c 的双酶切(Hind Ⅲ和 BamHⅠ)产物经1%琼脂糖凝胶电泳分析,可见与扩增条带大小一致的条带,见图2。基因测序结果与 GenBank 中公布的M. tb Rv1886c 基因序列完全一致,表明质粒构建正确。

图2 重组表达质粒pET-28a-Rv1886c 的酶切鉴定Fig. 2 Identification of the pET-28a-Rv1886c vector through restriction enzyme digestion
2. 3 重组Rv1886c 蛋白诱导表达条件的优化
2. 3. 1 最佳诱导剂浓度 12%SDS-PAGE 分析显示,在诱导剂浓度为 0. 2 ~ 2 mml / L 时,Ag85B 重组蛋白表达量较高,但诱导剂浓度为0. 2 mml / L 时,杂蛋白较多,因此选择最佳诱导剂浓度为0.5 mmol/L。见图3。
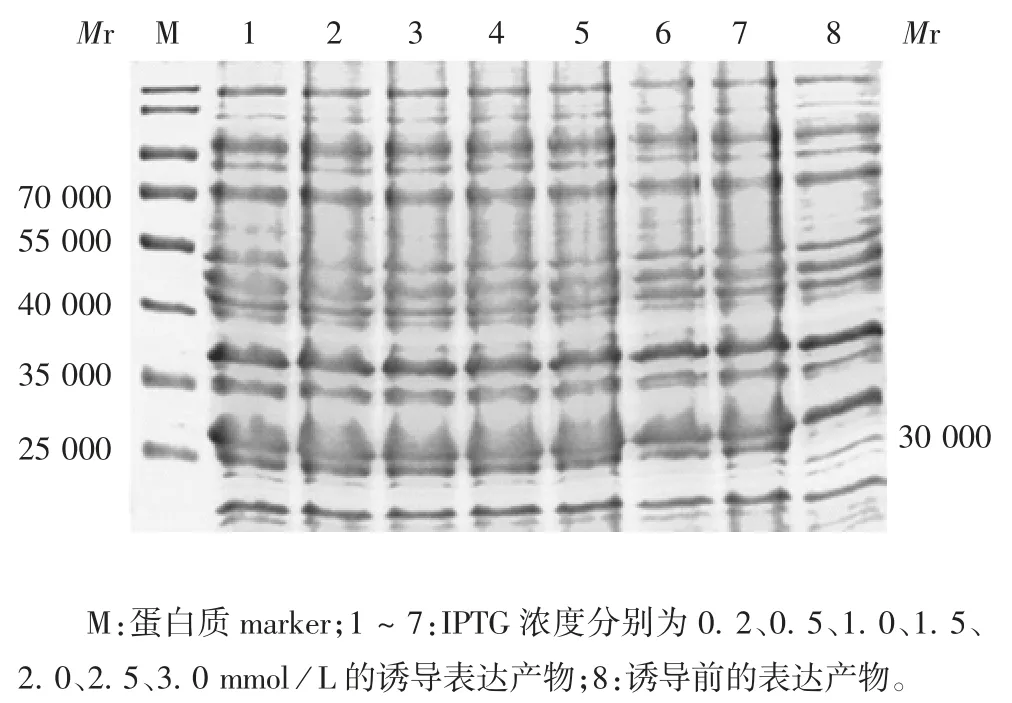
图3 37 ℃下不同浓度IPTG 诱导4 h 表达产物的SDSPAGE 分析Fig. 3 SDS-PAGE results of proteins expressed in transformed E. coli induced with IPTG in different concentrations at 37 ℃for 4 h
2. 3. 2 最佳诱导时间 12% SDS-PAGE 分析显示,诱导8 h,Ag85B 重组蛋白表达量最高,但杂带较多;诱导4 和6 h,Ag85B 重组蛋白表达量高且杂带较少,因此确定最佳诱导时间为4 h。见图4。

图4 37 ℃下0. 5 mmol / L IPTG 诱导不同时间表达产物的SDS-PAGE 分析Fig. 4 SDS-PAGE results of proteins expressed in transformed E. coli induced by 0. 5 mmol / L IPTG at 37 ℃ for different time periods
2. 3. 3 最佳诱导温度 12% SDS-PAGE 分析显示,诱导温度为37 ℃时,Ag85B 重组蛋白表达量最高,因此确定最佳诱导温度为37 ℃。见图5。

图5 0. 5 mmol / L IPTG 于不同温度下诱导 4 h 表达产物的SDS-PAGE 分析Fig. 5 SDS-PAGE results of proteins expressed in transformed E. coli induced by 0. 5mmol / L IPTG at different temperatures
2. 4 纯化重组蛋白的鉴定
2. 4. 1 SDS-PAGE 分析 纯化重组蛋白的纯度达90%以上,蛋白浓度约为1. 5 mg / mL,可用于动物免疫。见图6。

图6 纯化重组蛋白的SDS-PAGE 分析Fig. 6 SDS-PAGE results of purified recombinant protein
2. 4. 2 Western blot 分析 纯化的重组蛋白可与Ag85B单克隆抗体反应,在相对分子质量约30 000 处可见特异条带,见图7。

图7 纯化重组蛋白的Western blot 分析Fig. 7 Western blotting results of purified recombinant protein
2. 5 小鼠血清抗体效价 间接ELISA 结果显示,小鼠血清抗体滴度高达1︰51 200,见图8。

图8 间接ELISA 法测定血清Ag85B 抗体滴度Fig. 8 Determination of serous Ag85B antibody titer through indirect ELISA
2. 6 Ag85B 多克隆抗体的特异性 Western blot 分析显示,在相对分子质量约30 000 处可见明显条带,且在稀释浓度为1︰25 000 条件下也可发生特异性反应。见图9。

图9 Western blot 鉴定不同稀释度的抗Ag85B 血清Fig. 9 Identification of anti Ag85B sera with different dilutions through Western blotting
3 讨 论
《“十三五”全国结核病防治规划》明确提出了规划目标:2020 年我国肺结核发病和死亡人数进一步减少,全国肺结核发病率下降至58 / 10 万以下,肺结核患者病原学阳性率达50%以上[7]。2020 年我国已基本完成规划目标[8]。WHO 和我国对诊断TB 的技术规范进行了推荐[9-10],TB 的诊断技术需因地施策和规范应用才能发挥其功效,不应盲目寻求新方法,更不能忽略经典的TB 病原学及血清学检查[11]。
M. tb 的分泌性蛋白是刺激宿主免疫系统产生免疫效应的外源性抗原,是诊断TB 的标志分子[12]。Ag85 复合物是常见的M. tb 分泌蛋白,占M. tb 分泌蛋白总量的45%,该复合物包括Ag85A、Ag85B 和Ag85C 3 种组分,其中 Ag85B 占 22%,Ag85A 占15%,Ag85C 占8%[13]。因Ag85 复合物可诱导强烈的 Th1型细胞免疫应答,该复合物尤其Ag85A 和Ag85B 是最有前景的TB 疫苗候选抗原[14]。Ag85B 是由M. tb Rv1886c 基因编码的相对分子质量为30 000 的早期分泌性蛋白。Rv1886c 编码的约40 个氨基酸的前导序列在分泌时被切除,然后Ag85B 释放到M. tb菌体外,因此在M. tb 培养滤液中,第3 天即可检测到 Ag85B[15]。又由于 Ag85B 的分泌量高于 Ag85A,因此Ag85B 有望成为TB 的血清学早期诊断标志物。
本研究成功地对Rv1886c 基因进行克隆及表达。通过优化条件,获得了较高纯度的重组蛋白Ag85B,该蛋白可有效刺激小鼠产生体液免疫应答,抗体滴度达1︰51 200。以纯化的Ag85B 蛋白为抗原,抗血清为一抗进行Western blot,在相对分子质量约30 000处可见明显条带,且在抗血清稀释浓度为1︰25 000条件下,Ag85B 与其抗血清也能发生特异性反应,表明Ag85B 与其抗血清结合具有高灵敏度和特异性,可作为TB 血清学诊断的候选抗原分子。本研究为TB 的血清学早期诊断奠定了基础。
——一道江苏高考题的奥秘解读和拓展

