b 型流感嗜血杆菌结合疫苗游离多糖含量检测高效阴离子交换色谱-脉冲安培法的建立及验证
赵丹,李茂光,毛琦琦,李亚南,陈苏京,叶强
中国食品药品检定研究院国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室,北京 102629
b 型流感嗜血杆菌(Haemophilus influenzae type b,Hib)是引起小儿呼吸道系统原发性感染和病毒性疾病时继发感染的致病菌之一,可导致脑膜炎、肺炎、败血症、心包炎等多种侵袭性疾病[1-2]。目前预防Hib 感染的主要应对措施是接种疫苗,随着Hib疫苗使用的不断扩大,Hib 相关疾病获得了较好的控制[3]。Hib 结合疫苗是由纯化的Hib 荚膜多糖多聚磷酸核糖基核糖醇(polyribosylribitolphosphate,PRP)[4]与载体蛋白共价结合后经纯化而成的多糖蛋白结合疫苗。结合疫苗中的主要有效成分为多糖-蛋白结合物,游离多糖含量过高会显著影响大分子结合物的免疫原性[5]。因此游离多糖含量是结合疫苗的一项重要质量控制指标[6]。
高效阴离子交换色谱-脉冲安培(high performance anion exchange chromatography with pulsed amperometric detector,HPAEC-PAD)检测方法的出现为糖类物质的分离测定提供了简单高效的手段,其具有灵敏度高、分离效果和重现性好、供试品不需衍生处理[7]等优点,已逐渐成为糖类化合物分析的首选方法之一[8],在测定多糖含量方面得到越来越广泛的应用。目前《中国药典》三部(2020 版)检测Hib 结合疫苗游离多糖含量的方法为乙醇分步沉淀法,该方法操作繁琐且要求较高;对于结合物浓度或游离多糖含量较低的样品,可能因样品游离多糖含量低于测定下限而导致一定的误差[9]。本研究采用超速离心法将未结合的PRP 与结合的PRP 分离,提取上清中的游离多糖,在碱性条件下将多糖水解,采用CarboPacPA-10 4 mm × 250 mm 分析柱,氢氧化钠-醋酸钠溶液洗脱,经脉冲安培检测器检测,同时对建立的方法进行验证,并初步将其应用于Hib 结合疫苗的游离多糖含量测定。
1 材料与方法
1. 1 供试品及标准品 14 批Hib 结合疫苗(批号:1 ~ 14)为中国食品药品检定研究院留样;Hib PRP国际标准品(批号:12 / 306)购自英国国家生物制品检定所。
1. 2 主要试剂及仪器 50%氢氧化钠购自美国Sigma 公司;三水醋酸钠购自美国Thermo Fisher-Scientific 公司;DionexCarboPacPA-10 4 mm × 250 mm分析柱、DionexCarboPacPA-10 4 mm × 50 mm 保护柱购自美国 Thermo 公司;0. 22 μm 滤膜和 10 K 超滤膜购自美国PALL 公司;ICS-5000 色谱分析系统(脉冲安培检测器、变色龙7. 0 工作站)购自美国Thermo 公司。
1. 3 溶液制备
1. 3. 1 水解液 取1. 5 mL 10 mol /L 氢氧化钠溶液加超纯水定容至10 mL,备用。
1. 3. 2 洗脱液 取204.15 g 三水醋酸钠,用1 500 mL超纯水溶解后,经0. 22 μm 滤膜过滤,脱气后加入19. 5 mL 50%氢氧化钠,备用。
1. 4 游离多糖的分离 取750 μL 供试品分别于409 700、498 500、596 100 × g 离心 30 min,取上清400 μL,即为游离多糖供试品溶液。分别检测各离心力条件下游离多糖供试品溶液中的多糖含量及蛋白残留量。
1. 5 供试品及定量标准品的制备
1. 5. 1 PRP 标准品稀释 将Hib PRP 国际标准品用超纯水稀释至19.616 μg/mL,即为PRP 储备液。再将PRP 储备液用0. 9%氯化钠溶液稀释,获得浓度为0. 77、1. 53、3. 06、6. 13、12. 26 μg /mL 标准工作液。
1. 5. 2 供试品稀释 取100 μL 供试品,加入300 μL 0. 9%氯化钠溶液混匀,即为多糖供试品溶液。
1. 5. 3 水解 取多糖供试品溶液、游离多糖供试品溶液及 Hib PRP 标准品各 400 μL,分别加入 100 μL水解液,室温放置约16 h,水解结束后用10 K 超滤膜超滤,收集滤过液备用。
1. 6 色谱条件 分析柱:DionexCarboPacPA-10 4 mm×250 mm;保护柱:DionexCarboPacPA-10 4 mm×50 mm;洗脱液洗脱程序见表 1;流速:1. 2 mL / min;进样量:60 μL;柱温:30 ℃。
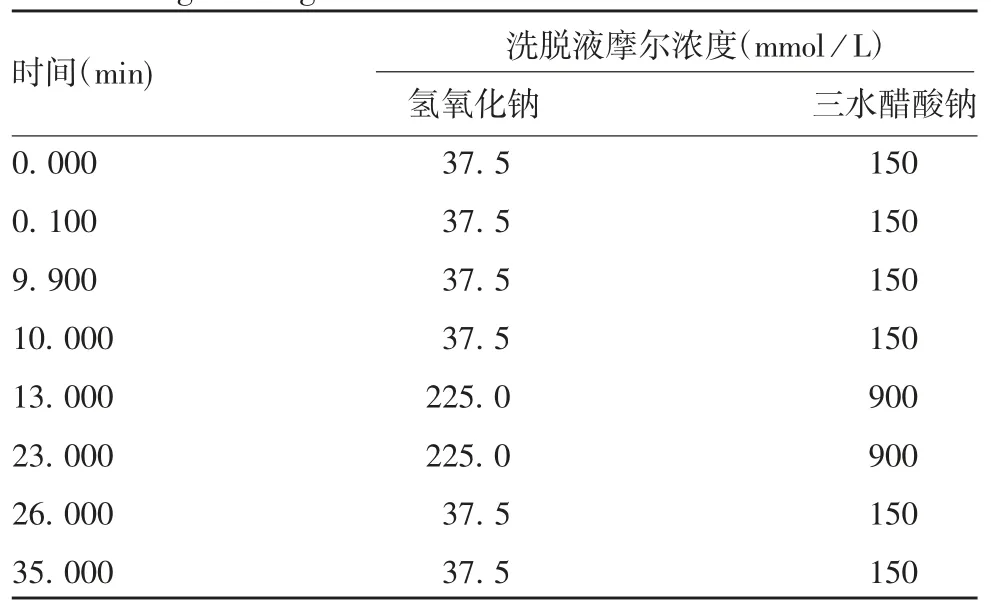
表1 梯度洗脱程序Tab. 1 Program of gradient elution
1. 7 方法的验证
1. 7. 1 专属性 按1.6 项色谱条件分别检测PRP 标准品、多糖供试品溶液、游离多糖供试品溶液(批号均为14)、空白对照多糖含量。
1. 7. 2 线性 按1.6 项色谱条件检测不同浓度(0.77、1. 53、3. 06、6. 13、12. 26 μg / mL)PRP 标准品工作液多糖含量。以PRP 标准品浓度为横坐标,对应的峰面积为纵坐标,绘制标准曲线。
1. 7. 3 定量限 将 0. 77 μg / mL PRP 标准品稀释至约2 ng / mL,按1. 6 项色谱条件检测多糖含量,以信噪比10 ∶1 为定量限。
1. 7. 4 精密度
1. 7. 4. 1 重复性 按1. 6 项色谱条件重复检测游离多糖供试品溶液(批号14)6 次,计算峰面积、游离多糖含量及塔板数的RSD。
1. 7. 4. 2 中间精密度 取2 批待测游离多糖供试品,按1. 6 项色谱条件在不同时间分3 次检测游离多糖含量,计算RSD。
1. 7. 5 稳定性 取游离多糖供试品溶液(批号14),按1. 6 项色谱条件在24 h 内连续检测20 次,计算峰面积、游离多糖含量及塔板数的RSD。
1. 7. 6 准确度 取游离多糖供试品溶液(批号14),分别加入高、中、低(1.171 4、1.464 3 和 1.757 1 μg /mL)3 个浓度的Hib PRP 多糖,按1. 4 项分离游离多糖,按1. 5. 3 项进行供试品的水解,按1. 6 项色谱条件进行检测,计算游离多糖的平均加标回收率均值及RSD。
1. 8 方法的初步应用 用建立的方法测定13 批Hib结合疫苗游离多糖含量,同时与乙醇沉淀法检测结果进行比较。
2 结 果
2. 1 游离多糖分离条件选择 不同离心力(409 700、498 500、596 100 × g)下,游离多糖供试品溶液中的游离多糖含量分别为8. 55%、7. 88%和5. 36%,蛋白含量分别为 8. 65、0 和 0 μg / mL。
2. 2 专属性 PRP 标准品、多糖供试品溶液、游离多糖供试品溶液在相应位置均出现明显色谱峰,而空白对照无对应色谱峰出现,专属性良好,见图1。
2. 3 线性 标准品浓度在 0. 77 ~ 12. 26 μg / mL 范围内,与峰面积呈良好的线性关系,回归方程和相关系数见表2,离子色谱图见图2。

图2 PRP 标准曲线图谱Fig. 2 Standard curve of PRP

表2 线性回归方程及相关系数Tab. 2 Linear regression equation and correlation coefficient
2. 4 定量限 该方法定量限为1. 875 ng / mL。
2. 5 精密度
2. 5. 1 重复性 游离多糖供试品溶液6 次检测结果的峰面积、游离多糖含量及塔板数的RSD 分别为4. 09%、4. 00%和0. 77%,重复性良好。
2. 5. 2 中间精密度 2 批游离多糖供试品不同时间3 次检测结果游离多糖含量的RSD 分别为2. 61%和2. 48%,精密性良好,见表3。

表3 精密性验证结果Tab. 3 Verification for precision
2. 6 稳定性 游离多糖供试品溶液24 h 内20 次检测结果的峰面积、游离多糖含量和塔板数的RSD 分别为4. 82%、4. 71%和2. 16%,稳定性良好。
2. 7 准确度 供试品溶液游离多糖的平均加标回收率均值及RSD 分别为100. 26%和3. 96%,见表4。

表4 准确性验证结果Tab. 4 Verification for accuracy
2. 8 方法的初步应用 两种方法游离多糖含量检测结果均 <20%,在《中国药典》三部(2020 版)规定的合格范围内,见图3。

图3 两种方法游离多糖含量检测结果的比较Fig. 3 Comparison of free polysaccharide contents determined by two methods
3 讨 论
目前,Hib 结合疫苗是国际公认的最为有效的细菌性疫苗之一[10],接种Hib 结合疫苗可有效降低Hib 侵袭性感染的风险[11],使机体产生有效的应答和免疫保护。但疫苗中的游离多糖含量与其可产生的保护效果密切相关,结合疫苗中游离多糖含量过高会明显影响大分子结合物的免疫原性,因此游离多糖含量的检测是多糖蛋白结合疫苗纯化工艺验证、结合物原液质量控制和稳定性研究的重要指标[12]。目前游离多糖检测方法有疏水色谱法、冷酚抽提法、乙醇分步沉淀法、高效液相色谱(HPLC)法等[13-15]。其中冷酚抽提法和乙醇分步沉淀法均是通过加入化学沉淀剂使结合多糖沉淀达到分离游离多糖的目的,但额外引入的化学沉淀剂会对色谱柱造成损伤,使其寿命缩短,甚至干扰测定。
本研究利用结合多糖与游离多糖分子大小、沉降系数[16]等不同的原理,采用超速离心的方法将供试品中结合多糖与游离多糖进行分离,并将其在碱性条件下水解,通过HPAEC-PAD 法测定游离多糖含量。本研究还对不同离心力下上清中的游离多糖及蛋白含量进行了考察,结果表明,离心力在409 700 × g 时,上清中有明显蛋白残留,即有结合物残留;离心力在596 100 × g 时,上清中未检出蛋白残留,但游离多糖含量明显下降,仅为建立方法检测结果的68%。因此,最终选择498 500 × g 作为供试品游离多糖分离条件。
本研究建立的方法专属性良好,空白对照在多糖峰相应位置无对应色谱峰。精密度和稳定性RSD 均 <5%,加标回收率为92. 40% ~ 106. 32%。将建立的方法与乙醇沉淀法比较,两者游离多糖含量检测结果均 <20%,在《中国药典》三部(2020 版)规定的合格范围内。用建立的方法测定的1 ~ 9 批次供试品的游离多糖含量较乙醇沉淀法明显偏低,推测用建立的方法测定游离多糖含量低的供试品时,可能较乙醇沉淀法更为灵敏。此外,乙醇沉淀法的测定结果显示的是低分子质量结合多糖及游离多糖的总和,而所建立的方法的测定结果仅显示游离多糖含量,推测可能低分子结合物较高分子结合物更易降解。上述推测尚需进一步证实。
综上所述,本研究建立的检测Hib 结合疫苗游离多糖含量的超速离心联合HPAEC-PAD 法具有良好的专属性、精密度、稳定性和准确度,可作为Hib 结合疫苗游离多糖含量的测定方法。同时,也为其他多糖蛋白结合疫苗游离多糖提取和检测提供了思路。

