长效生长激素相关蛋白含量检测反相高效液相色谱法的建立及验证
赵鑫,俞露,孙瑞欣,朱秋媚,王江林,刘涵,刘玉林,刘景会,邹勇
长春生物制品研究所有限责任公司细胞因子室,吉林 长春 130012
长效生长激素(recombinant human growth hormone-Fc,rhGH-Fc)免疫融合蛋白是利用一段柔软多肽将人生长激素与IgG4 Fc 片段相连,将基因克隆至GS 双表达载体,再利用CHO-k1 细胞进行表达的一种Fc 融合蛋白[1]。rhGH-Fc 融合蛋白具有与生长激素相同的生理作用,同时拥有较长的半衰期[2]。相较短效生长激素,rhGH-Fc 可减少用药次数,提高患者依从性,从而提高治疗效果[3]。国内的长效生长激素均为PEG 化生长激素,而Fc 融合蛋白除了可通过增大药物相对分子质量降低清除率,还可通过FcRn 结合域来提高pH 敏感性结合力,以缓释的方式延长药物半衰期。与PEG 化药物相比,Fc 融合蛋白不仅具有更长的药物半衰期,而且具有更好的生物相容性。
相关蛋白是蛋白质在物理、化学作用下,由于蛋白聚集或某些氨基酸侧链发生氧化、脱酰胺等化学修饰反应[4],产生的与原蛋白质结构类似,但物理、化学性质又与原蛋白质存在差异的一类蛋白。氧化和脱酰胺反应是rhGH-Fc 最容易发生的降解反应,脱酰胺反应主要是 Asn / Glu(天冬酰胺 / 谷氨酸)在临近氨基酸α 碳亲核攻击下脱掉酰胺基水解成Asp / Glu(天冬氨酸 / 谷氨酸)残基[5],氧化反应主要是由于Met 位点中的含硫基团易被空气中氧气氧化[6]。研究表明,蛋白质的生物学活性会受蛋白结构影响[7],相关蛋白产物也可能会影响蛋白质的免疫原性[8]。蛋白质相关蛋白的含量变化既可体现部分蛋白质结构的变化,同时也反映了蛋白质的稳定程度,因此,建立稳定、准确的相关蛋白检测方法至关重要。
本研究建立了rhGH-Fc 相关蛋白含量的反相高效液相色谱(RP-HPLC)法,并对建立的方法进行验证。
1 材料与方法
1. 1 主要试剂及仪器 rhGH-Fc 蛋白纯化液(CHOK1 细胞表达)由长春生物制品研究所有限责任公司细胞因子室制备,批号分别为S190826、S191031 和S191112;乙腈(LC / MS)购自美国 Honeywell 公司;甲酸(LC / MS)购自美国 Fisher 公司;盐酸胍购自美国 Gibco 公司;二硫苏糖醇(dithiothreitol,DTT)购自美国 Promega 公司;碘乙酰胺(iodoacetamide,IAM)购自美国Sigma 公司;碳酸氢铵、硫酸铵和乙腈(高效液相淋洗)购自国药集团化学试剂有限公司;三氟乙酸(trifluoroacetic acid,TFA)购自美国 Sigma-Aldrich 公司;磷酸氢二钠和磷酸二氢钠购自湖南九典制药有限公司;超滤管和0. 22 μm 无菌滤膜购自美国Millpore 公司;AcQuity 液相色谱系统、G2-XS 精确质量四级杆飞行时间(Q-TOF)液质联用系统、Xevo G2 OTof 质谱仪、UNIFI 软件及 BEH C18色谱柱(130 Å 1. 7 μm,2. 1 mm × 100 mm)购自美国Waters 公司;PerkinElmer Flexa 型高效液相色谱系统(配有UV/VIS 检测器、自动进样器、往复式柱塞泵、TCNav 色谱工作站、柱温箱)购自美国PerkinElmer公司;ZORBAX 300SB-C18(4. 6 mm × 250 mm,5-Micron)色谱柱购自美国Agilent 公司;G-25 色谱柱购自美国GE 公司。
1. 2 样品配制
1. 2. 1 对照品溶液 向rhGH-Fc 原液中缓慢加入45%饱和度的硫酸铵(按25 ℃硫酸铵饱和度计算表),并不断搅拌,直至硫酸铵全部溶解,4 ℃静置30 min;7 200 × g 离心 30 min;弃上清,得到蛋白沉淀,用冷注射用水复溶,7 200 × g 离心 20 min;弃沉淀,上清液经 5 mmol / L PB 缓冲液(pH 7. 0)平衡好的 G-25色谱柱纯化,得到缓冲液为 5 mmol / L PB(pH 7. 0)、蛋白浓度为 1 mg / mL 的蛋白样品,作为 rhGH-Fc 对照品溶液,于-20 ℃保存。
1. 2. 2 氧化加速试验样品 向rhGH-Fc 对照品溶液中加入0. 1%过氧化氢,用0. 22 μm 无菌滤膜滤至灭菌西林瓶中,4 ℃放置48 h。
1. 2. 3 脱酰胺加速试验样品 将rhGH-Fc 对照品溶液用0. 22 μm 无菌滤膜滤至灭菌西林瓶中,37 ℃放置6 d。
1. 3 rhGH-Fc 相关蛋白结构解析
1. 3. 1 样品处理 取对照品溶液、氧化加速试验样品、脱酰胺加速试验样品各150 μL,分别按以下步骤处理:加入 300 μL 盐酸胍(8 mol / L),加入 2 μL DTT(1 mol / L),50 ℃水浴 30 min;放至室温,加入4 μL IAM(1 mol / L),避光 30 min;加至超滤管中,12 000 × g 离心 5 min,弃膜下液,加入 50 mmol / L NH4HCO(3pH 8. 0)缓冲液置换,重复离心步骤15次;用置换用缓冲液将样品浓度调至0. 3 mg / mL,按15 ∶1 的比例加入胰蛋白酶,37 ℃酶切4. 5 h。
1. 3. 2 质谱检测方法 用Waters Xevo G2 QTof 质谱仪,色谱柱为 BEH C18(130 Å 1. 7 μm,2. 1 mm ×100 mm);流动相A 为水 + 0. 1%甲酸,流动相B 为乙腈+0.1%甲酸;柱温为65 ℃;流速为0.3 mL/min;样品保存温度为10 ℃;上样量为1. 5 μg。按下述线性梯度洗脱程序检测:0 ~ 2 min,100% A;2 ~32 min,100% A→60% A;32 ~ 33 min,60% A→5%A;33 ~ 39 min,5% A。
1. 4 方法优化
1. 4. 1 梯度洗脱方法 色谱条件:色谱柱ZORBAX 300SB-C18(4. 6 mm × 250 mm,5-Micron);流动相 A为水+0.1%TFA,流动相B 为乙腈+0.1%TFA;柱温为 45 ℃;流速为 0. 7 mL / min;上样量为 40 μg;检测波长为280 nm。梯度洗脱方法如下:①:0~40 min,30% B→100% B。②:0 ~ 40 min,35% B→80% B;③:0 ~ 10 min,35% B→55% B;10 ~ 40 min,55%B→80% B。④:0 ~ 10 min,35% B→55% B;10 ~40 min,55% B→75% B。⑤:0 ~ 10 min,35% B→55%B;10~50 min,55%B→75%B。⑥:0~10 min,45% B→55% B;10 ~ 40 min,55% B→65% B。
1. 4. 2 流动相 色谱条件:色谱柱ZORBAX 300SBC18(4.6 mm × 250 mm,5-Micron);柱温为 45 ℃;流速为 0.7 mL /min;上样量为 40 μg;检测波长为 280 nm。流动相方案1:流动相A 为水 + 0. 1% TFA,流动相B 为乙腈 + 0. 1% TFA;梯度洗脱方法:0 ~ 10 min,35% B→55% B;10 ~ 50 min,55% B→75% B。流动相方案2:流动相A 为30%乙腈 + 0. 1%,流动相B为80%乙腈+0.1%TFA,梯度洗脱方法:0~10 min,10% B→50% B;10 ~ 50 min,50% B→90% B。
1. 5 方法的验证
色谱条件:色谱柱ZORBAX 300SB-C18(4.6 mm×250 mm,5-Micron);流动相 A 为 30%乙腈 + 0. 1%TFA,流动相B 为80%乙腈 + 0. 1% TFA,梯度洗脱方法为 0 ~ 10 min,10% B→50% B;10 ~ 50 min,50% B→90% B;柱温为 45 ℃;流速为 0. 7 mL / min;上样量为40 μg;检测波长280 nm。
1. 5. 1 系统适应性 取rhGH-Fc 对照品1 mL,按色谱条件进样检测,计算理论塔板数、拖尾因子、主蛋白与相关蛋白分离度。
1. 5. 2 重复性 取rhGH-Fc 对照品1 mL,按色谱条件进样检测,重复进样6 次,记录主峰比例,主峰峰面积,计算平均值和相对标准偏差(RSD)。
1. 5. 3 专属性 取rhGH-Fc 对照品和5 mmol / L PB缓冲液(pH 7. 0)各1 mL,分别按色谱条件进样检测。
1. 5. 4 耐用性 两台相同型号高效液相色谱仪,记为设备1 和2;按照配方配制2 批流动相,记为流动相1 和2;取2 根相同型号,使用程度不同的色谱柱,记为色谱柱1 和2;设置柱温箱温度为40、45 和50 ℃。不同条件下进样检测,记录主峰纯度,计算平均值和RSD。
1. 5. 5 检测限及定量限 将样品稀释5 个梯度,浓度分别为 0. 1、0. 05、0. 025、0. 01、0. 005 mg / mL,按色谱条件进样检测,记录信噪比(S / N),检测限S / N 不小于 3,定量限 S / N 不小于 10。
1. 6 rhGH-Fc 氧化产物及脱酰胺产物的检测 用建立的相关蛋白检测方法对rhGH-Fc 氧化加速试验样品和脱酰胺加速试验样品进行检测,并与rhGH-Fc对照品图谱进行比较。
1. 7 rhGH-Fc 相关蛋白检测方法的初步应用 用建立的相关蛋白检测方法对本室纯化的不同批次rhGH-Fc 纯化液进行检测,并分析检测结果。
2 结 果
2. 1 rhGH-Fc 相关蛋白结构 通过质谱肽图分析,rhGH-Fc 的主要脱酰胺位点为第299 和368 位的天冬酰胺残基;rhGH-Fc 的主要氧化位点除了与短效生长激素相同的第14、125 位甲硫氨酸外,在第236 和342 位的甲硫氨酸处也容易发生氧化反应。见图1 和表1。
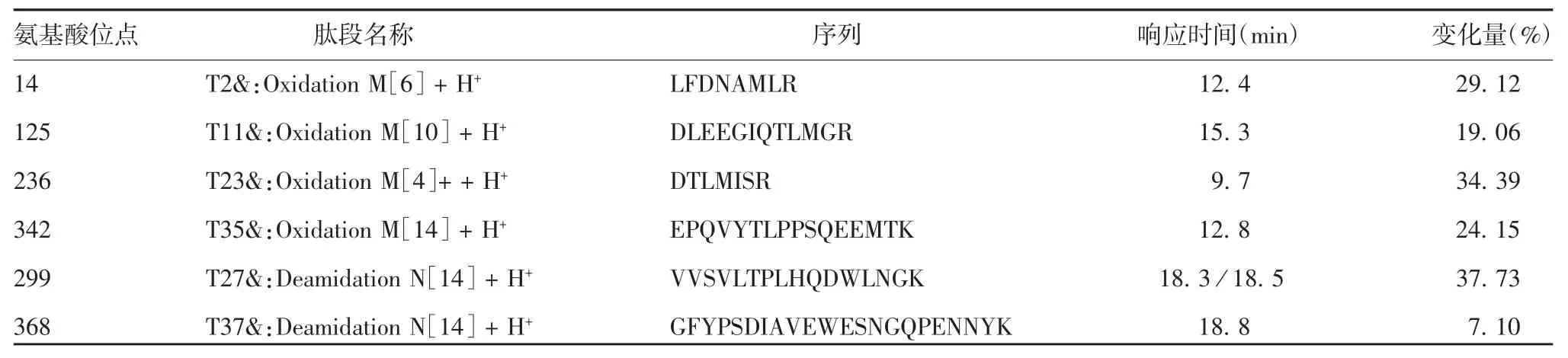
表1 rhGH-Fc 主要氧化和脱酰胺位点Tab. 1 Major oxidation and deamidation sites of rhGH-Fc

图1 rhGH-Fc 质谱肽图检测Fig. 1 Mass spectrometry peptide mapping of rhGH-Fc
2. 2 方法优化的结果 梯度洗脱方法⑤较梯度洗脱方法①、②、③、④分离度更高,分离效果好;较梯度洗脱方法⑥峰型更对称,出峰时间更合理。见图2。因此,选则梯度洗脱方法⑤为rhGH-Fc 相关蛋白含量检测的梯度洗脱方法。流动相方案2 较1 分离度有所提高,峰型更对称,见图3。因此,选则流动相方案2 为rhGH-Fc 相关蛋白含量检测的流动相方案。

图2 各洗脱方法的对比图Fig. 2 Comparison of various elution methods
2. 3 方法的验证结果
2. 3. 1 系统适应性 结果显示,主峰理论塔板数为13 919,拖尾因子为1. 4,主蛋白与相关蛋白分离度为1. 9,符合《中国药典》二部(2015 版)重组人生长激素相关蛋白质项目中拖尾因子0. 9 ~ 1. 8,分离度大于1. 0 的要求。见图3。

图3 rhGH-Fc 相关蛋白检测方法的优化及系统适应性验证Fig. 3 Optimization of determination method for rhGH-Fc associated protein and verification for system adaptability
2. 3. 2 重复性 结果显示,对照品主峰纯度平均值为96. 51%,RSD 为0. 22%,主峰峰面积平均值为3 286 333. 38,RSD 为 1. 8%,符合《中国药典》四部(2015 版)0512 HPLC 法中 RSD 小于 2%的要求。见表2。

表2 重复性验证结果Tab. 2 Verification for reproducibility
2. 3. 3 专属性 结果表明,PB 缓冲液在蛋白出峰时间未出峰,对蛋白纯度检测无干扰,见图4。表明该方法专属性良好。

图4 专属性验证结果Fig. 4 Verification for specificity
2. 3. 4 耐用性 结果显示,相同色谱柱条件下,不同设备、不同批次流动相、不同柱温对检测结果无明显影响;主峰纯度平均值为96. 64%,RSD 为0. 05%。见表3。

表3 耐用性验证结果Tab. 3 Verification for durability
2. 3. 5 检测限及定量限 结果显示,蛋白浓度为0.01 mg/mL 时,S/N=4,该方法检测限为 0.01 mg/mL;蛋白浓度为 0. 025 mg / mL 时,S / N = 13,该方法定量限为 0. 025 mg / mL。
2. 4 rhGH-Fc 氧化产物及脱酰胺产物分析 结果显示,与对照品溶液相比,rhGH-Fc 氧化加速试验样品及rhGH-Fc 脱酰胺加速试验样品的氧化产物峰和脱酰胺产物峰均明显升高,见图5。表明相较于质谱检测,建立的方法更简便、快速、直观,更适用于日常大量样品的检测。

图5 rhGH-Fc 相关蛋白的HPLC 法检测Fig. 5 Determination of rhGH-Fc associated protein by HPLC
2. 5 rhGH-Fc 相关蛋白检测方法的初步应用 用建立的方法均可快速、灵敏地检测出不同批次rhGHFc 纯化液的相关蛋白含量,见图6。
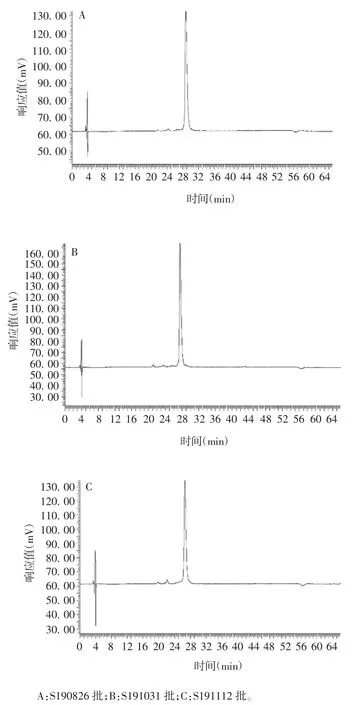
图6 3 批rhGH-Fc 纯化液相关蛋白检测结果Fig. 6 Determination of three batches of purified rhGH-Fc
3 讨 论
通过质谱结构解析结果发现,rhGH-Fc 存在多个易发生氧化和脱酰胺反应的位点,这些位点除了分布于rhGH 片段上,在Fc 片段上也存在。由于氧化和脱酰胺反应产生的相关蛋白会影响产品质量,在蛋白纯化和制剂开发过程中要对相关蛋白含量加以控制,因此需建立一种快速、便捷的RP-HPLC 检测方法用于药品研究过程的相关蛋白检测。
长春生物制品研究所有限责任公司细胞因子室生产的rhGH-Fc 融合蛋白是真核表达,糖基化修饰复杂,组分较多,在进行相关蛋白检测时,如果采用类似重组人生长激素的等度洗脱方法[9],当使用甲醇、正丙醇等洗脱强度弱的流动相时,强保留杂质组分可能会滞留在色谱柱上,很难被完全洗脱,所有组分集中在图谱后部,分离度差,峰型不对称,不能准确分析rhGH-Fc 相关蛋白含量;当使用洗脱强度强的乙腈作为流动相时,弱保留杂质组分会在色谱图起始部分一起流出,很难分离所有组分,分析效果差。采用梯度洗脱方法可有效解决上述问题,因此本文设计了乙腈作为流动相的梯度洗脱方法进行rhGH-Fc 相关蛋白含量检测。
影响梯度洗脱的影响因素较多。梯度洗脱陡度影响各组分间的分离度[10],当梯度陡度较大时,各组分间分离度较差,不能达到《中国药典》二部(2015版)要求,因此可适当放缓梯度陡度来达到更好的分离效果。但如果陡度过缓,既会延长分析时间,也会影响峰型及对称性。若1 个梯度洗脱陡度不能完全分离,可在1 个梯度洗脱中采用2 个不同的梯度陡度使分离度进一步提高[11]。强洗脱溶剂B 的浓度变化范围影响出峰时间,若B 的起始浓度过低,谱图起始比较空旷,无组分峰出现;B 的起始浓度过高,谱图后部比较空旷,表明梯度洗脱未结束全部组分已被洗脱出,较早流出的组分可能产生重叠,降低分离度。优化流动相A、B 中的乙腈浓度可使梯度洗脱过程中的梯度变化更缓和,出峰时间更合理,对于提高分离度和改善峰型均有明显效果。
综上所述,本研究成功建立了rhGH-Fc 相关蛋白含量RP-HPLC 检测方法。经验证,此方法能有效分离本产品相关蛋白,具有较好的系统适应性,且专属性好、耐用性强、检测限低,可满足药品研发过程中RP-HPLC 相关蛋白含量的检测需求。

