水溶液中胞嘧啶阳离子自由基降解反应机理的理论研究
吴丽丹,严钱钱,曾志虹,曾楠
(上饶师范学院 化学与环境科学学院,江西 上饶 334001)
当生物体中的DNA和其他生物分子暴露在内源性产生的活性氧自由基或许多外源性的化学试剂中时,它们可能被氧化性损伤,这在炎症、癌症等疾病的病理生理学中起重要作用[1]。外源性DNA损伤最主要的一个来源是碱基的单电子氧化,它可能发生在DNA被电离辐射或有光敏剂的过程中[2]。近20年来,人们对电离辐射损伤细胞DNA的分子机制进行了大量研究[3-4]。越来越多的证据表明,电离辐射产生的DNA碱基阳离子自由基引发了各种物理和化学变化,构成了细胞毒性DNA损伤的主要类型之一[4-5]。因此,对碱基阳离子自由基降解途径的研究可以为理解电离辐射或化学试剂引起的DNA损伤机制提供指导。本文选取胞嘧啶阳离子自由基(C+·)为研究对象,研究其在水溶液中的降解反应。
根据电子自旋共振和脉冲射解研究,2'-脱氧胞嘧啶核苷(d C)中产生的C+·在水溶液中主要经历从环外NH2脱质子反应,生成的氨基自由基C(-H)·进一步异构化为亚氨基自由基,如图1所示[6-7]。水合产物C5OH·和C6OH·非常少[6]。而在双链DNA中产生的C+·,其水合作用变得显著,因为相应的稳态产物显著增加了[8]。双链DNA与自由d C中产物产率的显著差异说明C+·的降解途径可能具有高度的结构依赖性。近期Wang等[9]利用时间分辨光谱研究i-Motif结构及自由dC中C+·的降解证实了这一点。i-Motif是在弱酸性条件下,通过半质子化碱基对C(H)+∶C的互化网络,由富含胞嘧啶的序列形成的一种独特DNA二级结构[10]。在自由dC中,C+·主要发生脱质子和异构化反应,速率常数分别为1.4×107s-1、8.8×104s-1[9]。而在i-Motif结构中,C+·主要发生水合反应,速率常数为5.3×103s-1[9]。

图1 C+·降解反应;d R为脱氧核糖
到目前为止,实验上对C+·在水溶液中降解反应的研究比较多,而且结果表明C+·的降解途径具有高度的结构依赖性。理论上对C+·在水溶液中降解反应的研究尚没有。因此本文将利用量子化学从理论上研究C+·在水溶液中的降解反应。由于C+·的降解途径具有高度的结构依赖性,我们选取自由dC和i-Motif两种结构作为具体研究对象,因为i-Motif结构可以排除双链DNA中鸟嘌呤碱基的干扰,期望从理论上阐明C+·降解途径具有结构依赖性的原因。
1 理论计算方法
自由dC和i-Motif结构中C+·的存在形式分别为C+·,C(H)+∶C+·,它们的结构如图2所示。运用M062X泛函在6-31+G(d)水平上优化了C+·及C(H)+∶C+·发生脱质子反应和水合反应所涉及的反应物、过渡态、中间体以及产物的构型,并在同样的条件下得到了各构型的能量。M062X泛函被证实适合此类研究[11]。由于C(H)+∶C+·计算模型中包含59个原子,用比6-31+G(d)更大的基组计算耗时太长,因此考虑到计算效率,没有用更大的基组计算。通过频率分析确认了计算所得的构型。所有的驻点频率都为正值,而过渡态有唯一虚频。此外,所有的过渡态通过内禀反应坐标进行了确认[12]。为了考虑溶剂的影响,计算得到的能量利用连续介质模型(PCM)进行校正[13]。所有计算都是利用Gaussian 09程序包完成[14]。

图2 C+·及C(H)+∶C+·的结构;dR为脱氧核糖
2 结果与讨论
之前对胸腺嘧啶阳离子自由基(T+·)脱质子过程的研究发现,在水溶液中释放的质子将被水分子稳定形成水合质子,因此水分子的存在对脱质子过程有影响[11]。为了模拟C+·在水溶液中的环境,在计算模型中加入了显性水分子。加入的显性水分子的数目也被证实对脱质子过程非常重要[11]。对于C+·,若只加入1~5个显性水分子,脱质子过程未能计算出。加入6个显性水分子后,优化出了脱质子过程,因此计算模型为C+·…6 H2O。而对于C(H)+∶C+·,由于C(H)+与C+·形成氢键,减少了C+·周围所需显性水分子的数目,加入4个显性水分子即优化出了脱质子过程,因此计算模型为C(H)+∶C+·…4H2O。
2.1 C+·…6H 2 O脱质子及水合反应
C+·脱质子的位点是环外NH2,其上有2个H,分别标为Ha、Hb,如图2所示。在6个显性H2O存在条件下,优化所得C+·脱质子反应所涉及的反应物、过渡态、中间体及产物的结构如图3所示。C+·首先与6个H2O通过氢键复合,形成反应物RA。经过过渡态TS1A,水分子夺取质子Hb形成中间体IM1A。在IM1A中,圆圈圈出的即为水合质子。跨越过渡态TS1A需要的能量(ΔE)为22.4 kJ/mol。中间体IM1A经过过渡态TS2A,将剩余的Ha旋转到原来Hb的位置,形成中间体IM2A。跨越过渡态TS2A需要的能量(ΔE)为32.7 kJ/mol。从反应物RA开始,也可经过渡态TS3A,水分子夺取质子Ha直接形成中间体IM2A。但是跨越过渡态TS3A需要的能量(ΔE)为54.4 kJ/mol,比跨越TS1A和TS2A的能量都高。中间体IM2A中的Ha可通过过渡态TS4A转移到N3位,形成亚氨基自由基和水合质子的复合物,即最终的产物PA。TS4A为四元环过渡态,在此过渡态中,Ha直接从环外N转移给N3,跨越此过渡态需要的能量(ΔE)为190.8 kJ/mol。中间体IM2A中的Ha也可通过一分子水的帮助,经过渡态TS5A转移到N3位,形成最终的产物PA。TS5A为六元环过渡态,在此过渡态中,Ha从环外N转移给H2O,同时H2O中的一个H转移给N3,实现水分子帮助的H转移。跨越过渡态TS5A需要的能量(ΔE)为76.5 kJ/mol,比跨越TS4A需要的能量大大减少。最终的亚氨基自由基产物PA的能量比反应物RA低12.2 kJ/mol,说明产物稳定。而氨基自由基无论是IM1A还是IM2A都比反应物RA能量高,说明它们不稳定,会继续反应生成最终的产物PA。由各过渡态的能垒可以确定最终C+·脱质子反应的路径是RA→TS1A→IM1A→TS2A→IM2A→TS5A→PA,反应的决速步是由IM2A生成产物PA,能垒为76.5 kJ/mol。

图3 M062X/6-31+G(d)方法计算得到C+·在6个显性H 2 O存在条件下脱质子反应的相对势能曲线
C+·与H2O可发生C5和C6加成,生成C5OH·和C6OH·。为了使水合计算条件与脱质子一致,计算了C+·与6个显性H2O发生C5及C6加成的反应,所涉及的反应物、过渡态、中间体及产物的结构如图4所示。发生C5加成时,C+·首先与6个H2O复合形成反应物RB。随后,H2O中的OH亲核加成到C5原子,同时H2O中的H转移给C6原子形成中间体IMB。此过程经过渡态TS1B完成,需要跨越的能垒(ΔE)为215.9 kJ/mol,是整个反应路径的决速步骤。之后,C6上的一个质子通过过渡态TS2B释放到水中,形成水合质子(图4中圆圈所示)和C5OH·复合物,即最终的产物PB。跨越过渡态TS2B需要的能量(ΔE)为14.6 kJ/mol。产物PB的能量比反应物RB低22.7 kJ/mol,说明产物稳定。
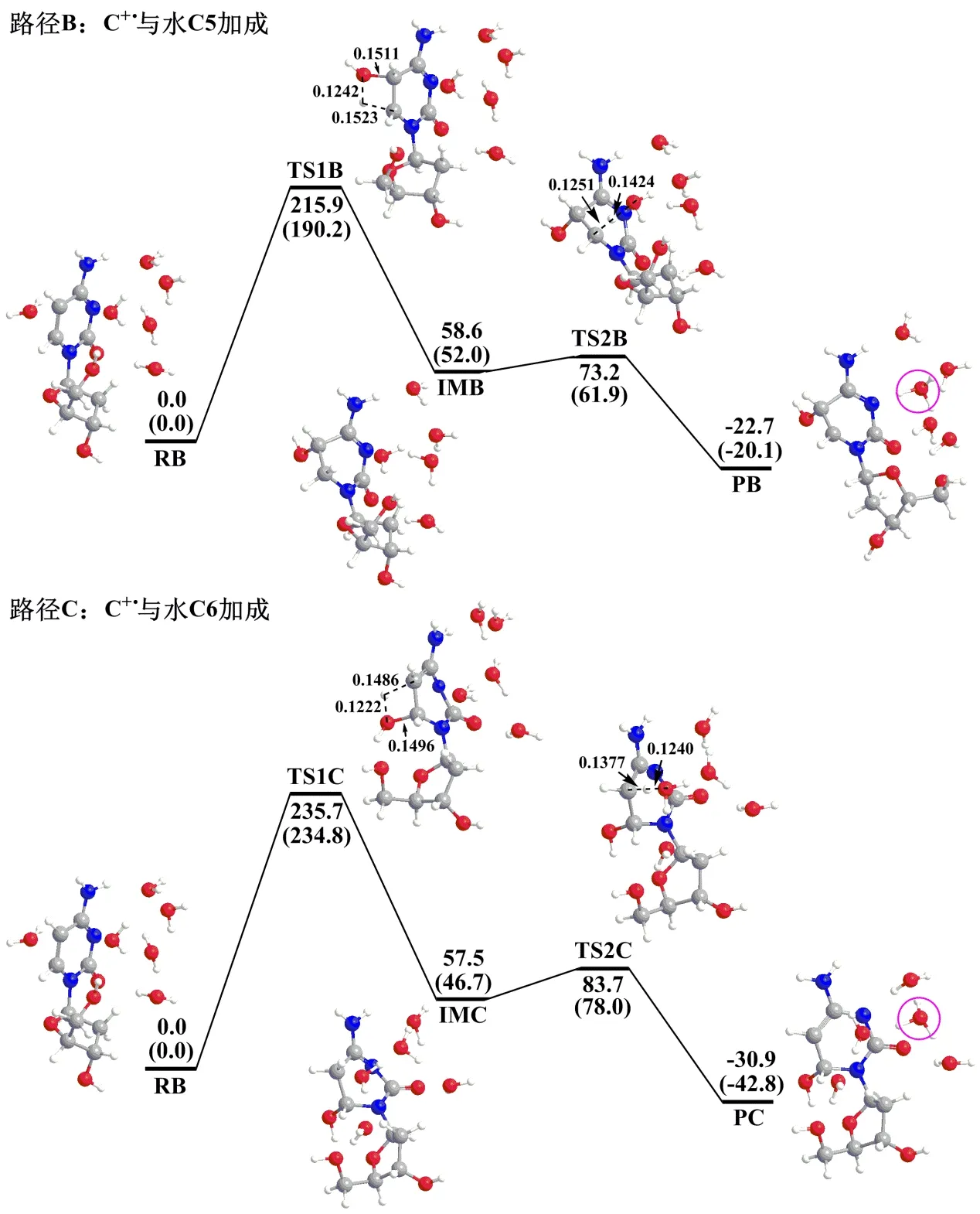
图4 M062X/6-31+G(d)方法计算得到C+·与6个显性H 2 O发生C5及C6加成反应的相对势能曲线
发生C6加成时,反应物RB经过渡态TS1C将H2O中的OH亲核加成到C6原子,同时H2O中的H转移给C5原子形成中间体IMC。此过程需要跨越的能垒(ΔE)为235.7 kJ/mol,是整个反应路径的决速步骤。之后,C5上的一个质子通过过渡态TS2C释放到水中,形成水合质子和C6OH·复合物PC。跨越过渡态TS2C需要的能量(ΔE)为26.2 kJ/mol。产物PC的能量比反应物RB低30.9 kJ/mol,说明产物稳定。
由计算所得C+·…6H2O脱质子及水合反应结果可知,C+·脱质子或与水发生C5、C6加成的产物都比相应的反应物能量低,反应都放热,热力学表明这些反应都能够发生。但是C+·脱质子的能垒(76.5 kJ/mol)远比C+·与水C5、C6加成的能垒(分别为215.9、235.7 kJ/mol)低,因此最有利的反应途径是C+·脱质子。即在自由dC中,C+·主要发生脱质子反应,与实验结果一致[9]。脱质子步骤的能垒为22.4 kJ/mol,随后异构化步骤的能垒为76.5 kJ/mol,计算所得此两步能垒的相对大小与文献中所测反应速率常数的相对大小也一致[9]。
为了考虑溶剂水对各路径影响,利用PCM对计算得到的能量进行了校正。各路径的能垒都降低了,C+·脱质子的能垒变为68.4 kJ/mol,降低了8.1 kJ/mol;C+·与水C5、C6加成的能垒分别变为190.2、234.8 kJ/mol,分别降低了25.7、0.9 kJ/mol。考虑溶剂水后,自由d C中C+·仍然主要发生脱质子反应。
2.2 C(H)+∶C+·…4H 2 O脱质子及水合反应
在C(H)+∶C+·结构中,C+·环外NH2中的Hb与C(H)+的O形成了氢键(如图2所示),导致Hb不能释放到水溶剂中,因此C(H)+∶C+·结构中C+·脱质子的位点为Ha。在4个显性H2O存在条件下,优化所得C(H)+∶C+·脱质子反应所涉及的反应物、过渡态及产物的结构如图5所示。C(H)+∶C+·首先与4个H2O复合形成反应物RD。经过过渡态TSD,水分子夺取C+·的质子Ha形成氨基自由基与水合质子,此氨基自由基依然与C(H)+通过3个氢键形成配合物,即产物PD。在PD中圆圈圈出的即为水合质子。跨越过渡态TSD需要的能量(ΔE)为35.4 kJ/mol。在PD结构中,由于氨基自由基的Hb、N3分别与C(H)+的O、N3 H形成了氢键,由氨基自由基异构化为亚氨基自由基的过程被抑制,因此PD即为最终的产物。它的能量比反应物RD高17.6 kJ/mol,说明PD不稳定,容易沿着反应途径逆向变回反应物RD。

图5 M062X/6-31+G(d)方法计算得到C(H)+∶C+·在4个显性H 2 O存在条件下脱质子反应的相对势能曲线
C(H)+∶C+·结构中C+·与H2O也可发生C5和C6加成,生成C5OH·和C6OH·。C(H)+∶C+·与4个显性H2O发生C5及C6加成反应所涉及的反应物、过渡态、中间体及产物的结构如图6所示。反应的过程与C+·中类似,都是H2O中的OH先加成到C+·的C5(C5加成)或C6(C6加成)原子,同时H2O中的H转移给C6(C5加成)或C5(C6加成)原子,之后C6(C5加成)或C5(C6加成)上的一个质子释放到水中形成最终产物。在C(H)+∶C+·结构中,C5加成两步的能垒分别为183.7、15.3 kJ/mol;C6加成两步的能垒分别为212.3、92.4 kJ/mol,整个反应路径的决速步骤也都是第一步。因此C(H)+的存在对C+·水合反应的机理无影响。生成的产物也都稳定,其中PE的能量比反应物RE低8.2 kJ/mol,PF的能量比反应物RE低20.2 kJ/mol。
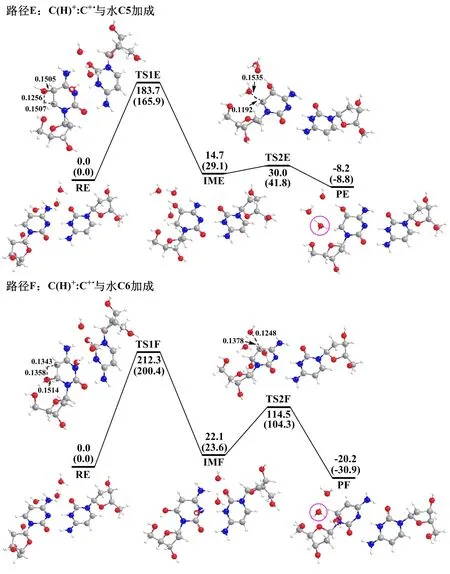
图6 M062X/6-31+G(d)方法计算得到C(H)+∶C+·钱瑛(2015)与4个显性H 2 O发生C5及C6加成反应的相对势能曲线
由计算所得C(H)+∶C+·…4H2O脱质子及水合反应结果可知,C(H)+∶C+·结构中C+·脱质子的产物不稳定,与水发生C5、C6加成的产物都相对稳定。因此,即使C+·脱质子的能垒最低(35.4 kJ/mol),C+·脱质子反应也不能发生,因为生成的脱质子产物会沿着反应途径逆向变回反应物,相当于反应没有发生。C+·与水C5、C6加成的能垒(分别为183.7、212.3 kJ/mol)虽相对较高,但因其为唯二可发生的反应,因此C(H)+∶C+·结构中最有利的反应途径是C+·水合。即在i-Motif结构中,C+·主要发生水合反应,与实验结果一致[9]。在C(H)+∶C+·结构中C+·水合的能垒(183.7 kJ/mol)比C+·结构中C+·脱质子(22.4 kJ/mol)和异构化(76.5 kJ/mol)的能垒高,因此C(H)+∶C+·结构中C+·水合的反应速率应当是最慢的,这与文献所测的反应速率常数相对大小一致[9]。
为了考虑溶剂水对各路径影响,利用PCM对计算得到的能量进行了校正。各路径的能垒都降低了,C(H)+∶C+·结构中C+·脱质子的能垒变为34.5 kJ/mol,降低了0.9 kJ/mol;C+·与水C5、C6加成的能垒分别变为165.9、200.4 kJ/mol,分别降低了17.8、11.9 kJ/mol。各路径产物的能量也有变化,但稳定性没有改变:脱质子的产物依然不稳定,而C5、C6加成的产物都稳定。考虑溶剂水后,i-Motif结构中C+·仍然主要发生水合反应。
3 结论
通过M062X/6-31+G(d)水平上的计算研究发现,在自由dC中C+·主要发生脱质子反应,且脱质子产物并不稳定,会通过异构化生成稳定产物;而在i-Motif结构中C+·主要发生水合反应。i-Motif结构中C+·水合反应的能垒(183.7 kJ/mol)比自由d C中C+·脱质子(22.4 kJ/mol)和异构化(76.5 kJ/mol)的能垒高,因此i-Motif结构中C+·水合反应的速率慢于自由dC中C+·脱质子和异构化。i-Motif结构中C+·脱质子反应不会发生,因而自由dC及i-Motif结构中C+·反应机理不一样。

