次黄嘌呤氢迁移反应机理的理论研究
张爱华,杨宝华,李 琳,施致雄
(首都医科大学 燕京医学院,北京 顺义101300)
0 引言
氢迁移反应在众多化学反应和生命过程中发挥了重要的作用,因生物体内杂环化合物氢迁移影响其化学、生物和药学性质[1-2],备受科研工作者的关注。此外,因为大多数杂环化合物异构体的浓度过低,所以用实验方法来研究异构化反应机理对于化学和分子生物学来讲仍然是一大挑战。近年来,关于核酸碱基及其衍生物分子等杂环化合物的氢迁移反应引起了很多学者的研究兴趣,并进行了相关理论研究[3-4]。关于次黄嘌呤的实验研究[5]和理论研究相对鸟嘌呤、腺嘌呤、尿嘧啶而言比较少。次黄嘌呤(Hypoxanthine,Hx)是体内一磷酸腺苷(AMP)代谢的中间产物,具有重要的生理功能。它可以用作医药中间体、食品色素、化妆品颜料、保鲜剂、农药中间体,也具有抗病毒和抗肿瘤的功效。理论研究方面,苏彦雷等[6]运用量子化学计算的方法,解析次黄嘌呤及其代谢的相关化合物;何云清[7]进行了次黄嘌呤和黄嘌呤的结构和振动光谱理论研究;但研究水催化次黄嘌呤氢迁移反应机理尚未见报道。张爱华等[8-9]讨论过嘧啶、嘌呤水解去氨基导致基因突。为了深入探讨分子结构发生变化导致性质变化问题,本文用量子化学的方法研究次黄嘌呤在无水、1分子水和2分子水的作用下的氢迁移反应机理,其转化过程如图1所示。
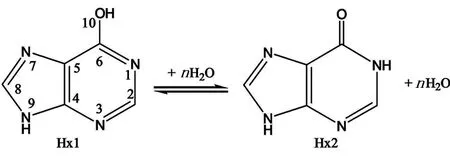
图1 次黄嘌呤氢迁移反应示意图Fig. 1 The profile of H shift reaction for hypoxanthine
1 计算方法
采用B3LYP方法[10-12],在6-31G**水平上对所研究反应的反应物、过渡态和产物的几何构型进行了全优化计算,得到各反应的活化能垒。同时计算振动频率,以确认所得到的构型为能量极小点或过渡态。根据过渡态的虚振动模式判断它们位于正确的反应途径上。用同样的方法计算内禀反应坐标(IRC)[13-14],得到随反应进程的能量变化和几何参数的变化,详细探讨了反应过程,进一步确认了过渡态连接相应的驻点。所有计算均采用Gaussian 09[15]程序完成。
2 结果和讨论
图2给出了本文所研究的目标分子次黄嘌呤氢迁移反应涉及的主要几何构型的关键键参数。为了便于讨论,次黄嘌呤的烯醇式结构(Hx1)给出了所有原子的元素符号和标号,次黄嘌呤的酮式结构标记为Hx2,见图1;其余的只给出了发生反应关键部位的原子的元素符号和标号,见图2。
图2 反应物、产物、中间体和过渡态的分子结构(键长:nm)Fig. 2 Molecular structuresof the reactants, products, various intermediates, and transition states
图 3为基态下各反应途径的相对势能曲线。
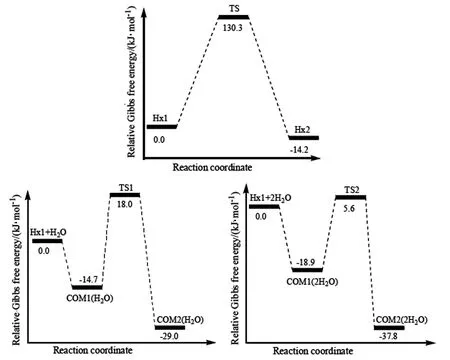
图3 反应的相对势能曲线图Fig. 3 The relative potential energy profile of the reaction
2.1 氢迁移的反应
2.1.1 无水催化的氢迁移反应
对于无水催化的次黄嘌呤氢迁移反应,通过理论计算找到了它的反应途径:
Hx1→TS→Hx2
(1)
在这条反应途径中,反应物Hx1要克服130.3 kJ/mol的能垒,经过四元环过渡态TS生成产物Hx2,实现次黄嘌呤的烯醇式结构向酮式结构的转换。在这个过程中,C6-O10之间的键距由0.133 9 nm(Hx1)变成0.121 7 nm(Hx2),具有了双键的性质;同时,O10-H14键逐渐断裂,N1-H14键逐渐形成,H14从O10迁移到N1,发生的是分子内氢迁移反应。
2.1.2 水催化的氢迁移反应
对于水催化次黄嘌呤的氢迁移反应,通过理论计算找到了它的反应途径:
Hx1+H2O→COM1(H2O)→
TS1→COM2(H2O)
(2)
Hx1+2H2O→COM1(2H2O)→
TS2→COM2(2H2O)
(3)
在反应途径(2)中,1分子水从无穷远处逐渐接近次黄嘌呤Hx1时,由于静电作用生成具有氢键特征的复合物COM1(H2O),H14-O15 和H16-N1 键的键长分别为 0.171 6 和0.193 7 nm。当复合物COM1(H2O)中的水分子和Hx1再继续接近时,经过过渡态TS1,形成Hx2和1分子H2O,组成复合物COM2(H2O)。TS1是一个六元环的结构,N1-C6、 C6-O10、O10-H14、H14-O15、O15-H16 和 H16-N1的键距分别为0.138 2、0.127 9、0.124 9、0.119 2、0.120 0 和0.130 9 nm,另外复合物COM2(H2O)也是典型的氢键复合物,在该复合物中C6-O10键的键长为 0.123 2 nm,已形成典型的C=O双键。在1分子水催化的氢迁移过程中,H14向水分子移动的同时,水分子上的H16向Hx1的N1端迁移,该过程中氢质子的迁移是同步进行的,因此属于氢质子的同步穿梭反应。
反应途径(3)为2分子水催化的氢迁移反应历程。2分子水从无穷远处逐渐接近Hx1时生成具有氢键特征的复合物COM1(2H2O),其中H14-O15、H16-O18 和H19-N1 键的键长分别为 0.161 0、0.169 9和0.180 5 nm。接着Hx1的H14进攻1分子水H2O的O15端,该分子水H2O的H16端进攻另外1分子水H2O的O18端,它的O19进攻Hx1的N1端,只需跨越24.5 kJ/mol的能垒,就能经过八元环的过渡态TS2,形成具有氢键特征的复合物COM2(2H2O),复合物中包括Hx2和2分子H2O。在过渡态TS2中,C6-O10、O10-H14、H14-O15、O15-H16、H16-O18、O18-H19 和 H19-N1的键距分别为0.127 1、 0.128 3、0.114 0、0.118 1、0.123 5、0.115 7和0.135 1 nm。在复合物COM2(2H2O)中C6-O10键的键长为 0.123 4 nm,已形成典型的C=O双键,而O10-H14键的键长为 0.175 3 nm,已断裂。在2分子水催化的氢迁移过程中,H14、H16、H19的迁移是同步进行的,因此属于氢质子的同步穿梭反应。
2.2 氢迁移反应的能量性质
2.2.1 反应活化能分析
如果没有水参与,外界需要提供了130.3 kJ/mol的活化Gibbs自由能才能使Hx1发生内氢迁移反应,这在动力学上是很难发生的[16]。在有1分子水催化下,H2O和 Hx1靠氢键相互作用生成复合物COM1(H2O),放出大量的热,发生氢迁移反应的势能面较低。对于开放体系,只要吸收32.7 kJ/mol的活化Gibbs自由能,就能形成COM1(H2O)⟺COM2(H2O)平衡,而封闭体系需要的活化Gibbs自由能更小,氢迁移反应更容易发生。在2分子水催化下,对于开放体系,Hx1的氢迁移反应的活化Gibbs自由能仅为24.5 kJ/mol,而封闭体系需要的活化Gibbs自由能更小, Hx1的氢迁移反应更易发生了。总之,活化能分析表明,1分子水催化下,能降低97.6 kJ/mol的活化Gibbs自由能,2分子水催化下,能降低8.2 kJ/mol的活化Gibbs自由能,水催化下Hx1的氢迁移反应很容易进行,随着水分子数目的增加,对活化能垒的降低作用将明显减弱;水分子作为H质子穿梭的桥,因使过渡态环张力降低、氢键的形成等降低了反应的活化能,使氢迁移反应更容易进行。
2.2.2 能量分解分析
对于过渡态性质的研究,人们提出了能量分解的方法[17-18],反应活化能可以分解如下:
ΔG=ΔGstrain+ΔGint,
其中:ΔGstrain表示反应物物种从Hx1与H2O到TS的变形能,ΔGint表示反应物Hx1与H2O的相互作用能。很显然,反应物-水相互作用有利于稳定TS,降低反应的活化能。
从图3可以看出,从反应物到过渡态,Hx1由于具有比较大的变形能(130.3 kJ/mol),从而导致其有较高的活化能;相反地,Hx1-2H2O具有相对强的整体相互作用(-18.9 kJ/mol), 稳定了其TS,但其具有较小的变形能(5.6 kJ/mol),因此活化能很低;Hx1-H2O虽然整体相互作用能(-14.7 kJ/mol),但其具有一定的变形能(18.0 kJ/mol),因此也表现为较低的氢迁移活化能;对于Hx1-H2O、Hx1-2H2O表现出的强的整体相互作用能,可归结为其独特的氢键的形成。该结论与前面活化能分析的结论一致。
3 结论
采用DFT-B3LYP/6-31G**方法研究了次黄嘌呤的氢迁移反应机理。反应坐标计算表明次黄嘌呤的氢迁移反应是一步完成的,无水催化时经过四元环过渡态发生分子内氢迁移反应;有水催化时,其氢迁移反应都属于分子间氢质子的同步穿梭反应。
活化能分析表明:无水催化时,Hx1氢迁移反应的活化能较高,热力学上难以发生;而有水催化时氢键的形成降低了Hx1氢迁移反应的活化能,使氢迁移反应更容易进行。能量分解分析表明,Hx1-1H2O、Hx1-2H2O因氢键的形成具有相对强的整体相互作用能,很好地稳定了Hx1氢迁移的过渡态TS。本文研究结果为人们进一步认识氢迁移反应的作用机制及能量分析提供了新的研究思路。

