霍氏肠杆菌β-胡萝卜素9,10'双加氧酶的制备及其应用
魏 涛,王 敏,张志平,段乃心,杨 旭,黄 申,毛多斌*
(郑州轻工业大学 食品与生物工程学院,河南 郑州 450002)
β-紫罗兰酮[4-(2,6,6-三甲基-1-环己烯基)-3-丁烯-2-酮]又名芷香酮,是一种具有木香带紫罗兰花香的名贵香料,同时也是合成维生素A、E、视黄酸及β-胡萝卜素的重要中间体,广泛应用于食品、香料、化妆品和医药工业中[1-3]。β-紫罗兰酮是环化的类异戊二烯的代表,具有较强的生物活性[4],对肿瘤的发生有抑制作用[5],且在抗癌、抗真菌和降血脂都有一定的效果[6-9]。β-紫罗兰酮是植物次级代谢产物,采用提取的方法从植物得到的含量较低且成本昂贵[10-11]。目前,β-紫罗兰酮主要来源于以柠檬醛为原料的化学合成,但一般采用化学合成方法得到的物质为混合物[12-14],且化学方法的工艺较为复杂、产生的废液污染环境。生物酶法制备β-紫罗兰酮是近年来发展起来的新方法,该方法具有生产成本低、专一性强、操作方便和环境友好等优势[15-16]。由于受健康生活观念的影响,消费者倾向于选择天然香料,因此天然香料具有良好的市场前景,而微生物酶法得到的香料被视为“天然香料”[17]。郑坚强等[18]利用西方许旺酵母(Schwanniomyces occidentalis)发酵液转化β-胡萝卜素生成β-紫罗兰酮,发酵时间8 d,产物中β-紫罗兰酮的含量只有22.36%;SCHWARTZ S H等[19]将类胡萝卜素裂解双加氧酶成功导入大肠杆菌(Escherichia coli)中进行表达,并证明了该酶能对类胡萝卜素中第9和第10个碳原子之间的双键进行有效切割。NACKE C等[20]利用类胡萝卜素裂解双加氧酶大肠杆菌(Escherichia coli)工程菌的细胞破碎液催化β-胡萝卜素转化为β-紫罗兰酮,产率达到60%。
目前生物酶法制备β-紫罗兰酮存在主要问题是:催化专一性不高,反应产物较多,反应时间较长及β-紫罗兰酮产率不高等问题。本研究将源自霍氏肠杆菌(Enterobacter hormaechei)的β-胡萝卜素9,10'双加氧酶基因在大肠杆菌中BL21(DE3)中克隆表达,利用生物酶法催化水解β-胡萝卜素生成β-紫罗兰酮,获得一种适用于工业化生产β-紫罗兰酮的新型酶催化剂,优化酶法制备β-紫罗兰酮反应条件,研究成果预期为实现香精香料的绿色合成奠定理论和应用基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
霍氏肠杆菌(Enterobacter hormaechei):本实验室筛选获得,保藏于中国微生物菌种保藏管理委员会普通微生物中心(China committee for culture collection of microorganisms,CCCCM),保藏号为CGMCC No.1.10608。克隆与表达质粒载体pET15b-SM:本实验室构建与保存。
1.1.2 试剂
β-胡萝卜素(纯度96%):上海麦克林生化科技有限公司;大肠杆菌(Escherichia coli)DH5α、限制性内切酶NdeI和SalI、PyrobestTMDNA聚合酶、脱氧核糖核酸(deoxyribonucleic acid,DNA)连接试剂盒(kit ver.2.1)、细菌基因组DNA提取试剂盒(kit ver.3.0):日本TAKARA公司;大肠杆菌(Escherichia coli)BL21(DE3):德国Novagen公司;蔗糖(分析纯)、酵母浸粉(生化试剂)、氯霉素(分析纯)、10×磷酸盐缓冲液(phosphate buffered solution,PBS)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)(分析纯):生工生物工程(上海)股份有限公司。
1.1.3 培养基
LB培养基:胰蛋白胨1.0%,酵母浸粉0.5%,NaCl 1.0%。
含氨苄青霉素和氯霉素的LB液体培养基:胰蛋白胨1%,酵母浸粉0.5%,NaCl 1.0%,氨苄青霉素质量浓度为100 mg/L,氯霉素质量浓度为34 mg/L。
改良察氏培养基[21-22]:K2HPO40.2%,MgSO4·7H2O 0.1%,NaNO30.2%,FeSO4·7H2O 0.005%,KCl 0.1%,蔗糖5%,酵母浸粉0.5%。
以上所有培养基均在121 ℃条件下灭菌20 min。
1.2 仪器与设备
Y92-Ⅲ超声波细胞粉碎机:宁波新芝生物科技股份有限公司;DYY-6C电泳仪:北京市六一仪器厂;Alltech Prevail C18色谱柱(25 cm×4.6 cm):美国奥泰公司;JB-680B全自动凝胶成像分析仪:上海培清科技有限公司;15K低温离心机:美国Sigma-Aldrich公司;LC2010A/C型高效液相色谱(high performance liquid chromatography,HPLC)仪、SPD-M10A二极管阵列检测器:日本岛津公司;聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司。
1.3 方法
1.3.1 PCR扩增及重组质粒的构建
利用细菌基因组DNA提取试剂盒提取霍氏肠杆菌基因组DNA(提取方法见试剂盒说明书)。按照目前已经报道类胡萝卜素9、10'双加氧酶保守氨基酸序列,设计一对引物:上游引物5'-CGCCATATGGGAGAAGTAGCGAAGGAGGAAGTAGAAG-3',下游引物5'-CTAGTCGACTCAGTCGGTTGCTGCCA-3',其中,CATATG为上游引物NdeI酶切位点,GTCGAC为下游引物SalI酶切位点。以霍氏肠杆菌全基因组序列为模板进行PCR扩增,PCR扩增体系(50 μL)如下:模板(25 ng)1 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(25 mmol/L)1 μL,引物(100 μmol/L)各0.5 μL,10×PBS缓冲液5 μL,ProbestTMDNA聚合酶(5 U/μL)1 μL,超纯水41 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性45 s,51 ℃退火60 s,72 ℃延伸2 min,30个循环;72 ℃再延伸10 min。
PCR产物经NdeI酶和SalI酶双酶切后,连接到经同样内切酶酶切的pET15b-SM上,双酶切反应体系(20 μL)如下:PCR产物/pET15b-SM(400 ng)16 μL,NdeI内切酶(15 U/μL)1 μL,SalI内切酶(15 U/μL)1 μL,10×PBS缓冲液2 μL。双酶切反应混合液37 ℃反应4 h。
连接产物转化大肠杆菌E.coliDH5α,筛选重组质粒,并进行双酶切及测序验证,经测序分析鉴定得到β-胡萝卜素9,10'双加氧酶基因的序列和β-胡萝卜素9,10'双加氧酶的氨基酸序列。pET15b-SM是在Novogen原核表达载体pET15b基础上改造而成,在原多克隆位点添加了SalI和NsiI酶切位点,便于基因克隆以及提高蛋白表达量。
1.3.2 基因的诱导表达与蛋白质的纯化
将重组质粒转化E.coliBL21(DE3)。带有重组质粒的表达菌在含氨苄青霉素和氯霉素的LB液体培养基中过夜培养,然后按1%接种量接到300 mL含氨苄青霉素的LB液体培养基培养2 h,使OD600nm值为0.5;加入终浓度0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)于37 ℃继续培养4 h,4 ℃、12 000×g离心15 min。使用破壁缓冲液(50 mmol/L Tris-HCl,pH 8.0,50 mmol/L NaCl)悬浮收集菌体,超声波细胞粉碎机破碎菌体,12 000×g离心15 min,得到粗酶液。进一步采用镍柱亲和层析(洗脱缓冲液:20mmol/LTris-HCl,pH 7.5,500 mmol/L NaCl,300 mmol/L imidazole)和分子筛Sephacryl TM S-200 HR column(洗脱缓冲液:20 mmol/L Tris-HCl,pH 7.5,100 mmol/L NaCl;洗脱速度为:1 mL/min)纯化后,得到纯化的酶蛋白,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelectrophoresis,SDS-PAGE)来检测纯化效果。
1.3.3β-胡萝卜素9,10'双加氧酶酶活力的测定
β-胡萝卜素9,10'双加氧酶的酶活标准反应体系如下[23-25]:0.5 mg/mLβ-胡萝卜素、10 mmol/L三(2-甲酰乙基)膦盐酸盐(tris(2-carboxylethyl)phosphine hydrochloride,TCEP)、5%辛基-β-D-硫代吡喃葡萄糖苷(octylthioglucoside,OTG)、10 mmol/L FeSO4·7H2O、0.5%Tween 80、1 mmol/L二硫苏糖醇(dithiothreitol,DTT)、100mmol/LNaCl、80mmol/L Tricine/KOH缓冲液(pH8.5)和0.4 U/mL双加氧酶酶液。以不含有酶液的上述反应体系作对照组,40 ℃酶解60 min,加入37%的甲醛终止反应。测定酶活计算相对酶活。相对酶活:以最适反应条件下,对应酶活为参考值,其他条件下酶活与最适反应条件下酶活的比值。
β-胡萝卜素9,10'双加氧酶酶活力单位定义为:在一定条件下,每分钟生成1 μmol的β-紫罗兰酮所需要的酶量为一个活力单位(U/mL)。
高效液相色谱(HPLC)法检测反应产物,其色谱条件为:色谱柱为Alltech Prevail C18柱(25 cm×4.6 cm),采用二极管阵列检测器,流动相为正己烷∶甲基叔丁基醚(95∶5,V/V),洗脱速度为1.0 mL/min,在波长460 nm检测。分别量取0、30 μL、50 μL、100 μL、200 μL、400 μL、500 μL、700 μL、800 μL、900 μLβ-胡萝卜素储备液于10支25 mL容量瓶中,加蒸馏水定容,分光光度法测460 nm处吸光度值,以蒸馏水为空白对照,根据所得数据制定标准曲线。得到线性方程为y=0.2764x+0.0051(相关系数R2=0.9999)。式中,x表示β-胡萝卜素水溶液的质量浓度(μg/mL),y表示峰面积。
1.3.4 重组β-胡萝卜素9,10'双加氧酶酶学性质研究
(1)最适反应温度
在不同温度(22.5~50 ℃)下反应60 min,比较酶活性的大小,确定最适温度。
(2)最适反应pH值
在不同pH值(6.0~10.5)的缓冲液中检测酶活,所用缓冲液为磷酸盐缓冲液(50 mmol/L,pH 6.0~7.5)、Tris-HCl缓冲液(50 mmol/L,pH7.5~9.0)和CAPS缓冲液(50 mmol/L,pH 9.0~10.5),再确定最适反应pH值。
(3)酶浓度对β-紫罗兰酮产量的影响
在反应体系中分别添加不同质量浓度的β-胡萝卜素9,10'双加氧酶(0~0.6 U/mL),检测β-紫罗兰酮产量。
(4)底物浓度对β-紫罗兰酮产量的影响
在酶活为4 U/mL的反应体系中添加不同浓度底物浓度的β-胡萝卜素(0~800 mg/L),检测β-紫罗兰酮产量。
2 结果与分析
2.1 重组质粒双酶切结果验证
连接产物转化大肠杆菌E.coliDH5α,筛选重组质粒,并进行双酶切,结果见图1。由图1可知,β-胡萝卜素9,10'双加氧酶基因的PCR扩增的碱基长度约为1 500 bp。经过对重组质粒进行测序,得到编码β-胡萝卜素9,10'双加氧酶的核苷酸为1 485 bp。
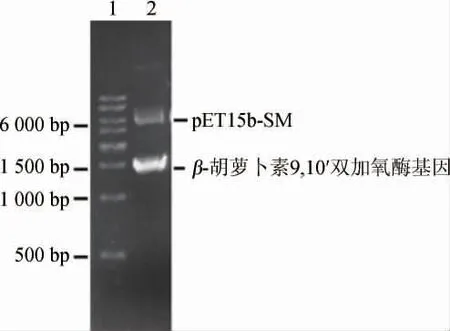
图1 β-胡萝卜素9,10'双加氧酶基因的PCR扩增电泳图Fig.1 PCR amplification electrophoresis of β-carotene-9,10'-dioxygenase gene
2.2 β-胡萝卜素9,10'双加氧酶基因序列分析
连接产物转化大肠杆菌E.coliDH5α,筛选重组质粒,并进行双酶切的基因序列分析,结果见图2。由图2可知,该β-胡萝卜素9,10'双加氧酶基因包含1 485 bp碱基,编码494个氨基酸。

图2 β-胡萝卜素9,10'双加氧酶基因的序列Fig.2 Sequence of β-carotene-9,10'-dioxygenase gene
2.3 β-胡萝卜素9,10'双加氧酶基因的扩增及表达
重组质粒在E.coliBL21(DE3)中表达后,通过超声波破壁、镍柱亲和层析和分子筛Sephacryl TM S-200 HR column处理,得到纯化重组胡萝卜素9,10'双加氧酶,SDS-PAGE分析结果见图3。由图3可知,该酶分子质量约57 kDa。
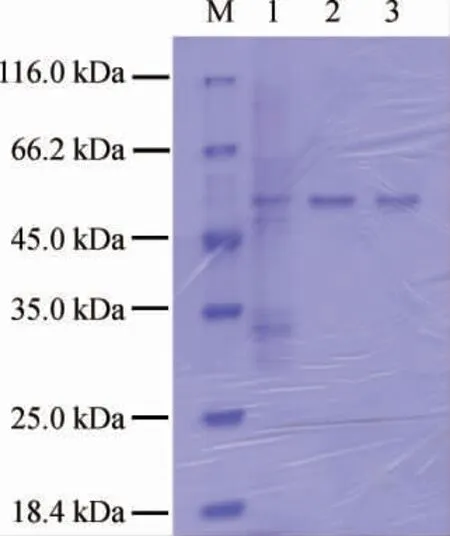
图3 β-胡萝卜素9,10'双加氧酶SDS-PAGE纯化结果Fig.3 SDS-PAGE purification results of β-carotene-9,10'-dioxygenase
2.4 β-胡萝卜素9,10'双加氧酶催化反应产物β-紫罗兰酮
β-胡萝卜素标准物和β-胡萝卜素9,10'双加氧酶水解产物HPLC分析结果见图4。由图4可知,β-胡萝卜素9,10'双加氧酶具有裂解β-胡萝卜素9,10'双键的活性,β-胡萝卜素9,10'双加氧酶可以转化β-胡萝卜素制备β-紫罗兰酮。

图4 β-胡萝卜素标准物(a)和β-胡萝卜素9,10'双加氧酶水解产物(b)HPLC分析结果Fig.4 HPLC analyse results of β-carolene slandard (a) and β-carotene-9,10'-dioxygenase hydrolysates (b)
2.5 β-胡萝卜素9,10'双加氧酶酶学性质的研究
2.5.1β-胡萝卜素9,10'双加氧酶的最适反应温度
温度对β-胡萝卜素9,10'双加氧酶的影响结果见图5。由图5可知,随着温度在22.5~40 ℃范围内的升高,相对酶活也在逐渐升高;当反应温度达到40 ℃时,β-胡萝卜素9,10'双加氧酶的相对酶活达到最大值;当反应温度高于40 ℃时,酶活逐渐降低。因此,β-胡萝卜素9,10'双加氧酶的最适反应温度为40 ℃。
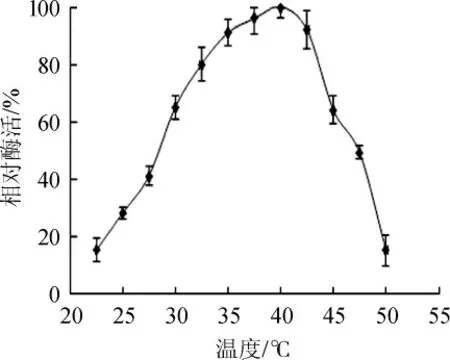
图5 β-胡萝卜素9,10'双加氧酶的最适反应温度Fig.5 The optimal reaction temperature of β-carotene-9,10'-dioxygenase
2.5.2β-胡萝卜素9,10'双加氧酶的最适反应pH值
pH值会改变位于酶活性中心、底物和辅酶的解离状态,进而改变酶与底物的结合状态以及催化水平[26-27]。pH值对β-胡萝卜素9,10'双加氧酶的影响结果见图6。由图6可知,随着pH值在6.0~8.5范围内的增加,相对酶活逐渐增加;当pH值为8.5时,相对酶活达到最大值;当pH值>8.5时,相对酶活下降。因此,β-胡萝卜素9,10'双加氧酶最适反应pH值为8.5。
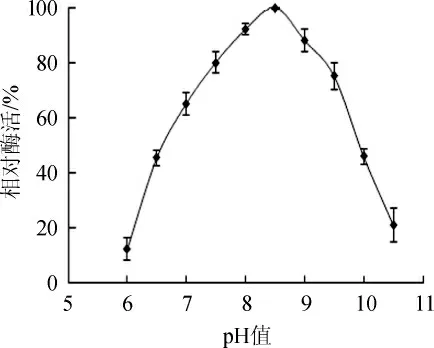
图6 β-胡萝卜素9,10'双加氧酶的最适反应pH值Fig.6 Optimal reaction pH of β-carotene-9,10'-dioxygenase
2.5.3 酶浓度对β-紫罗兰酮产量的影响
酶浓度对β-紫罗兰酮产量的影响见图7。由图7可知,随着酶活在0~0.4 U/mL范围内的增加,β-紫罗兰酮的相对产量逐渐增加;当酶活为0.4 U/mL时,β-紫罗兰酮的产量达到最大值,为115.9 mg/L;随着酶活>0.4 U/mL之后,β-紫罗兰酮的产量逐渐下降。因此,最适酶活为0.4 U/mL。

图7 酶活对β-紫罗兰酮产量的影响Fig.7 Effect of enzyme activity on β-ionone production
2.5.4 底物浓度对β-紫罗兰酮产量的影响
底物浓度对β-紫罗兰酮产量的影响见图8。由图8可知,随着底物质量浓度在0~500 mg/L范围内的增加,β-紫罗兰酮产量逐渐增加;当底物质量浓度为500 mg/L时,β-紫罗兰酮的产量达到最大值,为123.6 mg/L;当底物质量浓度>500 mg/L之后,β-紫罗兰酮产量逐渐下降。因此,最适底物质量浓度为500 mg/L。
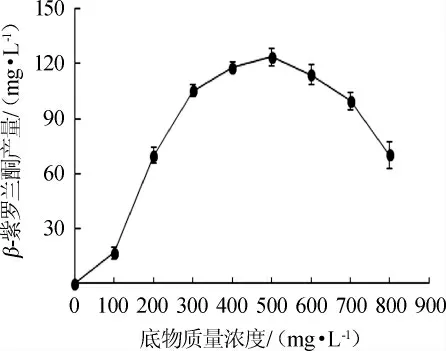
图8 底物质量浓度对β-紫罗兰酮产量的影响Fig.8 Effect of substrate mass concentration on β-ionone production
2.6 最佳反应条件下β-紫罗兰酮产量
在温度40℃,pH值8.5,β-胡萝卜素质量浓度为500mg/L,β-胡萝卜素9,10'双加氧酶酶活0.4 U/mL的最佳反应条件下,β-紫罗兰酮产量结果见图9。由图9可知,β-胡萝卜素9,10'双加氧酶在最佳条件下反应12 h,生成的β-紫罗兰酮产量为142.3 mg/L,产率达到79.4%。结果表明,该酶可以高效催化合成β-紫罗兰酮,具有很好的工业应用价值。
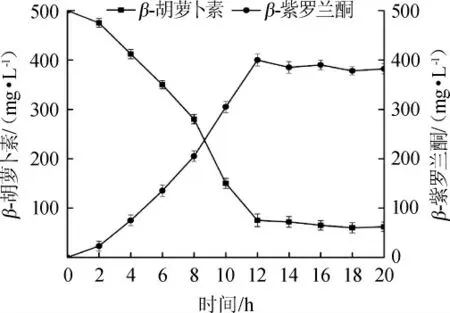
图9 在最佳反应条件下β-紫罗兰酮产量Fig.9 β-ionone yield under the optimal reaction conditions
3 结论
本实验在霍氏肠杆菌中发现了一种能够高效催化降解β-胡萝卜素的类胡萝卜素9,10'双加氧酶的菌株,该菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.1.10608。采用基因工程方法在大肠杆菌E.coli中克隆表达该双加氧酶基因,经镍柱亲和层析和分子筛Sephacryl TM S-200等方法制备了该酶蛋白,分子质量为57 kDa。酶学性质研究表明,该酶的最适反应温度和反应pH值分别为40 ℃和8.5。在最佳反应条件:底物β-胡萝卜素质量浓度500 mg/L,类胡萝卜素9,10'双加氧酶酶质量浓度0.4 U/mL,反应温度40 ℃,水解反应12 h,反应pH 8.5,β-紫罗兰酮产量为142.3 mg/L,产率达到79.4%。综上所述,霍氏肠杆菌β-胡萝卜素9,10'双加氧酶具有良好的催化活性,可以高效催化降解β-胡萝卜素,制备β-紫罗兰酮,具有较好的工业应用前景。

