中药调控色氨酸-肠道菌群代谢治疗溃疡性结肠炎的进展
刘涛 欧阳林旗 陈镇 徐寅 吴金鸿 邓桂明

〔摘要〕 溃疡性结肠炎(ulcerative colitis, UC)是一种慢性、易复发的炎症性肠病,临床上以血性腹泻、腹痛等为特征症状。UC的发病机制与肠黏膜免疫异常、肠道菌群失调、色氨酸代谢紊乱等密切相关。色氨酸-肠道菌群代谢能促进机体肠道免疫功能的发育和完善,因而对缓解肠道炎症具有重要意义。中医药在治疗UC方面具有一定的特色和优势,许多中药及中药复方被证实有明显的免疫调节作用。本文就UC中色氨酸-肠道菌群代谢对肠黏膜屏障功能和免疫功能的影响,以及中药调控色氨酸-肠道菌群代谢治疗UC的研究进展进行综述,以期为中药治疗UC的机制研究与新药研发提供参考。
〔关键词〕 溃疡性结肠炎;色氨酸-肠道菌群代谢;免疫功能;肠道炎症;中药
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.02.027
Research progress on traditional Chinese medicine regulating tryptophan-gut microbiota
metabolism in the treatment of ulcerative colitis
LIU Tao1, OUYANG Linqi1,2, CHEN Zhen1, XU Yin1, WU Jinhong1, DENG Guiming1*
(1. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China;
2. School of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Ulcerative colitis (UC) is a chronic, recurring inflammatory bowel disease, clinically characterized by bloody diarrhea and abdominal pain. The pathogenesis of UC is closely related to abnormal intestinal mucosal immunity, imbalance of gut microbiota, and tryptophan metabolism disorder. The tryptophan-gut microbiota metabolism can promote the development and perfection of the body's intestinal immune function, so it is of great significance to alleviate intestinal inflammation. Traditional Chinese medicine has characteristics advantages in UC treatment. Many single herb and traditional Chinese medicine compound were proved having obvious effect of immunological regulation. In this review, we focused on the effects of tryptophan-gut microbiota metabolism on intestinal mucosal barrier function and immune function in UC, and the research progress of traditional Chinese medicine on regulating tryptophan-gut microbiota metabolism for the treatment of UC, with a view to providing references for mechanistic studies of traditional Chinese medicine for the treatment of UC and the development of new drugs.
〔Keywords〕 ulcerative colitis; tryptophan-gut microbiota metabolism; immune function; intestinal inflammation; traditional Chinese medicine
溃疡性结肠炎(ulcerative colitis, UC)是一种特发性、慢性的炎症性肠病,病变部位始于直肠,继而延伸至整个结肠[1]。血性腹泻是UC的特征性症状,临床上常通过结肠镜检和组织病理学对其进行诊断辨别[1]。目前,UC的发病机制尚不明确,研究显示,其作用机制与遗传易感性、环境因素、肠道免疫异常、肠道菌群失调、色氨酸(tryptophan, TRP)异常代谢、上皮屏障缺陷等密切相关[2]。
TRP是机体中八大必需氨基酸之一,其经肠道菌群代谢途径生成的活性物质,在维持肠道菌群多样性、肠道屏障完整性、肠道免疫平衡等方面具有重要作用[3]。TRP-肠道菌群途径上的代谢物可刺激相关免疫细胞和免疫細胞因子,介导肠道免疫,因此,它被视为联系肠道菌群和肠道免疫的重要桥梁[4]。TRP经肠道菌群代谢后,不仅可以增强肠道机械屏障功能、维持肠道屏障完整性,还能诱导T细胞和先天性淋巴细胞(innate lymphoid cells, ILCs)增殖、分化,增强肠黏膜免疫功能[4-5]。因此,TRP-肠道菌群代谢对维持肠黏膜屏障功能,以及肠道免疫系统的发育具有重要意义。TRP-肠道菌群代谢失衡导致肠黏膜屏障功能受损,继而引起UC等疾病的发生、发展[6-7]。
目前,临床上西药治疗UC主要以5-氨基水杨酸盐、糖皮质类固醇、免疫抑制剂、干扰素等为主,而这类药物对UC治标不治本,长期使用易给患者带来诸多不良反应[8]。然而,中医药在防治炎症性肠病方面具有疗效显著、不良反应少、复发率低等优势和特色。因此,本文拟从TRP-肠道菌群代谢对肠道免疫的调控角度,阐明TRP-肠道菌群、肠黏膜屏障、UC三者之间的关系,系统梳理近年来中药调控TRP-肠道菌群代谢治疗UC的研究进展。
1 TRP-肠道菌群代谢通路
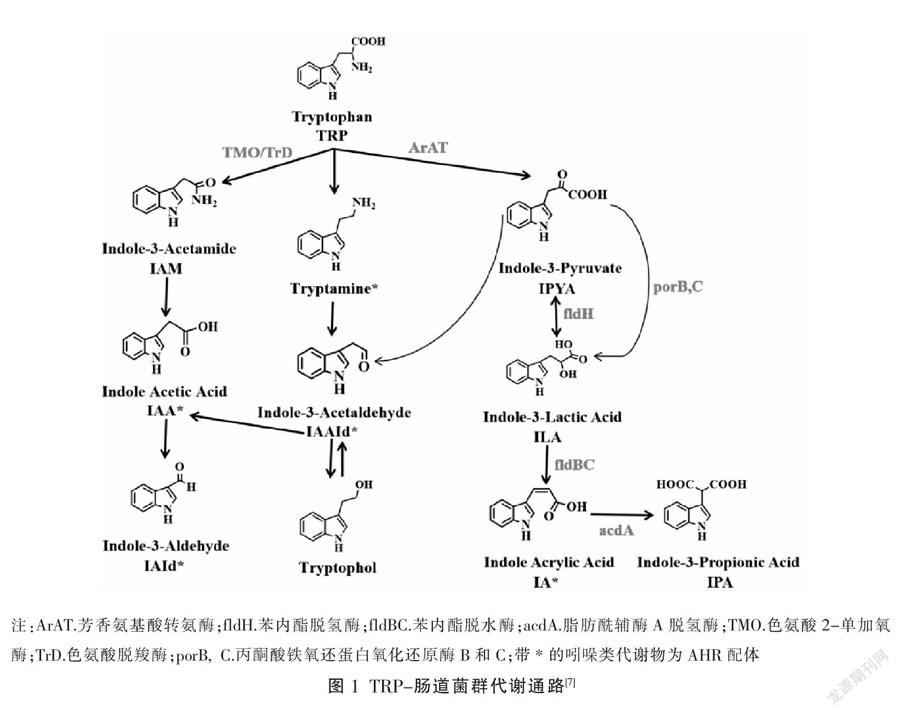
饮食是哺乳动物摄取TRP主要途径,摄入的TRP大部分在体内被分解代谢。肠道菌群被视为TRP代谢的重要驱动力,TRP沿着肠道菌群代谢途径(见图1)生成吲哚-3-甲醛(indole-3-aldehyde, IAId)、吲哚-2-乙酸(indole acetic acid, IAA)、吲哚-3-丙酸(indole-3-propionic, IPA)、吲哚-3-乳酸(indole-3-lactic acid, ILA)、吲哚-3-乙醛(indole-3-acetaldehyde, IAAId)、吲哚-3-乙酰胺(indole-3-acetamide, IAM)等芳香烃受体(aryl hydrocarbon receptor, AHR)配体。AHR信号是维持肠道稳态的关键因素,它被激活后能够促进肠上皮细胞更新,免疫细胞增殖、分化,从而维持肠黏膜屏障完整性[9]。
2 TRP-肠道菌群代谢对肠黏膜屏障的影响
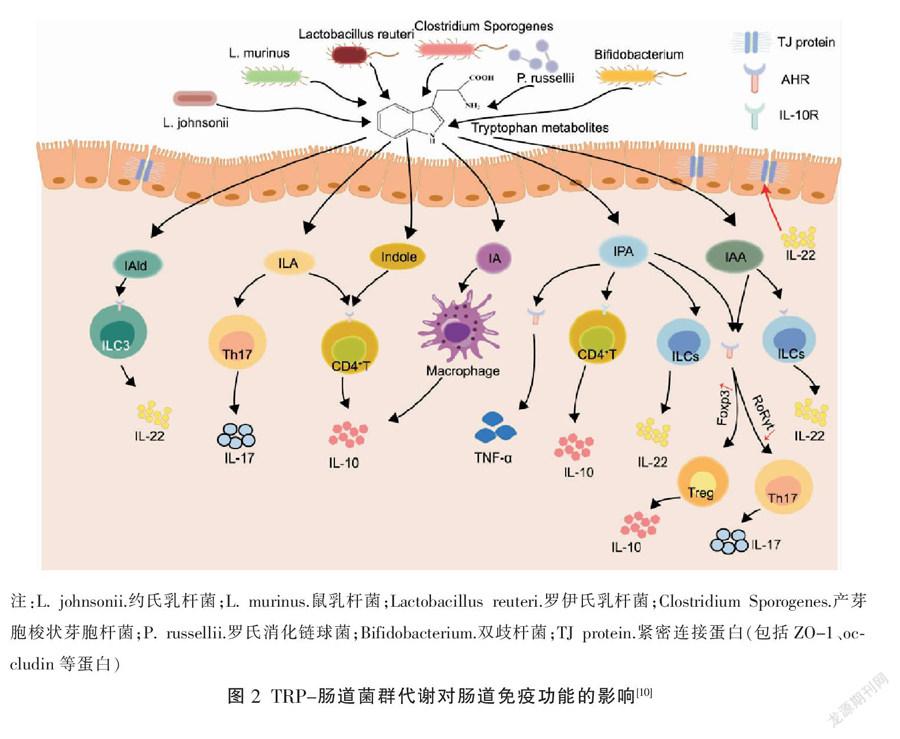
肠道菌群代谢途径上的TRP代谢物可通过增强肠道机械屏障功能,维持肠道屏障完整性;同时还能促进肠道免疫系统的发育和完善,如诱导T淋巴细胞及ILCs增殖、分化,增强肠黏膜免疫功能(见图2)。
2.1 维持肠黏膜机械屏障的完整性
TRP-肠道菌群代谢物可通过激活AHR,增强肠上皮细胞紧密连接蛋白表达,减轻肠道炎症,最终维持肠黏膜屏障完整性。Choi等[11]研究证明,吲哚可增强肠道中紧密连接蛋白Claudin-1的表达,降低肠道屏障通透性。Scott S等[12]研究发现,吲哚-3-乙醇、IPA、IAAId等能够抑制小鼠体内肌球蛋白IIA及Rzin的表达活性,降低肠道屏障通透性,维持肠道屏障完整性,缓解小鼠结肠炎症。Dodd等[13]在无菌小鼠中定植引起fldC(生成IPA相关的基因)突变的生孢梭菌后,发现该小鼠血清中IPA含量降低,肠道通透性随之也降低。由此说明,IPA、IAA等吲哚衍生物可以降低小鼠肠道通透性。此外,IA等TRP代谢物可激活AHR信号,促进肠道中杯状细胞分泌黏液蛋白,从而增强肠上皮屏障功能,缓解小鼠的炎症反应[14]。
2.2 增强肠黏膜免疫功能
2.2.1 调控T细胞的增殖分化 TRP-肠道菌群代谢物可通过激活AHR信号促进T细胞的增殖、分化,增强机体肠黏膜免疫功能。TRP在双歧杆菌、乳杆菌等肠道微生物作用下代谢生成IPA、ILA等AHR配体。其中,ILA以剂量依赖的方式激活AHR信号,减少Th17细胞极化,上调 Th17细胞中的免疫调节半乳糖凝集素1,增强肠黏膜免疫功能[15]。此外,TRP在类杆菌作用下生成IAA、IPA、IAId等AHR配体,它们能够激活AHR信号诱导CD4+T细胞分化,促进IL-10分泌、释放,最终增强UC大鼠肠道免疫功能[16-17]。
2.2.2 介导ILCs的增殖与分化 ILCs是先天性免疫系统的重要组成,其主要被分为5个亚群:NK细胞、ILC1s、ILC2s、ILC3s和LTI10细胞[18]。其中,ILC3s能够主动分泌和释放IL-22,促进肠道中抗菌肽的表达,增强肠黏膜免疫功能[19]。研究者给结肠炎小鼠补充TRP后,发现该小鼠血清中IL-22的表达伴随着IAA浓度的增加而上调[20]。原因在于,TRP在约氏乳杆菌、罗伊氏乳杆菌、鼠乳杆菌、梭状芽胞杆菌等作用下被代谢生成IAId、IPA、IAA等AHR配体,它们能够激活AHR刺激ILC3s分泌、释放IL-22 [21-22]。由此表明,TRP-肠道菌群代谢能够诱导ILCs增殖、分化成ILC3s,促进IL-22等免疫细胞因子的分泌和释放,增强肠黏膜免疫功能。
3 TRP-肠道菌群代谢对UC的影响
肠道菌群及其代谢物在维持肠道健康方面具有重要作用,当前已引起了人们极大的关注。当CARD9基因被敲除后,小鼠体内TRP-肠道菌群代谢通路出现异常,从而导致该小鼠患UC的风险增加。但给CARD9基因表达缺陷的小鼠补充IAA、IPA等TRP-肠道菌群代谢物后,其肠道中IL-22水平显著增加,结肠炎症反应得到抑制[23]。此外,TRP经肠道菌群代谢途径生成的IPA、IAA等TRP代谢物能够激活AHR来维持UC小鼠结肠中Th17/Treg细胞平衡,改善其病理症状[17]。由此表明,TRP-肠道菌群代谢在抑制UC小鼠肠道炎症反应、改善该小鼠病理症状等方面具有重要作用。
4 中药调控TRP-肠道菌群代谢治疗UC
中医药传承数千年,为人类疾病的预防和治疗作出了重大贡献。中药作为中医防治疾病的物质基础,基于其多成分、多靶点、整体调控的优势,近年来已成为治疗UC的重要手段。UC属于中医学“久痢”“肠澼”的范畴,其病机以脾胃虚弱为本、湿热蕴结为标,属本虚标实,故临床上治療UC以清热化湿止痢为主,兼以健脾固肾,常用代表方有大黄牡丹汤、清肠温中汤、理中汤、黄芩汤、白头翁汤等[24-25]。中医在治疗UC时,除了使用方药服用等内治法外,还会采用针灸、穴位埋线、灌肠等中医外治法。其中,灌肠液常用中药有黄连、黄芩、黄柏、赤芍、白芍、厚朴、干姜等。大量动物实验研究[26-42]发现,以TRP-肠道菌群代谢通路为作用靶点,中药(中药活性成分、复方)能够有效降低UC小鼠肠道炎症严重程度(见表1)。
4.1 活性成分
4.1.1 生物碱 生物碱是一类具有环状结构的含氮有机化合物。研究发现,小檗碱、巴马汀等生物碱具有减轻UC大鼠肠道炎症程度的活性[26-27]。毛茛科植物黄连根茎中蕴含着大量的生物碱,如小檗碱、巴马汀等。其中,小檗碱可显著改善UC大鼠肠道菌群失调状态,特别是逆转乳酸杆菌、拟杆菌等微生物的失调,促进TRP代谢生成IPA、IAA和IA,进而激活AHR信号,提高紧密连接蛋白和IL-22的表达水平,恢复UC大鼠肠道屏障功能[26]。Zhang等[27]研究发现,巴马汀也能恢复UC小鼠肠道菌群平衡,从而介导小鼠体内TRP代谢,以此增强UC小鼠肠道免疫功能,发挥抗UC的活性。
4.1.2 多酚类 多酚是指植物中具有酚羟基结构的一类化合物,具有抗氧化、抗炎等药理作用。Zhao等[43]研究发现,木兰科植物厚朴中的厚朴酚具有抗UC的活性,其作用机制是通过促进TRP代谢生成IAA、IA等AHR配体,激活AHR信号,增强小鼠肠道免疫功能,降低结肠中炎症细胞因子(TNF-α、IL-6和IL-1β)水平,从而改善UC小鼠结肠病变状态。
4.1.3 多糖类 植物多糖是一类由糖苷键连接而成的天然高分子化合物,它是维持生命活动正常运转的基本物质之一。近年来,研究发现白术多糖、银耳多糖、姜黄多糖等化合物对UC具有拮抗作用[28-30]。Feng等[28]研究发现,白术多糖能够恢复UC小鼠肠道菌群紊乱状态,促进血浆中TRP等氨基酸代谢,最终发挥治疗UC的作用。Xu等[29]发现,银耳多糖可通过调控UC小鼠肠道菌群,促进其体内TPR代谢生成5-羟基吲哚等吲哚类物质,激活AHR信号,从而抑制该小鼠肠道炎症反应,改善其结肠病理症状。Yang等[30]研究发现,姜科植物姜黄中的姜黄多糖能够改善UC小鼠肠道菌群失调状态,增加乳酸菌、梭状芽孢杆菌等细菌的丰度,促进IAA、IAAId、IAM等AHR配体生成,通过激活AHR信号来上调肠道紧密连接蛋白表达,修复UC小鼠肠道屏障功能,抑制结肠炎症反应。此外,茯砖茶多糖同样能够缓解UC小鼠症状,其主要作用机制是:茯砖茶多糖能够改善UC小鼠肠道菌群紊乱状态,提高肠道中乳酸菌和阿克曼菌的丰度和数量,促进TRP代谢生成IAId、IAA等AHR配体,从而增强结肠中IL-22以及ZO-1、occludin表达,最终改善UC小鼠肠道炎症,修复其肠道屏障[31]。
4.1.4 黄酮类 天然黄酮类化合物是一类植物次生代谢产物,广泛存在于植物中。近年来,大量研究发现,黄酮类化合物具有抗UC的活性,如黄芩素、山姜素、柚皮素等[44-46]。黄芩素是唇形科植物黄芩中黄酮类成分含量最高的化合物之一,研究发现,黄芩素可直接激活AHR来调控Th17/Treg细胞平衡,最终对UC小鼠发挥治疗作用[44]。此外,姜科植物高良姜中的山姜素和柚皮素同样能够对UC小鼠产生治疗作用,其作用机制与黄芩素对UC小鼠产生的作用机制类似[45-47]。
4.1.5 其他 白芍总苷是一种由芍药苷、白芍内酯等单体成分组成的混合物,它不仅具有免疫调节、抗炎等作用,而且对肠道菌群也具有调控作用[48]。范淇淋[32]研究发现,白芍总苷能够升高乳酸菌、瘤胃球菌,以及降低拟杆菌等肠道微生物丰度,恢复UC小鼠肠道菌群失调状态,从而促进TRP代谢,增加结肠中IAA浓度、降低ILA浓度,最终改善UC小鼠症状。由广藿香醇和广藿香酮组成的广藿香油源于唇形科植物广藿香,其具有抗炎、抗菌、免疫调节等药理作用[49]。研究发现,广藿香油可通过调控UC小鼠肠道菌群变化,促进该小鼠体内TRP等氨基酸代谢,最终改善UC小鼠的病理症状[33-34]。
4.2 复方中药
大黄牡丹汤是临床上治疗UC的常用方,该方出自张仲景的《金匮要略》,具有泻热破瘀、散结消肿的功效。有研究表明,大黄牡丹汤对UC小鼠肠道菌群进行调节后,发现该模型动物血清中TRP及吲哚类代谢物等AHR配体水平增加,其肠道Th17/Treg细胞之间的平衡得以恢复,UC小鼠肠道炎症有所减轻[35-36],由此表明,大黄牡丹汤可以通过TRP-肠道菌群代谢通路来调控UC小鼠肠道免疫功能,发挥抗UC的作用。
清肠温中汤是由李军翔教授常年治疗UC总结出来的经验方,该方具有健脾温中、化瘀止血的功效。Sun等[37]研究发现,清肠温中汤能够调节UC小鼠肠道菌群的代谢谱变化,特别是它能够增强TRP代谢,并通过激活Wnt/β-连环蛋白信号,促进肠道干细胞介导的上皮再生,最终对UC小鼠肠黏膜屏障完整性起到保护作用。
理中汤源自张仲景的《金匮要略》,具有温中祛寒、补气健脾等功效,临床上常用于治療UC、急/慢性胃炎等脾胃虚寒证。有研究表明,理中汤可以重新塑造肠道菌群结构,同时改变菌群代谢谱,促进UC小鼠肠道TRP等内源性物质代谢,增强肠道免疫功能,最终发挥抗UC的作用[38]。此外,临床上也常用黄芩汤来治疗UC,该方发挥抗UC的作用机制与理中汤类似[39-40]。
白头翁汤出自张仲景的《伤寒杂病论》,具有清热解毒、凉血止痢之功效,该方在临床上对治疗肠炎具有确切疗效。研究表明,白头翁汤可通过调节UC小鼠肠道菌群变化,显著改善该小鼠的结肠炎症症状[41]。此外,Hua Y等[42]利用代谢组学技术研究发现,白头翁汤可显著改变湿热腹泻型小鼠体内TRP、胆汁酸等物质代谢,从而改善该小鼠病理症状。由此推测,白头翁汤可通过调节UC小鼠肠道菌群,进一步影响其体内TRP等内源性代谢物变化,最终对UC发挥治疗作用。
5 结语与展望
肠道菌群是TRP生成吲哚类代谢物的重要途径,部分吲哚类代谢物可通过激活AHR,影响机体肠黏膜屏障功能和肠道免疫功能。由此表明,这一类TRP代谢物与UC、克罗恩病、肠易激综合征等胃肠道疾病的发生、发展密切相关。如果说激活AHR是治疗UC的关键,那么维持TRP-肠道菌群代谢平衡则是治疗UC的重要前提。由此表明,TRP-肠道菌群代谢通路已然成为相关药物治疗UC的重要途径之一。一些具有抗UC活性的中药常以恢复机体肠道菌群稳态为切入点,进而有效预防或纠正肠道TRP代谢失调,最终达到治疗UC的目的。因此,TRP-肠道菌群代谢通路可以作为筛选抗UC药物的重要途径或靶点之一。
現阶段,虽然中药治疗UC的临床疗效已得到认可,但是在基础研究中仍存在以下几个问题:(1)中药抗UC的药效物质基础研究不够完善,且具体作用机制尚不明确;(2)中药对肠道菌群的组成和结构具有调控作用,但目前尚不明确中药中具体哪些药效成分对肠道菌群进行调控;(3)当前,16S rRNA或16S rDNA测序是检测分析肠道菌群变化的主流技术,但是这种技术存在一定局限性,体现在对肠道菌群检测范围窄、检测层次不够深入等方面。
未来,随着宏基因组、代谢组等多组学技术的发展,人们在研究中可以更好地将中药药效成分、肠道菌群、疾病特定代谢物进行一一关联,从而筛选出特定成分对相关菌群或代谢物实现靶向干预,最终对UC实现精准治疗。同时,抗UC中药的研发也将会迎来更加美好的发展前景。
参考文献
[1] KOBAYASHI T, SIEGMUND B, LE BERRE C, et al. Ulcerative colitis[J]. Nature Reviews Disease Primers, 2020, 6: 74.
[2] CHEN C J, HU H M, LIAO W T. Pathophysiology of inflammatory bowel diseases[J]. The New England Journal of Medicine, 2021, 384(14): 1376-1377.
[3] LI X L, ZHANG Z H, ZABED H M, et al. An insight into the roles of dietary tryptophan and its metabolites in intestinal inflammation and inflammatory bowel disease[J]. Molecular Nutrition & Food Research, 2021, 65(5): 2000461.
[4] PLATTEN M, NOLLEN E A A, RÖHRIG U F, et al. Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond[J]. Nature Reviews Drug Discovery, 2019, 18(5): 379-401.
[5] ROAGER H M, LICHT T R. Microbial tryptophan catabolites in health and disease[J]. Nature Communications, 2018, 9: 3294.
[6] GAO J, XU K, LIU H N, et al. Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 13.
[7] AGUS A, PLANCHAIS J, SOKOL H. Gut microbiota regulation of tryptophan metabolism in health and disease[J]. Cell Host & Microbe, 2018, 23(6): 716-724.
[8] FEUERSTEIN J D, ISAACS K L, SCHNEIDER Y, et al. AGA clinical practice guidelines on the management of moderate to severe ulcerative colitis[J]. Gastroenterology, 2020, 158(5): 1450-1461.
[9] PERNOMIAN L, DUARTE-SILVA M, DE BARROS CARDOSO C R. The aryl hydrocarbon receptor (AHR) as a potential target for the control of intestinal inflammation: Insights from an immune and bacteria sensor receptor[J]. Clinical Reviews in Allergy & Immunology, 2020, 59(3): 382-390.
[10] ZHANG J, ZHU S W, MA N, et al. Metabolites of microbiota response to tryptophan and intestinal mucosal immunity: A therapeutic target to control intestinal inflammation[J]. Medicinal Research Reviews, 2021, 41(2): 1061-1088.
[11] CHOI Y, ABDELMEGEED M A, SONG B J. Preventive effects of indole-3-carbinol against alcohol-induced liver injury in mice via antioxidant, anti-inflammatory, and anti-apoptotic mechanisms: Role of gut-liver-adipose tissue axis[J]. The Journal of Nutritional Biochemistry, 2018, 55: 12-25.
[12] SCOTT S A, FU J J, CHANG P V. Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(32): 19376-19387.
[13] DODD D, SPITZER M H, VAN TREUREN W, et al. A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites[J]. Nature, 2017, 551(7682): 648-652.
[14] WLODARSKA M, LUO C W, KOLDE R, et al. Indoleacrylic acid produced by commensal Peptostreptococcus species suppresses inflammation[J]. Cell Host & Microbe, 2017, 22(1): 25-37.
[15] HENRICK B M, RODRIGUEZ L, LAKSHMIKANTH T, et al. Bifidobacteria-mediated immune system imprinting early in life[J]. Cell, 2021, 184(15): 3884-3898.
[16] LIU X C, ZHANG X N, ZHANG J X, et al. Activation of aryl hydro?
carbon receptor in Langerhans cells by a microbial metabolite of tryptophan negatively regulates skin inflammation[J]. Journal of Dermatological Science, 2020, 100(3): 192-200.
[17] LI K Y, HAO Z H, DU J Y, et al. Bacteroides thetaiotaomicron relieves colon inflammation by activating aryl hydrocarbon receptor and modulating CD4+T cell homeostasis[J]. International Immunopharmacology, 2021, 90: 107183.
[18] VIVIER E, ARTIS D, COLONNA M, et al. Innate lymphoid cells: 10 years on[J]. Cell, 2018, 174(5): 1054-1066.
[19] PANTAZI E, POWELL N. Group 3 ILCs: Peacekeepers or troublemakers what’s your gut telling You?![J]. Frontiers in Immunology, 2019, 10: 676.
[20] CERVANTES-BARRAGAN L, CHAI J N, TIANERO M D, et al. Lactobacillus reuteri induces gut intraepithelial CD4+ CD8αα+T cells[J]. Science, 2017, 357(6353): 806-810.
[21] BORGHI M, PARIANO M, SOLITO V, et al. Targeting the aryl hydro⁃carbon receptor with indole-3-aldehyde protects from vulvovaginal candidiasis via the IL-22-IL-18 cross-talk[J]. Frontiers in Immunology, 2019, 10: 2364.
[22] IHEKWEAZU F D, ENGEVIK M A, RUAN W, et al. Bacteroides Ovatus promotes IL-22 production and reduces trinitrobenzene sulfonic acid-driven colonic inflammation[J]. The American Journal of Pathology, 2021, 191(4): 704-719.
[23] LAMAS B, RICHARD M L, LEDUCQ V, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands[J]. Nature Medicine, 2016, 22(6): 598-605.
[24] 张天涵,沈 洪.炎症性肠病的中医辨治思路[J].中医杂志,2019, 60(14):1191-1193,1236.
[25] 李玉玲,刘 云,时昭红.中医对炎症性肠病的认识与治疗研究进展[J].临床内科杂志,2021,38(2):87-89.
[26] JING W H, DONG S J, LUO X L, et al. Berberine improves colitis by triggering AhR activation by microbial tryptophan catabolites[J]. Pharmacological Research, 2021, 164: 105358.
[27] ZHANG X J, YUAN Z W, QU C, et al. Palmatine ameliorated murine colitis by suppressing tryptophan metabolism and regulating gut microbiota[J]. Pharmacological Research, 2018, 137: 34-46.
[28] FENG W W, LIU J, TAN Y Z, et al. Polysaccharides from Atractylodes macrocephala Koidz. Ameliorate ulcerative colitis via extensive modification of gut microbiota and host metabolism[J]. Food Research International, 2020, 138: 109777.
[29] XU Y Y, XIE L Y, ZHANG Z Y, et al. Tremella fuciformis polysaccharides inhibited colonic inflammation in dextran sulfate sodium-treated mice via Foxp3+ T cells, gut microbiota, and bacterial metabolites[J]. Frontiers in Immunology, 2021, 12: 648162.
[30] YANG C C, DU Y, REN D Y, et al. Gut microbiota-dependent catabolites of tryptophan play a predominant role in the protective effects of turmeric polysaccharides against DSS-induced ulcerative colitis[J]. Food & Function, 2021, 12(20): 9793-9807.
[31] YANG W Q, REN D Y, ZHAO Y, et al. Fuzhuan brick tea polysaccharide improved ulcerative colitis in association with gut microbiota-derived tryptophan metabolism[J]. Journal of Agricultural and Food Chemistry, 2021, 69(30): 8448-8459.
[32] 范淇淋.白芍總苷治疗小鼠溃疡性结肠炎作用机制的研究[D]. 广州:广东药科大学,2019.
[33] YU X T, YANG G H, JIANG H, et al. Patchouli oil ameliorates acute colitis: A targeted metabolite analysis of 2, 4, 6-trinitrobenzenesulfonic acid-induced rats[J]. Experimental and Therapeutic Medicine, 2017, 14(2): 1184-1192.
[34] WU J Z, GAN Y X, LI M X, et al. Patchouli alcohol attenuates 5-fluorouracil-induced intestinal mucositis via TLR2/MyD88/NF-kB pathway and regulation of microbiota[J]. Biomedicine & Pharmacotherapy, 2020, 124: 109883.
[35] LUO S, WEN R Y, WANG Q, et al. Rhubarb Peony Decoction ameliorates ulcerative colitis in mice by regulating gut microbiota to restoring Th17/Treg balance[J]. Journal of Ethnopharmacology, 2019, 231: 39-49.
[36] 农菲菲,罗 爽,赵钟祥,等.基于UPLC/Q-TOF-MS技术的大黄牡丹汤治疗IBD大鼠的血清代谢组学研究[J].中药新药与临床药理,2019,30(5):571-579.
[37] SUN Z M, LI J X, WANG W T, et al. Qingchang Wenzhong Decoction accelerates intestinal mucosal healing through modulation of dysregulated gut microbiome, intestinal barrier and immune responses in mice[J]. Frontiers in Pharmacology, 2021, 12: 738152.
[38] ZOU J F, SHEN Y M, CHEN M J, et al. Lizhong Decoction ameliorates ulcerative colitis in mice via modulating gut microbiota
and its metabolites[J]. Applied Microbiology and Biotechnology, 2020, 104(13): 5999-6012.
[39] LI M Y, LUO H J, WU X, et al. Anti-inflammatory effects of Huangqin Decoction on dextran sulfate sodium-induced ulcerative colitis in mice through regulation of the gut microbiota and suppression of the ras-PI3K-Akt-HIF-1α and NF-κB pathways[J]. Frontiers in Pharmacology, 2020, 10: 1552.
[40] 王敦方.基于TLR4/MyD88通路和组学研究黄芩汤治疗溃疡性结肠炎的作用机制[D].北京:中国中医科学院,2017.
[41] CHEN X Q, LV X Y, LIU S J. Baitouweng Decoction alleviates dextran sulfate sodium-induced ulcerative colitis by regulating intestinal microbiota and the IL-6/STAT3 signaling pathway[J]. Journal of Ethnopharmacology, 2021, 265: 113357.
[42] HUA Y L, MA Q, LI W, et al. Metabolomics analysis of Pulsatilla decoction on treatment of wetness-heat-induced diarrhea in rats based on UPLC-Q/TOF-MS/MS[J]. Biomedical Chromatography, 2019, 33(11): e4629.
[43] ZHAO L, XIAO H T, MU H X, et al. Magnolol, a natural polyphenol, attenuates dextran sulfate sodium-induced colitis in mice[J]. Molecules, 2017, 22(7): 1218.
[44] LIU C, LI Y Y, CHEN Y P, et al. Baicalein restores the balance of Th17/treg cells via aryl hydrocarbon receptor to attenuate colitis[J]. Mediators of Inflammation, 2020, 2020: 5918587.
[45] LV Q, SHI C, QIAO S M, et al. Alpinetin exerts anti-colitis efficacy by activating AhR, regulating miR-302/DNMT-1/CREB signals, and therefore promoting Treg differentiation[J]. Cell Death & Disease, 2018, 9: 890.
[46] GUO A, HE D M, XU H B, et al. Promotion of regulatory T cell induction by immunomodulatory herbal medicine licorice and its two constituents[J]. Scientific Reports, 2015, 5: 14046.
[47] WANG J P, NIU X L, WU C F, et al. Naringenin modifies the development of lineage-specific effector CD4+ T cells[J]. Frontiers in Immunology, 2018, 9: 2267.
[48] PENG J E, LU X R, XIE K L, et al. Dynamic alterations in the gut microbiota of collagen-induced arthritis rats following the prolonged administration of total glucosides of paeony[J]. Frontiers in Cellular and Infection Microbiology, 2019, 9: 204.
[49] 王 磊,李跟旺.廣藿香抗菌消炎调节免疫作用的最新研究[J]. 西部中医药,2018,31(2):138-140.

