内质网应激在年龄相关性黄斑变性中的研究进展
刘 霞,王 艳,江华维,任玉玲,陈 晨
0引言
年龄相关性黄斑变性(age-related macular degeneration, ARMD)是一种影响视网膜黄斑区域,导致中心视力进行性丧失的疾病,也是50岁以上老年人视力下降甚至失明的主要原因之一[1]。2015年全球失明人口所有年龄段失明原因中ARMD排第四位,在导致中重度视力障碍原因中排第三位(仅次于屈光不正和白内障),在人口老龄化地区ARMD的致盲比例更高[2]。ARMD分为干性ARMD和湿性ARMD,前者的主要表现是黄斑区玻璃膜疣形成和地图样萎缩,后者的主要表现是脉络膜新生血管形成[3]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞是位于视网膜最外层的单层六角形细胞,富含色素颗粒,且具有极性。RPE功能失调与ARMD关系密切[4]。目前ARMD的发病机制尚未完全阐明,但大量研究发现多种危险因素介导的内质网应激在该病的发生发展中起着重要作用。本文就内质网应激的信号转导通路、内质网应激在视网膜色素上皮细胞中的生理作用及其在ARMD发病机制中的研究进展作一综述。
1内质网与内质网应激
内质网是真核细胞内一种特殊的膜性细胞器,承担着跨膜蛋白和分泌蛋白的合成、折叠、组装、修饰的任务,同时也是脂肪、甾体合成以及Ca2+储存的主要场所[5]。蛋白折叠是一个非常容易出错的过程,Ca2+水平失调、蛋白合成水平提高、持续的氧化应激、营养物质过多或限制、毒素刺激、缺氧、基因突变等因素均可影响蛋白的正常折叠或运输,导致大量未折叠蛋白和/或错误折叠蛋白积聚在内质网腔,此种状态即称为内质网应激(endoplasmic reticulum stress, ER stress)[6]。此时,细胞内会产生适应性的信号转导级联反应——未折叠蛋白反应(unfolded protein response, UPR)来缓解内质网应激。如果强烈的内质网应激持续存在,动态平衡难以恢复,将启动细胞凋亡程序清除受损细胞来保护机体[7]。
2内质网应激中的UPR
UPR主要通过三种跨膜蛋白激活信号级联反应:活化转录因子6(activating transcription factor 6,ATF6),蛋白激酶样内质网激酶(protein kinase-1ike ER kinase,PERK)以及肌醇需求酶1(inositol-requiring enzyme 1,IRE1)。生理条件下,这三种跨膜蛋白的内质网腔内部分均与葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)结合,处于非活化状态。内质网应激时,GRP78解离引起跨膜蛋白的活化,启动UPR[8-9](图1)。
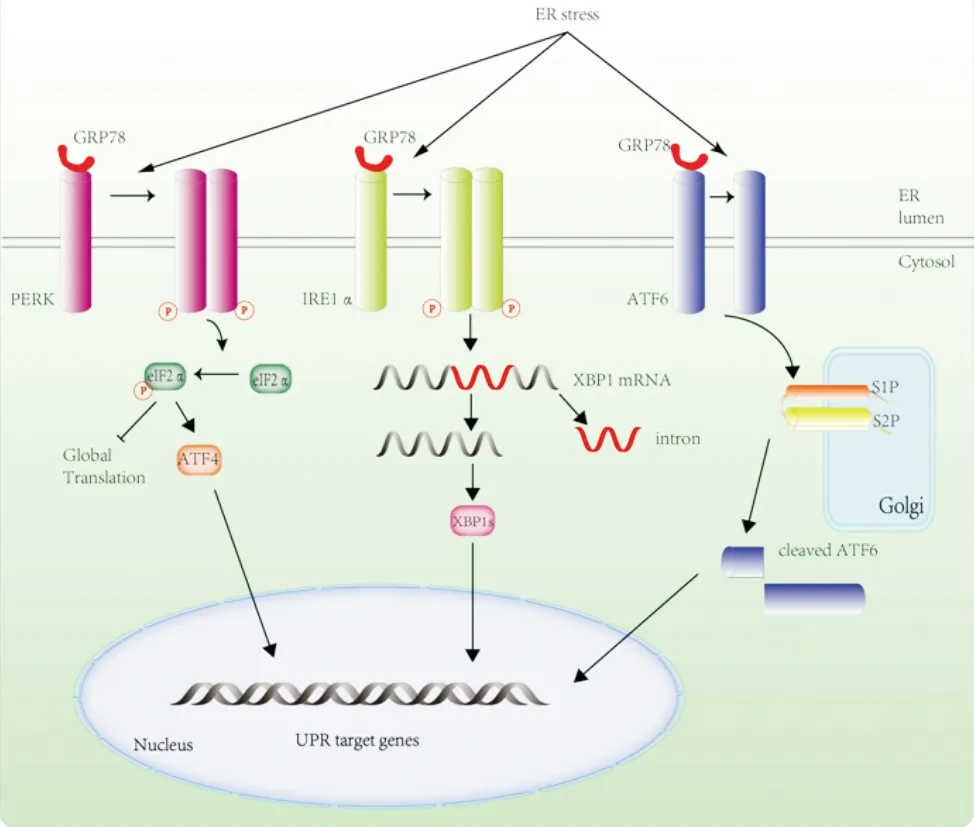
图1 UPR的信号转导机制示意图。
2.1IRE1介导的UPR IRE1是位于内质网的一种跨膜激酶,存在于所有真核生物中,结构非常保守[10]。内质网应激时,IRE1与GRP78解离,通过自身磷酸化而激活其核酸内切酶功能[11]。转录因子X盒结合蛋白1(X box-binding protein 1, XBP1)的mRNA是其底物。IRE1从XBP1的mRNA上剪掉一个26碱基对的片段,该mRNA两个断端重新连接后,其编码蛋白发生改变,表达剪切型XBP1(XBP1s,XBP1的活性形式)。XBP1s进入细胞核,增强其下游基因表达,调节内质网蛋白的折叠和运输、磷脂生物合成以及内质网相关的蛋白降解,从而增强细胞对环境变化的适应性[12]。另一方面,IRE1的核酸酶活性能裂解多种RNA,从而降低内质网mRNA丰度和蛋白折叠负荷,这一过程称为受调节的IRE1依赖的裂解(regulated IRE1-dependent decay,RIDD)。RIDD可以裂解大量位于内质网和细胞浆的mRNA、核糖体RNA和小RNA,在调控葡萄糖代谢、炎症、凋亡等过程中起着重要的生物学作用[13]。如果内质网应激无法缓解,IRE1将激活c-Jun氨基末端激酶(JNK)通路,介导细胞凋亡[7]。
2.2PERK介导的UPR 同IRE1一样,PERK也是内质网定位的跨膜蛋白,与GRP78解离后,通过自身磷酸化而激活。内质网应激时,激活的PERK在Ser51处磷酸化真核翻译起始因子2(eukaryotic translation initiation factor 2, eIF2)的α亚基。磷酸化的eIF2α抑制总体蛋白翻译,从而降低内质网蛋白负荷,缓解内质网应激。另一方面,磷酸化的eIF2α可特异性增加转录激活因子4(activating transcription factor 4, ATF4)的翻译。ATF4进入细胞核,促进细胞存活相关基因的表达,激活自噬、抗氧化反应,维持蛋白的合成和运输。C/EBP同源蛋白(C/EBP homologous protein,CHOP)是一个前凋亡因子,内质网应激时被ATF4激活,通过抑制抗凋亡蛋白Bcl-2的转录并增加死亡受体5(death receptor 5,DR5)的基因表达,介导细胞凋亡[14-15]。
2.3ATF6介导的UPR ATF6是一种Ⅱ型跨膜蛋白,包含亮氨酸拉链结构域。内质网应激时,ATF6与GRP78解离,再与外壳蛋白Ⅱ(COPⅡ)复合物相互作用被转运到高尔基体,然后被S1P和S2P两种蛋白酶切割为两部分,释放出稳定的bZIP转录因子ATF6-N。ATF6-N进入细胞核,参与转录因子CHOP、XBP1表达的调控,激活与蛋白折叠相关的基因表达,帮助恢复内质网蛋白折叠的动态平衡[16-17]。ATF6的转运与激活是受到高度调控的过程,该过程与内质网驻留蛋白18(ERp18)相关。ERp18是一种氧化还原酶,它介导ATF6与GRP78的离解,并调节ATF6转出内质网的过程。ERp18缺失时,ATF6无法被S1P或S2P蛋白酶正确切割,因而不能产生其活性形式ATF6-N[18]。
3内质网应激与ARMD
Lenox等[19]研究发现,正常老化视网膜中,内质网稳态破坏导致UPR激活,氧化应激和炎症信号增加。各种危险因素(如年龄、吸烟、光损伤等)都可以在视网膜中引起内质网应激,导致ARMD的发生发展[20-21]。接下来将从内质网应激与氧化应激、炎症、自噬、细胞凋亡、血管生成和RPE分泌蛋白失衡的相互作用来介绍内质网应激与ARMD发病机制的关系。
3.1内质网应激与氧化应激氧化应激是ARMD发生发展中最重要的机制。生理情况下,活性氧(reactive oxygen species,ROS)对于正常细胞功能维持是必要的,而吸烟、高脂饮食等危险因素将刺激细胞产生过多ROS,损伤细胞蛋白和DNA,损害细胞生理功能[22]。RPE细胞具有强大的抗氧化能力,其中NF-E2相关因子2(NF-E2-related factor 2,Nrf2)是对抗氧化应激最重要的调节分子。Nrf2是一种bZIP转录因子,它能与抗氧化反应元件(antioxidant response elements, ARE)结合,激活一系列含有ARE的抗氧化基因,对ROS诱导的视网膜细胞凋亡有保护作用[23-24]。Nrf2基因敲除的小鼠表现出玻璃膜疣样沉积、脂褐质堆积、自发性脉络膜新生血管等与人类ARMD相似的表型[25]。在ARMD中,内质网应激与氧化应激有较多的交互作用。Cullinan等[26]研究发现,Nrf2是PERK的直接底物,PERK可以磷酸化Nrf2,使其与抑制蛋白Keap1离解,进入细胞核。由此可见,PERK通路虽然通过eIF2α/ATF4/CHOP信号诱导细胞凋亡,却通过Nrf2信号保护细胞生存。He等[27]发现,ATF4可以与Nrf2形成二聚体,共同调节抗氧化酶血红素加氧酶1(Heme oxygenase-1, HO-1)的表达。而我们之前的研究[28]发现XBP1对Nrf2有调节作用,在ARPE-19细胞中过表达剪切型XBP1后,Nrf2的水平也增加;在RPE特异性XBP1基因敲除的小鼠,Nrf2的表达也显著降低。这些研究证明,调控内质网应激可以影响氧化应激的关键分子Nrf2,进而影响细胞的抗氧化反应。
3.2内质网应激与炎症玻璃膜疣位于RPE与Bruch膜之间,是ARMD的典型体征。玻璃膜疣的成分包含很多炎症相关物质,包括补体成分、免疫球蛋白、人类白细胞抗原和急性时相蛋白等,这证明炎症与ARMD密切相关[29]。有学者[30]提出ARMD发生的两级模型假设:第一级是人眼在光、吸烟、衰老等危险因素作用下,各种损伤分子如补体因子、白细胞介素等不断积累。第二级是这些损伤分子诱发的炎症宿主反应。这种(无菌性)炎症反应造成细胞和组织的额外损伤,最终发展为ARMD。
内质网应激时,IRE1信号通路可以使核因子κB抑制蛋白IκB(I kappa B Proteins)降解,从而激活核因子κB(nuclear factor-kappa B,NF-κB)。PERK-eIF2α通路则减少IκB的蛋白翻译,使得NF-κB得以入核。NF-κB通过调节细胞因子、趋化因子、生长因子和血管生成因子的转录在炎症反应中起关键作用。UPR的另一条通路,ATF6,可以激活急性时相反应[31-32],活化的ATF6在细胞核内调节急性时相蛋白的基因转录。Kheitan等[33]通过构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络对ARMD中内质网应激和炎症的相互关系进行研究,发现MAPK信号通路是与内质网应激和炎症交叉作用相关度最高的通路。MAPK信号通路通过对不同刺激的磷酸化反应来调节转录因子的活性,如通过JNK和p38/MAPK的活化来调节RPE细胞的凋亡。由此可见,ARMD中内质网应激和炎症常常同时存在而相互影响。
3.3内质网应激与自噬功能障碍自噬是一种溶酶体介导的降解过程,将非必须或已损害的细胞成分降解来为细胞供能,维持细胞内环境平衡[34]。研究发现,随年龄增加,RPE自噬能力逐渐下降,光感受器外节以及脂褐质在RPE和Bruch膜之间积累[35]。RPE自噬功能障碍与ARMD的发生发展密切相关[36]。Golestaneh等[37]报道,ARMD患者的RPE细胞中,自噬体变大,脂滴变多,且自噬体和受损线粒体的数量显著多于正常RPE。自噬功能障碍会导致异常蛋白和ROS在内质网积聚,从而导致内质网应激。Feng等[38]研究发现,内质网分子伴侣GRP78能诱导RPE自噬增加,用siRNA抑制GRP78表达后,RPE自噬功能降低。自噬诱导剂雷帕霉素可以减少内质网应激,从而保护RPE细胞免受蓝光诱导的凋亡。Song等[39]报道,可见光在体外培养的RPE细胞中诱导自噬增加,持久过强的自噬引起RPE细胞凋亡。小鼠腹腔注射内质网应激抑制剂Salubrinal后再暴露于强光,此时强光诱导的自噬较对照组少,强光导致的视网膜结构异常显著轻于对照组,可见抑制内质网应激能减少过多的自噬而保护RPE细胞。
3.4内质网应激与细胞凋亡RPE细胞密度随年龄增加而下降,其凋亡率随年龄增加而增加[40]。RPE细胞凋亡是干性ARMD的重要标志[41]。UPR的PERK通路和IRE1通路可通过不同的机制导致细胞凋亡。PERK激活eIF2α,后者抑制总体蛋白合成来减轻内质网应激,但持久过强的抑制蛋白合成不利于细胞存活;PERK通路还激活前凋亡蛋白CHOP,抑制Bcl-2的转录而诱导细胞凋亡。同时,IRE1磷酸化可活化RIDD,过强的RIDD可降解位于内质网的几百种mRNA,剥夺了内质网的蛋白组分,反而加重内质网应激,引起细胞凋亡[7,13,42]。
吸烟是ARMD的独立危险因素,烟雾中有多种成分可损伤视网膜[43]。我们前期的研究发现,在吸烟小鼠模型中,RPE中的XBP1s和CHOP的mRNA水平显著升高,而神经视网膜中XBP1s的mRNA水平亦显著上升,这说明内质网应激参与了吸烟导致ARMD的过程。我们进一步研究发现,香烟烟雾的主要成分氢醌在RPE细胞中诱导GRP78、PERK、eIF2-α、ATF4、CHOP的表达,最后激活caspase3,导致细胞凋亡。同时,内质网应激抑制剂4-苯基丁酸能抑制前凋亡蛋白CHOP的水平,从而抑制氢醌诱导的RPE凋亡。更深入的机制研究发现,用过表达显性负性突变PERK的腺病毒感染细胞,使正常PERK被抑制后,氢醌诱导的RPE凋亡显著减少,说明氢醌诱导RPE凋亡主要是通过PERK通路。另一方面,剪切型XBP1则对RPE凋亡有保护作用。利用腺病毒在RPE细胞中过表达剪切型XBP1后,氢醌诱导的细胞凋亡显著下降[44]。由此可见,调控内质网应激可以影响RPE细胞凋亡。
3.5内质网应激与血管生成RPE细胞过量表达血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)导致脉络膜新生血管(choroidal neovascularization,CNV)形成是湿性ARMD发生的关键环节。内质网应激时,UPR的PERK通路可以激活ATF4,IRE1通路可以激活JNK,ATF4和JNK可以直接调节VEGF的转录,使其水平升高[45-46]。Pollreisz等[47]研究发现,氧化磷脂(一类脂质氧化产物)在人胚胎RPE细胞和原代RPE细胞中增加VEGF的mRNA水平,并使细胞分泌的VEGF增加。siRNA阻断细胞内ATF4信号后,氧化磷脂诱导的VEGF表达显著下降,说明ATF4在氧化磷脂诱导的VEGF表达中是必需的。这证实了内质网应激在RPE分泌VEGF过程中的作用。
目前,抗VEGF注射在湿性ARMD的治疗中取得了确切疗效。然而,ANCHOR、MARINA等临床试验表明,抗VEGF治疗后新生血管的消退经常并不完全,也不持久[48],我们仍然需要新的ARMD治疗靶点。Liu等[49]研究发现,在视网膜血管内皮细胞中,外源性VEGF、高糖、过氧化氢均能诱导UPR,激活IRE1和ATF6,抑制细胞内VEGF裂解,使VEGF聚集。siRNA抑制IRE1和ATF6表达后,细胞内VEGF裂解显著增加,内皮细胞成管显著减少。在激光诱导的CNV小鼠模型中,玻璃体腔注射IRE1或ATF6的siRNA后,CNV形成减少35%以上。当siRNA处理联合抗VEGF治疗时,CNV形成减少60%以上。这一研究证实了内质网应激在CNV形成中的作用,并为湿性ARMD治疗提供了新的靶点。
3.6内质网应激与RPE分泌蛋白失衡RPE分泌蛋白的平衡对维持光感受器细胞和Bruch膜/脉络膜的结构和功能至关重要[50]。RPE顶部分泌的蛋白主要有透明质酸,αB晶体蛋白,色素上皮衍生因子等;其基底部分泌的蛋白主要有血管内皮生长因子,成纤维细胞生长因子5,内皮素Ⅰ等[51]。内质网在RPE分泌蛋白平衡中起着质控作用。内质网应激时,蛋白折叠和运输功能受损,可能有错误折叠的蛋白被分泌到细胞外,影响组织的正常生理功能[50-52]。
Luibl等[53]在人类玻璃膜疣标本中发现了淀粉样蛋白的存在。Wang等[54]研究发现,24月龄的小鼠RPE分泌的淀粉样蛋白明显比2月龄小鼠RPE分泌的淀粉样蛋白多。β淀粉样蛋白具有毒性作用,可以导致RPE空泡产生和视网膜细胞老化,还可激活补体级联反应,诱导RPE分泌VEGF,促进ARMD发生[55-56]。Plate等[57]和Wang等[58]研究发现,UPR的ATF6通路能减少淀粉样免疫球蛋白轻链的分泌,而XBP1通路能增加内质网对淀粉样免疫球蛋白轻链的降解,证明UPR在淀粉样蛋白的分泌中有调控作用。Matsui等[59]研究发现,β淀粉样蛋白在RPE细胞中诱导VEGF的分泌,而用内质网应激抑制剂4-苯基丁酸同时处理细胞后,受刺激分泌的VEGF水平显著降低。因此Matsui等[59]指出内质网应激抑制剂可能在伴有玻璃膜疣的ARMD患者中有预防新生血管生成作用。
4小结与展望
综上所述,大量研究证实ARMD与内质网应激密切相关。目前针对ARMD的治疗手段比较有限,抗VEGF疗法治疗湿性ARMD也具有一定的疗效差异性和远期局限性。对于干性ARMD的治疗,除了干细胞治疗已经进入临床研究阶段,尚无有效药物可以挽救RPE细胞的凋亡和感光细胞的损伤。未折叠蛋白反应作为内质网应激主要的信号通路,与炎症、氧化应激、自噬等机制相互作用,形成一个复杂的调控网络。UPR的三条信号通路早期可以通过诱导自噬和抗氧化反应、调控炎症信号来恢复内质网稳态,但长期过度的UPR激活可能导致自噬功能障碍、炎症信号增加、ROS聚集而诱导细胞凋亡。了解以持续UPR为特征的年龄相关性视网膜疾病的分子机制,从UPR的上下游研究如何调控相关基因表达以维持细胞或组织正常生理代谢,进一步探讨内质网应激在ARMD发生发展中的作用,有助于为ARMD治疗提供新的思路和可能的分子靶点。
- 国际眼科杂志的其它文章
- Assessment of macular vascular network after panretinal photocoagulation in the patients with diabetic retinopathy by OCTA
- Study on the sequence of morphological and angiographic changes due to intraocular pressure elevation in the optic nerve head
- 傅里叶域光学相干断层扫描仪测量角膜上皮厚度参数鉴别早期圆锥角膜
- 加替沙星和左氧氟沙星对急性细菌性结膜炎有效性与安全性的Meta分析
- 地塞米松诱导的人小梁网基因表达谱变化及生物信息学分析
- OCTA联合微视野计在视网膜静脉阻塞黄斑水肿中的应用

