金葡菌和大肠埃希菌细菌外囊泡的生物学特性比较研究
于海宽,冯韬锦,王端阳,姜矞恒,陈铭,李毅,尹鹏滨,张里程,唐佩福,刘蜀彬
1 解放军医学院,北京 100853;2 解放军总医院第四医学中心 骨科医学部,北京 100853;3 国家骨科与运动康复临床医学研究中心 骨科,北京 100853;4 解放军总医院第五医学中心 骨科,北京 100071;5 解放军南部战区总医院 骨科,广东广州 510010;6 哈尔滨医科大学附属第二医院 骨科,黑龙江哈尔滨 150086
细菌、古细菌、真核生物都会向外部环境释放出纳米尺寸的外膜囊泡[1-2]。细菌外囊泡中含有特定的内容物,包括蛋白质、核酸、脂质及从细菌母体释放出的各种代谢产物[3]。细菌外囊泡在细菌生长过程中不断被释放,可参与细菌生长、生物膜形成、水平基因转移、应激反应、营养获取、毒素传递、抗生素耐药、宿主免疫调节等相关生物学过程[3-11]。近年来研究人员将细菌外囊泡作为天然免疫原性、可修饰的新型递送载体,广泛应用于构建新型疫苗、靶向递送药物等领域[5-7,12]。细菌外囊泡具有广阔的临床应用前景,然而目前对于细菌外囊泡的特性研究仍处于初始阶段。革兰阴性(G-)细菌和革兰阳性(G+)细菌具有不同的细胞壁结构,其细菌外囊泡产生的机制也截然不同。在革兰阴性菌中,细菌的细胞壁结构疏松,分为内膜、周质空间和细胞壁外膜,细菌囊泡从外膜被夹断,因此被称为外膜囊泡(outer membrane vesicle,OMV);其内容物包括细胞质、周质和细胞壁成分,直径为20~ 250 nm[13-14]。革兰阳性细菌的细胞壁厚度为20~ 80 nm,没有细胞壁外膜,细胞壁呈现高度交联的状态,革兰阳性细菌囊泡来源于细胞质,称为细胞质囊泡(cytoplasmic membrane vesicle,CMV),其内容物包括细胞质和细胞膜成分,直径为20~ 400 nm[15]。两种类型细菌外囊泡的特性目前研究较少。本研究拟以大肠埃希菌和金葡菌为代表,探索革兰阴性菌和革兰阳性菌细菌外囊泡的理化性质和生物学特性,初步分析不同来源细菌外囊泡潜在临床应用场景,为细菌外囊泡进一步临床应用和工程化制备奠定基础[16]。
材料与方法
1 菌株、试剂和仪器 金葡菌(BNCC186335)和大肠埃希菌(BL21) 购买自丰海生物。RAW264.7细胞系购买自北京协和医院细胞资源中心。NB 肉汤培养基(AOBOX 公司);胎牛血清(Gibco 公司);DMEM 培养液、α-MEM 培养液、青霉素/链霉素双抗液、胎牛血清(Corning 公司);BCA 试剂盒(上海碧云天生物有限公司);Zombie NIR™死活染色液、Alexa Fluor® 488 anti-mouse F4/80 Antibody、PE anti-mouse/human CD11b Antibody、APC antimouse CD86 Antibody、Alexa Fluor® 700 antimouse CD206 (MMR) Antibody (Biolegend公司);NTA(Particle Metrix 公司);电镜(日本JOEL 公司);Dynamic Light Scattering (NANO ZS 公司);流式细胞仪(Beckman 公司);酶标仪(Tecan infinite m200 pro 公司)。
2 细菌培养和外囊泡的提取 以36 g NB 粉与1 L 水的比例配制肉汤培养基,用玻璃棒搅拌均匀,用封口膜密封,高温液体灭菌后,将1 mL 菌液放入2 L 细菌培养基。放入恒温摇床中,至培养基OD600达到1.0(约8 h 后),收集细菌培养基。将细菌培养8 h后,先用离心机8 000 g 离心20 min去除游离的细菌,再用0.45 µm 水系滤膜过滤泵对培养基进行过滤,进一步去除游离的细菌。将去除菌体的细菌上清液放入5 L 的烧瓶中。连接切向流过滤系统对细菌菌液进行浓缩,浓缩至60 mL后,停止浓缩。将其放入超速离心管中,100 000 g离心3 h后,弃上清,PBS 重悬后离心100 000 g再次离心70 min,用1 mL PBS 重悬即为最终提取的细菌外囊泡,冻存于-80℃中备用。
3 细菌外囊泡电镜鉴定 将20 µL 提取的金葡菌和大肠埃希菌的BEVs 悬液加载至200 目铜网表面,室温静置5 min,用滤纸吸干液体后加入醋酸双氧铀复染2 min,用滤纸吸干表面染料。再用蒸馏水洗涤铜网3次,室温干燥。然后用透射电镜进行观察拍摄。
4 细菌外囊泡的颗粒数检测 使用Zeta View 粒径分析仪检测,将样品与PBS 按照1∶5 000 的比例进行稀释至5 mL。首先用标准品对仪器进行校准。然后将5 mL 样品注入,选择预设的程序对样品的颗粒数进行检测。最后用无菌双蒸水将仪器进行清洗。
5 细菌外囊泡的粒径与Zeta 电位检测 使用动态光散射粒度仪 (dynamic light scattering,DLS)检测,将样品与PBS 按照1∶100 的比例混合形成1.5 mL 的稀释液,加入特定的样品池中,将样品池放入DLS 仪器中。选择预设的程序,通过纳米颗粒示踪分析仪捕获并分析纳米颗粒物质在溶液中的布朗运动情况,对样品的粒径和电位大小进行检测。
6 细菌外囊泡的蛋白定量 向50 µL 的细菌外囊泡样本中加入50 µL RIPA 裂解液,置于冰上裂解30 min,10 000 g 离心,吸取上清至新的EP 管。根据BCA 试剂盒的说明书配置工作液和不同梯度的标准品。向96 孔板中每孔加入20 µL 样品和200 µL 工作液,37℃孵育0.5 h。通过酶标仪在562 nm 处进行吸光值检测,根据标准品算出标准曲线,并计算出样品浓度。
7 RAW264.7 的激活 RAW264.7 是一种巨噬细胞系,是炎症细胞模型之一,用于细胞吞噬、细胞免疫、分子免疫学研究中。将复苏后的RAW264.7以5 × 104/孔传至24 孔板,用DMEM(含有10%FBS 和1% 双抗) 培养1 d。通过NTA 检测两种细菌外囊泡颗粒数后,按照1 × 108个囊泡/mL配置DMEM 培养基,对RAW264.7 进行干预。加入同等体积的PBS 缓冲液作为对照组。用Zombie NIR™死活染色液、Alexa Fluor® 488 anti-mouse F4/80 Antibody、PE anti-mouse/human CD11b Antibody、APC anti-mouse CD86 Antibody(Biolegend)、Alexa Fluor® 700 anti-mouse CD206 (MMR) Antibody 对细胞进行染色,通过流式上机检测其各项指标的表达情况。
8 统计学分析 采用GraphPad Prism9.0 进行数据分析。采用Shapiro-wilk 检验评估数据的正态性,符合正态分布的两组计量资料采用非配对双尾t检验(unpaired two-tailedt-test) 进行比较,多组计量资料比较采用单因素方差分析,P<0.05 为差异有统计学意义。
结果
1 细菌外囊泡透射电镜分析 利用切向流过滤系统结合超速离心法(图1)成功提取金葡菌和大肠埃希菌的细菌外囊泡,透射电镜下均可观察到杯状、茶托状的双层膜结构(图2),大小为20~ 300 nm,呈分散或聚集分布。其中金葡菌的细菌外囊泡直径相比大肠埃希菌分泌的细菌外囊泡略大,视野中囊泡的数量相比大肠埃希菌的细菌外囊少。

图1 细菌外囊泡提取示意图A:切向流过滤系统 B:超速离心Fig.1 Schematic representation of BEVs extractionA: Tangential flow filter system B: Ultracentrifugation

图2 提取的两种细菌外囊泡形态的电镜图片A:金葡菌来源的细菌外囊泡;B:大肠埃希菌来源的细菌外囊泡Fig.2 Electron microscope photographs of BEVs of two types of bacteria extractedA: BEVs derived from S.aureus;B: BEVs derived from E.coli
2 两种细菌外囊泡粒径分布和Zeta 电位比较金葡菌外囊泡直径50.75 nm,粒径范围37.84~396.1 nm;大肠埃希菌外囊泡直径为22.15 nm,粒径范围13.54~ 78.82 nm,比金葡菌直径略小。此外,金葡菌和大肠埃希菌的细菌外囊泡带负电荷,分别为(-19.7 ± 0.17) mV 和(-24.1 ± 2.55) mV,提示均为膜结构,大肠埃希菌外囊泡Zeta 电位略低于金葡菌外囊泡(P<0.05)。见图3。
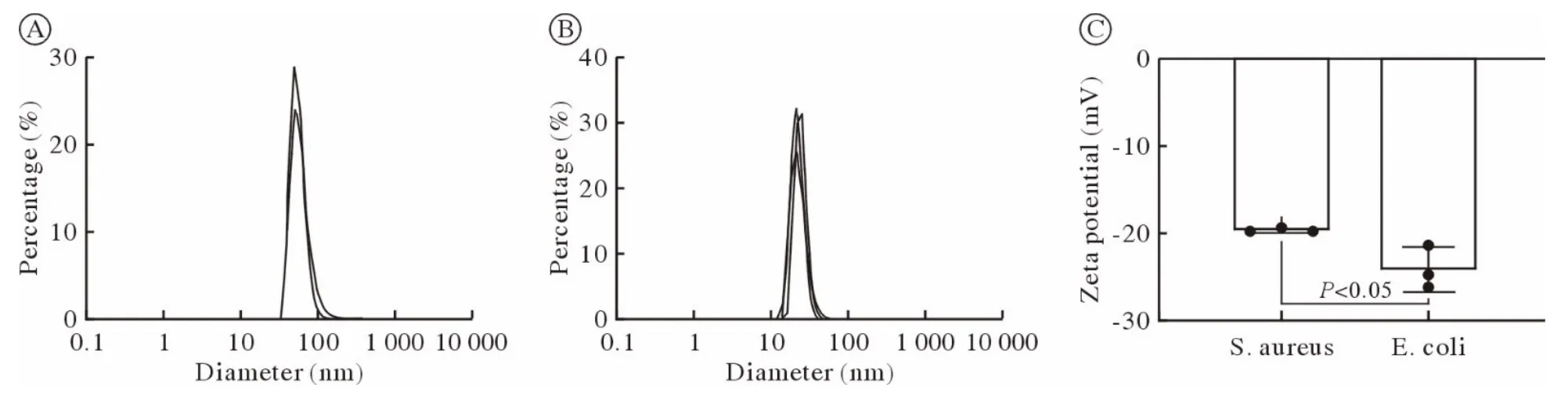
图3 DLS 检测两种细菌外囊泡粒径分布及Zeta 电位(n=3)A:金葡菌来源的细菌外囊泡的粒径分布;B:大肠埃希菌来源的细菌外囊泡的粒径分布;C:两种细菌外囊泡的Zeta 电位Fig.3 The particle size and Zeta potential of BEVs of two types of bacterial measured by DLS (n=3)A: The particle size of BEVs derived from S.aureus;B: The particle size of BEVs derived from E.coli;C: Zeta potential of BEVs of two types of bacteria
3 两种细菌外囊泡产量和纯度比较 图4 所示金葡菌和大肠埃希菌外囊泡蛋白产量分别为(0.94 ±0.04) mg 和(1.71 ± 0.19) mg;颗粒数分别为4.00 × 1011(± 1 × 1010)/mL 和9.47 × 1011(± 2.52 × 1010)/mL;说明在同等培养条件下,大肠埃希菌分泌的囊泡颗粒数更多,蛋白产量更高(P<0.05)。通过颗粒数/蛋白量比值可以观察到单位蛋白量中大肠埃希菌外囊泡数为5.59 × 1011(± 1.6 × 1010),而金葡菌外囊泡数为4.24 × 1011(± 6.43 × 1010),说明大肠埃希菌外囊泡的纯度更高(P<0.001)。

图4 金葡菌和大肠埃希菌来源细菌外囊泡颗粒数、总蛋白量、颗粒数/蛋白比值(n=3)A:NTA 检测两种细菌外囊泡的颗粒数;B:BCA 法检测两种细菌外囊泡的总蛋白量;C:两种细菌外囊泡的颗粒数/蛋白总量比值Fig.4 Particle number,total protein amount,particle number/protein ratio of bacterial outer vesicles derived from S.aureus and E.coli (n=3)A: Particles of BEVs of two types of bacterial measured by NTA;B: Total protein content of BEVs of two types of bacterial measured by BCA;C: Particles/total protein ratios of BEVs of two types of bacteria
4 两种细菌外囊泡对巨噬细胞系RAW264.7 的刺激作用 如图5 所示,两种细菌外囊泡与巨噬细胞系RAW264.7 共孵育48 h,加入相同体积的PBS作为对照组,通过流式抗体CD86(M1 型巨噬细胞的标志蛋白) 和CD206(M2 型巨噬细胞的标志蛋白)染色观察细菌外囊泡对RAW264.7 细胞的激活情况。结果显示两种细菌外囊泡都能激活RAW264.7细胞,促进巨噬细胞系向M1 型转化。加入金葡菌囊泡后,RAW264.7 的CD86 表达阳性细胞占比为20.23%,相比对照组(PBS 组)升高45.9 倍(P<0.001);CD206 表达阳性细胞占比为4.5%,相比对照组升高34.6 倍(P<0.001)。大肠埃希菌外囊泡刺激后RAW264.7 的CD86 表达阳性细胞占比为11.16%,相比对照组(PBS 组)升高25.4 倍(P<0.001);CD206 表达阳性的细胞占比为2.09%,相比对照组升高16.1 倍。另外金葡菌囊泡干预组CD86和CD206 表达阳性的细胞占比较大肠埃希菌组更高(P<0.05),表明金葡菌外囊泡相比大肠埃希菌外囊泡对RAW264.7 的激活作用更明显。
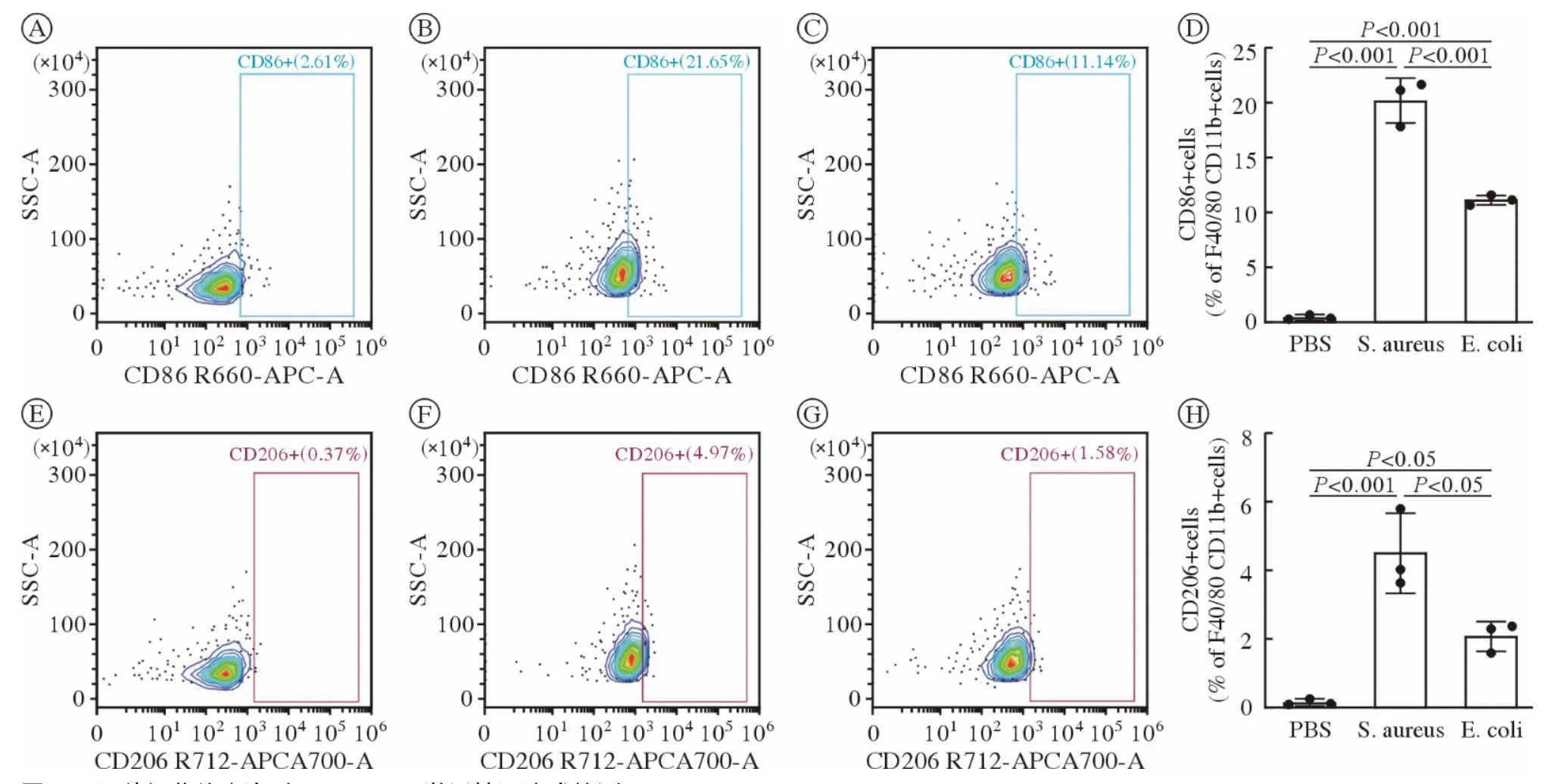
图5 两种细菌外囊泡对RAW264.7 激活情况流式检测(n=3)A:PBS 组RAW264.7 的CD86 阳性细胞占比;B:在金葡菌细菌外囊泡刺激后,RAW264.7 的CD86 阳性细胞占比;C:在大肠埃希菌细菌外囊泡刺激后,RAW264.7 的CD86 阳性细胞占比;D:对金葡菌和大肠埃希菌的细菌外囊泡刺激后的CD86 阳性细胞占比统计;E:PBS 组RAW264.7 的CD206 阳性细胞占比;F:在金葡菌细菌外囊泡刺激后,RAW264.7 的CD206 阳性细胞占比;G:在大肠埃希菌细菌外囊泡刺激后,RAW264.7 的CD206 阳性细胞占比;H:对金葡菌和大肠埃希菌的细菌外囊泡刺激后的CD206 阳性细胞占比统计Fig.5 Activation of RAW264.7 in BEVs of two types of bacterial detected by flow cytometer (n=3)A: The proportion of CD86 positive cells in RAW264.7 in PBS group;B: The proportion of CD86 positive cells in RAW264.7 after BEVs from S.aureus stimulation;C: The proportion of CD86 positive cells in RAW264.7 after stimulation of BEVs from E.coli;D: Statistics of the percentage of CD86 positive cells stimulated by BEVs of S.aureus and E.coli;E: The proportion of CD206 positive cells in RAW264.7 in PBS group;F: The proportion of CD206 positive cells in RAW264.7 after BEVs from S.aureus stimulation;G: The proportion of CD206 positive cells in RAW264.7 after stimulation of BEVs from E.coli;H: Statistics of the percentage of CD206 positive cells stimulated by BEVs of S.aureus and E.coli
讨论
细菌分泌的细菌外囊泡中含有一系列来自菌体的内容物,包括脂多糖、肽聚糖、菌膜、细菌周质、毒素蛋白和核酸[3]。细菌外囊泡在疾病的发生发展、细菌耐药性的产生等过程中均具有重要作用,在肿瘤治疗、感染、疫苗等领域已开展大量研究。Zhang等[17]通过幽门螺杆菌外囊泡包裹聚乳酸纳米颗粒与胃黏膜上皮竞争性结合以减少幽门螺杆菌在胃黏膜上的定植;Chen等[18]通过将黑色素瘤细胞膜与沙门菌囊泡融合,再联合光热治疗来抑制黑色素瘤的发展;Li等[19]通过质粒转染使细菌外囊泡表达PD1 抗体治疗结肠癌;Gao等[20]通过金葡菌外囊泡包载抗生素靶向治疗胞内金葡菌感染。关于细菌外囊泡的特性研究,目前仍处于初始阶段。
本研究通过应用切向流过滤系统结合超速离心法提取的金葡菌和大肠埃希菌外囊泡在电镜下有典型的茶托状、杯状双层膜结构。相比于大肠埃希菌外囊泡,金葡菌外囊泡直径更大。这可能是两种细菌分泌细菌外囊泡的方式不同导致的,大肠埃希菌外囊泡由细菌细胞壁外膜产生,而金葡菌是由细菌细胞膜产生[14,21]。大肠埃希菌的Zeta 电位比金葡菌外囊泡低,可能是由于大肠埃希菌细菌的膜蛋白含量更高,导致电负性程度高。从产量上看,在同样的培养条件和培养时间下,大肠埃希菌产生的囊泡数量更多,蛋白量更高,可能是由于大肠埃希菌菌体更大,细胞壁结构疏松,更容易生成外囊泡[22]。金葡菌受高度交联的细胞壁阻碍,产生的细菌外囊泡较少。由于大肠埃希菌外囊泡直径更小,颗粒数比金葡菌外囊泡更多,造成大肠埃希菌外膜囊泡的颗粒数/蛋白比值更高。从生物学效应上看,金葡菌外囊泡相比大肠埃希菌外囊泡对RAW264.7 的激活作用更明显,可能是由于金葡菌囊泡中携带了更多的毒力蛋白等细菌外毒素[15],促使更多的RAW264.7细胞向M1 型巨噬细胞转化。
综上所述,本研究发现金葡菌外囊泡直径大于大肠埃希菌外囊泡,在颗粒数和蛋白产量方面稍低,但对免疫细胞的激活能力更强。大肠埃希菌激活免疫细胞能力稍差,但囊泡的颗粒数产量和纯度更高[23]。金葡菌外囊泡和大肠埃希菌外囊泡是药物递送的良好载体,如果通过工程化改造提高其免疫原性降低毒性,将在肿瘤、疫苗等领域具有很好的应用前景[6,24]。其次,细菌外囊泡在细菌生理和发病机制中起着至关重要的作用。体液中特异性细菌外囊泡的存在可能与特定的疾病感染状态有关,因此细菌外囊泡可能作为临床诊断的标志物之一[25-26]。另一方面,细菌外囊泡可能提供一种新的抗菌治疗策略。虽然这一想法已被提出多年,但迄今为止尚无研究表明这一策略的可行性。细菌外囊泡组成的复杂性和产生的机制尚未明确可能是这种方法的主要难题。目前细菌外囊泡的相关标志性蛋白国际上仍无共识,因此本研究未对细菌囊泡中特异性标志蛋白进行表征。本研究探索比较了金葡菌与大肠埃希菌来源的细菌外囊泡的生物学特性,以期为药物递送、疫苗制备提供理论依据和参考[7,27]。

