营养风险筛查结合患者主观整体评估与恶性肿瘤肌肉减少症的相关性
刘莹 谭寅凤 王雷 王玉娇 陈锡颖 赵艳金祁薇 张迎 何抒阳
吉林市人民医院1临床营养与老年医学科,2肿瘤科(吉林吉林132000)
肌肉减少症(肌少症)是一种进行性和广泛性的骨骼肌疾病,主要表现为肌肉质量和功能的加速丧失,可引起跌倒、功能下降、虚弱和死亡等不良后果[1]。恶性肿瘤患者在不同的进展阶段均可发生肌少症,发生率可达32.05%~70.40%[2]。肌少症通过影响机体的正常代谢,从而增加肿瘤治疗药物毒副作用、延长住院时间,影响患者预后生存[3]。
营养干预是防治肌少症的重要措施之一,NRS⁃2002是住院患者营养风险筛查的主要方法[4],PG⁃SGA 是针对肿瘤患者营养情况而设计的评价方法[5],目前两种评价方法在肿瘤患者中均有应用,但关于NRS⁃2002 结合PG⁃SGA 对肿瘤患者营养风险筛查与评估的研究较少[6],并且尚未见二者联合应用于恶性肿瘤肌少症的报道。本研究旨在探讨NRS⁃2002 结合PG⁃SGA与恶性肿瘤肌少症的相关性,以期为尽早发现恶性肿瘤肌少症患者提供有效的参考依据。
1 资料与方法
1.1 一般资料自2020年1月至2021年2月在吉林省五家医院肿瘤科共招募456 例志愿者,其中吉林市人民医院102 例、吉林大学中日联谊医院90 例、吉林省人民医院87 例、吉林医药学院附属医院85 例和通化市中心医院92 例。纳入标准:(1)年龄≥60 岁;(2)明确诊断为恶性肿瘤;(3)对本次研究知情同意。排除标准:(1)恶性肿瘤晚期完全卧床、生命体征不稳定;(2)恶性肿瘤伴有其他影响肌肉力量、功能、质量诊断的严重疾病;(3)不能配合完成筛查、评估及检测等其他情况。本研究通过各医院伦理委员会审核批准。
1.2 研究方法
1.2.1 调查问卷患者的基础信息以面对面的形式进行调查,由各医院经过统一培训的医生或护士实施。(1)研究对象基础情况问卷:姓名、性别、年龄、肿瘤类型;(2)营养风险筛查问卷:采用欧洲肠外肠内营养学会(ESPEN)推荐的NRS⁃2002 量表进行评分,0~ 2 分为无营养风险,≥3 分为有营养风险[4];(3)营养情况评估问卷:采用美国营养师协会(ADA)等机构推荐的PG⁃SGA 量表进行评分,0~ 8 分为营养正常,≥9 分为营养异常[5]。根据NRS⁃2002 和PG⁃SGA 的评分结果将患者的营养状况分为四级:营养正常(NRS⁃2002 < 3 分且PG⁃SGA < 9 分),营养风险(NRS⁃2002 ≥3 分且PG⁃SGA<9 分),可能营养不良(NRS⁃2002<3 分且PG⁃SGA ≥9 分),营养不良(NRS⁃2002 ≥3 分且PG⁃SGA ≥9 分)。
1.2.2 肌少症筛查参考欧洲老年人肌少症工作组(EWGSOP)的评估流程对入组患者进行筛选[7]。(1)肌力测试:应用椅立、握力测试检测患者骨骼肌力量,椅立测试5 次> 15 s 或握力测试(男性< 27 kg,女性< 16 kg)则诊断为可能肌少症;(2)肌量评价:当诊断为可能肌少症后,采用生物电阻抗分析(BIA)评估四肢骨骼肌质量(ASM),并计算骨骼肌质量指数(SMI)=ASM/身高2,男性(ASM< 20 kg 或SMI<7 kg/m2)、女性(ASM< 15 kg或SMI<6 kg/m2)则确诊为肌少症;(3)体能测试:当确诊为肌少症后,进一步应用6 m 步速检测法测定步速,当步速≤0.8 m/s时则诊断为严重肌少症。
1.2.3 体格检查测量所有患者的体质量(WT)、身高(HT)、上臂围(AC)、上臂肌围(AMC)、腰围(WC)、内脏脂肪面积(VFA)和基础代谢率(BMR),并计算身体质量指数[BMI=WT(kg)/HT2(m2)]。
1.2.4 生化指标检测采集患者清晨空腹静脉血5 mL。测定总蛋白(TP)、前白蛋白(PA)、白蛋白(ALB)、血红蛋白(HB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、尿素(Ur)、肌酐(Cr)、血糖(GLU)、高密度脂蛋白胆固醇(HDL⁃C)、低密度脂蛋白胆固醇(LDL⁃C)、血清钠离子(Na+)、血清钾离子(K+)和血清钙离子(Ca2+)。
1.2.5 质量控制为保证本研究的质量,各医院均采用统一的标准操作程序(SOP),调查员经过严格的专业培训,并由固定的医生或护士负责,以减少调查研究中产生的偏倚。
1.3 统计学方法应用SPSS 20.0 对数据进行统计学分析。正态分布计量资料表示为均数±标准差,比较用单因素方差分析和t检验;非正态分布计量资料表示为均数±标准差,比较用Kruskal⁃Wallis 检验和Mann⁃WhitneyU检验。计数资料表示为例(%),比较用χ2检验。应用Spearman 等级相关性分析营养状况与理化指标的相关性;不同营养状况的恶性肿瘤肌少症患病危险采用多元有序logistic 回归分析。以P< 0.05 为差异有统计学意义。
2 结果
2.1 研究对象的基础资料三组患者的BMI、AC、AMC、WC、VFA、BMR 差异均有统计学意义(P<0.001),见表1。
表1 三组患者的基础资料情况Tab.1 Basic information of patients in three group±s

表1 三组患者的基础资料情况Tab.1 Basic information of patients in three group±s
注:与可能肌少症组比较,*P<0.05;与肌少症组比较,#P<0.05
变量性别(男/女)年龄(岁)BMI(kg/m2)AC(cm)AMC(cm)WC[M(P25,P75),cm]VFA[M(P25,P75),cm]BMR[M(P25,P75),kcal/d]可能肌少症组(n=222)102/120 61.19±9.91 24.09±3.31 28.62±3.66 24.12±3.26 78.20(68.05,88.85)71.85(45.18,112.73)1 361.00(1 252.00,1 494.00)肌少症组(n=148)79/69 61.16±9.44 21.33±2.99*27.19±3.20*23.29±2.72*79.80(70.15,87.10)82.25(53.13,118.28)1 213.50(1 139.25,1 352.25)*严重肌少症组(n=86)49/37 62.53±7.70 18.78±3.01*#24.99±3.33*#21.36±2.53*#70.40(64.55,7.10)*#51.40(37.30,73.10)*#1 213.00(1 130.50,1 320.00)*F/H/χ2值3.775 0.731 96.203 32.830 25.242 22.161 19.678 78.899 P值0.151 0.482<0.001<0.001<0.001<0.001<0.001<0.001
2.2 不同肌少症组的生化指标情况三组患者血清的TP、PA、ALB、GGT、ALP、HDL⁃C、Na+、K+、Ca2+差异有统计学意义(P< 0.05),见表2。
表2 三组患者的生化指标情况比较Tab.2 Comparison of biochemical indicators of patients in three groups±s
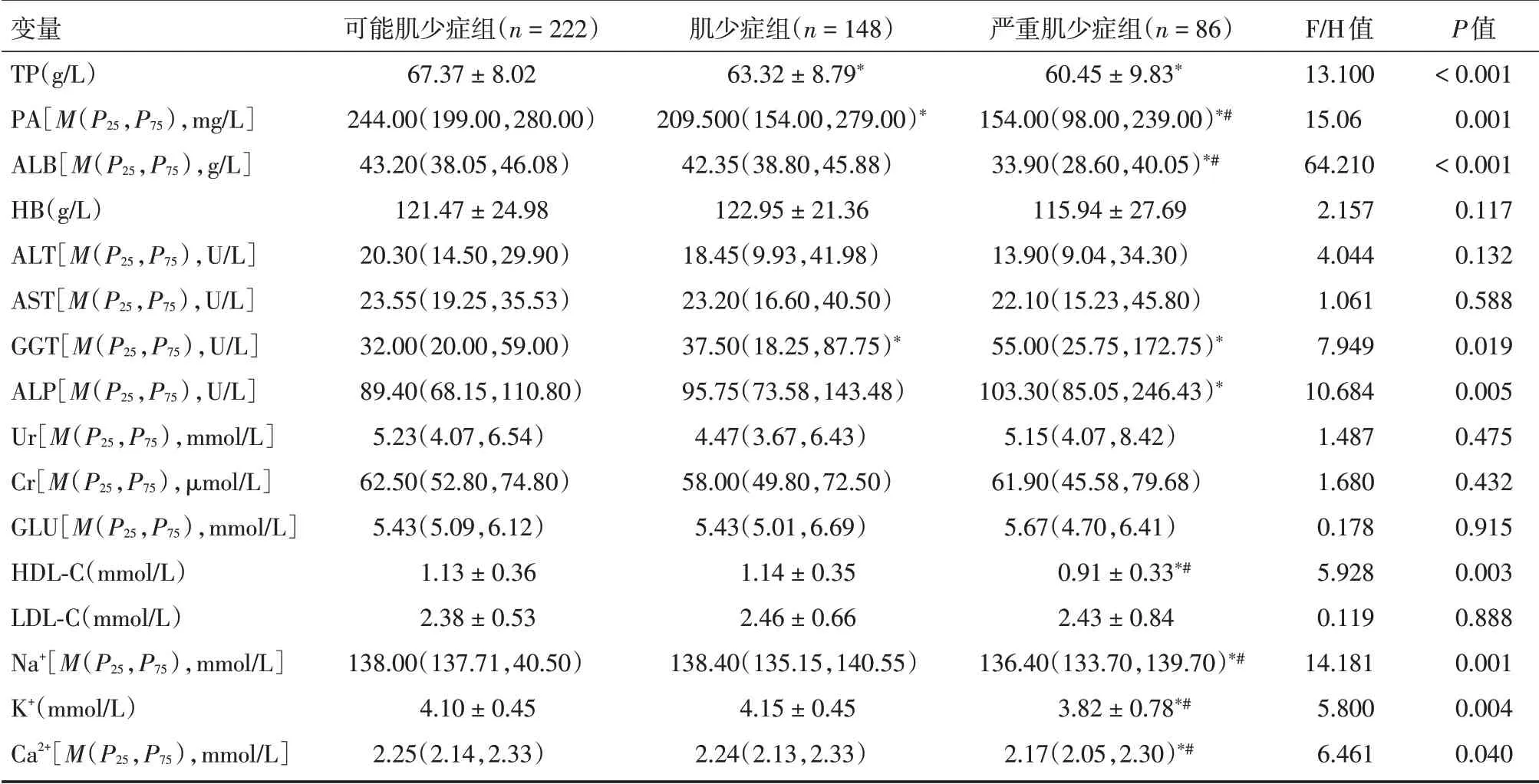
表2 三组患者的生化指标情况比较Tab.2 Comparison of biochemical indicators of patients in three groups±s
注:与可能肌少症组比较,*P<0.05;与肌少症组比较,#P<0.05
变量TP(g/L)PA[M(P25,P75),mg/L]ALB[M(P25,P75),g/L]HB(g/L)ALT[M(P25,P75),U/L]AST[M(P25,P75),U/L]GGT[M(P25,P75),U/L]ALP[M(P25,P75),U/L]Ur[M(P25,P75),mmol/L]Cr[M(P25,P75),μmol/L]GLU[M(P25,P75),mmol/L]HDL⁃C(mmol/L)LDL⁃C(mmol/L)Na+[M(P25,P75),mmol/L]K+(mmol/L)Ca2+[M(P25,P75),mmol/L]可能肌少症组(n=222)67.37±8.02 244.00(199.00,280.00)43.20(38.05,46.08)121.47±24.98 20.30(14.50,29.90)23.55(19.25,35.53)32.00(20.00,59.00)89.40(68.15,110.80)5.23(4.07,6.54)62.50(52.80,74.80)5.43(5.09,6.12)1.13±0.36 2.38±0.53 138.00(137.71,40.50)4.10±0.45 2.25(2.14,2.33)肌少症组(n=148)63.32±8.79*209.500(154.00,279.00)*42.35(38.80,45.88)122.95±21.36 18.45(9.93,41.98)23.20(16.60,40.50)37.50(18.25,87.75)*95.75(73.58,143.48)4.47(3.67,6.43)58.00(49.80,72.50)5.43(5.01,6.69)1.14±0.35 2.46±0.66 138.40(135.15,140.55)4.15±0.45 2.24(2.13,2.33)严重肌少症组(n=86)60.45±9.83*154.00(98.00,239.00)*#33.90(28.60,40.05)*#115.94±27.69 13.90(9.04,34.30)22.10(15.23,45.80)55.00(25.75,172.75)*103.30(85.05,246.43)*5.15(4.07,8.42)61.90(45.58,79.68)5.67(4.70,6.41)0.91±0.33*#2.43±0.84 136.40(133.70,139.70)*#3.82±0.78*#2.17(2.05,2.30)*#F/H值13.100 15.06 64.210 2.157 4.044 1.061 7.949 10.684 1.487 1.680 0.178 5.928 0.119 14.181 5.800 6.461 P值<0.001 0.001<0.001 0.117 0.132 0.588 0.019 0.005 0.475 0.432 0.915 0.003 0.888 0.001 0.004 0.040
2.3 营养状况与肌少症分级以及人体理化指标的关联分析患者的营养状况与BMI、AC、AMC、WC、VFA、BMR、TP、PA、ALB、HDL⁃C、Na+、K+和Ca2+均呈负相关(P< 0.01),与肌少症分级、GGT、ALP 均呈正相关(P<0.001),见图1。
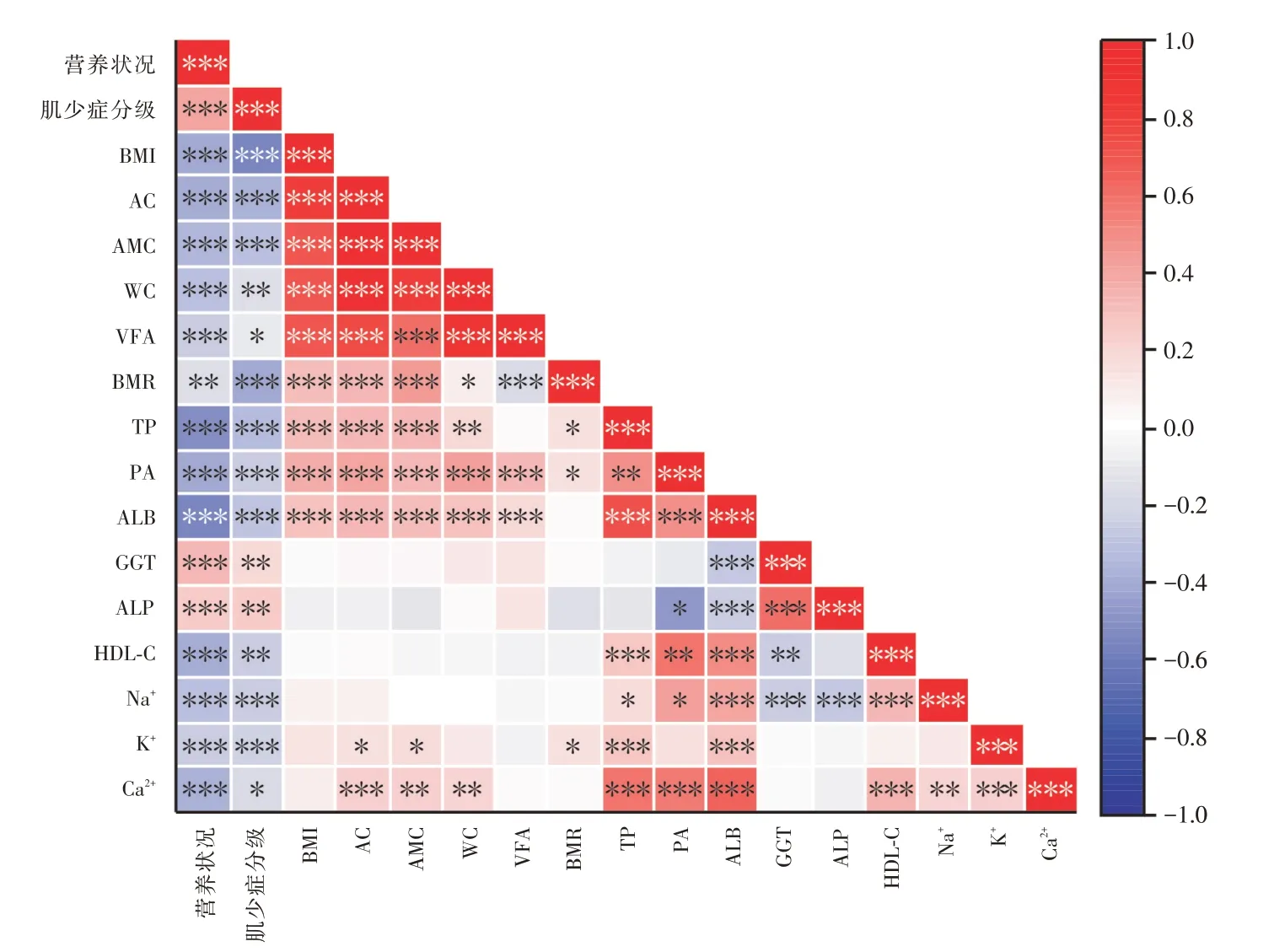
图1 营养状况与肌少症分级以及人体理化指标的相关性Fig.1 Correlation between nutritional status and classification of sarcopenia and physical and chemical indicators of human body
2.4 肌少症的危险因素分析调整性别、年龄和BMI 后,营养不良肌少症患病危险是营养正常的1.572 倍(95%CI:1.366~ 1.809),差异有统计学意义(P<0.001),见表3。

表3 不同营养状况肌少症的logistic 分析Tab.3 Logistic analysis of sarcopenia in different nutritional status
2.5 不同营养状况组肌少症发生情况不同营养状况组的肌少症患病情况差异有统计学意义(χ2=112.941,P< 0.001),营养正常组、营养风险组、可能营养不良组、营养不良组的肌少症和严重肌少症合计患病率分别为36.14%(73/202)、50.00%(25/50)、41.67%(20/48)、74.36%(116/156),见图2。
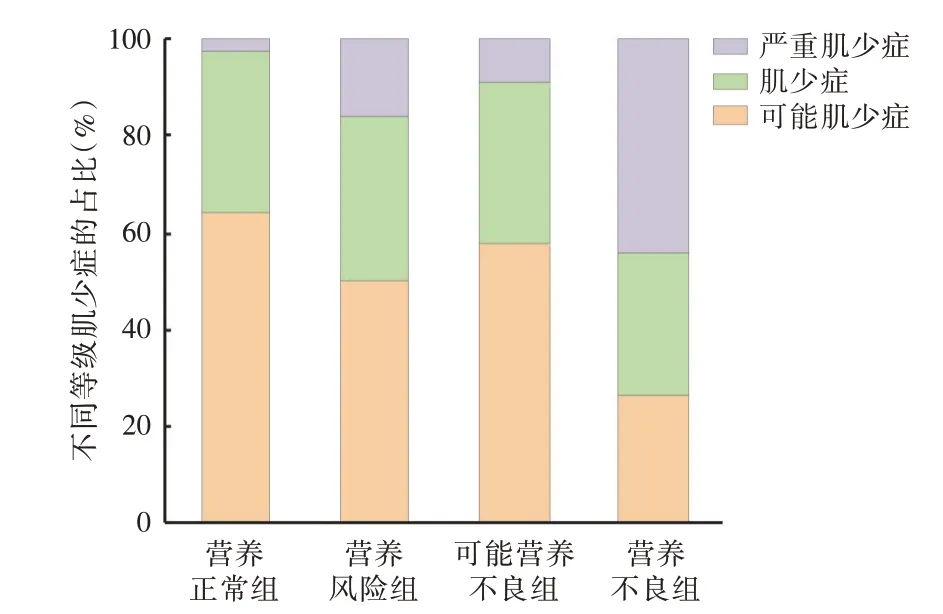
图2 不同营养状况患者肌少症患病率情况的比较Fig.2 Comparison of the prevalence of sarcopenia in patients with different nutritional status
3 讨论
肌少症分为原发性肌少症和继发性肌少症,原发性肌少症主要与衰老相关的骨骼肌质量减少,继发性肌少症常见于恶性肿瘤、慢性阻塞性肺疾病、心力衰竭等患者[8]。一项Meta分析表明[9],肌少症在非小细胞肺癌患者中的患病率可达52%,并且肌少症与较短的总生存期相关(HR=2.23;95%CI:1.68~ 2.94)。营养不良是肌少症的危险因素之一,影响恶性肿瘤患者的预后[10]。目前,NRS⁃2002 量表和PG⁃SGA 量表在肿瘤患者营养评估中均有应用[6],但二者各有侧重和优缺点。本研究将两种量表结合应用,通过提高恶性肿瘤患者营养不良阳性筛查率,为早期发现肿瘤患者伴发肌少症提供有效的参考依据。
消瘦为肌少症的主要特征之一,主要表现为骨骼肌质量减少[10]。本研究结果显示,严重肌少症组的BMI、AC、AMC、WC、VFA、BMR 等指标均低于可能肌少症组,表明肌少症不仅表现为肌肉质量减少方面,同时也表现在脂肪减少和代谢率降低方面。
血清蛋白含量对于反映机体营养状况具有重要参考价值,其与肌少症的发生密切相关[10]。一项纳入187 名恶性肿瘤患者的横断面研究表明[11],血清ALB 含量在肌少症组(39.2 ± 4.5)g/L 和严重肌少症组(38.1 ± 5.9)g/L 显著低于无肌少症组(42.8 ± 3.8)g/L 和可能肌少症组(42.1 ± 4.5)g/L。本研究发现,研究对象的血清TP、PA、ALB 的含量随肌少症等级的加重而降低,结果与以往报道相似,表明血清中蛋白含量可能成为不同等级肌少症的预测因子。
本研究发现严重肌少症组血清中GGT、ALP含量高于可能肌少症组,表明随肌少症等级的增加,患者肝脏疾病越严重。但BEER 等[12]对265 例慢性肝病患者研究发现,无论患者处于代偿期(cACLD)还是失代偿期(dACLD),肌少症患者血清的GGT、ALP 与无肌少症患者相比,差异均无统计学意义。分析原因可能由于肌少症的诊断标准不同所致,BEER 等[12]应用磁共振成像(MRI)技术检测患者的骨骼肌质量,并以调整横向腰肌厚度(TPMT)作为诊断肌少症的依据,而本研究则采用EWGSOP 分级标准[7]。此外,患者的疾病严重程度、样本量等也可能导致结果的不一致,但血清ALT 和AST 在肌少症组和非肌少症组无明显变化,与本研究结果具有一致性。因此,还需开展大样本多中心的研究,以便进一步验证肌少症与肝脏代谢指标的关系。
多项研究表明[13-15],结直肠癌、肺癌和胃癌等的发生与血清HDL⁃C 水平降低有关,ABE 等[16]报道,中重度肌少症患者的HDL⁃C 含量低于非肌少症患者,结果与本研究相似,可能原因为HDL⁃C 及其载脂蛋白(ApoA⁃1 和Apo⁃E)具有介导胆固醇逆转运、抗氧化和抗炎等作用[17],进而防止肌少症的发生。肌少症不仅表现为骨骼肌质量减少,还表现在肌能衰减方面,而Na+、K+、Ca2+等对调节神经肌肉活动具有重要作用,尤其Ca2+为25⁃羟维生素D[25(OH)⁃ D]的前体物质[18],而维生素D 缺乏是导致肌少症的独立危险因素在以往报道中已得到证实[19]。
营养不良是导致肌少症的重要因素之一[10],本研究发现营养状况与多项人体相关的理化指标均具有相关性,并且与肌少症分级呈显著正相关,表明营养状况越差患严重肌少症程度越高,杨辉等[6]研究表明,NRS⁃2002 评分及PG⁃SGA 评分与BMI、ALB、PA 呈负相关,与超敏C 反应蛋白(CRP)呈正相关,结果与本研究具有一致性。
调整性别、年龄和BMI 后,logistic 回归分析显示营养不良为肌少症的独立危险因素,营养不良组肌少症患病危险是营养正常组的1.572 倍(95%CI:1.366~ 1.809),表明随营养不良程度的升高,恶性肿瘤肌少症的发病危险增加。
本研究结果同时显示,恶性肿瘤患者肌少症的患病率为51.32%(234/456),而RICHARDS 等[20]研究报道,直肠癌患者的肌少症发生率为32.9%(115/350),患病率低于本研究,可能受评价标准、地区、人群以及恶性肿瘤类型和疾病严重程度不同所致。本研究发现营养不良组(NRS⁃2002 ≥3分且PG⁃SGA ≥9 分)肌少症和严重肌少症合计患病率最高为74.36%,而营养风险组(NRS⁃2002 ≥3 分且PG⁃SGA<9 分)和可能营养不良组(NRS⁃2002 <3 分且PG⁃SGA ≥9 分)的合计患病率仅为50.00%和41.67%,表明RS⁃2002 结合PG⁃SGA 可有效提高肌少症的阳性筛查率。
本研究也存在不足之处,如未调查患者的膳食情况、受教育程度以及相关的家族史,并没有对某一特定类型的恶性肿瘤进行研究,并且本研究骨骼肌质量的测量采用生物电阻抗分析法(BIA),未采用精密度更高的双能X 线吸收法(DXA),上述因素均可能对研究结果产生一定的影响。
综上所述,NRS⁃2002 结合PG⁃SGA与恶性肿瘤肌肉减少症之间存在相关性,二者联合应用可有效提高肌肉减少症的阳性筛查率,为恶性肿瘤患者肌肉减少症的早期发现提供新的途径。
(本研究为五院联合开展的吉林省卫生健康管理模式革新项目,为吉林省的健康管理工作提供数据支持,在此向所有参加和支持本研究工作的医护人员表示衷心地感谢。)

