SLM成形不同孔隙结构骨支架的仿真与实验研究
孙海波,徐淑波,张森,李阳,任国成,景财年
应用技术
SLM成形不同孔隙结构骨支架的仿真与实验研究
孙海波,徐淑波,张森,李阳,任国成,景财年
(山东建筑大学 材料科学与工程学院,济南 250101)
确定多孔骨骼支架的最佳结构及孔隙率。建立不同孔隙率、不同结构的18个多孔支架模型,通过有限元对多孔支架分别进行应力、应变模拟分析,通过选择性激光熔化(SLM)技术制备A,B,C这3种不同结构、孔隙率范围相近(65%~90%)、支架直径相同(300 μm)的多孔316L支架。通过压缩试验、微观组织分析、X射线衍射试验(XRD)对不同多孔支架进行表面微观组织分析及力学性能研究。通过有限元模拟获得适用于人体皮质骨及松质骨的不同多孔支架结构及孔隙率。A类结构孔隙率为90%的多孔骨骼支架弹性模量为7.5 GPa,抗压强度为11.62 MPa,与人体松质骨相吻合;B类结构孔隙率为80%的多孔骨骼支架弹性模量为18.9 GPa,抗压强度为127.01 MPa,与皮质骨相吻合。通过模拟及试验,确定了适用于不同骨骼部位的最佳结构及孔隙率,并且多孔结构有利于营养物质及血液的运输,保证了骨骼替代物的生物力学性能,有助于患者的康复。
选择性激光熔化;多孔支架;有限元模拟;孔隙率
骨组织缺损已经成为危害人类身体健康、降低人们生活质量的主要问题,骨骼替代物的研究对于骨组织缺损患者十分重要,理想的骨骼替代物应符合人体骨骼的相关力学性能,拥有良好生物相容性及孔隙率,以保证血液及营养物质的输送,加快患者的康复过程,并且骨骼代替物应与骨缺损部位形状一致,保证替代的成功率,因此,骨骼支架在骨组织缺损治疗中起着至关重要的作用[1],而传统加工方式存在支架加工精度不足、成形困难的问题。
随着增材制造(Additive manufacturing,AM)技术的发展,3D打印多孔支架(Porous scaffold)成为治疗骨组织缺损的新技术,其个性化制造的特点解决了传统制造方法由于骨缺损形状不同而导致成形困难的问题[2]。通过增材制造技术制备多孔骨骼支架,能够有效控制支架的尺寸、孔径、孔隙率及结构特征,能够更好地保证血液、营养物质及代谢废物在骨骼支架间的运输,并且通过增材制造技术可以根据患者的不同情况进行精准的个性化制备,保证替代手术的成功率。
多孔结构具有轻量化、缓冲吸震等特性[3],多孔骨骼支架有利于血液、营养物质的运输以及代谢废物的排出,同时有利于骨细胞在支架上的附着并向内生长以及组织液的渗透,使植入物最终能够与生物体成功融合,加速患者的康复过程[4-5]。适用于人体骨组织缺损骨骼支架的最佳结构以及孔隙率并没有定论,文中详细论述了选择性激光熔化成形多孔骨骼支架的制备工艺,并对不同孔隙率、不同结构的多孔骨骼支架进行了微观组织分析及力学性能研究[6]。
1 多孔骨骼支架的制备
考虑到不同多孔结构的力学性能,设计了A,B,C这3种单元结构,如图1所示,其中A为体心立方体结构,单元杆截面为圆形,直径为300 μm,B为面心立方体结构,单元杆截面为圆形,直径为300 μm,C为垂直立体结构,3根单元杆相互垂直,连接处有一直径为400 μm的球以避免应力集中,单元杆截面为圆形,直径为300 μm。采用NX(Siemens NX)建模软件绘制模型,将单元结构分别沿,,这3个方向阵列得到三维多孔支架,利用选择性激光熔化成形(Selective laser melting,SLM)制备多孔支架。

图1 单元结构详情
采用316L不锈钢(Stainless steel,SS)球状粉末材料,其微观组织形貌见图2,可以看出粉末平均直径为40 μm左右,具体成分见表1。316L不锈钢是国际医疗产业目前最常用的金属材料之一[7],其耐腐蚀性强、力学性能优良、价格低廉、加工性好等特点令其成为骨骼替换物的最佳材料之一[8]。选择性激光熔化成形制备多孔支架的具体参数为:激光功率为150 W,铺粉层厚为50 μm,扫面速度为500 mm/s,扫描间距为60 μm,采用-层间交错加轮廓扫描方案,在氩气保护下制备。将孔隙率为80%,85%,90%的A类结构以及孔隙率为75%和80%的B类结构的多孔支架进行选择性激光熔化成形,由于其他结构、孔隙率的多孔支架的力学性能与人体骨骼的力学性能不匹配,故不进行制备。多孔支架制备完成后利用线切割设备令其与打印基板分离,图3为选择性激光熔化成形制备的316L不锈钢多孔骨骼支架实体。

图2 球状316L不锈钢粉末扫描电镜
室温下,316L不锈钢为奥氏体组织,文中采用选择性激光熔化技术对多孔支架进行制备,选择性激光熔化技术为增材制造,逐层叠加的制造方式使其在加工时组织生长方向与传统加工方式不同,利用X射线衍射(XRD)对多孔骨骼支架堆叠面进行物相分析,图4为X射线衍射图谱,可以看出,选择性激光熔化成形的多孔骨骼支架组织仍为奥氏体组织,晶粒取向择优选择(111)方向。图5为试样建造面的金相组织,可以看出在选择性激光熔化成形过程中激光往复扫描,导致成形面上的各晶粒呈带状有规则排列,并且晶粒形态呈现多边形或近圆形,并且晶粒外延生长与激光熔化成形方向基本一致。
表1 球状316L不锈钢022Cr17Ni12Mo2化学成分(体积分数)

Tab.1 022Cr17Ni12Mo2 composition in spherical 316L stainless steel (volume fraction) %

图3 选择性激光熔化成形制备的316L不锈钢多孔骨骼支架实体

图4 X-射线衍射图谱
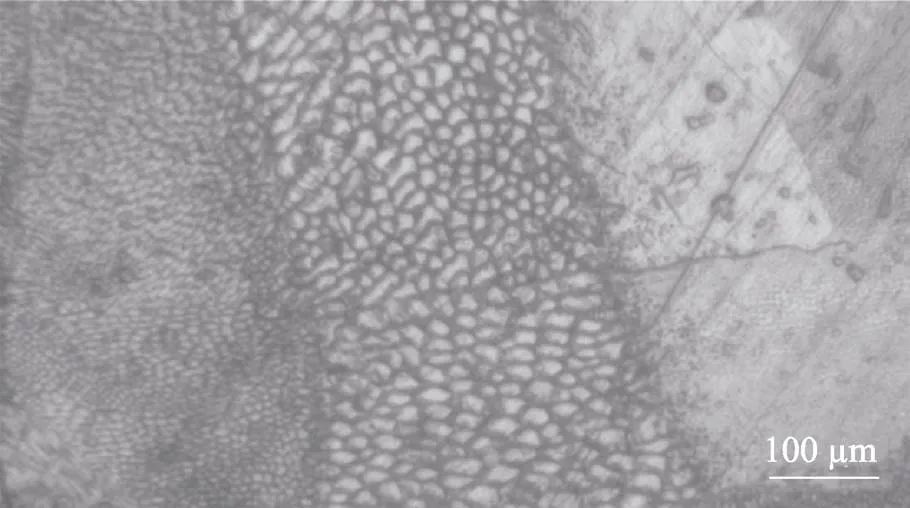
图5 微观组织
2 有限元分析
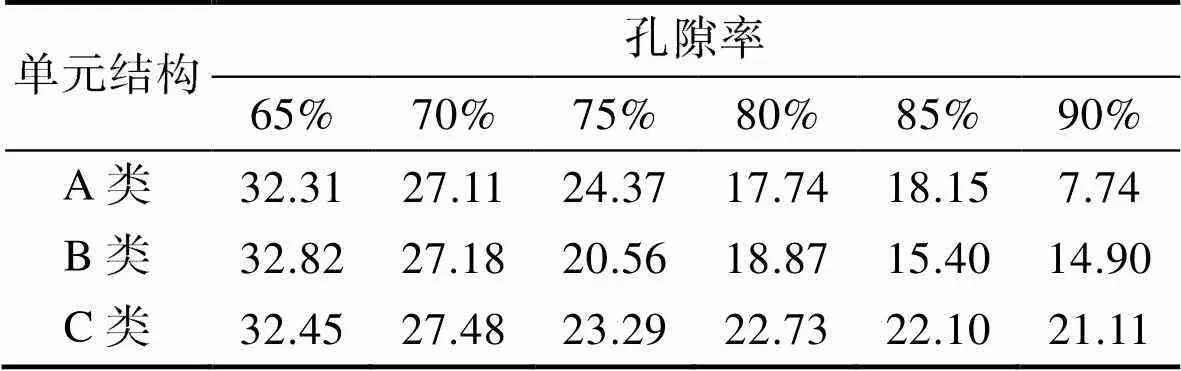
前期文献研究表明,骨骼替代物的理想孔隙率为65%~90%,实体截面直径理想尺寸为300~500 μm[9-11],这样的骨骼替代物能够保证骨细胞附着及血管生长,能够保证营养物质的运输,有助于缺损骨组织的恢复。文中单元结构杆的直径均设置为300 μm,将孔隙率从65%~90%每5%设置一个梯度,共设置6个孔隙梯度,316L多孔支架保留了其耐腐蚀、强度高等特点,并且有良好的生物力学性能,是最适合骨骼替代物的材料之一[12-14]。
建立不同孔隙率的多孔支架模型,采用Ansys软件将不同孔隙率、不同结构的多孔支架进行有限元模拟,为方便模拟,模型两端分别加层厚为200 μm刚性板,刚性板四周与模型平齐,试验中平台及刚性板变形较支架结构变形可忽略不计。将材料设置为316L不锈钢,弹性模量为195 GPa,泊松比为0.3,密度为7.98 g/cm3,约束下刚性面自由度,在上刚性面加载2000 N载荷,进行应力-应变分析,比较、优化获得最佳的多孔支架。表2为各支架模型的弹性模量平均值。
表2 各支架弹性模量平均值
Tab.2 Average elastic modulus of each scaffold GPa
人体皮质骨弹性模量介于17~20 GPa,松质骨弹性模量介于3.2~7.8 GPa[15],骨骼支架的设计在考虑强度的同时也应兼顾支架的力学性能,骨骼支架植入体中应与植入位置周围自然骨的力学性能相吻合,若弹性模量高于自然骨弹性模量,则易出现应力屏蔽现象,使骨骼支架周围出现骨质疏松的现象。根据模拟结果得到,A类结构孔隙率为80%和85%的多孔支架的弹性模量分别为17.74 GPa和18.15 GPa,B类结构孔隙率为80%的多孔支架弹性模量为18.87 GPa,与人体皮质骨弹性模量相吻合;A类结构孔隙率为90%的多孔支架弹性模量为7.74 GPa,与人体松质骨弹性模量范围吻合。图6为A,B,C这3类结构多孔支架的变形及应力分布云图,由图6a—c可以看出,多孔支架均在上部,变形量较大,且总变形量大于人体骨骼变形量的极限。由图6d—f可以看出,多孔支架的应力在支架上端及下端较大,中间部分应力较小;C类结构横向单元杆应力极小,应力主要集中在竖向单元杆,应力集中现象严重,因此适合于人体植入。图7为多孔支架应力、变形内部,其中图7a和b为A和B这2种不同结构多孔支架应力的内部细节,图7c和d为A和B这2种不同结构多孔支架变形内部细节,可以看出由于多孔支架是由单元结构阵列而来,在单元杆的连接处会有一定缺陷而导致应力集中,因此,对单元杆连接点进行填充,使2个单元杆完全接触,可以一定程度上减小应力,避免应力集中现象的发生。
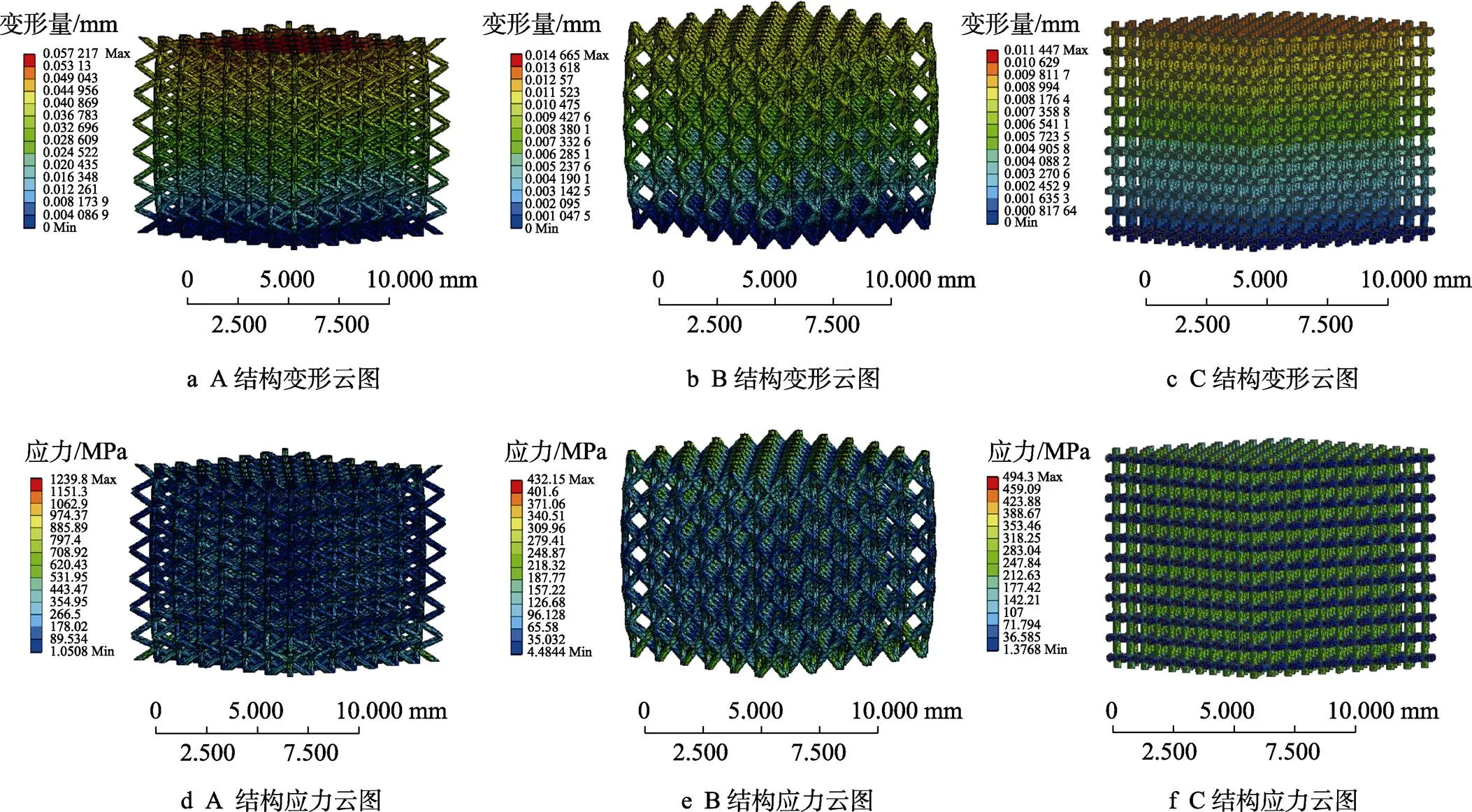
图6 多孔支架变形、应力云图

图7 多孔支架应力、变形内部
3 结果与分析
3.1 压缩试验分析
对已制备的多孔骨骼支架进行压缩试验,设置下压速度为0.5 mm/min,图8为应力-应变曲线,可以看出,各多孔骨骼支架压缩过程的变化趋势基本一致,都经历3个阶段:① 从压缩试验开始到第1个拐点处,多孔骨骼支架内部单元杆发生弹性变形,应变范围均小于0.1;② 后续为平台应力阶段,多孔骨骼支架局部杆件应力超过屈服强度开始发生塑性变形,由于多孔骨骼支架内部有复杂孔洞,发生塑性变形的单元杆之间不会立刻接触,因此,应变量持续增加时,应力大小相对稳定;③ 当应变量增加到一定程度后,多孔骨骼支架内部单元杆开始接触并逐渐压实,导致在不大的应变范围内应力迅速增加,吸能作用大大下降。
在压缩试验过程中应力-应变曲线光滑,上升、下降过渡通顺,证明了材料具有良好的延展性,并且多孔骨骼支架减震吸能效果良好。由图8可以看出,B结构较A结构来说弹性阶段斜率更大,表明在相同应变范围内,B结构能够承受更大的力,抗压强度大,力学性能更加优异。
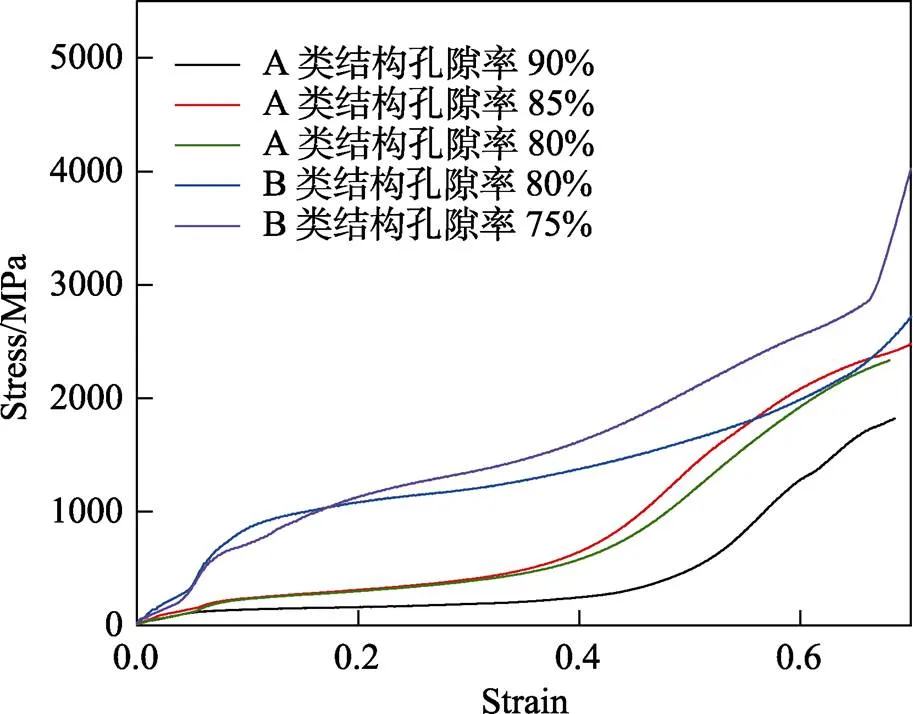
图8 应力-应变曲线
3.2 多孔骨骼支架力学性能分析
多孔骨骼支架是由单元杆连接而成的网状体,其形状各不相同,并且内部存在复杂孔洞。关于多孔结构的弹性模量,学者Gibson与Ashby经过研究确立了多孔支架密度与弹性模量支架的幂函数特征关系,并创立了Gibson-Ashby模型[16],即:
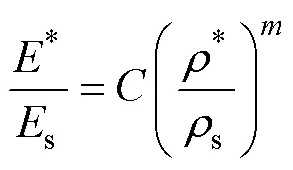
式中:*为多孔骨骼支架的弹性模量;s为其固体的弹性模量,大小为210 GPa;*为多孔骨骼支架的密度;s为其固体的密度,测得为7.98 g/cm3;和为几何常数,开孔结构中=1,=2。为获得多孔骨骼支架的实际弹性模量,对制备的多孔骨骼支架密度分别进行测算,并带入式(1)中算得多孔骨骼支架的实际弹性模量,见表3。
通过表3可以看出,A和B不同结构多孔骨骼支架的抗压强度差距较大,人体皮质骨抗压强度为102.9~140.7 MPa,松质骨抗压强度为3.2~7.8 MPa,而制备的A结构孔隙率为85%的多孔骨骼支架虽然在弹性模量上与皮质骨弹性模量吻合,但抗压强度相差较大,不能满足人体正常活动的力学性能,因此不适用于皮质骨植入物;B结构孔隙率为80%的多孔骨骼支架在弹性模量、抗压强度方面均符合皮质骨力学性能要求,因此适用于人体皮质骨植入物。A结构孔隙率90%的多孔骨骼支架弹性模量与松质骨弹性模量相吻合,并且抗压强度略大于松质骨抗压强度,因此适用于松质骨植入物。
表3 多孔骨骼支架实际密度及弹性模量

Tab.3 Actual density and elastic modulus of porous bone scaffold
4 结论
1)选择性激光熔化成形的多孔骨骼支架组织仍为奥氏体组织,成形面上的各晶粒呈带状有规则排列且分布均匀,晶粒形态呈现多边形或近圆形,晶粒外延生长与激光熔化成形方向基本一致,采用选择性激光熔化技术制备的316L多孔骨骼支架生物力学性能符合人体骨骼植入需求,并且具有更好的力学性能。
2)通过有限元模拟分析得到了孔隙率合理的多孔骨骼支架,经优化后孔隙率为90%的多孔骨骼支架A结构的弹性模量与人体松质骨弹性模量吻合,A结构孔隙率为85%和80%、B结构孔隙率为80%和75%的多孔骨骼支架弹性模量与人体皮质骨弹性模量相符合,C结构多孔骨骼支架由于结构问题不适用于人体骨骼植入,为后续试验研究提供了理论指导。
3)通过试验探究,得到孔隙率为90%的多孔骨骼支架A结构的弹性模量与抗压强度均符合松质骨力学性能要求,适用于人体松质骨植入物,而孔隙率为80%的多孔骨骼支架B结构的弹性模量与抗压强度均符合皮质骨力学性能要求,适用于人体皮质骨植入物,明确了适用于不同骨骼位置替代的支架单元结构及孔隙率。
[1] 赵志国, 柏林, 李黎, 等. 激光选区熔化成形技术的发展现状及研究进展[J]. 航空制造技术, 2014, 57(19): 46-49.
ZHAO Zhi-guo, BO Lin, LI Li, et al. Development Status and Research Progress of Laser Selective Melting Technology[J]. Aeronautical Manufacturing Technology, 2014, 57(19): 46-49.
[2] 梁晓康, 董鹏, 陈济轮, 等. 激光选区熔化成形Ti-6Al-4V钛合金的显微组织及性能[J]. 应用激光, 2014, 34(2): 101-104.
LIANG Xiao-kang, DONG Peng, CHEN Ji-lun, et al. Microstructure and Properties of Ti-6Al-4V Titanium Alloy Formed by Laser Selective Melting[J]. Applied Laser, 2014, 34(2): 101-104.
[3] 张亚民, 吴姚莎, 杨均宝, 等. 粉末形貌对选区激光熔化316L不锈钢力学性能的影响[J]. 金属热处理, 2021, 46(2): 173-177.
ZHANG Ya-min, WU Yao-sha, YANG Jun-bao, et al. Effect of Powder Morphology on Mechanical Properties of 316L Stainless Steel by Selective Laser Melting[J]. Heat Treatment of Metals, 2021, 46(2): 173-177.
[4] 尹华. 金属粉末选区激光熔化成形工艺研究[D]. 太原: 中北大学, 2010: 27-33.
YIN Hua. Research on Selective Laser Melting Process of Metal Powder[D]. Taiyuan: North University of China, 2010: 27-33.
[5] NAGARAJAN B, HU Z, GAO S, et al. Effect of In-Situ Laser Remelting on the Microstructure of SS316L Fabricated by Micro Selective Laser Melting[M]. Singapore: Springer, 2019: 32-35.
[6] 孙星. 3D打印可再生多孔骨骼支架及性能研究[D]. 济南: 山东建筑大学, 2020: 29-32.
SUN Xing. Research on 3D Printed Regenerative Porous Bone Scaffold and Its Performance[D]. Jinan: Shandong Jianzhu University, 2020: 29-32.
[7] 王翔. 基于3D打印的人工骨骼支架结构设计[D]. 南宁: 广西大学, 2019: 19-24.
WANG Xiang. Structure Design of Artificial Bone Scaffold Based on 3D Printing[D]. Nanning: Guangxi University, 2019: 19-24.
[8] GAO J B, BEN D D, YANG H J, et al. Effects of Electropulsing on the Microstructure and Microhardness of a Selective Laser Melted Ti6Al4V Alloy[J]. Journal of Alloys and Compounds, 2012, 35: 120-125.
[9] ČERVINEK Ondřej, WERNER Benjamin, KOUTNY Daniel, et al. Computational Approaches of Quasi-Static Compression Loading of SS316L Lattice Structures Made by Selective Laser Melting[J]. Materials, 2021, 14(9): 2462.
[10] PEI F A, JJ A, LI Y A, et al. Accelerated Degradation of Poly(l-Lactide) Bone Scaffold: Crystallinity and Hydrophilicity[J]. Materials Chemistry and Physics, 2021, 266: 124545.
[11] MASOOD S H, SINGH J P, MORSI Y. The Design and Manufacturing of Porous Scaffolds for Tissue Engineering Using Rapid Prototyping[J]. International Journal of Advanced Manufacturing Technology, 2005, 27(3/4): 415-420.
[12] ARAHIRA T, MARUTA M, MATSUYA S, et al. Development and Characterization of a Novel Porous β-TCP Scaffold with a Three-Dimensional PLLA Network Structure for Use in Bone Tissue Engineering[J]. Materials Letters, 2015, 152: 148-150.
[13] ANTONY K. Studies on Single Track Laser Melting of SS316l Powder[J]. Vellore, 2014: 78-86.
[14] ANTONY K, ARIVAZAHAGAN N, SENTHILKUMARAN K. Influence of Laser Melting Process Parameters on Surface Roughness Behavior for SS316l Powder[J]. Journal of Corrosion Science and Engineering, 2013, 16: 77-91.
[15] 徐淑波, 孟子翔, 刘鹏, 等. 激光选区融化成形多孔硬骨支架的建模仿真及实验研究[J]. 稀有金属材料与工程, 2020, 409(8): 242-246.
XU Shu-bo, MENG Zi-xiang, LIU Peng, et al. Modeling, Simulation and Experimental Study of Laser Selective Thaw Forming Porous Bony Stents[J]. Rare Metal Materials and Engineering, 2020, 409(8): 242-246.
[16] LORNA J, GIBSON, MICHAEL F A. Cellular Solids: Structure and Properties[M]. Cambridge: Cambridge University Press, 1997: 161-179.
Simulation and Experimental Study of Bone Scaffolds with Different Pore Structures Formed by SLM
SUN Hai-bo, XU Shu-bo, ZHANG Sen, LI Yang, REN Guo-cheng, JING Cai-nian
(School of Materials Science and Engineering, Shandong Jianzhu University, Jinan 250101, China)
The work aims to determine the optimal structure and porosity of the porous bone scaffold.18 porous scaffold models with different porosities and structures were established and the stress and strain of porous scaffolds were simulated and analyzed by finite element method. 316L porous scaffolds with the different structures of A, B and C, the similar porosities (65% ~ 90%) and the same scaffold diameter (300 μm)were prepared by selective laser melting (SLM). The surface microstructure and mechanical properties of different porous scaffolds were studied by compression test, microstructure analysis and X-ray diffraction (XRD). The structure and porosity of different porous scaffolds for human cortical and cancellous bone were obtained by finite element simulation. The elastic modulus and compressive strength of the porous bone scaffold with structure A and porosity of 90% were 7.5 GPa and 11.62 MPa, which were consistent with human cancellous bone, and the elastic modulus and compressive strength of the porous bone scaffold with structure B and porosity of 80% were 18.9 GPa and 127.01 MPa, which were consistent with cortical bone.Through simulation and experiment, the optimal structure and porosity suitable for different bone parts have been determined, and the porous structure is conducive to the transport of nutrients and blood, ensuring the biomechanical properties of bone substitutes, which is conducive to the recovery of patients.
selective laser melting; porous scaffold; finite element simulation; porosity
10.3969/j.issn.1674-6457.2022.02.019
TB303
A
1674-6457(2022)02-0123-06
2021-07-02
山东省重点研发计划(2017GGX30128)
孙海波(1997—),男,硕士生,主要研究方向为增材制造。
徐淑波(1977—),男,博士,教授,主要研究方向为增材制造。

