木犀草苷对MCF-7细胞增殖、迁移、侵袭的影响及其机制
陈 建, 曾智锐, 雷 珊, 薛 燕, 陈腾祥, 王 璐*
(1.贵州医科大学基础医学院生理教研室,贵州 贵阳 550025;2.贵阳市妇幼保健院,贵州 贵阳 550004)
乳腺癌(breast carcinoma)是全世界女性面临的最普遍的恶性肿瘤[1]。目前,诊断和治疗乳腺癌的技术手段有了很大的改善,使得早期乳腺癌患者的生存率大大提高,但是转移性乳腺癌患者的生存率仍然很低,导致其死亡率高的主要原因是肿瘤的转移和复发[2]。因此,研发出抑制乳腺癌转移的药物对乳腺癌患者具有重要意义。近年来,中药及其活性提取物在抗乳腺癌中发挥着重要作用,其具有多途径、多靶点和毒副作用低等优点,有研究表明,多种中药成分对乳腺癌的生长、转移、复发和耐药性具有很好的抑制作用[3]。
木犀草苷(cynaroside)又名木犀草素-7-O-葡萄糖苷(luteolin-7-O-glucoside),是一种广泛存在于忍冬科药用植物中的黄酮类化合物,具有抗炎、抗病毒、抗肿瘤以及心血管系统和神经系统保护等多种生物活性[4]。研究发现,木犀草苷能显著抑制人白血病细胞系K526的增殖,且具有浓度依赖性[5]。王婷婷等[6]发现木犀草苷通过影响凋亡相关基因cyclin D1、survivin、c-myc和p53基因的表达,诱导细胞凋亡,改变人食管癌细胞Ecol109的细胞周期,从而抑制Ecal109细胞的生长。木犀草苷通过调控MAPK和mTOR信号通路抑制人宫颈癌细胞的增殖并促进其细胞凋亡[7]。此外,木犀草苷还会影响肿瘤新生血管的形成,最终使肿瘤细胞凋亡[8]。因此,木犀草苷是一种具有抗肿瘤潜能的天然化合物。有研究表明,从决明子叶[9],鼠尾草[10]和栝楼[11]等多种植物中提取的木犀草苷成分对乳腺癌细胞的增殖有一定抑制作用,然而,木犀草苷对乳腺癌细胞的具体作用及其机制尚不明确,故本研究探索该成分对乳腺癌细胞增殖、迁移和侵袭能力及其机制的影响,以期为乳腺癌新药研发提供新思路。
1 材料
1.1 细胞株 人乳腺癌MCF-7细胞株,购自中国科学院生物细胞库。
1.2 药物 木犀草苷对照品(纯度98.67%,批号HY-N0540),购自美国MCE公司,使用DMSO配制成10 mmol/L母液,在-20 ℃下保存。使用时,用含10%胎牛血清的DMEM培养基将其稀释至不同浓度的工作液。
1.3 试剂 DMEM细胞培养基(货号C11995500BT),购自美国Gibco公司;胎牛血清(fetal bovine serum, FBS,货号BI500),购自以色列Bioind公司;0.25%胰酶(货号325-043-EL),购自维森特生物技术(南京)有限公司;二甲基亚砜(dimethylsulfoxide,DMSO,货号D2650),购自美国Sigma公司;细胞增殖与毒性检测试剂(cell counting kit-8, CCK8,货号MA0218),购自大连美伦生物技术有限公司;一次性细胞嵌入皿24孔8 μm(货号TCS003024),购自广州洁特生物过滤股份有限公司;无EDTA胰蛋白酶消化液(货号T1350)、高效蛋白裂解液(货号P0013B)、蛋白酶抑制剂PMSF(货号ST505)、BCA定量试剂盒(货号PC0020)、制胶试剂丙烯酰胺(29∶1,30%溶液)(货号BL513B)、10% SDS溶液(货号S1010)、APS、1 mol/L Tris-HCl(pH 6.8,货号T1020),均购自北京索莱宝科技有限公司;PVDF膜(批号ISEQ00010),购自美国Millipore公司;单克隆抗体N-cadherin(货号66219-1-Ig)、E-cadherin(货号60335-1-Ig)、Vimentin(货号60330-1-Ig)和Bcl-2(货号60178-1-Ig),均购自武汉三鹰生物技术有限公司;单克隆抗体PCNA(货号GB11010),购自武汉塞维尔生物科技有限公司;多克隆抗体Bax(货号YT0459)、单克隆抗体β-actin(货号AP0060),购自安诺伦(北京)生物科技有限公司;山羊抗兔(货号AS014)、山羊抗鼠二抗(货号AS003),购自武汉爱博泰克生物科技有限公司;ECL超敏曝光液(货号36222ES60),购自武汉聚能慧达生物有限公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒(货号40302ES50),购自上海翊圣生物科技有限公司。
2 方法
2.1 细胞培养 MCF-7细胞培养于含10%FBS的DMEM培养基中(37 ℃、5% CO2),待细胞汇合至90%以上时胰酶消化传代,取生长状态良好的细胞用于后续实验。
2.2 CCK-8实验检测细胞活力 胰酶消化MCF-7细胞后离心,用含10% FBS的培养基重悬制成细胞悬液,按照每孔3×103个细胞的密度进行计数,铺于96孔板上,每个浓度重复6次,继续培养24 h,分别用12.5、25、50 μmol/L木犀草苷溶液处理,以加入等体积DMSO的DMEM培养液(即0 μmol/L)为对照组,加药后培养48 h,每孔加入100 μL 含10% CCK-8的DMEM培养基,放入培养箱中反应2 h,采用酶标仪检测在450 nm波长处各孔光密度(OD)值。以0 μmol/L为对照孔,只含CCK-8的DMEM培养基孔为调零孔,计算存活率,存活率=[(给药组OD值-调零孔OD值)/(对照组OD值-调零孔OD值)]×100%。
2.3 克隆形成实验检测细胞存活情况 胰酶消化MCF-7细胞后离心,加入含血清培养基制成细胞悬液,血球计数板计数后按照每皿500个细胞的密度接种于6 cm的小皿中。继续培养5 d后,分别用12.5、25、50 μmol/L浓度的木犀草苷溶液处理细胞,以加入等体积DMSO的DMEM培养液(即0 μmol/L)为对照组,加药处理后继续培养。在第10天时吸出培养基,4%多聚甲醛溶液固定30 min,吸出固定液后,0.1%结晶紫溶液染色1 h(均在室温下进行),双蒸水将多余结晶紫洗净,将小皿放入烘箱内烘干,拍照后计算克隆形成数。
2.4 流式细胞术检测MCF-7细胞凋亡率 取生长状态良好的MCF-7细胞,以每孔4×104个的密度接种于6孔板中,培养24 h后分别加入12.5、25、50 μmol/L木犀草苷溶液处理细胞,以加入等体积的DMSO(即0 μmol/L)为对照组,设置3组复孔,在培养箱中继续培养48 h,不含EDTA的胰酶消化细胞,收集所有液体于离心管中,1 000 r/min(离心半径8 cm)离心5 min,弃上清,PBS洗涤,再离心5 min,将细胞沉淀转入流式管中,每管加入100 μL binding buffer重悬细胞,再加入5 μL FITC染液、10 μL PI染液,轻轻混匀,室温下染色15 min,将流式管放在冰上保存,上流式细胞仪前再加入400 μL binding buffer液混匀,用流式细胞仪检测各组细胞的凋亡情况,计算总凋亡率,总凋亡率=晚期凋亡率(右上象限)+早期凋亡率(右下象限)。
2.5 划痕实验检测细胞迁移能力 MCF-7细胞按照每孔2×105个细胞的密度接种于6孔板中,放入培养箱培养,待细胞密度达95%以上时,在单层细胞上用200 μL移液器枪头平行划3道痕,PBS振荡漂洗3次,加入含不同浓度(12.5、25、50 μmol/L)木犀草苷的无血清DMEM培养液,对照组加入含等体积DMSO的无血清DMEM培养液(即0 μmol/L)。分别在划痕0、48 h后,给药组在倒置显微镜下随机选取5个视野进行拍照,划痕宽度在Image Pro Plus软件中测量,计算相对迁移率,相对迁移率=[(给药组0 h划痕宽度-给药组48 h划痕宽度)/(对照组0 h划痕宽度-对照组48 h划痕宽度)]×100%。
2.6 Transwell小室法检测细胞侵袭能力 按照Matrigel胶和无血清DMEM培养基为1∶8比例混匀后,每个小室加200 μL稀释液,在37 ℃培养箱中烘干1 h,吸掉多余培养基,将MCF-7细胞重悬,计数后按每室4×104个细胞的密度取200 μL悬液滴于上室中,对应的24孔板下室每孔分别加入含10% FBS的DMEM培养基,配制不同浓度(12.5、25和50 μmol/L)木犀草苷溶液各800 μL,对照组在有血清培养基中加入等体积DMSO,36 h后用4%多聚甲醛固定Transwell小室30 min,将固定液吸出,加入0.1%结晶紫溶液染色1 h,清洗干净后放入烘箱烘干,在显微镜下拍照,发现细胞染色较浅,故又用结晶紫复染30 min,重复以上操作。每个浓度随机选取5个视野拍照计数。
2.7 计算机分子对接 从Protein Data Bank(https://www.rcsb.org/)数据库中下载Calpain-2蛋白晶体结构(ID3BOW),从PubChem Compound数据库(https://www.ncbi.nlm.nih.gov/pccompound/)下载木犀草苷三级结构,将两者导进SYBYL软件,对蛋白晶体结构进行清除原结合分子、修复粘性末端、加氢处理后,以自动识别模式识别蛋白活性口袋,运用DOCKING功能对接木犀草苷与Calpain-2的活性口袋,根据结合打分判断分子与蛋白稳定结合的可能性,若在4~5分范围则可认为分子与蛋白能稳定结合[12]。
2.8 Western blot检测Calpain-2、N-cadherin、Vimentin、Mcl-1、PCNA、E-cadherin、Bcl-2、Bax蛋白表达 用不同浓度(12.5、25、50 μmol/L)木犀草苷溶液处理MCF-7细胞48 h后,吸出培养基,PBS洗2次,加入预冷的含2% PMSF蛋白酶抑制剂的强效裂解液,在冰上裂解细胞15 min,13 000 r/min离心30 min,吸取蛋白上清液,采用BCA法,以上样量30 μg/10 μL进行定量,30 μg蛋白用12%分离胶在80 V恒定电压下电泳30 min后,转为120 V继续电泳1.5 h,300 mA恒流2 h,将蛋白转至PVDF膜上,TBST溶液新鲜配制5%牛奶室温封闭2 h,将PVDF膜按照实验目的条带进行切膜并标记,加入稀释倍数为1∶1 000的一抗Calpain-2、N-cadherin、Vimentin、Mcl-1、PCNA、E-cadherin、Bcl-2、Bax、β-actin,在4 ℃冰箱中孵育过夜,第2天用TBST溶液洗涤3次,每次20 min,加入稀释倍数为1∶5 000的二抗,在室温摇床中孵育2 h,TBST洗涤3次,每次15 min,使用超敏ECL曝光液于多功能成像仪中进行曝光,通过成像仪自带的软件测量条带的灰度值后,以β-actin灰度值为内参,计算对应蛋白的相对表达。

3 结果
3.1 不同浓度木犀草苷对MCF-7细胞增殖的影响 如图1所示,与对照组(0 μmol/L)比较,给药组MCF-7细胞增殖率均降低(P<0.05),提示木犀草苷能抑制细胞增殖。
3.2 木犀草苷对MCF-7细胞克隆形成的影响 如图2所示,与对照组(0 μmol/L)比较,给药组MCF-7细胞克隆形成数目均降低(P<0.05),提示木犀草苷能抑制细胞克隆形成能力。
3.3 木犀草苷对MCF-7细胞凋亡的影响 如图3所示,12.5、25、50 μmol/L木犀草苷溶液处理48 h后,MCF-7细胞凋亡率分别为(3.36±0.58)%、(8.35±0.29)%、(11.91±0.21)%、(19.18±1.49)%;与对照组0 μmol/L比较,木犀草苷能使细胞凋亡率增加(P<0.05);木犀草苷可上调Bax蛋白表达,下调Mcl-1、Bcl-2蛋白表达,提示木犀草苷可诱导细胞的凋亡。
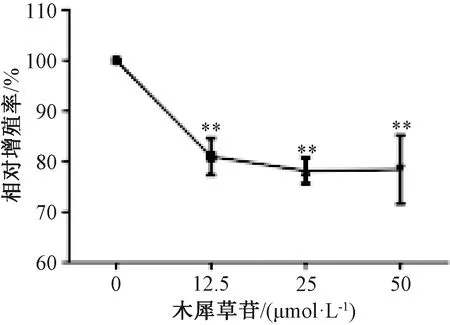
注:与对照组(0 μmol/L)比较,**P<0.01。图1 不同浓度木犀草苷对乳腺癌细胞MCF-7增殖的影响
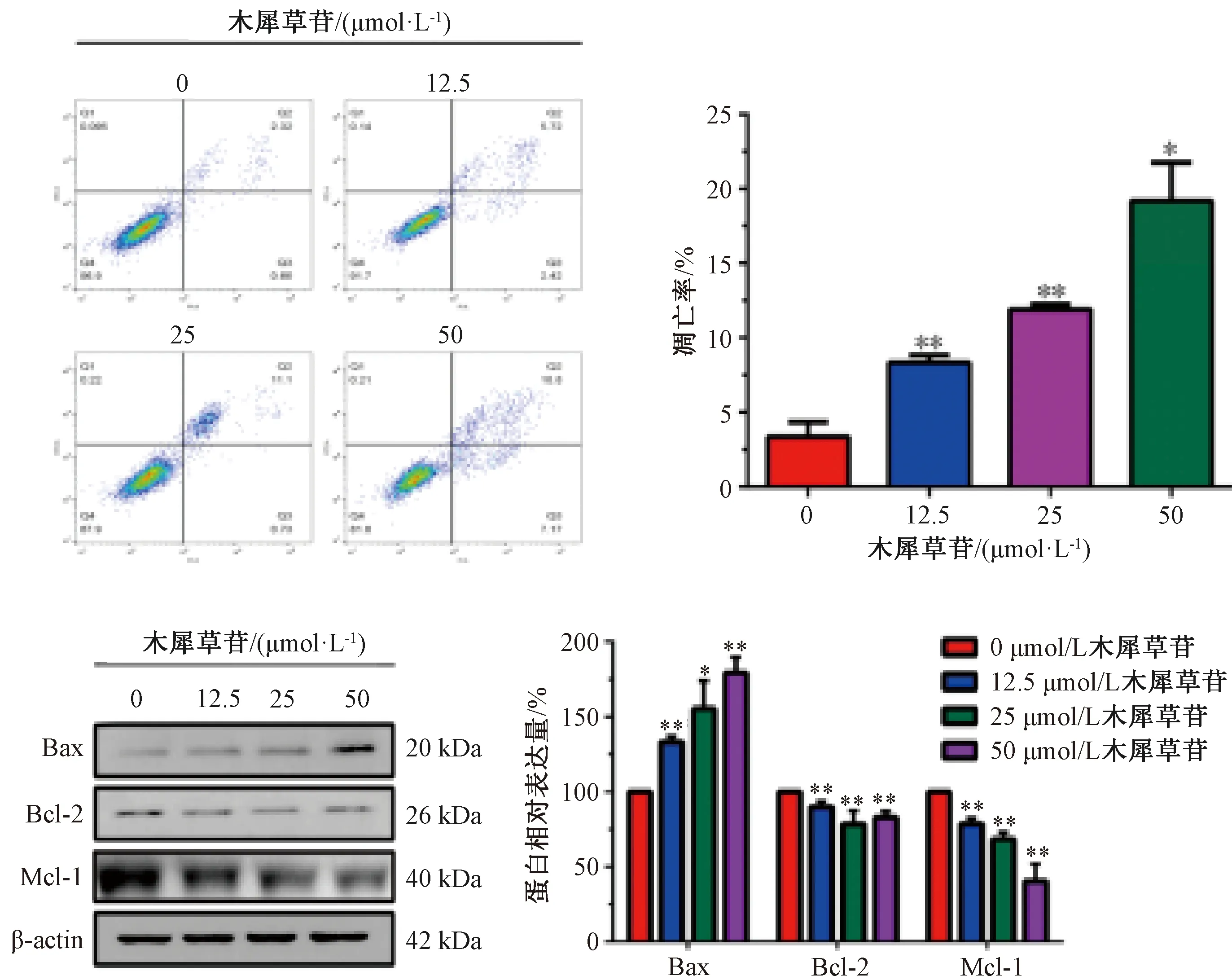
注:与对照组(0 μmol/L)比较,*P<0.05, **P<0.01。图3 木犀草苷对MCF-7凋亡的影响
3.4 木犀草苷对MCF-7细胞迁移的影响 如图4所示,与对照组(0 μmol/L)比较,给药组MCF-7细胞相对迁移率均降低(P<0.05),提示木犀草苷能抑制细胞迁移。

注:与对照组(0 μmol/L)比较,*P<0.05, **P<0.01。图4 木犀草苷对MCF-7细胞迁移的影响
3.5 木犀草苷对MCF-7细胞侵袭的影响 如图5所示,与对照组(0 μmol/L)比较,给药组MCF-7细胞相对侵袭能力均减弱(P<0.05),提示木犀草苷能抑制细胞侵袭。

注:与对照组(0 μmol/L)比较,*P<0.05, **P<0.01。图5 木犀草苷对MCF-7细胞侵袭的影响
3.6 木犀草苷与Calpain-2蛋白的分子对接 如图6所示,木犀草苷能与Calpain-2活性口袋结合,并被后者紧密包裹在内,对接打分(C-score)为5分,显示木犀草苷能稳定结合Calpain-2蛋白。

图6 木犀草苷与Calpain-2蛋白的分子对接
3.7 木犀草苷对Calpain-2、N-cadherin、Vimentin、E-cadherin、PCNA蛋白表达的影响 如图7所示,与对照组(0 μmol/L)比较,给药组Calpain-2、N-cadherin、Vimentin、PCNA蛋白表达降低(P<0.05),E-cadherin蛋白表达升高(P<0.05),提示,木犀草苷可能是通过靶向抑制Calpain-2表达来抑制MCF-7细胞增殖、迁移、侵袭。
4 讨论
乳腺癌是一类发病机制复杂且尚不明确的恶性肿瘤,由于其转移性高,病死率呈逐年上升趋势,并且越来越年轻化[13]。目前,乳腺癌的治疗主要采取手术、放化疗、内分泌药物及分子靶向药物等系统治疗方法,这些方法虽然能够延长患者的生存期,但因其毒副作用大以及预后较差,患者复发转移率仍有30%~40%[14]。因此,深入探索乳腺癌的发病机制,进一步寻找高效低毒抗乳腺癌的药物仍然是目前研究的热点。
近年来,中药以其多途径、多靶点和毒副作用小等独特的优势受到了国内外众多研究者的重视,目前已有大量关于中药及其有效成分抗乳腺癌的相关研究[3]。黄恺飞等[15]研究发现黄酮类化合物汉黄芩素通过降低ICAM-1、MMP-2和MMP-9的蛋白表达,从而抑制乳腺癌细胞MDA-MB-231的增殖、迁移和侵袭。多酚类化合物姜黄素通过下调MMP-9的表达[16]以及白藜芦醇通过逆转转化生长因子-β1(TGF-β1)诱导上皮细胞发生间质转化从而抑制MDA-MB-231细胞的迁移[17]。高欢等[18]研究发现萜类化合物雷公藤甲素通过激活ERK1/2而诱导MCF-7细胞发生自噬,最终抑制其生长和增殖。生物碱类辣椒素以及其它类总丹参酮等中药有效成分均能影响MCF-7细胞的活力,抑制其迁移和侵袭,诱导细胞凋亡[19-20]。
木犀草苷是一种存在于多种药用植物中的黄酮类化合物,已有研究证明其具有显著的抗肿瘤作用。有研究表明,从枯茗乙酸乙酯中提取出的木犀草苷成分,具有很好的抗肿瘤活性,能有效抑制乳腺癌MCF-7、MDA-MB-231细胞增殖[21]。Witkowska-Banaszczak等[22]从菊科植物当中分离出的木犀草苷单体化合物,可通过抑制炎症因子NF-κB在细胞核内的表达水平和α-淀粉酶活性,从而降低肝癌HepG-2细胞的存活率,发挥抗癌作用。Velmurugan等[23]研究证明木犀草苷通过调节MMP-2的表达,并抑制与细胞外信号传导相关的激酶的表达和活性,从而抑制口腔癌细胞FaDu和HSC-3的迁移和侵袭。还有研究表明木犀草苷能引起非小细胞肺癌发生G0/G1期周期阻滞以及自噬的发生,从而发挥抗癌作用[24]。
Calpain-2是Calpains家族的重要成员,能促进肿瘤的发生和发展,包括肿瘤细胞的存活、恶化和转移,以及新生血管的形成[25]。同时,Calpain-2的水解底物,如paxillin、FAK、催乳素和spectrin等,能促进细胞骨架重塑,降低细胞粘附力,增加Calpain-2的表达和活性,最终增强肿瘤细胞的迁移和侵袭能力[26-27]。本研究通过计算机分子对接技术发现木犀草苷可以稳定结合Calpain-2蛋白的活性口袋;蛋白质免疫印迹结果进一步说明不同浓度的木犀草苷能够抑制Calpain-2的表达。
Bcl-2蛋白家族包括促凋亡因子和抗凋亡因子,Parton等[28]研究发现抑制促凋亡蛋白Bax的表达,增加抗凋亡蛋白Bcl-2和细胞增殖蛋白PCNA的表达,能促进乳腺癌的发生和发展。邱晓晓等[29]运用血管紧张素转化酶抑制剂抑制Calpain-2的激活和蛋白表达,从而降低Bax蛋白表达量,增加Bcl-2的蛋白表达,最终抑制糖尿病老鼠心肌细胞的凋亡。此外,Mcl-1也是Bcl-2蛋白家族中重要的抗凋亡蛋白,参与调控肿瘤细胞和正常组织细胞的存活[30-31]。Young等[32]研究发现,使用Mcl-1抑制剂能诱导乳腺癌细胞MDA-MB-468-2A凋亡,并抑制MDA-MB-231-2A的侵袭和肺转移,从而抑制乳腺癌的远处转移,增强对抗肿瘤药物达沙替尼的敏感性。Sapili等[33]研究发现,Calpain-2的激活和蛋白表达上调能显著增加线粒体膜通透性,诱导Mcl-1的表达上调,使肿瘤细胞对抗癌药物的耐药性增加。本研究发现木犀草苷可能通过靶向抑制Calpain-2,使Bcl-2和Mcl-1的蛋白表达下调,Bax蛋白的表达上调,从而诱导乳腺癌细胞MCF-7发生凋亡。
上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞发生转移的重要过程,其中E-cadherin属于上皮生物标记物,N-cadherin和Vimentin属于间充质生物标记物。Chen等[34]研究发现,使用Calpain-2的抑制剂或沉默了CAPN2基因后,能使E-cadherin的表达上调,同时降低N-cadherin和Vimentin的蛋白表达,抑制肿瘤细胞的上皮间质转化过程,从而抑制乳腺细胞MCF-10A的侵袭和迁移。本研究发现木犀草苷能降低Calpain-2的蛋白表达,同时促进E-cadherin的表达,并下调Vimentin和N-cadherin的蛋白表达,从而抑制乳腺癌细胞MCF-7的迁移和侵袭。该结果预示,木犀草苷可能成为一种有效的抑制乳腺癌转移的中药成分。
综上所述,木犀草苷可能通过靶向调控Calpain-2从而抑制乳腺癌细胞的增殖、迁移和侵袭,并促进乳腺癌细胞的凋亡,有望成为一种治疗乳腺癌的有效活性成分。

