厚朴苷A在大鼠体内的药动学研究
杨 林, 殷永红*
(1.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院),湖北 黄石435000;2. 肾脏疾病发生与干预湖北省重点实验室, 湖北 黄石 435000)
厚朴苷A(图1A)为苯乙醇苷类化合物,于1988年由Hasegawa等在厚朴中首次分离得出[1-2]。关于其药效研究较少,有限的研究证明:其对新生隐球菌的钙调神经磷酸酶途径有特异性作用,具有较强的抗真菌活性[3];对自由基诱导的氧化损伤具有保护作用[4-6];对功能性消化不良具有一定治疗作用[7]。
目前,仅有一项关于采用高效液相色谱法(HPLC)测定大鼠血浆中的厚朴苷A浓度的报道[8],方法采用岛津LC-20A高效液相色谱仪,Agilent Zobax SB-C18(250 mm×20 mm,5 μm)色谱柱,流动相为甲醇-水溶液梯度洗脱,获得了大鼠灌胃给药200 mg·kg-1和尾静脉注射给药5 mg·kg-1后的药代动力学参数。除此之外的研究仅仅是分别采用高效液相色谱仪-二级阵列检测器(HPLC-DAD)[9]、双通道液相色谱-电化学检测(2LC-ECD)[10]和超高效液相色谱-四极杆飞行时间质谱联用(UPLC-Q-TOF-MS)[11]对药材或中药复方中的厚朴苷A进行定量或定性分析,未见更多关于生物基质中厚朴苷A浓度测定方法的报道。本文拟采用高效液相色谱-串联质谱法(LC-MS/MS)建立大鼠血浆中厚朴苷A浓度的测定方法,该方法可以显著提高前人方法的灵敏度和专属性,且大大提高工作效率。该方法验证后,成功应用于大鼠灌胃厚朴苷A后的药代动力学研究。具体报道如下:

图1 厚朴苷A(A)和黄芩苷(内标,B)的结构式Fig.1 Chemical structure of magnoloside A (A) and baicalin (IS, B)
1 实验部分
1.1 仪器
Thermo Finnigan TSQ Quantum Discovery MAX 型液相色谱-串联质谱联用系统(LC-MS /MS,美国Thermo公司);赛多利斯BS110S型电子分析天平(北京赛多利斯科学仪器有限公司);WH-2 微型漩涡混合器(常州市凯航仪器有限公司(金坛市新航仪器厂));AS3120A型超声波清洗器(天津奥特赛恩斯仪器有限公司);默克密理博Milli-Q Integral超纯水机(德国Merck公司);赛默飞Thermo Micro17R微量冷冻台式离心机(美国Thermo公司)。
1.2 试药
厚朴苷A对照品(纯度98%)购自宝鸡市辰光生物科技有限公司;黄芩苷对照品(内标,批号110715-201821,纯度95.4%,图1B)购自中国食品药品检定研究院。色谱级甲醇和乙腈均购自美国TEDIA(天地)试剂有限公司;分析纯甲酸由上海麦克林生化科技有限公司提供。
1.3 色谱及质谱条件
色谱条件:色谱柱为Hypersil C8 (MOS2) 色谱柱(2.1 mm × 50 mm,3 μm,大连依利特分析仪器有限公司);流动相采用0.1%甲酸水溶液-甲醇梯度洗脱,洗脱程序见表1。流速为0.4 mL·min-1;柱温设定为30 ℃,进样体积为10 μL。

表1 梯度洗脱程序
质谱条件:离子源采用电喷雾离子化电离源(ESI);扫描方式为选择离子监测(SRM);选择正离子模式。喷雾电压设定为3 500 V;加热毛细管温度(TEM)设定为270 ℃;鞘气流速为30 psi;辅助气流速为15 psi;碰撞气(CID)压力为1.5 mTorr;源内碰撞解离电压(Source CID)为10 V;厚朴苷A与黄芩苷(内标)[12]的检测离子对分别选择:[M+Na]+m/z647.4→485.1和[M+Na]+m/z469.3→293.2(图2),碰撞电压分别为30和28 eV。
1.4 对照品溶液的制备
称取适量的厚朴苷A对照品,精密称定,置于25 mL容量瓶中,加入甲醇使对照品完全溶解,摇匀,并定容至刻度,配制成厚朴苷A浓度为11.6 mg·mL-1的对照品储备溶液,放置于4 ℃冰箱内保存备用。临用之前,将厚朴苷A储备液从冰箱中取出,放置至室温,再用甲醇将储备液逐级稀释成浓度为100、500、2 000、10 000、15 000、20 000 ng·mL-1的厚朴苷A标准系列溶液。

图2 厚朴苷A(A)和黄芩苷(内标,B)的质谱图Fig.2 Mass spectrogram of magnoloside A (A) and baicalin (IS, B)
1.5 内标物溶液的制备
称取适量黄芩苷对照品(内标),精密称定,置10 mL容量瓶中,加入甲醇溶液使之完全溶解,摇匀,并定容至刻度,配制成黄芩苷浓度为1.04 mg·mL-1的黄芩苷(内标)对照品储备溶液,放置于4 ℃冰箱内保存备用。临用之前,用甲醇将黄芩苷(内标)对照品储备溶液稀释成浓度为500 ng·mL-1黄芩苷(内标)工作溶液。
1.6 血浆样品的处理
采用直接沉淀法处理血浆样品。精密量取大鼠血浆样品50 μL置于1.5 mL离心管中,精密加入150 μL黄芩苷(内标)工作溶液(500 ng·mL-1),充分漩涡振荡60 s,使完全混合均匀,于4 ℃下以14 000 rpm的转速离心10 min,离心结束后取上清液装入样品瓶,精密定量吸取样品10 μL注入LC-MS/MS仪器系统,进行定量分析。
1.7 药代动力学研究
18只雄性SD大鼠随机分成3组,每组6只,给药前至少12 h禁食不禁水。三组大鼠分别按照9、27、81 mg·kg-1的剂量灌胃给予厚朴苷A对照品。于灌胃前及灌胃后0.083、0.25、0.5、0.75、1、2、3、4、5、6、8和12 h从大鼠眼底静脉丛取血100 μL,全血置于抗凝的1.5 ml离心管中,于3 500 rpm离心10 min,分离上层血浆置-20 ℃冰箱中保存待测。药代动力学参数采用DAS 2.0软件计算。
2 结果与讨论
2.1 方法学考察
2.1.1 专属性
分别采用空白大鼠血浆样品、空白大鼠血浆加入厚朴苷A和黄芩苷(内标)标准溶液的样品和大鼠灌胃给药后30 min时的血浆样品进样分析并获得相应的色谱图,结果显示厚朴苷A和黄芩苷(内标)的出峰时间分别为4.35和3.73 min,空白大鼠血浆样品中的内源性物质和杂质在厚朴苷A和黄芩苷(内标)的出峰位置不存在干扰,实验结果证明该方法专属性良好(图3)。

A: 厚朴苷A; B: 黄芩苷(内标); I: 空白大鼠血浆样品; II: 空白大鼠血浆加入厚朴苷A和黄芩苷(内标)溶液样品; III: 大鼠给药后30 min的血浆样品图3 典型色谱图Fig.3 Typical chromatogram
2.1.2 标准曲线的建立
分别精密量取厚朴苷A标准系列溶液10 μL,置于90 μL大鼠空白血浆中,充分漩涡混匀60 s,配制成厚朴苷A浓度为10、50、200、1 000、1 500、2 000 ng·mL-1的标准大鼠血浆溶液。大鼠血浆样品处理方法参照“1.6 血浆样品的处理”项下所述方法。质控(QC)样品采用厚朴苷A浓度为200、5 000和16 000 ng·mL-1的标准溶液制备,同标准曲线样品配制方法制得厚朴苷A终浓度分别为20、500和1 600 ng·mL-1的QC样品,测定条件同上。以厚朴苷A响应与黄芩苷(内标)响应的比值为纵坐标(Y),厚朴苷A的质量浓度作为横坐标(X),采用最小二乘法进行线性回归,得到厚朴苷A的标准曲线方程为Y=0.004 5X+0.068(n=5,r2=0.995 7,W=1/X2)。结果表明,厚朴苷A在10~2 000 ng·mL-1的浓度范围内线性关系良好,10 ng·mL-1的信噪比(S/N)大于10:1,为本方法的定量下限。
2.1.3 精密度与准确度
厚朴苷A在大鼠空白血浆中的方法精密度与准确度采用定量下限、低、中、高四个浓度的QC样品(n=6)进行考察,连续测定3批,分别考察批内和批间精密度(RSD)与准确度,随行标准定量。实验结果显示批内和批间精密度(RSD)均小于15%(定量下限为≤ 20%),准确度在85%~115%的范围内(定量下限为80%~120%),符合《化学药物非临床药代动力学研究技术指导原则》对生物样品浓度测试的要求(见表2)。
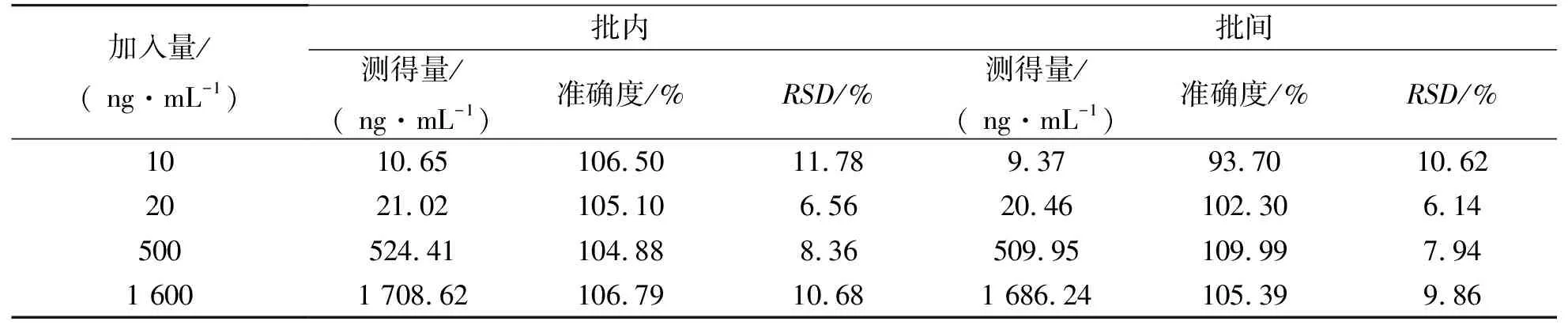
表2 大鼠血浆中厚朴苷A的精密度和准确度(n=6)
2.1.4 提取回收率与基质效应
采用三个浓度的QC样品(n=3)考察厚朴苷A在大鼠空白血浆中的提取回收率和基质效应。正常处理的QC样品响应值设定为A;相同浓度大鼠血浆处理后加入QC标准溶液的样品响应值设定为B;相同浓度无基质的QC样品响应值设定为C。A/B为提取回收率,B/C为基质效应。结果见表3。

表3 大鼠血浆中厚朴苷A的提取回收率和基质效应(mean±SD,n=3)
2.1.5 稳定性
依据《化学药物非临床药代动力学研究技术指导原则》采用低、高两个浓度的QC样品(n=6)考察厚朴苷A在不同条件下在大鼠血浆中的稳定性。分别考察上清液样本在自动进样器中4 ℃下放置24 h的稳定性;血浆样品在室温放置6 h的稳定性;三个循环冻融的稳定性以及-30 ℃冷冻10 d的稳定性,结果表明厚朴苷A在上述贮存及实验过程中保持稳定(表4)。

表4 大鼠血浆中厚朴苷A的稳定性( mean±SD,n=6)
2.2 药代动力学研究
采用DAS 2.0软件对血药浓度进行数据处理,处理后得到的主要药代动力学参数见表5。平均血药浓度-时间曲线见图4所示。结果显示,AUC和Cmax与给药剂量呈正比,显示在口服剂量9~81 mg·kg-1范围内,厚朴苷A在大鼠体内呈现线性动力学过程。

表5 大鼠灌胃厚朴苷A主要动力学参数(mean±SD,n=6)

图4 大鼠灌胃厚朴苷A后平均药-时曲线(mean±SD,n=6)Fig.4 Plasma concentration-time profiles formagnoloside A after i.g. doses(mean±SD, n=6)
3 结论
采用LC-MS/MS法建立了大鼠血浆中厚朴苷A浓度的测定方法,并应用于大鼠灌胃9、27、81 mg·kg-1剂量厚朴苷A后体内的药代动力学研究。建立的方法灵敏度高、准确、快速、稳定性高,适用于厚朴苷A的大鼠体内药代动力学研究,研究结果表明大鼠在灌胃剂量范围内呈现线性药代动力学过程,该研究对为厚朴苷A的开发利用,以及作为候选药物的研发打下坚实的基础。

