单宁酸对布氏田鼠抗氧化水平和肝脏自噬相关基因表达的影响
范瑞洋 王慧渊 王道晨 戴鑫 杨生妹
(扬州大学生物科学与技术学院,扬州 225009)
单宁是广泛存在于植物中的酚类植物次生代谢物,影响植食性动物的营养物质消化和吸收(Mehanshoet al., 1987; Chunget al., 1998),也具有抗氧化功能(Swain, 1979; Pepiet al., 2009)。抗氧化酶系中的谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)、过氧化氢酶(Catalase, CAT)和超氧化物歧化酶(Superoxide dismutase, SOD) 在应对氧化应激中发挥重要作用(Imreet al., 1984;Hazelton and Lang,1985)。SOD 能将超氧自由基转变为H2O2和分子氧,而GSH-Px和CAT则将有害的H2O2转变为无害的水,从而达到抗氧化效果(Fri‐dovich, 1978; Imreet al., 1984; Hazelton and Lang,1985)。丙二醛(Malondialdehyde, MDA) 是脂质过氧化的产物,能反映细胞膜受氧化应激损害的情况,与机体的氧化应激水平高低有关(Nnaet al.,2020)。自噬是一种进化保守机制,它在降解和回收利用折叠错误蛋白质和功能失调细胞器方面有重要作用,也被称为Ⅱ型细胞程序性死亡(Gal‐luzziet al.,2007)。Beclin1 蛋白是自噬的起始蛋白(Kiharaet al.,2001)。LC3 蛋白(microtubule-associ‐ated protein 1 light chain 3) 位于自噬体膜上,是自噬体形成的定位蛋白(Pankivet al.,2007;Ichimuraet al.,2008),LC3A 是LC3 的亚型之一(Yoshimori,2004; Liet al., 2011),在肝脏有表达(Zoiset al.,2011)。p62 蛋白可被自噬体吸收,然后降解(Ina‐miet al., 2011),是自噬的调节蛋白(Jianget al.,2015)。氧化应激能调节自噬,自噬能清除细胞和器官中被氧化的蛋白质和受损伤的线粒体(Slateret al., 1995; Hariharanet al., 2011; Leeet al., 2012;Malaviyaet al., 2014)。肝脏功能易受氧化应激的影 响(Cichoż-Lach and Michalak, 2014; Liet al.,2020),故肝脏是研究具有抗氧化功能的单宁是否同时也有调节自噬作用的理想器官。
布氏田鼠(Lasiopodomys brandtii) 为广泛分布于我国内蒙古草原的小型植食性哺乳动物,是内蒙古草原的主要鼠害之一(谢小明等,1994;施大钊等,1999;宛新荣等,2002b)。布氏田鼠喜食的植物中均含有丰富的植物次生代谢物——单宁(Daiet al., 2014;Yinet al., 2017)。但单宁对布氏田鼠抗氧化水平和自噬功能的影响仍不清楚。本研究选取4周龄雌雄布氏田鼠,让其饮用高、低浓度单宁酸溶液9周,测定布氏田鼠肝脏抗氧化水平和细胞自噬对单宁酸的响应程度,旨在揭示野外当年生布氏田鼠处理单宁的性别差异,为探讨植物次生代谢物在动物种群调节中的作用提供理论依据。
1 研究方法
1.1 实验动物与分组
本实验于2018 年3—8 月在扬州大学生物科学与技术学院行为生态学实验室进行。将捕捉于内蒙古草原的布氏田鼠带回实验室饲养,并建立繁殖系。布氏田鼠自由饮水并喂以鼠饲料(仪征动物科技有限公司,江苏扬州)。饲养室光照周期为12 L∶12 D (光照时间06: 00—18: 00),室温为22℃±1℃,湿度为50%±5%。幼鼠21 d断奶,然后单笼饲养适应7 d(笼壁上注明亲本情况)。幼鼠饲养至28 日龄后,挑选体重无显著差异的健康雌、雄性布氏田鼠各18 只(确保被选幼鼠间无同胞和半同胞关系)进行实验。实验分为3 组,每组雌、雄布氏田鼠各6 只:对照组(饮用蒸馏水)、低剂量组(饮用3 mg/mL 单宁酸溶液)和高剂量组(饮用6 mg/mL 单宁酸溶液),3 组的饮用量均为10 mL(选择10 mL 饮用量和高剂量组饮用6 mg/mL 单宁酸溶液是因为预实验发现24 h 内每只布氏田鼠都能饮用完10 mL 浓度不超过6 mg/mL 的单宁酸溶液)。
每隔1 d,在09: 00 分别给予每只布氏田鼠10 mL不同浓度单宁酸溶液或蒸馏水。在布氏田鼠4 周龄称量第1 次体重,然后每周称量1 次体重,实验至布氏田鼠13 周龄时结束。实验结束后,断头处死布氏田鼠,并采血;解剖取出肝脏称量肝脏湿重,随后迅速将肝脏放入RNA保护液中,4℃冰箱过夜静置后放入-70℃冰箱保存,用于qPCR检测肝脏中自噬相关基因表达。血样经3 000 r/min离心30 min 后吸取上层血浆,血浆保存在-70℃冰箱中,用ELISA 法测定血浆中抗氧化酶和MDA 水平。根据布氏田鼠第4~13周体重计算布氏田鼠饮用单宁酸1~9周的体重增长率。n周体重增长率=[第N周体重(g) -第4 周体重(g)]/第4 周体重(g)×100%,其中n=N-4,N为5 ~ 13,n为1~9。将肝脏湿重除以布氏田鼠体重,计算布氏田鼠肝脏指数。肝脏指数=[肝脏湿重(g)/体重(g)]×100%。
1.2 单宁酸溶液的配制
单宁酸母液(6 mg/mL)用3 g单宁酸(天津科密欧化学试剂有限公司)溶解在500 mL蒸馏水中配制,作为高剂量组单宁酸溶液;稀释一倍,即3 mg/mL的溶液作为低剂量组溶液,4℃冰箱保存。实验中高、低剂量组以及对照组的饮用量都为10 mL。
1.3 血浆抗氧化参数的测定
血浆中3 种抗氧化酶(SOD、CAT 和GSH-Px)以及血浆MDA 水平均采用酶联免疫吸附法(En‐zyme-linked Immunosorbent Assay, ELISA) 测定。对于每个抗氧化参数,每个样重复测定2次,操作步骤按照ELISA 试剂盒(上海联硕生物科技有限公司) 说明书进行,并参考之前的研究(Daiet al.,2020)。GSH-Px 的检测范围为12 ~ 400 U/L,CAT的检测范围为3 ~ 120 pg/mL,SOD 的检测范围为12.5 ~ 1 000 U/L,MDA 的检测范围为0.3 ~24 nmol/L。所有ELISA 试剂盒的批内和批间差都分别小于9%和15%。
1.4 肝脏自噬相关基因表达水平的测定
肝脏总RNA 的提取和保存参考前期研究建立的步骤(Daiet al., 2016)。用PrimeScript 1st strand逆转录试剂盒(大连宝生物)对肝脏1 μg RNA 样品进行逆转录获取cDNA。基因表达水平用荧光定量PCR 测定。目的基因(Beclin1和LC3A) 与内参基因(GAPDH) 的引物序列参考前期研究(Daiet al.,2020)(表1),p62的引物设计也参考前期研究(Daiet al.,2016)。首先从NCBI数据库中获取与布氏田鼠亲缘关系相近的脊椎动物p62 蛋白的氨基酸序列,然后用Clustal X (Larkinet al., 2007) 进行比对。根据比对结果,用软件(j-CODEHOP from base-by-base) 设计简并引物来扩增p62部分cDNA序列,将获得的cDNA产物送至生工生物工程有限公司(上海)进行测序,测序获得的p62部分cDNA序列提交至GenBank (获取号:MK477701)。进一步用NCBI Primer Blast tool 在线设计p62的荧光定量PCR 反应引物(表1),并用溶解曲线检查引物的特异性。荧光定量PCR 反应采用SYBR Premix EX Taq II 试剂盒(大连宝生物),在荧光定量PCR 仪(Applied Biosystems, Foster City, California, USA)上进行(Daiet al.,2016)。通过标准曲线来确保目的基因和内参基因的扩增效率在0.9~1.0范围内。基因表达的差异采用2-∆∆Ct法(Livak and Schmitt‐gen, 2001) 计算,GAPDH为内参基因(Xiet al.,2011)。雌性对照组每个目的基因的平均∆Ct 值作为参考来计算每个目的基因的相对表达量。

表1 荧光定量PCR实验中的引物序列Table 1 Primers used in the qPCR study
1.5 数据分析
用Shapiro-Wilk法和Levene法分别检验数据的正态分布和方差齐性。对非正态分布数据进行log10 或平方根转换。用双因素重复测量方差分析法(Double factors analysis of variance with repeated measures) 分析单宁酸剂量和性别对布氏田鼠体重增长率的影响。用双因素方差分析法(Double fac‐tors analysis of variance) 分析单宁酸剂量和性别对布氏田鼠肝脏指数、抗氧化参数和自噬相关基因表达的影响。首先检验是否有交互作用,如有交互作用则用syntax 语句进行简单效应(Simple ef‐fect) 分析;如无交互作用,则进一步进行主效应(Main effect)分析,事后两两比较均采用Tukey法。采用Sperman 相关分析法(Analysis of bivariate cor‐relations) 分析抗氧化参数与自噬基因表达的相关性。文中数据均以平均值±标准误(mean±SE)表示,P< 0.05 为差异显著。统计软件采用SPSS 16.0 for Windows。
2 结果
2.1 布氏田鼠肝脏指数和体重增长率的变化
双因素方差分析显示单宁酸剂量(F2,32= 1.364,P= 0.270) 和性别(F1,32= 1.870,P= 0.181) 对布氏田鼠肝脏指数均无显著影响,也无明显的交互作用(F2,30=0.041,P=0.960)(图1)。

?

图1 饮用蒸馏水(对照组)、低剂量(3 mg/mL)和高剂量(6 mg/mL)单宁酸9周后布氏田鼠肝脏指数的变化Fig. 1 Variations of liver index of Brandt’s voles fed distilled water(control group),low dose(3 mg/mL)and high dose(6 mg/mL)tannic ac‐id for 9 weeks(n=6)
双因素重复测量方差分析显示,单宁酸剂量(F2,32= 2.878,P= 0.071) 和性别(F1,32= 1.051,P=0.313) 对布氏田鼠的体重增长率均无显著影响, 也无明显的交互作用(F2,30= 0.517,P=0.601)(表2)。
2.2 布氏田鼠抗氧化水平的差异
双因素方差分析显示单宁酸剂量和性别对布氏田鼠GSH-Px 水平的影响有显著交互作用(F2,30=4.304,P=0.023)。单宁酸剂量对雄鼠GSH-Px 水平有显著影响(F2,30=14.839,P<0.001),雄鼠对照组GSH-Px 水平显著低于低剂量组和高剂量组(P=0.003,P< 0.001)。低剂量组(F1,30= 5.073,P=0.032) 和高剂量组(F1,30= 18.585,P< 0.001) 的GSH-Px 水平在性别间有显著差异,雌鼠的GSH-Px水平都低于雄鼠(低剂量组,P=0.032;高剂量组,P<0.001)(图2A)。
双因素方差分析显示单宁酸剂量(F2,32=11.674,P< 0.001) 和性别(F1,32= 34.523,P<0.001) 对布氏田鼠SOD 水平均有显著影响(F2,32=11.674,P< 0.001),但无明显的交互作用(F2,30=2.657,P=0.087)。高剂量组SOD 水平显著高于对照组和低剂量组(P< 0.001,P= 0.005)。雄鼠的SOD水平显著高于雌鼠(P<0.001)(图2B)。
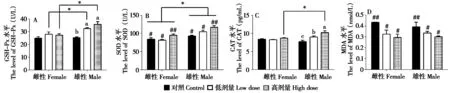
图2 饮用蒸馏水(对照组)、低剂量(3 mg/mL)和高剂量(6 mg/mL)单宁酸9周后布氏田鼠血浆中GSH-Px(A)、SOD(B)、CAT(C)和MDA(D)水平的变化. 不同字母表示当单宁酸剂量与布氏田鼠性别存在交互作用时经简单效应分析雄性布氏田鼠的单宁酸剂量组间有显著差异;*表示雄性与雌性布氏田鼠间有显著差异;不同的#数目表示当存在单宁酸剂量主效应时单宁酸剂量组间有显著差异(P<0.05)(n=6)Fig. 2 Variations of GSH-Px (A), SOD (B), CAT(C), and MDA(D) levels in the serum of Brandt’s voles fed distilled water (control group), low dose (3 mg/mL) and high dose (6 mg/mL) tannic acid for 9 weeks. Error bars indicate standard error. Different letters marked over the columns in the males mean significant differences between them at P<0.05 in the test of simple effect when there were an interaction effect between tannic acid dose and gender of Brandt’s voles. * means significant differences between males and females at P< 0.05. The different # numbers mean signifi‐cant differences between different dose groups at P<0.05 when there is a main effect of tannic acid dose(n=6)
双因素方差分析显示单宁酸剂量和性别对布氏田鼠CAT 水平的影响有显著的交互作用(F2,30=6.951,P=0.003)。单宁酸剂量对雄鼠CAT 水平有显著影响(F2,30= 17.424,P< 0.001),雄鼠对照组CAT 水平显著低于低剂量组和高剂量组(P=0.018,P<0.001),雄鼠低剂量组CAT 水平也显著低于高剂量组(P= 0.018)。高剂量组的CAT 水平在性别间有显著差异(F1,30= 13.587,P< 0.001),雌鼠CAT水平显著低于雄鼠(P=0.001)(图2C)。
双因素方差分析显示单宁酸剂量(F2,32=10.148,P<0.001)对布氏田鼠MDA 水平有显著影响,但MDA 水平在性别间无显著差异(F1,32=0.194,P=0.662),单宁酸剂量和性别也无明显的交互作用(F2,30= 0.671,P= 0.519)。对照组MDA水平显著高于低剂量组和高剂量组(P=0.012,P<0.001)(图2D)。
2.3 布氏田鼠肝脏自噬相关基因表达的差异
双因素方差分析显示单宁酸剂量对布氏田鼠Beclin1表达有显著影响(F2,32=21.086,P<0.001),但性别对Beclin1表达无显著影响(F1,32= 2.351,P=0.135),单宁酸剂量和性别无显著的交互作用(F2,30= 0.623,P= 0.543)。低剂量组布氏田鼠Beclin1表达显著高于对照组和高剂量组(P=0.046,P<0.001);对照组布氏田鼠Beclin1表达也显著高于高剂量组(P=0.001)(图3A)。
双因素方差分析显示单宁酸剂量和性别对布氏田鼠LC3A表达有显著的交互作用(F2,30=5.674,P= 0.008)。单宁酸剂量对雄鼠LC3A表达有显著影响(F2,30= 11.611,P< 0.001),雄鼠高剂量组LC3A表达水平显著低于对照组和低剂量组(P=0.018,P< 0.001) (图3B)。对照组(F1,30= 4.823,P= 0.036) 和低剂量组(F1,30= 24.952,P< 0.001)的LC3A表达在性别间有显著差异,雌鼠LC3A表达水平均显著低于雄鼠(对照组,P=0.036;低剂量组,P<0.001)(图3B)。
双因素方差分析显示单宁酸剂量对布氏田鼠p62表达有显著影响(F2,32=14.884,P<0.001),但性别对p62表达无显著影响(F1,32= 0.179,P=0.675),单宁酸剂量与性别无明显的交互作用(F2,30=1.775,P=0.187)。高剂量组p62表达显著低于对照组和低剂量组(P< 0.001,P= 0.001)(图3C)。

图3 饮用蒸馏水(对照组)、低剂量(3 mg/mL)和高剂量(6 mg/mL)单宁酸9 周后布氏田鼠肝脏中自噬相关基因Beclin1(A)、LC3A(B)和p62(C)相对表达量的变化. 不同字母表示当单宁酸剂量与布氏田鼠性别存在交互作用时经简单效应分析雄性布氏田鼠的单宁酸剂量组间有显著差异;*表示雄性与雌性布氏田鼠间有显著差异;不同的#数目表示当存在单宁酸剂量主效应时单宁酸剂量组间有显著差异(P<0.05)(n=6)Fig. 3 Variations of relative mRNA expression levels of Beclin1 (A),LC3A(B),and p62(C)in the liver of Brandt’s voles fed distilled water(control group), low dose (3 mg/mL) and high dose (6 mg/mL) tannic acid for 9 weeks. Error bars indicate standard error. Different letters marked over the columns in the males mean significant differences be‐tween them at P<0.05 in the test of simple effect when there is an in‐teraction effect between tannic acid dose and gender of Brandt’s voles. * means significant differences between males and females at P < 0.05. The different # numbers mean significant differences be‐tween different dose groups at P< 0.05 when there is a main effect of tannic acid dose(n=6)
2.4 血浆抗氧化参数与肝脏自噬相关基因表达的相关性
Spearman 相关分析发现,肝脏Beclin1表达与LC3A和p62的表达呈显著正相关(P<0.05)(表3),与血浆中SOD 和CAT 水平呈显著负相关(P<0.05),与血浆MDA 水平呈显著正相关(P<0.05)。肝脏LC3A的表达与p62的表达也呈显著正相关(P< 0.05)。肝脏p62的表达与血浆SOD、CAT 和GSH-Px 水平都呈显著负相关(P< 0.05)。血浆GSH-Px 水平与SOD 和CAT 水平呈显著正相关(P< 0.05),而与MDA 水平呈显著负相关(P<0.05)。SOD 与CAT 水平间也呈显著正相关(P<0.05)。
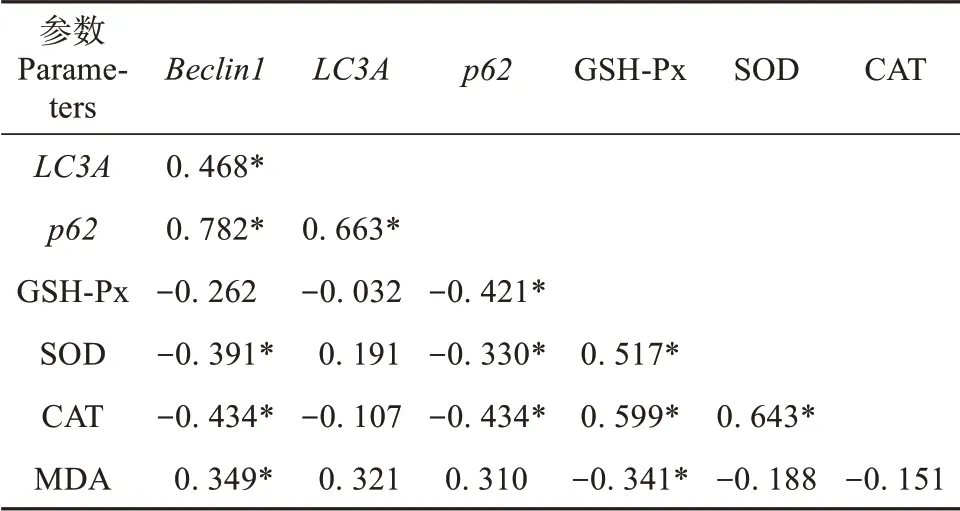
表3 饮用单宁酸9周后布氏田鼠肝脏自噬基因表达与血浆抗氧化参数的相关性Table 3 Correlations between the expression of autophagy-related genes in the liver and the parameters of antioxidant in serum of Brandt’s voles fed tannic acid for 9 weeks
3 讨论
本研究中单宁酸饮用9周,对雌雄布氏田鼠的体重增长率无显著影响。之前的研究也表明饲喂含单宁酸的食物5周,对青春期雌雄布氏田鼠的体重无显著影响(Yeet al., 2016);饮用单宁酸4 周,对青春期雄性布氏田鼠的体重无显著影响(Daiet al.,2020);饲喂含3.3%单宁的食物对布氏田鼠的体重无显著影响(陈竞峰等,2005);饲喂含单宁酸食物,高原鼢鼠(Eospalax baileyi) 体重无显著变化(Linet al., 2012)。与体重变化一致,本研究中肝脏指数未因单宁酸的摄入而发生明显变化。同样青春期雌雄布氏田鼠取食含单宁酸饲料5周,布氏田鼠肝脏重量无显著变化(Yeet al., 2016)。单宁酸一直被认为能影响动物对营养物质的消化和吸收(Mehanshoet al., 1987; Chunget al., 1998),所以本文推测动物可能通过适当增加取食量或提高唾液中单宁结合蛋白的分泌(Yeet al., 2016) 以及肠道单宁降解菌(Shimadaet al.,2006)降解单宁等机制适应食物中一定剂量的单宁酸,从而维持体重的变化,但这需要进一步深入研究。
本研究中,雄性布氏田鼠饲喂单宁酸高剂量组GSH-Px和CAT水平都高于对照组;雌雄鼠的高剂量组SOD水平也都高于对照组;而雌雄鼠MDA水平则高剂量组低于对照组,这些说明施加6 mg/mL单宁酸9周能提高布氏田鼠的抗氧化水平而降低布氏田鼠的氧化应激水平。饲喂含单宁酸的食物5周后,青春期布氏田鼠肝脏的CAT和GSH-Px水平增加(Yeet al., 2016);饲喂含单宁的石榴汁后雄性大鼠血浆中的CAT 和GSH-Px 水平均增高(Türket al., 2008);饲喂含单宁的食物能提高獭兔血清中SOD 水平而降低MDA 水平(陈赛娟等,2019);饲喂含单宁食物增加了奶牛血浆中SOD和GSH-Px水平,降低了MDA 水平(Liuet al., 2013)。饮用3 mg/mL 单宁酸9 周,雌雄布氏田鼠中只有MDA的水平降低,并且仅雄性布氏田鼠GSH-Px 和CAT水平增加,说明3 mg/mL单宁酸对布氏田鼠的抗氧化效果弱于6 mg/mL,单宁酸的抗氧化作用有剂量效应。单宁酸的剂量效应也在之前研究中发现,饮用3 mg/mL 单宁酸4 周能提高青春期雄性布氏田鼠的抗氧化水平,而6 mg/mL单宁酸却降低青春期雄鼠的抗氧化水平(Daiet al.,2020)。综合本研究与之前青春期布氏田鼠的研究,本文认为对于布氏田鼠,过少的单宁酸无明显的抗氧化效果,而过多的单宁酸则有负效应。青春期雄性布氏田鼠和成年雄鼠对6 mg/mL单宁酸的反应不同,说明雄鼠对单宁酸的反应与个体发育时期有关,成年雄鼠能耐受更高剂量的单宁酸,而较高的单宁酸剂量才能提高其抗氧化水平。本研究中,血浆中GSH-Px 与MDA 水平有显著负相关关系,同时SOD、CAT 与MDA 水平相关系数也为负值,说明在布氏田鼠中抗氧化酶也发挥着对抗氧化应激的作用。血浆中GSH-Px、SOD 和CAT 水平两两间都成正相关性,进一步说明和验证了GSH-Px、SOD和CAT在抗氧化过程中功能的一致性。
本研究中,雄性布氏田鼠高剂量组LC3A的表达水平低于对照组;高剂量组Beclin1和p62的表达水平均小于对照组,说明饮用6 mg/mL 单宁酸9 周能使布氏田鼠肝脏中的自噬水平降低,因此本文认为单宁酸能影响动物的自噬水平。自噬被阻断能使p62 蛋白积聚(Inamiet al., 2011),因而自噬被阻断引起的负反馈效应被认为是p62mRNA水平降低的可能原因。但LC3A和Beclin1与p62的表达呈显著正相关性,高剂量组p62mRNA水平的降低也伴随着LC3A和Beclin1的降低,因而本文认为布氏田鼠肝脏p62mRNA水平的降低是由自噬体形成减少,而不是自噬被阻断引起的负反馈效应导致。自噬能清除氧化损害的蛋白和细胞器,是除氧化还原反应信号通路(GSH-Px、SOD 和CAT 属于该通路) 外能实现抗氧化效果的另一条途径(Giordanoet al.,2014)。氧化应激能调节自噬,高氧化应激水平能促进自噬的发生(Slateret al.,1995;Leeet al.,2012)。本研究中,Beclin1表达与MDA 水平呈正相关;饮用6 mg/mL 单宁酸的布氏田鼠肝脏中自噬水平降低,而血浆中的抗氧化水平升高;3 种自噬标志蛋白基因的表达都与血浆中抗氧化酶水平呈负相关,这说明抗氧化水平能影响自噬,高水平的抗氧化水平能降低自噬,这也佐证了氧化应激能调节自噬,进一步说明自噬的功能是清除已被氧化应激损害的蛋白和细胞器,而抗氧化酶的作用是降低氧化应激,减少可能受氧化应激损害的蛋白和细胞器。与此一致,饮用3 mg/mL 单宁酸4 周的青春期布氏田鼠睾丸中的自噬水平降低,血浆中抗氧化水平提高(Daiet al.,2020)。
本研究中,雄性布氏田鼠的SOD 水平高于雌性;同时在低剂量组和高剂量组中雄鼠的GSH-Px都高于雌鼠;高剂量组雄鼠的CAT 也高于雌鼠,说明雄鼠抗氧化系统对单宁酸的反应强于雌鼠,从而导致相同剂量的单宁酸使雄鼠的抗氧化水平高于雌鼠。同样雄性大鼠对抗氧化剂的反应大于雌性(Bhatiaet al., 2012)。小鼠肝脏GSH-Px 水平对有害的吡咯里希啶类生物碱的反应表现出了性别差异(Lianget al., 2011)。有研究表明女性比男性有更高的抗氧化潜能,雄性比雌性更容易受到氧化应激的影响(Ideet al., 2002)。据此,本文推测野生雄性布氏田鼠的抗氧化系统更易受到植物单宁的影响。
野生布氏田鼠食物中的单宁含量的变动范围为3.5~7.5 mg/g(Yinet al.,2017),成年鼠每天能取食8~9 g 的植物干物质(宛新荣等,2002a),推算野生成年鼠每天摄入的单宁量为28.0 ~ 67.5 mg,因而本研究单宁酸高剂量组每天30 mg的摄入量达到野生田鼠单宁摄入量的下限。布氏田鼠饮用单宁酸从青春期4周龄到成年期13周龄,因此本研究在一定程度上可模拟野外当年新生布氏田鼠对植物次生代谢物——单宁的响应,并提示当单宁摄入量维持每天30 mg,则利于野生布氏田鼠提高抗氧化水平并降低组织细胞自噬水平。在野外,布氏田鼠喜食植物中单宁含量在6 月前较低(~3.5 mg/g)(Yinet al., 2017),据此推算该时期布氏田鼠单宁摄入量恰为每天30 mg 左右,因而本文推测6 月前的低量单宁摄入对布氏田鼠为正性作用,这可能是野生布氏田鼠种群增长率6 月最高(Yinet al.,2017)的原因之一。但野外植物中单宁含量有较大季节性波动,6月植物中单宁含量较5月明显上升,且直到9 月都维持在较高水平(~ 6 mg/g) (Yinet al., 2017),据此推算布氏田鼠夏季单宁每天摄入量远高于30 mg。单宁酸对布氏田鼠的作用存在剂量效应,过多的单宁酸有负效应,且雄鼠的抗氧化系统对单宁酸的反应更强,结合过量单宁等酚类化合物将会导致肝损伤(覃鲁珊等,2014; Hus‐sainet al.,2019),本文进一步推测在植物单宁含量高的季节,大量单宁摄入对野生布氏田鼠个体及种群的作用可能是负性的。尤其对雄鼠,6—9月植物单宁含量较高,可能是布氏田鼠7月后种群增长率低于6 月以及8 月中旬后种群数量下降(Yinet al.,2017)的原因之一,这也可解释6 月后新出生雄性布氏田鼠一般不参与当年繁殖的现象(宛新荣等,2002b;Renet al.,2016)。
总之,本研究表明单宁酸能提高布氏田鼠的抗氧化水平而降低肝脏的自噬,并存在剂量效应,单宁酸对雄性布氏田鼠抗氧化系统的影响大于雌性,提示单宁对野生布氏田鼠种群的作用受植物单宁含量季节性变化的影响,野生雄性布氏田鼠更易受植物单宁的影响,低量植物单宁摄入将提高野生田鼠的抗氧化水平而有利于布氏田鼠种群。

