胃蛋白酶水解藏羊血清蛋白工艺研究
张娅俐 洪晶 曹竑 田晓静 王婷婷 张福梅 柏家林 丁功涛 马忠仁 宋礼
摘要 为进一步利用血液资源,以藏羊血清为原料,采用胃蛋白酶对其进行水解。以水解度为指标,研究pH、温度、加酶量3个因素对藏羊血清水解度的影响规律;在此基础上,采用Box-Benhnken响应面试验优化胃蛋白酶水解藏羊血清蛋白工艺条件。结果表明:底物浓度为5%、加酶量为6 200 U时,最佳水解条件:温度为46 ℃、pH为2.25、酶解时间2 h,水解度为(23.41±0.23)%。
关键词 胃蛋白酶;水解;羊血清蛋白;响应面
中图分类号 TS 251.9 文献标识码 A 文章编号 0517-6611(2022)03-0174-04
doi:10.3969/j.issn.0517-6611.2022.03.047
Study on the Process of Gastric Protease Hydrolysis and Serum Protein in Sheep
ZHANG Ya-li, HONG Jing, CAO Hong et al
(School of Life Sciences and Engineering, Northwestern University of Nationalities, Lanzhou, Gansu 730124)
Abstract In order to make further use of blood resources, the serum of sheep was used as raw material and hydrolyzed by gastric protease. Taking hydrolysis as the index, the effect law of pH, temperature and enzyme addition on serum hydrolysis of Tibetan sheep was studied, and on this basis, the gastric protease hydrolysis process conditions of sheep serum protein were optimized by Box-Benhnken response surface test. The results showed that when the substrate concentration was 5% and the enzyme amount was 6 200 U, the optimal hydrolytic conditions were as follows: temperature 46 ℃, pH 2.25, enzymatic hydrolysis time 2 h, and the degree of hydrolysis was (23.41 ± 0.23)%.
Key words Gastric protease;Hydrolysis;Ovine serum protein;Response surface
基金项目 中央高校基本科研业务费专项资金资助(31920200115);科技部援助项目(KY201501005);甘肃省自然科学基金资助(18JR3RA371)。
作者简介 张娅俐(1996—),女,重庆人,硕士研究生,研究方向:特种经济动物饲养。通信作者,教授,从事食品生物技术及安全控制研究。
收稿日期 2021-05-18
血液一般占畜禽活体重4.0%~9.8%[1]。羊血是肉类加工业的主要副产物之一,羊血液中几乎含有人体所需的全部营养物质,包括大部分的蛋白质、氨基酸、维生素以及钾、钠、钙、铁等微量元素[2]。它还可作为医学和生物学中细菌培养、细菌鉴别及免疫学检测的重要试验材料,是动物血液中适合作培养基的物资,此外羊血中还含有专一性很强的凝血酶和超氧化物歧化酶等对人体有益的物质[3]。但由于许多原因,我国羊血资源利用率很低,多数屠宰企业将血液直接排放,造成宝贵的蛋白质资源浪费[3]。目前国内外将动物血液用于林化工业、制药、肥料、葡萄酒等工业[4]。
胃蛋白酶是一种消化性酸性蛋白酶,在适宜的环境中可将蛋白质分解为肽片段和酪氨酸、苯丙氨酸等氨基酸。不同的蛋白酶水解羊血清蛋白速率、水解产物都有很大差异。近年来,对其的研究引起了食品学界的广泛关注[5-6]。当前国内外有关利用植物蛋白[7-8]和动物蛋白[9-10]进行蛋白酶水解生产多肽的研究很多,利用动物血液开发功能性成分已成为研究热点,但研究多局限于猪血,关于羊血的研究鲜见报道。
笔者以胃蛋白酶对藏羊血清蛋白进行水解,测定其水解度,通过响应面试验优化其酶解条件,以期为藏羊血资源和藏羊血清功能多肽的开发利用提供理论依据。
1 材料與方法
1.1 材料与试剂
冷冻干燥处理的藏系绵羊血清,简称“藏羊血清”(青海省海西州天峻县);胰蛋白酶(北京中生瑞泰发展有限公司,3 000 U/mg);三氯乙酸、茚三酮、正丁醇、氢氧化钠、盐酸等其他试剂均为分析纯。
1.2 仪器与设备
722E型可见光分光光度计(上海光谱仪器有限公司);HWS28电热恒温水浴锅(上海-恒科技有限公司,上海-恒科学仪器有限公司);GL-3250B控温磁力搅拌器(江苏其林贝尔仪器制造有限公司);TGL-16M高速台式冷冻离心机(湘仪离心机仪器有限公司);LabconcoFreezoneil台式冻干系统(上海比朗仪器有限公司);DHP-9272型恒温干燥箱(上海一恒科技有限公司);JA2003N型电子天平(上海精密科技仪器有限公司);PB-10型精密pH计(Sartorius公司)。
1.3 试验方法
1.3.1 藏羊血清蛋白酶解液的制备。
准确称取5.0 g藏羊血清蛋白,加入100 mL超纯水溶解,调节pH,加入适量胃蛋白酶,在特定的温度下进行水解。水解后于95 ℃灭酶15 min,加入一定量10%三氯乙酸后,于8 000 r/min离心15 min,取上清液分析。
1.3.2 水解度的测定方法。
采用茚三酮比色法[11]测定样品中氨基酸含量,并以式(1)计算水解度(degree of hydrolysis,DH)。为消除不同氨基酸因呈色不同而对测定造成的误差[12-13],式中采用待水解原料的完全水解液作为标准。
水解度的计算公式如下:
DH=(Ah-A0)/(A1-A0)×100%(1)
式中:Ah为酶解液中总游离氨基数,mmol;
A1为原料蛋白强酸水解后的总游离氨基数,mmol;
A0为原料蛋白中固有的游离氨基数,mmol。
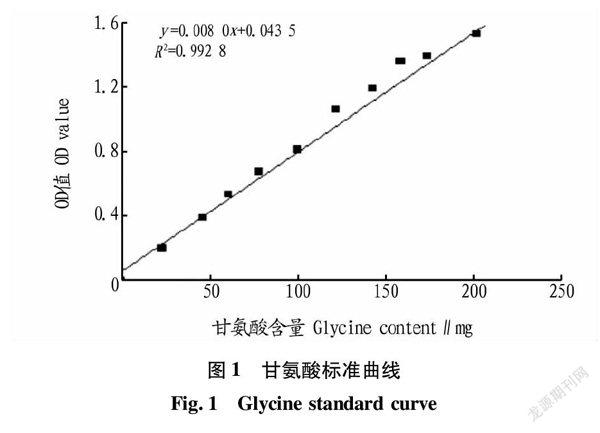
以甘氨酸含量(mg)为x轴,吸光值为y轴绘制标准曲线,曲线的回归方程为y=0.008 0x+0.043 5,R2=0.992 8。从图1可见,在甘氨酸含量0~200 mg呈良好的线性关系。
1.3.3 胃蛋白酶活力的测定。
采用福林法测定胃蛋白酶活力[5]。
1.3.4 单因素试验设计。
为优化藏羊血清蛋白水解效果,在底物浓度为5%的条件下,研究pH(1.0、2.0、3.0、4.0、5.0)、加酶量(3 000、4 500、6 000、7 500、9 000 U)和酶解温度(20、30、40、50、60 ℃)对胃蛋白酶水解藏羊血清蛋白效果的影响。
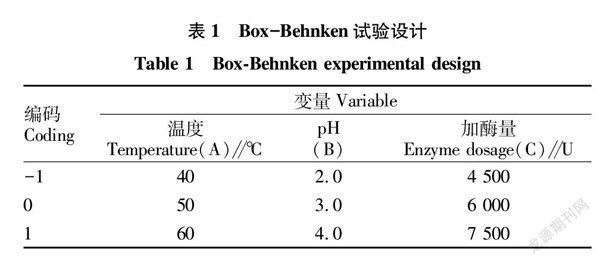
1.4 响应面试验设计
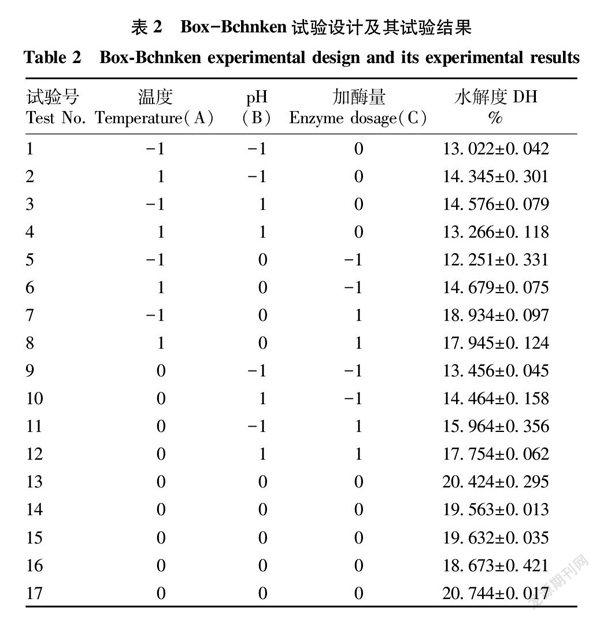
在单因素试验的基础上采用Box-Behnken响应面设计,设计见表1。采用F检验对胃蛋白酶水解藏羊血清蛋白的试验数据进行方差分析,评价模型的统计意义。
2 结果与分析
2.1 单因素试验结果
2.1.1 温度对水解度的影响。
酶蛋白分子的肽键具有特定的空间结构,在反应温度超某一极限值时,易引起肽键的断裂,从而导致酶活性降低[14];但如果反应温度过低,蛋白分子体系内运动的激烈程度会大大降低,导致酶与底物碰撞几率的降低[15]。
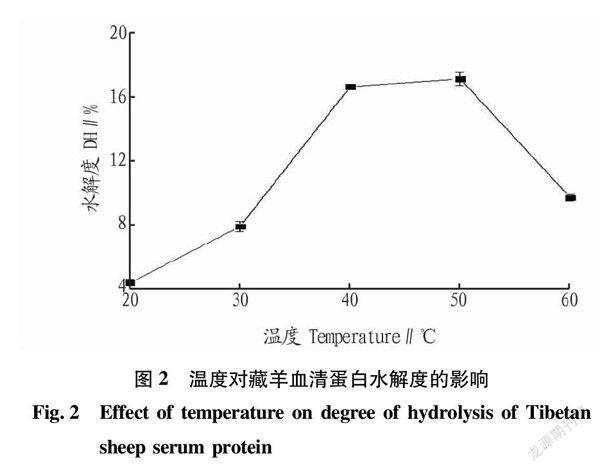
在底物浓度为5%、加酶量6 000 U、pH为3.0的条件下酶解2 h,研究酶解温度(20、30、40、50、60 ℃)对胃蛋白酶水解藏羊血清蛋白效果的影响,结果见图2。从图2可知,酶解温度在20~50 ℃时,水解度随温度的升高而增大;酶解温度超过50 ℃后,水解度迅速下降。故选择较佳的酶解温度为50 ℃。
2.1.2 加酶量对水解度的影响。
在蛋白质的水解过程中,随着加酶量的增大,溶液中水解的初速度增大,当原有的蛋白质减少到一定程度以后,增加溶液中胃蛋白酶的浓度,其能够与大分子蛋白质产生作用的几率比之前大大降低,因此并不是酶添加量越高其作用效果越大。根据酶动力学可知,酶的用量过少难以得到最大的水解度,过多会造成资源浪费[16]。
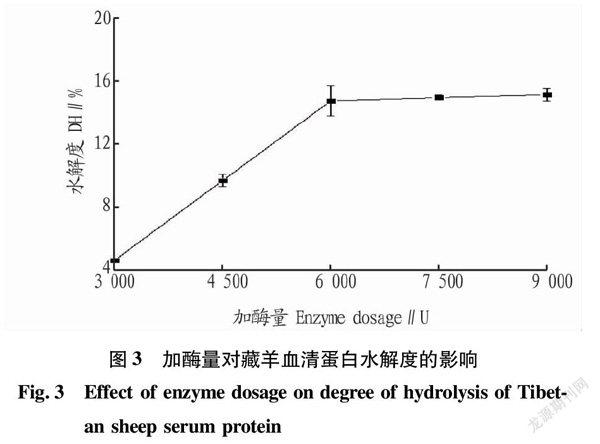
在底物浓度为5%、酶解温度为50 ℃、pH为3.0的条件下酶解2 h,研究加酶量(3 000、4 500、6 000、7 500、9 000 U)对胃蛋白酶水解效果的影响,结果见图3。由图3可知,藏羊血清蛋白水解度随着加酶量的增加不断升高,当加酶量超过6 000 U后水解度增加缓慢。故选择较佳的加酶量为6 000 U。
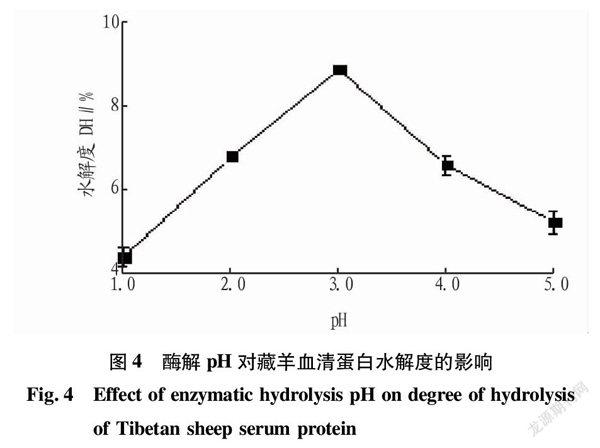
2.1.3 酶解pH对水解度的影响。
pH对水解度的影响主要表现于对酶活性的影响,因为胃蛋白酶的活性范围为pH在1~5,在偏中性尤其是碱性环境中胃蛋白酶就会发生解链而失去活性[17]。pH对水解度的影响不仅要考虑酶本身所产生的生物水解作用,更重要的是要考虑低pH环境对藏羊血清蛋白所产生的化学水解对生物水解作用的影响。
在底物浓度为5%、酶解温度为50 ℃、加酶量为6 000 U的条件下酶解2 h,研究酶解pH(1.0、2.0、3.0、4.0、5.0)对胃蛋白酶水解效果的影响,结果见图4。由图4可知,在pH小于3.0时,藏羊血清蛋白水解度随着酶解pH的升高不断增大;当酶解pH超过3.0后,其水解度逐渐下降。故选择较佳的酶解pH为3.0。
2.2 响应面试验结果
2.2.1 建立回归模型及方差分析。
Box-Behnken响应面试验设计方案及结果见表2。采用Design-Expert进行数据分析,以水解度为响应值,经回归拟合得到胃蛋白酶水解藏羊血清蛋白关于3因素的回归方程为
Y=19.81+0.18A+0.41B+1.97C-2.73A2-3.27B2-1.12C2-0.66AB-0.85AC+0.20BC
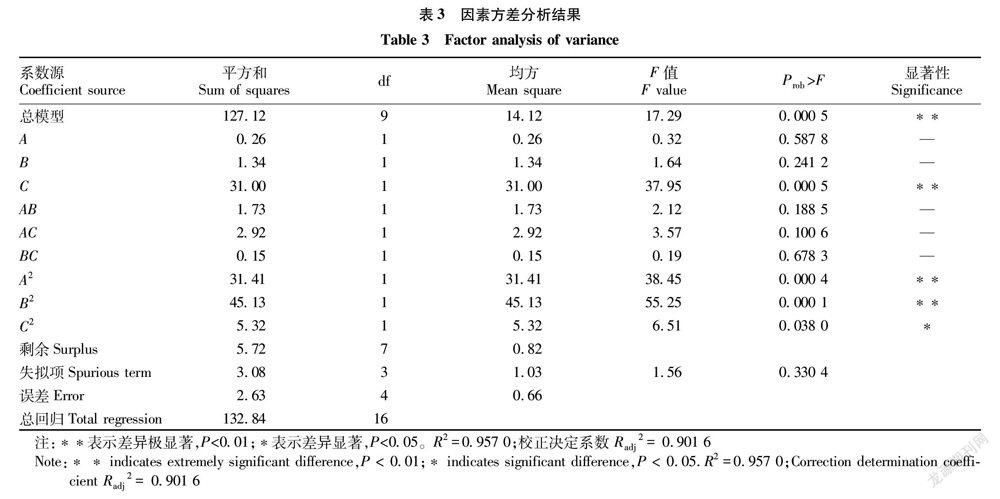
二次多項方差分析结果见表3,由表3可知,回归模型 F=17.29,P<0.01,说明三元二次回归模型极显著;失拟项不显著(P>0.05);总回归模型R2=0.957 0,调整后模型相关系数Radj2=0.901 6,说明该回归方程的拟合度较好,实际值与
预测值有较好的拟合相关性,试验方法可靠,可以用来预测
试验结果。通过回归系数绝对值对各因素变化与
水解度高低之间的分析,结果显示,影响胃蛋白酶水解效果的各因素由大到小为C>B>A,即3个因素对水解度的影响表现为加酶量>pH>温度。
2.2.2 响应面交互作用分析。
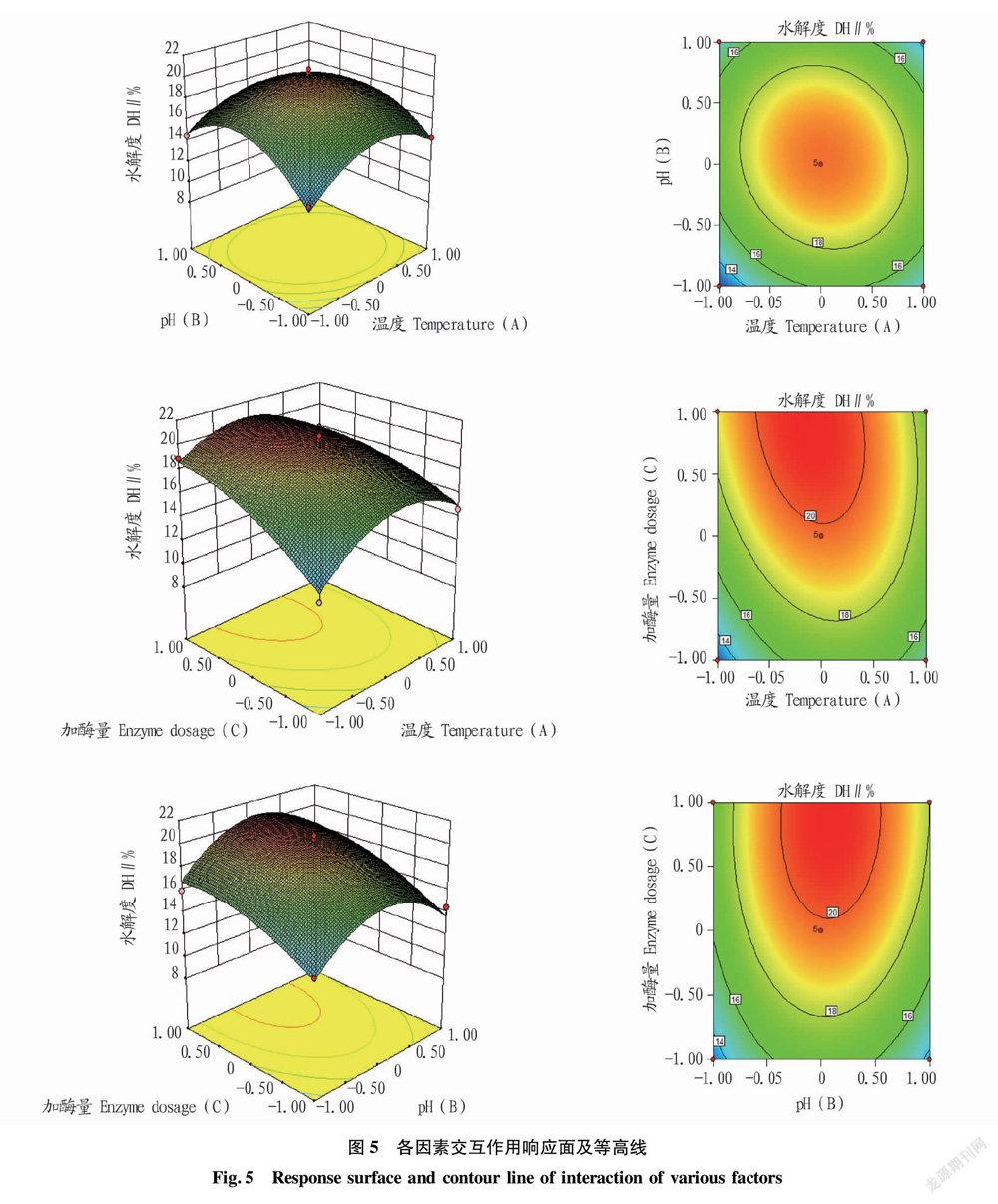
为了更直观地反映两两因素交互作用对胃蛋白酶水解效果的影响,根据回归方程绘制出其响应面图和等高线图,结果见图5。
各因素交互作用对响应值影响程度的强弱与响应面坡度和等高线密集度有关。响应面曲面坡度越陡峭,表示二者交互作用越显著[18-19],等高线圆形时交互作用较弱[20]。由图5可以看出,加酶量与pH交互作用的响应曲面坡度最陡峭,且其等高线图椭圆率高,pH和加酶量的交互作用对胃蛋白酶水解效果影响最显著;温度和pH等高线图形状较圆,表示因素交互作用较弱,即温度和pH的交互作用对胃蛋白酶水解效果影响不显著。
2.2.3 验证试验。
根据所建立的二次多项回归方程进行最优化分析,胃蛋白酶水解藏羊血清蛋白最佳条件为:温度(A)为46 ℃,pH为2.25,加酶量(C)为6 200 U,水解时间2 h,在该条件下,所建立模型预测的水解度最高可达(23.60±0.27)%。经试验验证,在该条件下重复试验3次得到的水解度平均值为(23.41±0.23)%,与模型的预测值接近,表明模型拟合良好,方法具有可行性。
3 结论
在单因素试验的基础上,采用响应面法优化了胃蛋白酶水解藏羊血清蛋白的条件,最后建立了水解度与酶解温度、pH、加酶量3个因素的二次多项式回归模型,验证试验证明了该模型的可靠性。优化获得胃蛋白酶水解藏羊血清蛋白的最佳酶解条件:底物浓度为5%,温度为46 ℃,pH为2.25,加酶量为6 200 U,水解时间2 h。在该工艺条件下,藏羊血清蛋白的水解度为(23.41±0.23)%。
水解藏羊血清蛋白是蛋白质研究领域中的热门方向,各种藏羊血清蛋白的酶解方法、检测手段也越来越受国内外学者的重视。该研究结果为藏羊血清的利用提供了又一种思路,也为今后关于藏羊血清蛋白水解物的利用与开发提供了基础。
参考文献
[1] 李芙琴,马黎明.浅谈家畜血液资源的开发利用[J].养殖与饲料,2010(6):73-75.
[2] 李晨光,庄红,吕学举,等.动物血液血红素铁提取方法研究[J].食品工业科技,2008,29(1):308-310.
[3] 周成伟,李芮洋,李景敏,等.羊血的开发和利用[J].科技视界,2019(13):81-82.
[4] 王芳,徐桂花,田建文.羊肉部分下脚料的利用与开发[J].食品工业科技,2009,30(11):347-348,352.
[5] 任建东,施用晖,乐国伟,等.鹿茸血肽疏水性分离及抗氧化和ACE抑制作用的研究[J].天然产物研究与开发,2010,22(2):302-306.
[6] 励建荣,封平.功能肽的研究进展[J].食品科学,2004,25(11):415-419.
[7] 程云辉,王璋,许时婴.麦胚蛋白的研究进展[J].食品与机械,2006,22(2):105-108.
[8] NAKAMURA Y,MASUDA O,TAKANO T.Decrease of tissue angiotensin I-converting enzyme activity upon feeding sour milk in spontaneously hypertensive rats[J].Bioscience,biotechnology,and biochemistry,1996,60(3):488-489.
[9] 陳胜军,李来好,曾名勇,等.罗非鱼鱼皮胶原蛋白降血压酶解液的制备与活性研究[J].食品科学,2005,26(8):229-233.
[10] 徐怀德,刘伟,姜莉.草鱼生物饮料加工技术研究[J].西北农林科技大学学报(自然科学版),2004,32(10):59-62.
[11] 余勃,陆兆新.微生物发酵法产大豆多肽液水解度的测定[J].食品科学,2005,26(4):104-107.
[12] 徐英操,刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007,28(7):173-176.
[13] 郭兴凤.蛋白质水解度的测定[J].中国油脂,2000,25(6):176-177.
[14] 邓乾春,陈春艳,潘雪梅,等.白果活性蛋白的酶法水解及抗氧化活性研究[J].农业工程学报,2005,21(11):155-159.
[15] 王梅,谷文英.酶解玉米黄粉蛋白制备可溶性肽[J].粮油食品科技,1999,17(1):1-3.
[16] 王硕,木泰华,李鹏高.胃蛋白酶水解甘薯蛋白制备血管紧张素转化酶抑制肽的研究[J].食品科技,2011,36(8):2-7.
[17] 曹竑,朱丽丽.风味蛋白酶水解藏羊血清蛋白工艺的研究[C]//中国畜牧兽医学会家禽生态学分会学术研讨会论文集.北京:中国畜牧兽医学会,2015:237-241.
[18] GHAEDI A M,GHAEDI M,VAFAEI A,et al.Adsorption of copper(II)using modified activated carbon prepared from Pomegranate wood:Optimization by bee algorithm and response surface methodology[J].Journal of molecular liquids,2015,206:195-206.
[19] 黄典,高雅,刘蕾,等.蛋白酶水解美味牛肝菌工艺优化及酶解产物的抗氧化活性[J].食品工业科技,2021,42(12):209-217.
[20] 周丹丹,周春晖,黄惠华.猴头菇多糖的超声辅助罐组式动态逆流提取及纯化研究[J].食品工业科技,2017,38(5):279-284.

