响应面优化诱导子促进印楝悬浮细胞培养产印楝素的研究
张云竹++方佳++钟秋平
摘 要 通过单因素实验法研究了水杨酸(SA)、萘乙酸(NAA)、壳聚糖(CTS)、吲哚丁酸(IBA)、茉莉酸(JA)、激动素(KT)和甲基茉莉酸(MJ) 等7种诱导剂对印楝悬浮细胞培养产印楝素的作用,筛选出SA、NAA、CTS、IBA等4种刺激效果明显的诱导剂,利用响应面法优化了该4种诱导剂的最佳组合为SA 92.00 mg/L、NAA 6.0 mg/L、CTS5 4.0 mg/L和IBA 3.0 mg/L,得到印楝素含量的实际值为8.61 mg/g,与理论预测值8.69的相对误差为0.92%。回归方程的预测值和实验值差异不显著,所得回归方程模型拟合情况良好,符合要求。
关键词 印楝 ;细胞悬浮培养 ;印楝素 ;响应面
分类号 S722.7
印楝(Azadirachta indica A. Juss)是一种极其安全的药用资源植物[1],在农业、医药、环保、化妆及食品中应用广泛[2-4]。起药用效果的主要是印楝籽通过次级代谢产生的印楝素,不仅具有高效杀虫、拒食等功效,还能抑制生长发育、胃毒、呼吸和昆虫激素分泌等,并具有降低昆虫生育能力和杀灭微生物等作用[5-9]。但印楝籽1 a只产1次,数量有限,不能长久保存,且印楝籽中的印楝素含量受种源、降雨、种子形态、采样期和组培条件等因素的影响[10-11]。由于从印楝籽中提取印楝素具有局限性,因此采用悬浮细胞培养规模化开发印楝素则是行之有效的方法。梁军等[12]建立了印楝悬浮细胞培养体系,Balaji等[13]考察了生物及非生物诱导子对印楝悬浮细胞培养产印楝素的影响。考虑到诱导子之间存在协同效应,本试验研究不同诱导子如SA、NAA、CTS、IBA、JA、KT及MJ对印楝悬浮细胞培养产印楝素的影响,选择最优诱导剂,并考察它们之间相互作用的效果,以期为提高悬浮培养细胞的印楝素产量提供依据。
1 材料与方法
1.1 材料
印楝愈伤组织来自野生印楝籽源经固体培养基多次继代诱导培养产生的生长旺盛、色泽嫩黄、疏松易碎的组织。
1.2 悬浮培养系的诱导
将2 g愈伤组织接种到装有40 mL MS液体培养基的100 mL三角瓶中,内含不同浓度诱导子。接种后置于旋转摇床振荡培养,摇床转速为90 r/min,温度为25℃。
1.3 悬浮培养系的建立
将生长良好的细胞株培养液30 mL接种到内含蔗糖40 g/L+BA 2.0 mg/L的MS液体培养基中,500 mL的三角瓶装液量为150 mL,25 ℃培养,每天光照16 h/黑暗8 h。
1.4 诱导子的筛选
分别选用SA、NAA、CTS、IBA、JA、KT及MJ作为诱导子,其浓度如表1所示。将不同浓度的诱导子在悬浮培养诱导时加入,培养约8 d后接入已建立的悬浮培养系中,培养至第15天时收集细胞并分析印楝素的含量。用水和95%乙醇溶解的诱导子,在对照试验时分别加入同样量的水和乙醇。
1.5 响应面优化
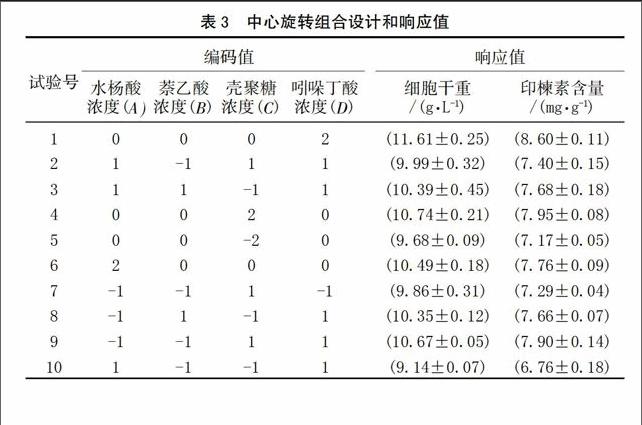
根据单因素实验结果,分别选用SA、NAA、CTS及IBA作进一步的优化实验,实验水平如表2所示。每组实验培养至第15天时分别收集细胞并测定印楝素的含量。
1.6 细胞干重的测定
将培养好的细胞悬浮液,摇匀后取100 mL,3 000 r/min 离心20 min,沉淀用蒸馏水清洗2次,50℃烘干至恒重,称量即为细胞干质量。
1.7 印楝素的提取和测定
用甲醇萃取干细胞中的印楝素,萃取参考梁军等[12]的方法。萃取液用0.45 μm滤膜过滤,清液采用HPLC法检测样品中印楝素的含量。色谱条件为C-18柱,乙腈∶水(10∶90)为流动相,流速为0.5 mL/min,检测波长为214 nm,柱温30℃。结果以1 g干愈伤组织中印楝素的mg数表示。
1.8 统计分析
数据统计采用采用SPSS与Design Expert 8.0.6统计软件进行分析。
2 结果与分析
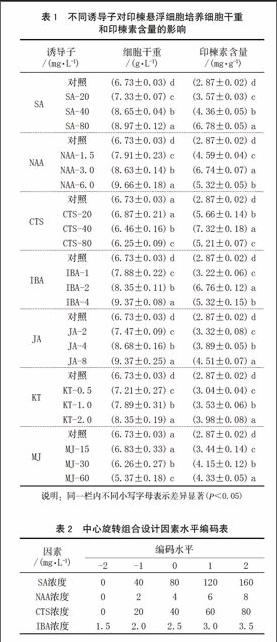
2.1 不同诱导子对印楝悬浮细胞产印楝素的影响
2.1.1 SA对印楝悬浮细胞产印楝素的影响
SA对细胞干重和印楝素含量影响如表1所示。从表1可以看出,细胞干重和印楝素含量随着SA浓度的提高而提高,当SA浓度为20 mg/L时,印楝素的含量为对照的1.24倍。当SA浓度提高至80 mg/L时,印楝素含量急剧增加为对照的2.36倍。在SA所试的各种浓度之间及各浓度与对照之间,印楝素含量差异显著(P<0.05),说明SA能有效诱导悬浮细胞合成印楝素。SA对印楝悬浮细胞的生长也有显著影响,SA各浓度间及各浓度与对照间差异显著(P<0.05)。由此说明,SA不仅可以刺激印楝悬浮细胞的生长,而且还可以促进印楝素的生物合成。SA是一种已知的系统获得性抗性(SAR)途径的诱导剂[14],其中一些抗性途径可能与印楝素的合成有关。
2.1.2 NAA对印楝悬浮细胞产印楝素的影响
NAA对印楝悬浮细胞生长有促进作用,在所试的浓度范围内,细胞干重随着NAA浓度的增加而增加,但印楝素的累积却呈现先增加后降低的趋势(表1),在NAA浓度为3.0 mg/L时,印楝素含量最大。考虑到细胞生长和印楝素的累积,NAA的浓度不能太高。
2.1.3 CTS对印楝悬浮细胞产印楝素的影响
CTS在一些悬浮细胞培养中被证明是一有效的次级代谢产物形成的促进剂[15]。对于印楝悬浮系的生长来讲,CTS的浓度不能太高,过高的CTS浓度对印楝细胞产生了毒害作用;对于印楝素合成来讲,较低的CTS浓度有利于印楝素的累积。当CTS浓度为40 mg/L时,细胞干重虽然比对照低,但印楝素的含量却显著高于对照,约为对照的2.55倍。因此,CTS浓度为40 mg/L左右为宜。
2.1.4 IBA对印楝悬浮细胞产印楝素的影响
IBA对悬浮细胞生长及印楝素合成的影响同NAA。细胞干重随IBA浓度的提高而提高,印楝素含量随IBA浓度的提高先升后降,在IBA浓度为2.0 mg/L时具有最高含量的印楝素,可见2.0 mg/L的IBA最好。
2.1.5 JA、KT和MJ对印楝悬浮细胞产印楝素的影响
JA和KT对悬浮细胞的生长有促进作用,MJ只有在低浓度即15 mg/L时,对悬浮细胞生长有利,高浓度对细胞生长有毒害作用。对印楝素合成和累积而言,在所试的浓度范围内,JA、KT和MJ虽能有效促进印楝素的合成和累积,但效果没有SA、NAA、CTS及IBA显著,与对照相比,印楝素含量仅有对照的1.06-1.57倍,提高的幅度远低于上述4种诱导剂。
2.2 印楝悬浮细胞产印楝素的响应面分析
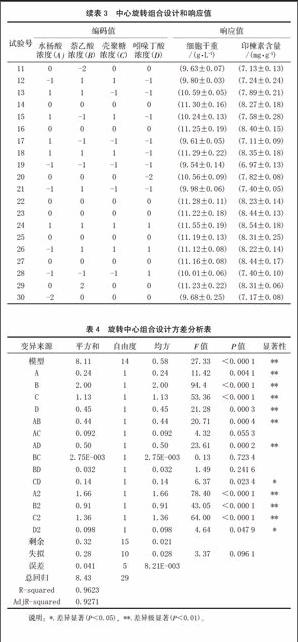
以印楝素含量为响应值的响应面试验设计与结果见表3,得到印楝素含量(Y)对SA(A)、NAA(B)、CTS(C)、IBA(D)经剔除不显著项后的二次多项回归模型为:
Y=2.855+0.037A+0.246 B+0.026 C+1.634 D+0.002 AB-0.009 AD+0.009 CD-1.538 E-004 A2-0.0456 B2-5.559 E-004 C2-0.239 D2
为了检验方程的有效性,对印楝素含量的数学模型进行方差分析(表4)。从表4可知,印楝素含量为响应值时,该二次方程模型有统计学意义(P<0.010 0)。回归方程失拟性检验无统计学意义(P=0.096 1),表明未知因素对试验结果干扰很小;回归方程的相关系数(R2=0.962 3)及变异系数CV(1.87%)均表明模型方程能够较好地反映真实的试验值。该方程与实际情况拟合很好,较好地反映了印楝素含量与SA、NAA、CTS和IBA的关系,因此所得的回归方程能较好地预测印楝素含量随各参数的变化规律。实验所选4个因素中A,B,C,D和AB、AD、CD 以及二次项的影响差异有统计学意义,其中A、B、C、D 为极有统计学意义,说明SA、NAA、CTS和IBA均对印楝素含量有极显著影响,SA影响最弱,但也达到了极显著水平(P<0.01),并且AB、AD、CD交互作用极明显。综合以上各参数,表明该实验方法可靠,各因素水平间设计合理,因此可用该回归模型代替实验真实点对结果进行分析。
响应面图形是响应值对各试验因子A、B、C、D 所构成的三维空间的曲面图,从响应面分析图上可形象地看出最佳参数及各参数之间的相互作用。根据回归方程得出不同因子的响应面分析图及相应等高线图,分析两两因素交互作用对印楝素含量的影响。通过 Design Expert 8.0.6 软件对各因素之间的交互作用进行响应面分析,根据方差分析结果,SA和IBA、SA和NAA、CTS和IBA之间交互作用呈极显著或显著[8]。NAA浓度一定,当SA浓度小于90 mg/L左右时,印楝素含量随着SA浓度的提高而增大,SA浓度超过90 mg/L时,印楝素含量开始下降,变化明显(图1);SA浓度一定,印楝素含量随着IBA浓度的增加而增加,IBA浓度3.0 mg/L时达到最大值(图2);IBA浓度一定,印楝素含量随着CTS浓度的提高而增加,当CTS浓度达54 mg/L左右时,印楝素含量达最大值,此后随着CTS浓度的进一步增加,印楝素含量则降低(图3)。其他交互作用方差分析P值均大于0.05,表明对于印楝素含量的影响,交互作用不明显。
2.3 悬浮细胞发酵产印楝素最优工艺及其验证
NAA、CTS和IBA是影响印楝素含量的最主要因素,SA次之,选择合适的发酵条件,可获得较高的印楝素含量。对响应面结果进行最优分析,以印楝素含量最高为评价指标,确定发酵工艺的最佳条件如下:SA 91.60 mg/L、NAA 6.00 mg/L、CTS 54.28 mg/L、IBA 3.00 mg/L,理论预测印楝素含量为8.69 mg/g。
为实验方便,4种诱导剂的浓度分别调整为SA 92.00 mg/L、NAA 6.0 mg/L、CTS 54.0 mg/L、IBA 3.0 mg/L,得到印楝素含量的实际值为8.61 mg/g,该值与理论预测值8.69的相对误差为0.92 %,说明该模型具有好的分析能力,可为实际操作提供良好的指导。
3 结论
通过对诱导剂诱导印楝悬浮细胞产印楝素的研究发现,在一定浓度范围内,SA、NAA、CTS、IBA、JA、KT及MJ皆能使印楝悬浮细胞生长,并促进悬浮细胞累积印楝素,前4种诱导剂的诱导效果明显好于后3种诱导剂。经对前4种诱导剂的进一步优化,将差异不显著的因素剔除后的回归方程为:
Y=2.855+0.037A+0.246B+0.026C+1.634D+0.002 AB-0.009AD+0.009CD-1.538E-004A2-0.0456 B2-5.559E-004C2-0.239D2
SA、NAA、CTS和IBA的最佳组合为SA 92.00 mg/L、NAA 6.0 mg/L、CTS 54.0 mg/L、IBA 3.0 mg/L,得到印楝素含量的实际值为8.61 mg/g,该值与理论预测值8.69的相对误差为0.92 %,能为实际操作提供良好的指导。
参考文献
[1] Shmutyerer H.Properties and potential of natural pesticides from the neem tree[J].Annu Rev Enmmol, 1990, 35(5): 271-297.
[2] 林靖凌,蔡春茂,彭黎旭. 印楝种仁粗提物对植物病原菌的抑制作用研究[J]. 安徽农业科学,2008,36(11):4 566-4 567.
[3] 程少敏,邓忠贤. 新型生物杀虫剂印楝素的应用[J]. 农药,2011,10:46-47.
[4] Bradley M, Katie S, Julia A. in: Mcmillan (Ed.),Neem, A Tree for Solving Global Problems,National Research council, USA[J]. Blackwell Science Inc,1992: 60-70.
[5] 贾建文,黄劲飞,王文祥,等. 不同杀虫成分对Sf9细胞凋亡的影响[J]. 华南农业大学学报,2009,30(4):29-36.
[6] Mordue A J, Blackwell A. Azadirachtin: an update [J]. Journal of Insect Physiology, 1993, 39: 903-924.
[7] Sayah F, Idaomar M, Soranzo L. Endocrine and neuroendocrine effects of azadirachtin in adult females of the earwig Labidura riparia[J]. Tissue and Cell, 1998, 30(1): 86-94.
[8] 徐汉虹. 杀虫植物与植物性杀虫剂[M]. 北京:中国农业出版社,2001.
[9] Trand X, Tsuzuki E, Terao H, et al. Evaluation on phytotoxicity of neem (Azadirachta indica. A. Juss). to crops and weeds[J]. Crop Protection, 2004, 23: 335-345.
[10] 王瑞波. 印楝的生长及其印楝素含量的初步研究[D].硕士学位论文,云南:云南大学,2004.
[11] 彭兴民,吴疆翀,程金焕.印楝农药原料林优树选择方法与标准[J]. 福建林学院学报,2010,30(3):265-269.
[12] 梁 军,魏 刚,吕 全,等. 印楝细胞悬浮培养系的建立及悬浮培养[J]. 林业科学研究,2003,16(5):568-574.
[13] Balaji K, Veeresham C, Srisilam K, et al. Azadirachtin, a novel biopesticide from cell cultures of Azadirachta indica[J]. Plant Biotechnol,2003, 5: 121-129.
[14] Zhang W, Yang X F, Qiu D W, et al. Pea Tl-induced systemic acquired resistance in tobacco follows salicylic acid-dependent pathway[J]. Mol Biol Rep, 2011, 38: 2 549-2 556
[15] Funk C, Brodelius P. Influence of growth regulator and an elicitor on phenyl propanoid metabolism in suspension cultures of Vanilla plantifolia[J]. Phytochemistry, 1990, 29: 818-828.

