姜黄素纳米粒对人视网膜色素上皮细胞的示踪研究
郑海生,蓝育青,李 芳,梁晓茜,杨镇朵,钟兴武
0引言
姜黄素(curcumin,Cur)作为我国的一种传统中药,具有多种疗效[1-3]。姜黄素在眼科的应用研究发现其具有抑制人视网膜色素上皮(human retinal pigment epithelium,hRPE)细胞增殖及糖尿病大鼠视网膜血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达等作用,因此其在防治眼底新生血管性病变中可以发挥抗新生血管的药理作用,并且已有临床试验研究姜黄素的药物代谢动力学及癌症治疗的生物有效剂量[4-5]。但姜黄素难溶于水,体内被快速代谢,体内半衰期短,且需要长期、反复用药。这给患者带来许多的不便与痛苦。同时由于其作用于组织和细胞的非选择性,且目前仍无稳定性较好的药物剂型,影响了姜黄素在临床上的广泛应用。因此研制姜黄素的新剂型具有重要的临床意义。纳米中药是指运用纳米技术制造的、粒径小于100nm 的中药有效成分、有效部位、原药及其复方制剂[6-7]。纳米中药与传统中药比较有其优势[8-10]:增大了药物的溶解度;更容易通过血-视网膜屏障、血-脑屏障定向作用于视网膜及中枢神经;具有缓释性、靶向性;提高药物的质量、减少副作用、提高疗效;节约有限的中药资源;利于中药标准化、国际化等特点。本研究主要通过纳米技术将姜黄素包载到脱氧胆酸基接枝的壳聚糖纳米粒中,制备成载药纳米粒,希望此纳米粒具有缓慢释放药物功能,降低姜黄素的不良反应,提高药物的疗效、长时间维持药效浓度,减少多次给药对患者带来的痛苦。同时通过观察比较姜黄素/壳聚糖-脱氧胆酸纳米粒和姜黄素原药对体外培养的hRPE细胞的作用,为寻找一种新型的、缓释的、安全有效地防治眼底新生血管性疾病的新药物提供初步的理论依据。
1材料和方法
1.1材料实验细胞:hRPE细胞(中山大学附属眼科中心医院提供,选第3~6代细胞用于实验)。主要试剂:姜黄素(购自SIGMA公司)、胎牛血清(Biological Industries公司)。主要仪器设备:光学倒置显微镜(德国Leica MPS-30)、荧光显微镜Axioplan2 imaging(德国 Zeiss)。
1.2方法
1.2.1材料合成与制备
1.2.1.1姜黄素/壳聚糖-脱氧胆酸纳米粒的合成将壳聚糖-脱氧胆酸放于PBS6.2中(按4mg/mL),不断搅拌使壳聚糖-脱氧胆酸膨胀溶解;称取一定量姜黄素并溶解于四氢呋喃中;然后缓慢滴加姜黄素的四氢呋喃溶液至壳聚糖-脱氧胆酸溶液中,再缓慢滴加蒸馏水,继续搅拌至少24h;在搅拌下升温至40℃,使残余的四氢呋喃挥发;最后在5 500转下离心15min,下层沉淀为未负载的药物,上清液即为壳聚糖-脱氧胆酸负载的姜黄素纳米粒。
1.2.1.2异硫氰酸/壳聚糖-脱氧胆酸纳米粒的合成称取壳聚糖-脱氧胆酸置于圆底烧瓶,滴加磷酸缓冲液(pH=6.2),不断搅拌使壳聚糖-脱氧胆酸溶解;取少量的荧光染料异硫氰酸荧光素溶于PBS6.2的缓冲液中,然后慢慢滴加至壳聚糖-脱氧胆酸溶液中,再缓慢滴加少量水,水滴加完后,继续搅拌至少24h;高速离心(20 000g,20min)分离,弃去上层液体,下层沉淀液为负载异硫氰酸荧光素的壳聚糖-脱氧胆酸纳米粒;加磷酸缓冲液溶解沉淀,可得到异硫氰酸/壳聚糖-脱氧胆酸纳米粒水溶液。
1.2.1.3异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒的合成称取壳聚糖-脱氧胆酸置于圆底烧瓶,滴加磷酸缓冲液,不断搅拌使壳聚糖-脱氧胆酸溶解;称取少量姜黄素并溶解于四氢呋喃中;然后缓慢滴加姜黄素的四氢呋喃溶液至壳聚糖-脱氧胆酸溶液中,再取少量的异硫氰酸荧光素溶于PBS6.2的缓冲液中,然后慢慢滴加至壳聚糖-脱氧胆酸溶液中(避光),继续搅拌至少24h;在搅拌下升温至40℃,使残余的四氢呋喃挥发;5 500转下离心15min,取上清液;高速离心(20 000g,20min)分离,弃去上层液体,下层沉淀液为负载异硫氰酸荧光素及姜黄素的壳聚糖-脱氧胆酸纳米粒;加磷酸缓冲液溶解沉淀,可得到异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒水溶液。
1.2.1.4姜黄素/壳聚糖-脱氧胆酸纳米粒的体外释放采用动态透析法考察姜黄素/壳聚糖-脱氧胆酸纳米粒在含20%乙醇的磷酸盐缓冲液(PBS,pH=6.2,缓冲液:乙醇=80∶20,v/v;乙醇作为药物的增溶剂)的释放特征。将3.8mL姜黄素/壳聚糖-脱氧胆酸纳米粒溶液(载药量27.5%)装入透析袋中,将透析袋放于196.2mL透析介质中(含20%乙醇的磷酸盐缓冲液,37.0℃,100r/min),每隔一段时间取透析介质溶液1.0mL,同时补充1.0mL介质溶液。采用紫外分光光度法(λ=433nm)测定药物的释放量,药物释放率=(药物释放量/药物总量)×100%。
1.2.1.5透射电子显微镜观察纳米粒形态分别取少量壳聚糖-脱氧胆酸纳米粒和姜黄素/壳聚糖-脱氧胆酸纳米粒溶液分别滴至铜网支持膜上,用滤纸将多余的液体吸除,待自然干燥后用2%磷钨酸染色,晾干后在透射电镜下观察二者的形态。
1.2.2异硫氰酸/壳聚糖-脱氧胆酸纳米粒及异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒与hRPE细胞的相互作用取对数生长期的hRPE细胞以1.0×105/cm2的密度接种于24孔板中,每孔500μL DMEM-F12培养基。培养24h后,细胞贴壁,更换新的培养基,分别加入异硫氰酸/壳聚糖-脱氧胆酸和异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒溶液,使溶液中壳聚糖-脱氧胆酸的最终浓度为1.0mg/mL。CO2培养箱内避光培养1、3、5d后,弃去培养基,并用PBS溶液冲洗3次,加入新的培养基,然后在倒置荧光显微镜下进行观察和照相。
2结果
2.1姜黄素/壳聚糖-脱氧胆酸纳米粒合成及其载药量及负载效率的测定所合成的姜黄素/壳聚糖-脱氧胆酸纳米粒溶液为淡黄色,并可见丁达尔(Tyndall)现象(图1A、B)。

图1 合成的姜黄素/壳聚糖-脱氧胆酸纳米粒溶液 A:合成的淡黄色姜黄素/壳聚糖-脱氧胆酸纳米粒溶液;B:纳米粒溶液的丁达尔(Tyndall)现象。
2.2姜黄素/壳聚糖-脱氧胆酸纳米粒的体外释放姜黄素/壳聚糖-脱氧胆酸纳米粒在溶液中的释放行为见图2,药物从纳米粒中释放96h后达到平衡,累积释放药物量为31.6%。
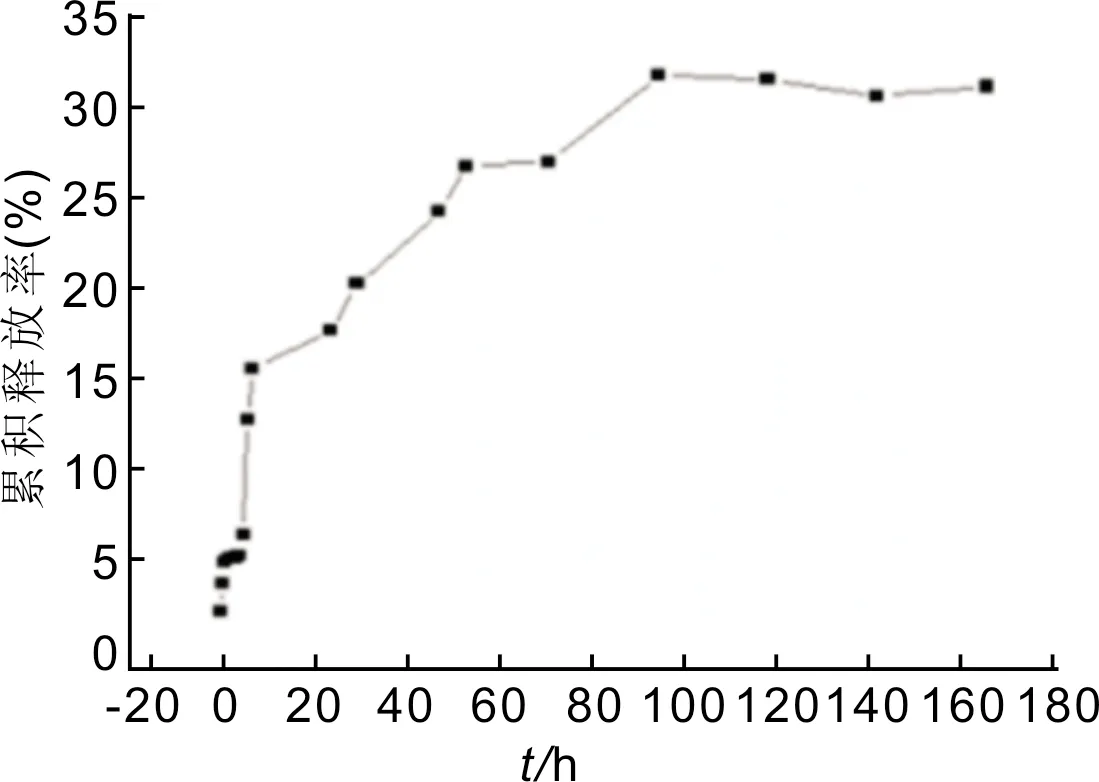
图2 姜黄素/壳聚糖-脱氧胆酸纳米微粒的体外释放。
2.3纳米粒形态通过透射电子显微镜观察可见未负载药物的壳聚糖-脱氧胆酸纳米微粒呈球形或类球形,大小均一,粒径约30~50nm(图3A);负载姜黄素的壳聚糖-脱氧胆酸纳米微粒粒径明显增大,约70~100nm(图3B)。

图3 壳聚糖-脱氧胆酸纳米微粒负载药物前后的透射电镜照片 A:未负载药物的壳聚糖-脱氧胆酸纳米微粒,粒径约30~50nm;B:负载姜黄素的壳聚糖-脱氧胆酸纳米微粒,载药量27.5%,粒径约70~100nm。
2.4异硫氰酸/壳聚糖-脱氧胆酸纳米粒及异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒与hRPE细胞的相互作用
2.4.1异硫氰酸/壳聚糖-脱氧胆酸纳米粒异硫氰酸/壳聚糖-脱氧胆酸纳米粒与hRPE细胞共培养24h后,倒置荧光显微镜下观察1、3、5d后纳米粒与细胞相互作用的关系见图4。
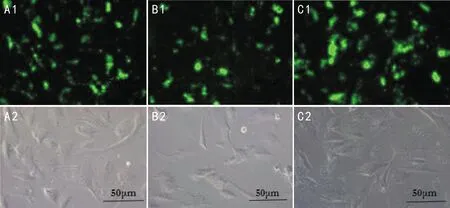
图4 异硫氰酸/壳聚糖-脱氧胆酸纳米粒与hRPE细胞的相互作用 A:作用1d后,壳聚糖-脱氧胆酸纳米粒大部分仍位于近细胞膜的部位(可能于细胞膜表面,或刚透过细胞膜进入细胞质中);B:作用3d后,壳聚糖-脱氧胆酸纳米粒逐渐向细胞核聚集,大部分位于细胞核周围;C:作用5d后,壳聚糖-脱氧胆酸纳米粒已进入细胞核,且壳聚糖-脱氧胆酸纳米粒可能在细胞内溶酶体的作用下部分降解,可见荧光染料扩散到整个细胞中,在荧光图中可看到细胞的轮廓,且细胞核区域的荧光较强。
2.4.2异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒与hRPE细胞共培养24h后,倒置荧光显微镜下观察1、3、5d后纳米粒与细胞相互作用的关系见图5。可见到此二者之间的相互关系与空载的壳聚糖-脱氧胆酸纳米粒具有相似的过程。
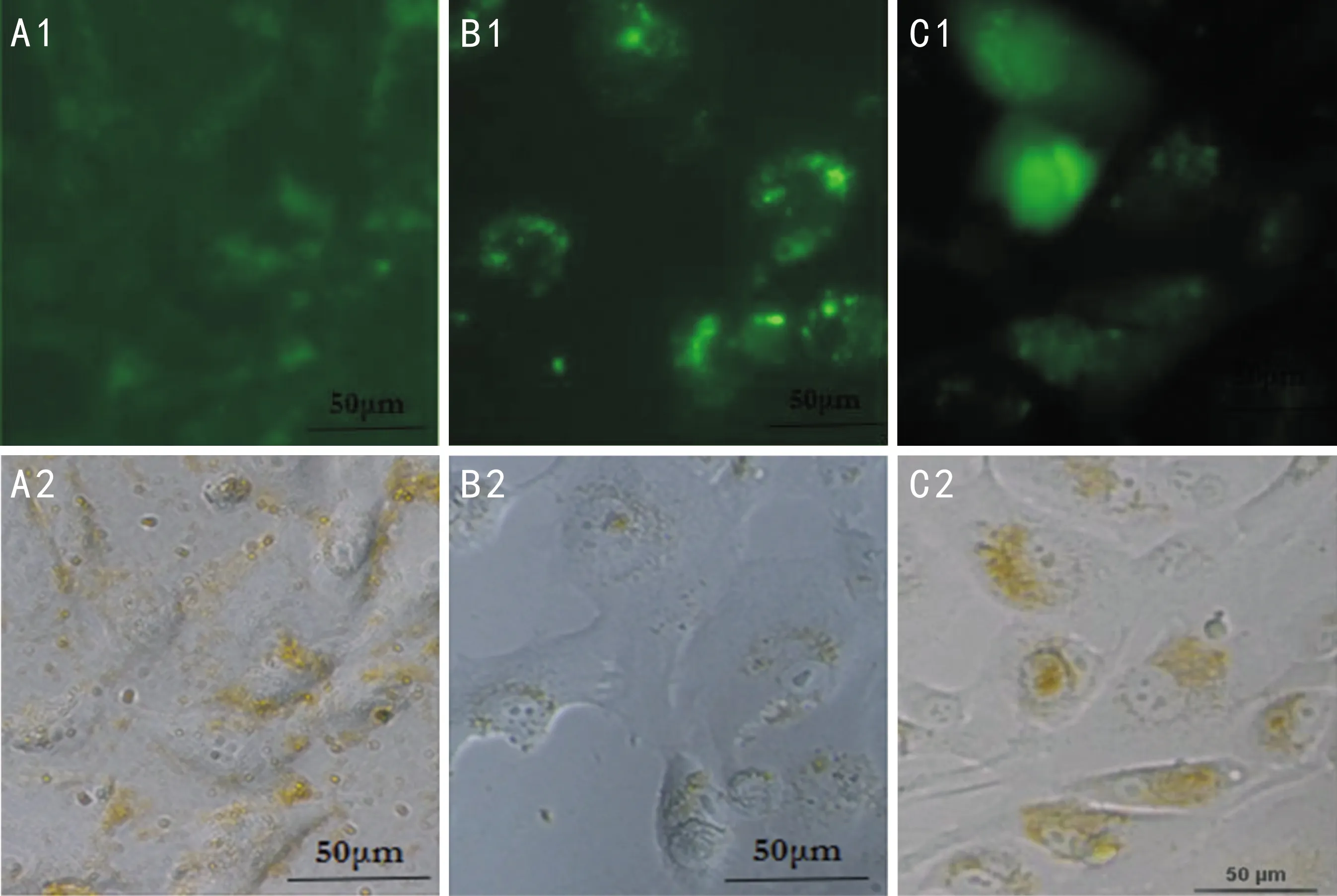
图5 异硫氰酸/姜黄素/壳聚糖-脱氧胆酸纳米粒与hRPE细胞的相互作用 A:作用1d后,壳聚糖-脱氧胆酸纳米粒大部分仍位于近细胞膜的部位(可能于细胞膜表面,或刚透过细胞膜进入细胞质中);B:作用3d后,姜黄素/壳聚糖-脱氧胆酸纳米粒逐渐向细胞核聚集,大部分位于细胞核周围;C:作用5d后,姜黄素/壳聚糖-脱氧胆酸纳米粒已进入细胞核。
3讨论
高分子化合物是制备纳米控释系统的主要载体材料,常以天然的大分子体系和合成的可生物降解的聚合物体系为主。壳聚糖是一种天然高分子聚合物,是至今为止唯一发现的带阳离子性质的碱性氨基多糖。壳聚糖在自然界中广泛存在于低等生物菌类、藻类的细胞,节支动物虾、蟹、昆虫的外壳等。壳聚糖具有较好的可降解性、生物相容性和黏附性[11]。壳聚糖包裹还可以提高脂质体的稳定性和适用性[12-13]。因此壳聚糖广泛应用于食品、医药、保健、生物工程等领域[14]。远在几千年前《本草纲目》中早已有蟹壳粉的记录,可见古人早已将壳聚糖作为医疗之用。在本研究中所合成的姜黄素/壳聚糖-脱氧胆酸纳米粒是选用了壳聚糖-脱氧胆酸为药物载体,壳聚糖-脱氧胆酸是采用EDC作耦合剂,在壳聚糖上接枝脱氧胆酸,合成具有两亲性的改性壳聚糖,该聚合物在水溶液中可形成纳米粒。纳米药物的缓释机制一般认为有:(1)吸附或连接于粒子表面的药物与纳米粒脱离;(2)纳米胶束内部的药物不断向外扩散;(3)纳米胶束本身不断被降解,药物不断地从胶束内被释放出来。
本研究通过合成脱氧胆酸基接枝的壳聚糖衍生物负载姜黄素纳米粒,并进行扩散释放实验法及利用荧光染料的示踪作用,在倒置荧光显微镜下观察异硫氰酸/壳聚糖-脱氧胆酸纳米粒与hRPE细胞相互作用情况。实验中发现药物从纳米粒中的释放表现为突释和缓释两个阶段,药物从纳米粒中释放96h后达到平衡,累积释放药物量为31.6%,其中前20h为突释阶段,药物释放达19.9%。体外扩散释放实验证明了本研究所合成的负载姜黄素纳米粒具有缓慢释放功能。倒置荧光显微镜下观察异硫氰酸/壳聚糖-脱氧胆酸纳米粒与hRPE细胞的作用发现,异硫氰酸/壳聚糖-脱氧胆酸纳米粒与细胞作用1d后,纳米粒大部分仍位于近细胞膜的部位(可能在细胞膜表面,也可能在细胞质中);作用3d后,纳米粒逐渐向细胞核会聚,且大部分位于细胞核周围;作用5d后,可看到纳米微粒已进入细胞核,且在细胞内溶酶体的作用下纳米微粒可能有部分降解,荧光染料扩散至整个细胞中,在荧光图中可看到细胞的轮廓,且细胞核区域的荧光较强。即随着时间的延长,纳米微粒由细胞外进入细胞内并逐渐降解。在细胞与纳米粒相互作用过程中,我们分析认为可能是壳聚糖含有带正电的氨基基团,而细胞膜表面蛋白多糖带负电。有研究显示聚阳离子的纳米粒可以通过纳米粒表面的正电荷与细胞表面带负电荷的蛋白多糖非特异性静电结合被吞噬进入细胞[15]。另有研究发现由于姜黄素在纳米粒中呈现缓释趋势增加了药物的内吞作用[16]。因此,本研究中壳聚糖-脱氧胆酸纳米粒可能通过电荷的相互作用而与细胞吸附,也可能是壳聚糖经过了脱氧胆酸改性,具有两亲性,而更易与细胞膜作用。然而,本研究仅观察了壳聚糖-脱氧胆酸纳米粒与hRPE细胞在不同时间内的相互作用关系,但这些作用与纳米粒的粒径大小、浓度之间的相互关系如何尚需进一步实验证明。本研究为进一步耦联特异性VEGF抗体制备靶向载药纳米粒及进行体内动物实验提供了研究基础,为寻找一种新型的、持久的、安全有效防治眼底新生血管性疾病的新药物提供了初步的理论依据。

