离子液体生态毒理研究进展
褚玲珑,赵晓祥
东华大学环境科学与工程学院,上海 201620
离子液体(ionic liquids, ILs)是由离子组成的有机盐,近室温下呈现液态,也称为室温熔融盐或低温熔融盐。离子液体具有诸多优良特性,如低蒸汽压、不挥发、强导电性和高稳定性等,可溶解许多无机盐和有机物[1-2],被看作继水和超临界二氧化碳后又一大类“绿色溶剂”[3]。
离子液体在多领域均有应用,例如,在化学领域可以作为理想的分离提纯溶液,被称为“液体分子筛”[4];在物理领域可以作为表面润滑剂;在生物领域,研究发现含有六氟磷酸([PF6])的离子液体能显著提升抗菌剂整体膜结构的抗菌能力[5]。除此之外,离子液体也可以应用于有机合成、纳米技术和高分子材料等方面[6-7]。
由于离子液体的广泛应用及其较高的水溶性,使其不可避免地进入到环境中[1,8]。离子液体化学稳定性和热稳定性高,难以被降解,导致它在环境的积累和扩散,对生态系统具有潜在危害。目前存在有生物降解、毒性和腐蚀性等问题[9]。
近年来,有关离子液体的生态毒性研究不断增多,涉及微生物、植物、动物、细胞及DNA等多方面,研究发现离子液体的潜在毒性可能会对生态环境造成影响。本文详细阐述了离子液体的性质,并从多角度综述其对生物的毒性作用及其毒性影响因素。探明不同结构的离子液体对生态环境的影响作用,一方面可以控制其使用和排放剂量,避免对各类生物和生态环境带来危害;另一方面可以设计合成具有相同使用效果,但对生物毒性更低的离子液体。以期为离子液体的毒性评估、合理使用和设计合成提供有效参考,真正成为“绿色溶剂”,推动“绿色化学”发展。
1 离子液体的结构与性质(Structure and properties of ionic liquids)
离子液体由各种有机阳离子和有机或者无机阴离子组成,阴离子和阳离子种类多样(表1),其组合会更加多样,因此在未来大量潜在的离子液体将会被设计开发出来[10]。了解离子液体结构和性质之间的特定关系,有利于我们用结构来调节离子液体的性质,以适应特定的需求和应用。
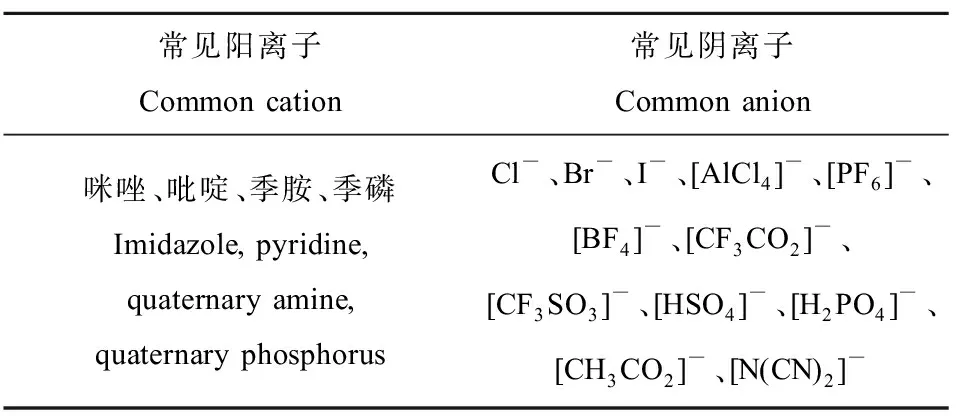
表1 常见组成离子液体(ILs)的阳离子与阴离子Table 1 Common cations and anions that form ionic liquids (ILs)
近年来,诸多研究对离子液体的物理和化学性质进行表征和预测[11-15],发现离子液体的物理和化学性质,受阳离子和阴离子的性质和大小以及库仑相互作用和范德华相互作用之间的平衡,以及氢键和π-π相互作用的影响[16-19]。这些研究结果对于选择和设计特定应用的离子液体大有裨益。
一般情况下,离子液体普遍拥有较低的熔点[14-15,19]。不同结构的离子液体熔点不同,含有天然产物的离子液体具有较高的熔点,其中最低的熔点会在0 ℃以下[20]。阳离子和阴离子都会影响离子液体的热稳定性[21-22],其中阴离子的影响高于阳离子,含有卤化物离子会大大降低其热稳定性(<300 ℃)[23]。离子液体的黏度也可以控制和调节,受范德华作用和氢键的影响,随烷基链延长、烷基链分叉或氟化作用的增加,离子液体的黏度会增加。当温度略有升高或存在少量有机溶剂时,离子液体的黏度会降低[24]。此外,阴离子对离子液体的黏度有很大的影响[14,19,25-27]。离子液体蒸气压与离子的排列方式有关,每一个离子都被一个对称的相反电荷壳包围,使静电自由能最小化[18]。除了以上这些性质与离子液体的结构有关之外,离子液体的密度和电导率则控制在一定范围内变化,在室温和一个大气压下,大多数离子液体的密度范围为0.9~1.7 g·cm-3[18,25-30],电导率范围为1~100 mS·cm-1[19,28,31]。
2 离子液体的生态毒理研究(Ecotoxicology of ionic liquids)
2.1 离子液体对微生物的毒性(Toxicity of ionic liquids to microorganisms)
微生物在自然环境中无处不在,尤其是在土壤中,存在许多环境必需的微生物,一旦受到离子液体的污染,对于整个生态系统和食物链都会造成严重影响,因此大部分对微生物的毒性研究均集中于土壤微生物。离子液体会改变土壤中细菌群落结构[32-33],抑制各类微生物的生长,影响生态环境中的稳态。对于不同结构的离子液体,其对于微生物的影响存在差异[34],不同的阴离子和阳离子之间还会互相影响彼此的毒性效应[35]。
(1)土壤微生物
离子液体能够被用作除草剂的溶剂,使用于土壤中,导致土壤受到离子液体污染。用作除草剂的离子液体(HILs)对农业土壤中本地细菌群落结构具有一定影响[36-37]。对经过HILs处理的土壤进行下一代测序,发现变形菌门均为优势门,放线菌增加,拟杆菌门丰度显著高于厚壁菌门丰度。离子液体会改变土壤微生物群落结构和多样性[32-33]。1-辛基-3-甲基咪唑六氟磷酸盐([Omim]PF6)6.0 mg·kg-1和8.0 mg·kg-1处理土壤后,Biolog-ECO板试验的平均孔显色(AWCD)低于其他处理,Biolog分析的多样性指数显著降低。采用实时聚合酶链反应(RT-PCR)测定氨氧化古菌(AOA-)和氨氧化细菌(AOB-)氨单加氧酶(amoA)基因的丰度,4.0、6.0和8.0 mg·kg-1处理中,AOA-和AOB- amoA基因丰度受到[Omim]PF6的抑制[38]。用1-丁基-3-甲基咪唑溴铵([C4mim]Br)、1-己基-3-甲基咪唑溴盐([C6mim]Br)和1-癸基-3-甲基咪唑溴盐([C10mim]Br)对褐土进行暴露试验后,均导致可培养微生物丰度下降。离子液体暴露抑制脲酶活性,促进酸性磷酸酶和β-葡萄糖苷酶活性。土壤微生物多样性和AOB-amoA和AOA-amoA基因的丰度显著降低。通过综合生物标志物反应(integrated biomarker response, IBR)指数的比较,离子液体对土壤微生物的毒性大小顺序如下:[C10mim]Br>[C6mim]Br>[C4mim]Br。在所有收集的生物标志物中,AOA-amoA基因的丰度对离子液体的暴露是最敏感的,极易受到离子液体的影响[39]。
(2)费氏弧菌
除了土壤中的微生物之外,离子液体同样也会抑制其他细菌的生长,其中费氏弧菌的相关研究较多。费氏弧菌是一类能够发射可见荧光的细菌(发光细菌),可以用作测定环境中毒物毒性的指标。
(3)其他
除了上述微生物之外,离子液体对于其他许多微生物均具有一定毒性[44]。在一定浓度下,所有离子液体对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌均有毒性,离子液体烷基链长度的增加与毒性的增加相对应,含吡啶阳离子的离子液体比含咪唑的同系列离子液体表现出更强的抑制作用[45]。具有短烷基侧链的咪唑基离子液体,如[Emim]Cl和[Bmim]Cl对大多数微生物都是具有毒性的[44]。
2.2 离子液体对植物的毒性(Toxicity of ionic liquids to plants)
高等植物从土壤中吸收水分时,其根部可能存在暴露于离子液体中的风险,使其受到离子液体毒性的影响,而像藻类等低等植物,生长于水环境中,对离子液体毒性更加敏感。植物属于食物链较为底层的生物,如果受到离子液体的污染,会通过生物富集和生物积累作用对整个生态系统产生严重影响,甚至危害到人类。
2.2.1 高等植物
在离子液体对高等植物的毒性研究中,以农作物作为实验对象的报道较多。小麦和水稻是我国主要的粮食作物,并且在种植时需要大量的水,易遭受水中离子液体污染。蚕豆营养价值较高,富含蛋白质、糖、矿物质、维生素、钙和铁,是粮食作物和动物饲料,具有十分重要的价值,在我国种植广泛,是世界上第三大重要的冬季食用豆作物。同时小麦、水稻和蚕豆可被加工成各式各样的食物进入人体,因此它们发育的正常与否直接关系到人体健康。本文通过总结农作物、中药植物及其他植物的离子液体毒性研究,分析其致毒机制,如图1所示。
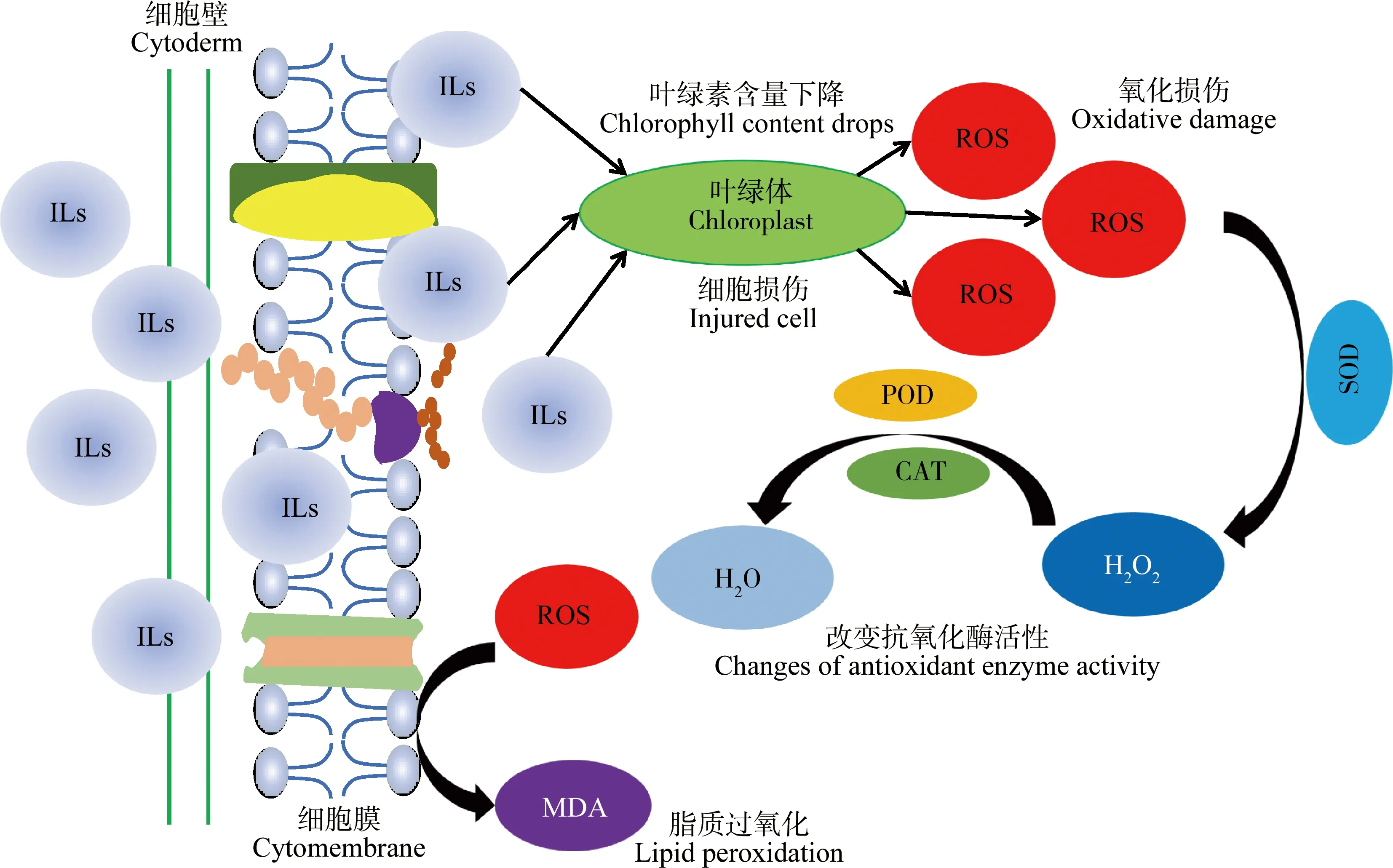
图1 离子液体对高等植物毒性机理示意图注:ROS表示活性氧自由基,ILs表示离子液体,H2O表示水,H2O2表示过氧化氢,CAT表示过氧化氢酶,POD表示过氧化物酶,SOD表示超氧化物歧化酶,MDA表示丙二醛。Fig. 1 Schematic diagram of ionic liquid toxicity to higher plantsNote: ROS stands for reactive oxygen free radical, ILs stands for ionic liquids, H2O stands for water, H2O2 stands for hydrogen peroxide, CAT stands for catalase, POD stands for peroxidase, SOD stands for superoxide dismutase, and MDA stands for malondialdehyde.
(1)农作物
离子液体会通过破坏细胞结构和抑制叶绿体生长来抑制农作物的生长,同时使农作物体内产生氧化应激[46]。不同阴离子、阳离子和烷基链长度的离子液体对农作物的毒性程度不同[47]。
数种离子液体对小麦幼苗显示有毒性作用。使用3种不同阴离子的咪唑离子液体:1-辛基-3-甲基咪唑氯盐([C8mim]Cl)、1-辛基-3-甲基咪唑溴盐([C8mim]Br)和1-辛基-3-甲基咪唑四氟硼酸盐([C8mim]BF4)污染褐土后培养小麦幼苗,3种离子液体均对小麦幼苗生长有抑制作用,诱导活性氧(ROS)的产生,小麦幼苗遭受氧化应激[46]。[C8mim]Cl、[C8mim]Br和[C8mim]BF4暴露后使得小麦体内抗氧化酶活性增强,表明氧化损伤可能是离子液体对小麦产生毒性的主要潜在机制。Chen等[48]将5种离子液体加入小麦幼苗水培液中,发现随着离子液体浓度的增加,小麦幼苗枝条和根系变短,干质量降低。处理组的小麦幼苗叶片抗氧化酶活性降低,丙二醛(MDA)含量升高。采用透射电子显微镜(TEM)观察,发现离子液体对小麦细胞结构的影响程度与研究测定的其他指标的总体趋势一致。离子液体通过扰乱植物代谢生理和改变细胞结构来影响植物的生长。不同阴离子的咪唑基离子液体的毒性程度不同。有学者将研究重点放在离子液体浓度范围、阴离子种类和阳离子链长度对小麦幼苗毒性的影响[47]。发现离子液体对小麦种子生长有明显的抑制作用,尤其是在浓度较高、含氟阴离子存在和阳离子烷基链长度较长的情况下。与非功能化类似物相比,氧功能化离子液体对小麦的毒性显著降低。
离子液体处理会抑制水稻幼苗生长发育,并且随着离子液体浓度的增加,水稻叶绿体的生长抑制率增加,光反应活性降低。叶绿体内超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性会随离子液体浓度的增加先升高后降低,表明其对水稻生长及光合系统均有毒性[49]。有报道发现3种不同烷基链长度的咪唑离子液体([C2mim]Br、[C4mim]Br和[C8mim]Br)会在水稻幼苗中积累,主要集中在根部,而茎和叶中只有少量离子液体转运和积累[50]。离子在水稻中的积累和转运取决于离子液体的浓度和烷基链长度。根、茎、叶中离子液体含量随烷基链长度的增加而降低。离子液体对水稻生长的毒性作用也与烷基链长度有关。不同离子液体均显著提高了水稻组织中MDA的含量,降低了叶绿素含量。离子液体对水稻幼苗光合作用的影响,会导致水稻对有机物的合成减少,最终使水稻的产量下降。同时,累积在水稻中的离子液体,会随着食物链进入人体,影响人体健康。
Liu等[51]研究了蚕豆幼苗受到土壤中1-癸基-3-甲基咪唑溴盐([Demim]Br)、1-癸基-3-甲基咪唑氯盐([Demim]Cl)和1-癸基-3-甲基咪唑硝酸盐([Demim]NO3)毒性的影响。低浓度下(1、5和25 mg·kg-1),离子液体对蚕豆幼苗生长影响不大;而50 mg·kg-1浓度下对幼苗的茎长、根长、干质量和色素含量均有显著影响。同时,ROS水平也显著升高,导致细胞脂质过氧化、DNA损伤和氧化损伤。3种咪唑离子液体(1-己基-3-甲基咪唑溴盐、1-己基-3-甲基咪唑硝酸盐和1-己基-3-甲基咪唑四氟硼酸盐)在0~2 500 mg·kg-1条件下对蚕豆生长有抑制作用,根据EC50值,[C6mim]BF4毒性最强[52]。在选定的离子液体浓度(0、1、10、100和500 mg·kg-1)下,测定10 d内蚕豆的生理指标。发现离子液体对蚕豆产生了氧化损伤,氧化应激可能是蚕豆中毒的主要潜在机制。此外,根据生理实验数据,计算IBR来比较3种离子液体的毒性,其毒性顺序为[C6mim]NO3<[C6mim]Br<[C6mim]BF4。
离子液体对于其他农作物的毒性也有报道。有学者研究了5种离子液体及其浓度变化对3种农作物发芽和生长状况的影响[53]。就种子发芽这一生态毒理指标而言,不同作物对离子液体毒性的敏感程度不同,其次序为:黄瓜>玉米>白菜。在一定浓度下,离子液体对白菜、黄瓜和玉米均具有一定的毒害作用。对于所考察的5种离子液体,阴离子为卤素的1-乙基-3-甲基咪唑溴盐([Emim]Br)和1-丁基-3-甲基咪唑氯盐([Bmim]Cl)对植物发芽和生长的抑制作用远大于阴离子为烷基硫酸酯和烷基磷酸酯的同类离子液体1-乙基-3-甲基咪唑硫酸乙酯盐([Emim][ES])、1-丁基-3-甲基咪唑磷酸二乙酯盐([Emim][DEP])和1,3-二甲基咪唑磷酸二甲酯盐([Mmim][DMP])。这种毒性顺序可能与卤素离子对细胞膜较强的穿透能力和由于离子液体的稳定性所造成的阴阳“离子对”的共迁移有关。在3种咪唑基离子液体([C4mim]Cl、[C4mim]BF4和[C8mim]Cl)对玉米幼苗生长性能和生化成分影响[54]的研究中发现,离子液体处理降低了种子的萌发率、根和枝的质量、叶面积、相对含水量和光合色素产量。随着离子液体浓度的增加,玉米幼苗的抗氧化活性降低,因此在离子液体胁迫条件下,玉米幼苗不能有效地清除自由基,从而受到氧化损伤。当离子液体浓度从50 mg·L-1增加到350 mg·L-1时,酚类物质的含量有所增加。从丁基到辛基增加咪唑阳离子上的烷基链长度,会增强离子液体对玉米幼苗生长的危害。高浓度(250 mg·L-1和350 mg·L-1)的离子液体对玉米种子萌发和幼苗生长的危害大小依次为:[C4mim]BF4>[C8mim]Cl>[C4mim]Cl。
1-丁基-3-甲基咪唑六氟磷酸盐([Bmim][PF6])和1-丁基-2,3-二甲基咪唑六氟磷酸盐([BMmim][PF6])取代基数量的差异并不影响其对春大麦和萝卜的毒性大小,对植物的根长和鲜质量抑制作用差异不大[55],但萝卜比春大麦对试验离子液体的抗性更强。离子液体会导致植物体内所有同化色素含量降低,诱导氧化应激,表现为植物体内MDA含量升高,H2O2和抗氧化酶(SOD、CAT和POD)水平发生变化。2种植物氧化应激的最佳生物标志物是叶绿素含量的变化和POD活性的增加。[Bmim][PF6]和[BMmim][PF6]均使春大麦和萝卜体内积累了大量的氟离子,进一步增加了对2种植物的毒性。另一研究中,随着离子液体在土壤中的浓度不断增加,春大麦和萝卜幼苗表现出典型的植物毒性症状。2种植株的茎长和根长均显著降低,鲜质量下降,干质量增加[56]。在春大麦中,对萌发的影响趋势与小麦相同,但对幼苗生长的影响趋势不同,醚基化离子液体的毒性更明显,烷基化在N-3位置的咪唑原子会显著降低阳离子的毒性[57]。
黑麦草作为各地普遍引种栽培的优良牧草,对于放牧业有重要意义。Habibul等[58]研究了不同烷基链长度(如[C2mim]+和[C8mim]+)的咪唑类离子液体对黑麦草的毒性。黑麦草能高效去除这2种离子液体,且[C2mim]+的吸收效率和积累量高于[C8mim]+,证实了植物对离子液体的同化作用取决于离子液体的烷烃链长度。同时,黑麦草吸收的离子液体滞留在根中,其从根向茎的转移受到限制。[C8mim]+对黑麦草的生长抑制作用更强,说明离子液体的长烷基链对植物生长有负面影响。
(2)中药植物
菘蓝作为我国广泛种植的中药植物,暴露于离子液体中,将会影响菘蓝发芽率,其鲜质量、干质量和希尔反应活性,随离子液体浓度的增加而不断降低,呈效应-剂量关系。通过透射电镜观察发现,细胞壁模糊,淀粉颗粒堆积,叶绿体结构受损。这些变化将影响菘蓝的光系统Ⅱ的功能和电子传递效率。植物体内超氧阴离子积累刺激抗氧化酶(SOD、POD和CAT)活性,引起脂质过氧化,MDA含量增加。同时还降低了靛玉红和总黄酮的含量,从而降低了板蓝根的药效作用。最后发现1-丁基-3-甲基咪唑氯盐([C4mim]Cl)毒性大于1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)[59]。
(3)其他植物
拟南芥因为对毒物敏感、自花授粉易培养和基因高度纯合,成为生态毒理研究的理想模式生物。因此,除了农作物和中药植物之外,离子液体对于其他植物的毒性研究主要集中于拟南芥。离子液体不仅会通过破坏拟南芥的细胞结构、生化反应来抑制其生长,还会对其蛋白质表达产生影响。
Jin等[60]用3种离子液体([C8mim]Cl、1-癸基-3-甲基咪唑氯盐([C10mim]Cl)和1-十二烷基-3-甲基咪唑氯盐([C12mim]Cl))对拟南芥进行毒性机理研究。随着离子液体浓度的升高和离子液体烷基链长度的延长,ROS水平升高,导致MDA含量和抗氧化酶(SOD、CAT、谷胱甘肽过氧化物酶(GPX)和POD)活性升高。但高浓度的离子液体可降低SOD、CAT和GPX活性。基于基因本体论(GO)和KEGG通路分析差异表达蛋白,细胞醛代谢过程、线粒体和线粒体呼吸链、谷胱甘肽转移酶和氧化还原酶活性以上调的方式富集,作为拟南芥抵御外界胁迫的防御机制。叶绿体、光合膜、类囊体、核糖体结构成分和跨膜转运蛋白等均作为下调蛋白富集。代谢途径、碳代谢、氨基酸生物合成、卟啉和叶绿素代谢均显著下调。另一研究发现,这3种咪唑氯盐离子液体还会对拟南芥生长和光系统产生影响[61]。根长、鲜质量、细胞膜透性和全株叶绿素含量均显著受胁迫影响。拟南芥叶片背面发生叶脉清净、叶褪绿和褐变现象,且呈剂量-效应关系。随着烷基链长度的增加,[C8mim]Cl和[C10mim]Cl处理均影响光合系统Ⅱ(PSⅡ)的叶绿素荧光参数,阻碍电子转移,破坏光化学能量转换。[C12mim]Cl处理下新生叶片的叶绿素荧光无显著变化,但对衰老叶片有严重影响。[C8mim]Cl、[C10mim]Cl和[C12mim]Cl处理的衰老叶片淀粉颗粒和嗜氧小球数量增多,体积增大,出现胞浆分解和叶绿体肿胀现象,而[C12mim]Cl处理的新生叶片未发生明显损伤,可能是植物启动自身保护机制的结果。除此之外,离子液体还会影响拟南芥幼苗根系向地性[62]。随着离子液体[C6mim]Br浓度的增加,根系生长和重力响应受到显著抑制。[C6mim]Br影响了根冠淀粉体的数量和分布,干扰了生长素外排载体PIN2和PIN3的部署,从而在重力刺激下削弱生长素流动,导致拟南芥幼苗根系向地性不足。
2.2.2 低等植物
由于藻类是淡水食物链中动物所需有机物的主要生产者,它们对于提供和维持其他较高营养水平的能量至关重要。藻类的生命周期很短,能对环境变化做出快速反应,且普遍存在,使其成为毒理学研究的理想生物。研究发现,离子液体会破坏藻细胞结构,影响细胞内的各种功能,抑制藻细胞增殖,使细胞产生氧化应激,最终导致藻细胞死亡,致毒机制如图2所示。
(1)斜生栅藻
离子液体会对斜生栅藻的生长、光合色素含量、叶绿素荧光和细胞超微结构产生影响。3种不同甲基取代基的咪唑氯盐离子液体(1-癸基咪唑氯盐([C10im]Cl)、[C10mim]Cl和1-癸基-2,3-二甲基咪唑氯盐([C10Dmim]Cl))处理显著抑制了藻类的生长。叶绿素a、叶绿素b和总叶绿素含量下降,影响了光合反应。PSⅡ的叶绿素荧光参数,包括最小荧光产量(F0)、PSII潜在效率(Fv/F0)、PSII光化学最大量子效率(Fv/Fm)、光化学量子产量(Y(Ⅱ))和非光化学猝灭系数(NPQ)均受到影响。这说明,离子液体可以破坏PSⅡ,抑制光合作用的初级反应,阻断电子传递过程,导致散热能力的丧失[63]。藻细胞的光合速率和呼吸速率也因离子液体处理而降低。[C10mim]Cl处理后,叶绿体肿胀和层状结构基本消失,淀粉粒和液泡数量均增加。离子液体会增加其细胞膜通透性,对藻类细胞结构有破坏作用[64]。在研究中发现一甲基取代的离子液体的毒性大于非甲基取代的离子液体,非甲基取代的离子液体的毒性大于二甲基取代的离子液体[65]。离子液体会引起斜生栅藻的氧化应激反应[66],ROS水平与离子液体浓度呈正相关。在离子液体处理下,抗氧化酶的活性以及抗坏血酸和谷胱甘肽的含量均发生了浓度依赖性的变化。脯氨酸积累量随离子液体浓度的增加而增加。IBR指数分析表明,8种氧化应激反应指标的毒性顺序为:[C10im]Cl<[C10Dmim]Cl<[C10mim]Cl。蛋白质组学分析表明,离子液体影响了斜生栅藻蛋白质的类型和分布,叶绿体和PSⅡ作为细胞组分受到影响。IBR指数和蛋白质组分析表明,氧化应激反应是离子液体应激的主要生物标志物之一。
有学者证实了1-烷基-3-甲基酒石酸咪唑等手性离子液体对斜生栅藻产生的对映选择性氧化应激[67]。离子液体对藻类具有对映选择性毒性,这种对映选择性最初随着碳链长度的增加而持续存在,但随着碳链长度的增加而不再表现出来,是由于阳离子部分毒性权重的变化[68]。阳离子和阴离子会影响离子液体对斜生栅藻的毒性大小,咪唑类离子液体的生长抑制作用强于吡啶类离子液体,硝酸盐类离子液体和溴化类离子液体的生长抑制作用强于氯类离子液体[69]。
(2)小球藻
1-烷基-3-甲基-咪唑氯盐[Cnmim][Cl] (n=4,6,8)处理小球藻后,藻细胞增殖都受到抑制,但是藻类的细胞大小、复杂性和膜通透性都有所增加。四尾栅藻比小球藻对离子液体的敏感性更低,对离子液体表现出更好的抗性[70]。离子液体对小球藻的毒性随烷基链长度的增加而增加[71],而阴离子对其毒性影响不大。此外,叶绿素a含量和叶绿素荧光参数(Fv/Fm和ΦPSⅡ)的变化表明,离子液体均会破坏藻的光合系统,导致其光合效率降低。可溶性蛋白含量的增加和抗氧化酶活性的提高可能是该藻对离子液体暴露的积极响应机制。当暴露于离子液体时,小球藻中MDA含量显著增加,说明ROS在藻细胞中积累导致藻类生物膜和叶绿体的损伤[72]。2种不同阳离子型离子(1-己基-3-甲基吡啶氯离子([C6Py]Cl)和1-己基-3-甲基咪唑氯离子([C6mim]Cl))会引起小球藻细胞变形、质壁分解、细胞膜和细胞壁损伤,影响细胞器结构。随着离子液体浓度的升高,ROS浓度升高,SOD和CAT活性先升高后降低,表明抗氧化防御系统被激活以对抗ROS。与[C6Py]Cl相比,[C6mim]Cl对小球藻的毒性更大[73]。
(3)羊角月牙藻
对比几种离子液体和传统有机溶剂对羊角月牙藻生长的影响,发现离子液体毒性与培养时间和其结构密切相关,培养时间增加会增加毒性作用。在测试的离子液体中,1-丁基-1-甲基吡咯溴盐的毒性最小,其毒性水平与二甲基甲酰胺相似。尽管离子液体被认为是绿色溶剂,但一般来说,离子液体的毒性比所检测的有机溶剂约大2个或4个数量级[74]。
(4)硅藻
离子液体对硅藻光合作用均有抑制作用,会使得硅藻叶绿素a含量显著降低,PSⅡ反应中心受损,发生显著的生理生化反应,以抵御离子液体对其的损伤作用。例如,可溶性蛋白质含量和SOD和CAT活性显著增加,形成一个保护机制以应对离子液体的毒性[75-76]。阳离子和阴离子的种类会影响离子液体对硅藻的毒性。
2.3 离子液体对动物的毒性(Toxicity of ionic liquids to animals)
目前,在离子液体对动物的毒性研究方面,研究对象主要分为脊椎动物和无脊椎动物。前者包括斑马鱼、泥鳅、鲢鱼、鲤鱼和小鼠等;后者包括蚯蚓、家蚕、水蚤和尖膀胱螺[77]等。在众多研究中发现,离子液体对动物的毒性主要体现在对其的生长、运动行为、发育和遗传等具有不良影响。
2.3.1 离子液体对脊椎动物的毒性
(1)鱼类
离子液体的高水溶性使其容易进入水体,对水生生物造成不利影响。鱼类是水中最为常见的生物,同时也是食物链中重要的一环。离子液体对鱼类的毒性大小受烷基链长度的影响较大。其对鱼类的影响表现为损伤肠道和肝胆健康后,导致鱼类摄食不规律并发生逃逸现象,存在致死和影响胚胎发育的毒性作用[78]。
斑马鱼和人类基因有着87%的高度同源性,这意味着其实验结果大多数情况下适用于人体,可作为模式生物。在离子液体对斑马鱼的急性毒性研究中[79],发现斑马鱼对离子液体具有较高的敏感性。在评估3种离子液体对斑马鱼的毒性时,发现斑马鱼暴露于离子液体28 d后,ROS和MDA含量增加,酶活性特别是SOD活性受到抑制[80]。离子液体的毒性随着碳链长度的增加而增强,但斑马鱼暴露于不同阴离子处理组的50%致死浓度(LC50)值相近,即离子液体对其毒性相近。对1-乙基-3-甲基咪唑离子液体([C2mim]R, R=Cl, Br, BF4)和1-烷基-3-甲基咪唑溴盐([Cnmim]Br,n=2,4,8,10,12)进行毒性研究[81],发现烷基链的长度会影响上述离子液体对斑马鱼毒性大小,且影响作用大于阴离子。在利用死亡率(包括LC50)、致畸性、运动和神经毒性以及孵化率来研究离子液体对斑马鱼胚胎发育的潜在急性毒性[82]时,发现当氯化胆碱([Chol]Cl)的浓度达到200 mg·L-1时,[Chol]Cl对斑马鱼神经肌肉发育有显著影响。除了模式生物鱼之外,也有学者对鲤鱼、鲢鱼等食用鱼以及孔雀鱼等观赏鱼进行离子液体的毒理研究。Chang等[83]发现1-辛基-3-甲基咪唑六氟磷酸盐([C8mim][PF6])可破坏普通鲤鱼的肠道物理屏障、损害免疫屏障并改变肠道微生物群,对鱼的肠道健康状况会产生负面影响,可能对鱼的健康构成严重风险。Ma等[84]用[C8mim]Br处理鲢鱼后,显著提高了鲢鱼体内血清乳酸脱氢酶(LDH)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性,表明[C8mim]Br处理引起了鲢鱼器官损伤。长期暴露还改变了鱼脑、鳃、肠、肾、肝和肌肉中SOD、CAT活性和谷胱甘肽(GSH)水平,增加了MDA水平,可能导致了鱼器官内的氧化应激。进一步研究发现,[C8mim]Br处理提高了红霉素-N-去甲基化酶(ERND)和谷胱甘肽S-转移酶(GST)的活性,这2种酶可能参与了[C8mim]Br在鱼肝脏中的代谢。慢性[C8mim]Br暴露显著促进了诱导型一氧化氮合酶(iNOS)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和核因子-κB(NF-κB)的表达,并改变了转化生长因子-β(TGF-β)的水平,表明离子液体可能导致鱼肝脏炎症。此外,还改变了鱼肝脏中琥珀酸脱氢酶(SDH)活性,促进caspase-9和caspase-3的活性,表明慢性[C8mim]Br暴露也可通过线粒体途径诱导肝细胞凋亡。孔雀鱼在离子液体1-丁基-3-甲基咪唑溴化盐中浸泡96 h后,体内的CAT、GST和SOD等抗氧化酶活性均随离子液体浓度的增加而升高[85]。离子液体对鱼类的致毒机制总结如图3所示。

图3 离子液体对鱼类的毒性机理示意图注:ROS表示活性氧自由基,ILs表示离子液体,MDA表示丙二醛。Fig. 3 Schematic diagram of ionic liquid toxicity to fishNote: ROS stands for reactive oxygen radical, ILs stands for ionic liquids, and MDA stands for malondialdehyde.
泥鳅在河底、田间和湖底等泥水混合物中生存,分布广泛,属于底层鱼类,既会接触水也会接触土壤,有多重渠道接触离子液体。研究表明[C8mim]Cl对泥鳅的胚胎发育四阶段和仔鱼期均具有毒性作用,[C8mim]Cl浓度越高,泥鳅畸形和死亡数目越多[86]。当研究[C8mim]Cl对其肝脏的氧化损伤效应时,发现各浓度组中ROS含量、脂质过氧化物(LPO)在染毒后显著升高,随着暴露时间的延长,谷丙转氨酶(GPT)含量、谷胱甘肽还原酶(GR)活力显著下降,表明[C8mim]Cl对泥鳅肝脏有明显的氧化损伤效应[87]。燕帅国等[88]采用微核试验,发现被1-十六烷基-3-甲基咪唑氯盐([C16mim]Cl)处理过的实验组,红细胞微核率明显升高;酶活性分析实验中,发现离子液体可以提高血清中GPT和谷草转氨酶(GOT)的活性。
(2)小鼠
离子液体对小鼠的毒性研究结果表明,离子液体主要对小鼠的肠道[89]、肝脏和肾脏[90]等器官造成损伤,进而导致小鼠的死亡。相关学者检测了离子液体1-辛基-3-甲基咪唑(M8OI)毒性的靶器官,并确定其为引发肝病原发性胆管炎(PBC)的危险物质[90]。成年雄性C57Bl6小鼠通过2次腹腔注射(时间0和18 h)急性暴露于M8OI,并在24 h检测其作用。终止时在肾脏中观察到局灶性、轻灶性、多灶性和中度变性,随着剂量的增加,其严重程度增加。在小鼠肾脏切片中观察到损伤作用,肾脏切片积累的M8OI水平高于肝脏切片,肝脏切片中M8OI代谢明显更活跃。这些数据表明,腹腔注射M8OI后的靶器官是肾脏。
2.3.2 离子液体对无脊椎动物的毒性
(1)蚕
蚕对于毒物十分敏感[91],其毒性研究大部分集中于家蚕幼虫,因为这直接关系着家蚕的产丝量和产丝品质。Gao等[92]以家蚕幼虫作为一种新对象来评估离子液体的生物毒性。首先从3个家蚕品系中确定对离子液体最敏感的品种。其次用其幼虫比较不同结构离子液体的毒性。离子液体对家蚕幼虫的生长和发育有明显毒性作用,[C8mim]Cl、1-辛基-3-甲基-吡啶氯盐([C8mpy]Cl)和[C8mim]BF4的24 h幼虫半数致死浓度(24 h-LC50)值为112.3、156.3和68.9 μg·g-1,说明阴离子和阳离子类型对离子的毒性有影响。最后观察到,幼虫不同组织发生了明显的生理生化反应。如不同组织的SOD、CAT和POD活性显著升高,形成了缓解离子液体毒性作用的主动保护机制。幼虫MDA含量增加,表明离子液体可引起脂质过氧化和细胞损伤。离子液体[C8mim]Cl可引起家蚕幼虫中肠和丝腺的显著生理生化变化,最终导致幼虫死亡。从分子水平研究这一致毒机制,发现可能是通过线粒体途径和死亡受体启动途径来调控细胞凋亡[93]。
(2)蚯蚓
离子液体溶于水中,随着地表径流、地下径流和降水等作用,部分进入土壤环境,从而对土壤中的动物产生影响。在众多土壤生物中,蚯蚓因为易存活和对土壤环境敏感等优势,成为了主要研究对象。离子液体会对蚯蚓的生理生化反应[94]和繁殖[95-96]产生影响,并具有一定的遗传毒性。咪唑硝酸盐离子液体([Cnmim]NO3(n=4,6,8,10,12))对蚯蚓(赤子爱胜蚓)具有亚慢性毒性[97]。蚯蚓表现出氧化应激和氧化损伤,同时存在烷基链效应和切断效应(发生在C10),且随着浓度的增加,其毒性增强。通过蚯蚓来评价1-烷基-3-甲基咪唑溴化离子液体([Cnmim]Br (n=2,4,6,10,12))对陆地生态系统的毒性时[94]发现,1-乙基-3-甲基咪唑溴盐([C2mim]Br)的毒性最低,随着烷基长度的增加,[C10mim]Br毒性最高,在[C12mim]Br处存在切断效应(毒性降低)。试验结束时,对人工土壤中咪唑离子液体的分析表明,所选离子液体保持相对稳定,变化率<7.39%[97],说明离子液体会在土壤环境中进行累积,难以降解。通过研究1-丁基-3-甲基-咪唑四氟硼酸盐([C4mim]BF4)、[C8mim]BF4和[C8mim]Br对蚯蚓体内ROS含量、酶活性和MDA含量等的影响,进行3种离子液体的生态毒性和遗传毒性评价,发现3种离子液体均可导致蚯蚓机体的氧化胁迫[95]。
(3)水蚤
水蚤生长水域范围广,数量多,是淡水食物链的重要组成部分。水蚤对于不同烷基链长度的离子液体具有不同的敏感程度,离子液体会影响水蚤的生理生化反应,同时对水蚤具有一定胚胎毒性。
当水蚤暴露于咪唑和胆碱离子液体(1-乙基-3-甲基咪唑氯盐([C2mim]Cl)、1-十二烷基-3-甲基咪唑氯盐([C12mim]Cl)和氯化胆碱([Chol]Cl))后,发现[C2mim]Cl和[C12mim]Cl是转录水平上毒性最小和最大的离子液体,表明烷基链是离子液体毒性的驱动因子。每种离子液体的独特基因表达特征也可被识别,揭示其毒性的具体机制[98]。研究中发现,水蚤对[Cnmim]NO3(n=2,4,6,8,10,12)较为敏感[99]。急性毒性实验中,[C6mim]Br暴露后水蚤发育异常,且呈浓度依赖性。[C6mim]Br在水蚤体内具有一定的胚胎毒性。在21 d的慢性暴露中,1.6 mg·L-1的暴露浓度导致水蚤成活率、蜕皮和第一窝数量显著下降。1.6 mg·L-1浓度处理组子代总数显著下降。总的来说,与对照组相比,所有实验组后代的异常情况都显著增加,[C6mim]Br会影响水蚤胚胎发育和繁殖[100],实验中未发现对性别分化的影响。咪唑(IM)、1-甲基咪唑(1MIM)、1-乙基-3-甲基-氯咪唑(1E3MIM)和1-丁基-3-甲基-氯咪唑(1B3MIM) 4种咪唑基离子液体会引起水蚤细胞内的氧化应激[101]。IM和1MIM具有中度慢性毒性,主要影响生殖参数。相反,1E3MIM和1B3MIM表现出更高的慢性毒性效应,导致与对照相比,暴露生物的死亡率显著增加。1E3MIM和1B3MIM的慢性毒性作用在第4代副产品(BPs)中仍然显著,而IM和1MIM的第2代BPs的慢性毒性作用已经可以忽略。离子液体及其BPs对水生生态系统有潜在的风险。
(4)其他
除了水蚤之外,水环境中其他无脊椎动物也会受到离子液体的影响。不同类型咪唑为基础的离子液体会引起四膜虫体内ROS水平升高,从而对四膜虫造成损伤,而谷胱甘肽、半胱氨酸和烟酰胺腺嘌呤二核苷酸(NADH)则会清除ROS,达到解毒目的[102]。NADH的脱毒能力最强,其次是GSH和半胱氨酸。最后,RT-PCR结果显示,金属硫蛋白可能参与了离子液体的解毒。低浓度的咪唑基溴盐离子液体对秀丽隐杆线虫有毒性作用,对其生长、运动行为和发育均有不良影响[103],导致ROS的产生和衰老相关基因的表达[104]。
2.4 离子液体对细胞的毒性(Cytotoxicity of ionic liquids)
离子液体对植物细胞具有毒性作用,例如,离子液体会改变洋葱细胞分裂和核物质,说明离子液体在洋葱遗传水平上具有一定毒性。同时,离子液体对血液淋巴细胞具有基因毒性,证实了其可能对人体细胞具有毒性作用[105],目前较多的研究集中于离子液体对人细胞(正常角质形成细胞HaCaT和肝细胞HepG2[106]以及人宫颈癌细胞Hela)的毒性。总的来说,离子液体会通过改变细胞膜的性质[107]来破坏细胞结构,引起氧化应激反应,抑制细胞生长,甚至导致细胞死亡[108],具有一定遗传毒性。
离子液体[TFSI]对HaCaT和人真皮成纤维细胞均产生了显著的细胞毒性。[TFSI]的细胞毒性可与有毒的传统有机溶剂二甲苯相当。荧光和流式细胞分析显示,暴露于[TFSI]中的细胞发生了细胞死亡。[TFSI]增加了ROS的产生,降低了谷胱甘肽[109],表明离子液体具有潜在的皮肤毒性[110]。
1-十六烷基-3-甲基咪唑氯盐([C16min]Cl)会抑制HepG2生长,降低细胞活力;抑制SOD,降低谷胱甘肽含量,增加细胞MDA水平,并改变细胞周期。此外,[C16min]Cl的诱导改变了p53、Bax和Bcl-2的转录,说明[C16min]Cl会诱导HepG2细胞凋亡[111]。同时对Hela细胞也有类似致毒机制[112],[C10mim]Cl暴露导致Hela细胞膜破裂,线粒体肿胀空泡化,细胞骨架结构呈球形,增加ROS的产生,降低线粒体膜电位,诱导细胞凋亡和细胞周期阻滞。诱导细胞膜结构损伤,影响细胞超微结构的完整性,引起氧化损伤,最终导致细胞增殖的抑制。在[C10mim]Cl处理的细胞中,观察到生化信息的变化,包括不饱和脂肪酸和羰基与脂质、脂质与蛋白质的比值增加,酰胺Ⅰ与酰胺Ⅱ、α-螺旋与β-薄片的比值降低。[C10mim]Cl可影响膜脂烷基链结构和细胞膜流动性,促进脂质过氧化,改变蛋白质二级结构。膜结构是[C10mim]Cl诱导的细胞毒性的关键靶点,膜损伤与[C10mim]Cl诱导的细胞毒性有关[113]。[C8mim]Br暴露可改变HepG2细胞热休克蛋白70(HSP70)和HSP90的蛋白水平,普遍抑制总抗氧化能力(T-AOC),可诱导HepG2细胞的生化紊乱并引起氧化应激。[C8mim]Br诱导的细胞凋亡可能是通过线粒体途径介导的。进一步研究发现,[C8mim]Br暴露增加了肿瘤坏死因子α(TNF-α)的转录和含量,促进了Fas和FasL的表达,TNF-α和Fas/FasL参与了[C8mim]Br诱导的细胞凋亡[114]。长烃链离子液体对HepG2有较强的不利作用。
离子液体引起的哺乳动物细胞死亡是由于它们改变了细胞膜结构的调节和物理性质[115]。另外在填埋场附近发现了具有不同水平的1-辛基-3-甲基咪唑(M8OI)的土壤,这可能引发人类的自身免疫性肝病[116]。
除了对人体细胞的毒性之外,有报道发现,离子液体对模型革兰氏阳性菌和革兰氏阴性菌(分别为蜡样芽孢杆菌和大肠杆菌)具有细胞毒性作用。离子液体对革兰氏阳性菌和革兰氏阴性菌表现出不同程度的毒性,由于离子液体与细胞膜之间的相互作用不同,离子液体对革兰氏阳性细菌表现出更高的毒性[117]。
通过MTT细胞活力测定,获得离子液体对HEK-293和C6细胞的细胞毒性数据。以四氟硼酸为阴离子的离子液体和以苯环为阳离子的离子液体相比,具有较强的毒性[118]。离子液体未直接抑制线粒体复合物Ⅰ~Ⅳ或复合物Ⅴ (F0F1-ATPase)。甲基咪唑离子液体具有线粒体电子受体的功能,很容易与线粒体内膜整合,并接受电子链上的电子,从而导致氧化应激[108]。
[C2mim]Br对草地贪夜蛾细胞的毒性作用与其结构、浓度和暴露时间长短有关。观察到[C2mim]Br诱导的细胞凋亡的形态学特征,如细胞收缩、卷曲、凋亡小体、固缩和核碎裂等[119]。当离子液体含有长烷基链时,由于其较高的亲脂性,细胞毒性更强[120]。
为了解离子液体在分子水平上的细胞毒性,Jing等[107]研究了离子液体与脂质双分子层作为模型细胞膜的相互作用。离子液体可以通过插入和扰乱脂质双分子层,末端覆盖脂质双分子层的疏水边缘,并最终在高浓度下瓦解脂质双分子层。离子液体的插入引起脂质双分子层的肿胀,与离子液体的阳离子烷链和阴离子的疏水性有很强的依赖性,并与离子液体的细胞毒性有很强的相关性。
2.5 离子液体对酶的毒性(Toxicity of ionic liquids to enzymes)
酶作为生物催化剂,参与生物体内的许多化学反应,它们发挥着关键作用。离子液体对于酶的毒性表现在改变酶原本的结构,抑制其活性,使酶失去它的功能。
咪唑离子液体对脱氢酶活性具有抑制作用,且抑制作用随着烷基取代基链长的增加而增加[121]。胰蛋白酶活性也会受到离子液体的抑制[122],且抑制程度与离子液体的化学结构密切相关。初步分析表明,离子液体的疏水性是离子液体-胰蛋白酶(IL-trypsin)相互作用的驱动力之一。通过分析胰蛋白酶在离子液体存在下的荧光行为,得到了其热力学参数、吉布斯自由能变化(ΔG)、焓变(ΔH)和熵变(ΔS)。ΔH和ΔS均表明,氢键是IL-trypsin相互作用的主要驱动力。评价离子液体的毒性时,应综合考虑离子液体的氢键能力和疏水性[122]。另有学者报道了不同离子液体对南极假丝酵母脂肪酶(candida antarctica lipase)[123]、乳酸脱氢酶(LDH)[124]和乙酰胆碱酯酶(AChE)[125]酶活性的毒性效应。
2.6 离子液体对DNA的毒性(DNA toxicity of ionic liquids)
离子液体对DNA的毒性研究较少,目前有以斑马鱼肝细胞、蚯蚓细胞、涡虫细胞以及HepG2细胞内的DNA为对象,进行离子液体毒性研究的实验。awniczak 等[36]根据斑马鱼肝细胞中OTM值的大小判断DNA损伤程度。发现暴露于3种离子液体中的斑马鱼的OTM值随浓度和时间的增加而增加。但不是所有的离子液体的浓度都与OTM的值正相关,例如,[MOEmim]BF4浓度与DNA损伤之间没有显著的剂量效应关系。实验组在第7天和第14天的OTM值与对照组相比略有升高。各实验组的OTM值在第28天均有所增加,且高浓度处理组的OTM值大于低浓度处理组。综上所述,离子液体对斑马鱼的DNA会产生不同程度损伤。还有学者用[C4mim]BF4、[C8mim]BF4和[C8mim]Br这3种离子液体对蚯蚓进行遗传毒性研究,表明离子液体均可导致蚯蚓的体腔细胞DNA损伤[95]。除了动物之外,离子液体对于微生物的细胞DNA也会造成损伤,例如,[C8mim]Br会损伤涡虫的DNA,对其也具有遗传毒性[126]。同时,人体细胞中的DNA也不例外,[C16min]Cl会诱导HepG2中DNA损伤和凋亡[111]。
3 总结和展望(Summary and outlook)
本文在简单介绍离子液体的结构与性质之后,阐述了不同种类的生物及其小分子结构,包括微生物(费氏弧菌等)、植物(小麦、水稻、蚕豆、拟南芥和藻类等)、动物(鱼类、小鼠、蚯蚓和蚕等)、细胞(正常角质形成细胞HaCaT、肝细胞HepG、人宫颈癌细胞Hela和草地贪夜蛾细胞等)、酶(脱氢酶、胰蛋白酶等)和DNA暴露于不同种类的离子液体后,对其生物生长发育、遗传繁殖、组织器官、细胞结构和生命小分子等产生的毒性效应。探明离子液体对生物的致毒机制,有利于合理安全地使用离子液体,避免离子液体对生态环境造成影响,使其真正成为“绿色溶剂”。
基于目前对于离子液体生态毒理的研究,未来离子液体在生物方面的研究可能会从小型、简单的生物,向大型、复杂的生物发展。动物和植物还将是研究的主体,而细胞水平的研究将会随着科技的进步越来越丰富和深入,创建环境友好离子液体毒理研究数据库,完善该方面的研究。同时未来在研究离子液体毒理的基础上,合理环保地开发和使用离子液体将成为一个新的研究热点。

