扑草净胁迫对四角蛤蜊解毒相关基因表达的影响
刘丽娟,姜向阳,刘慧慧,黄会,宫向红,何金霞,刘小静,王玮云,张秀珍
山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,烟台 264006
扑草净(prometryn)化学名称为4,6-双异丙胺基-2-甲硫基-1,3,5-三嗪,分子式为C10H19N5S,是一种高效低毒的内吸型除草剂,在农业生产中主要用于防除一年生禾本科及阔叶草[1]。美国、巴西和加拿大等分别将扑草净作为除草剂或杀虫剂用于农业生产;不过为避免扑草净对环境、人类和动物造成潜在的健康风险,欧盟自2004年起禁止其作为农药销售和使用[2];在我国,扑草净不仅在农业中广泛应用于防除杂草,还在水产养殖中用于清除大型藻类[3],但由于其在鱼体内代谢情况不明,无法对食品安全性进行评价,2010年水产用扑草净粉被列入中华人民共和国农业部《兽药试行标准废止目录》(公告第1435号)[4]。
扑草净在20 ℃水中溶解度为33 mg·L-1,属于低水溶性,不易渗入土层下面,并且其化学性质稳定,半衰期长,难降解,容易随着降水、淋溶和径流的作用由土壤迁移入水体[5],扑草净残留在国内外海洋环境中常有检出[6-10]。2012年以来,日本在从中国进口的海水贝类中多次检出扑草净残留超过基准值(0.01 mg·kg-1)[11-12]。我国7个省份多种养殖水产品中检出扑草净[13],水环境中扑草净残留对水生生物的影响受到广泛关注。谢剑等[14]和王田田等[15]先后研究了扑草净对不同海洋生物的急性毒性;田秀慧等[16]、刘丽娟等[17]和张望等[18]研究发现,刺参、菲律宾蛤仔和文蛤均对养殖海水中的扑草净有一定富集效应;Stará等[19-20]和黄会等[21]研究发现,水体中的扑草净对鲤鱼、克氏原螯虾和四角蛤蜊抗氧化酶活性产生影响。但在mRNA水平上的研究不足,迄今为止尚未见扑草净对水生生物的基因表达影响研究。
本文以我国沿海重要海水滩涂养殖贝类四角蛤蜊(Mactraveneriformis)为实验对象,根据项目组2018年对黄河口海域除草剂污染调查结果,海水中扑草净平均检出浓度为0.24 μg·L-1,最高检出浓度1.09 μg·L-1,设计3个实验浓度0.2、1.0和10.0 μg·L-1并开展胁迫试验,经筛选以肌动蛋白β-Actin基因作为参比基因[22-23],研究了不同浓度扑草净胁迫下,四角蛤蜊6个解毒相关基因:超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、谷胱甘肽S-转移酶(glutathione S-transferase, GST)、细胞色素P450第四亚族(cytochrome P450, CYP4)和金属硫蛋白(metallothionein, MT)基因表达随时间变化的规律,首次从mRNA水平揭示了扑草净对水生生物的生理影响,探讨了其致毒机理,以期为海洋生态环境保护提供依据。
1 材料与方法(Materials and methods)
1.1 材料与试剂
四角蛤蜊取自东营市黄河口滩涂贝类养殖区,体质量(8.38±0.51) g,壳长(4.10±0.38) cm。小新月菱形藻藻种来自山东省海洋资源与环境研究院藻种室。养殖用海水取自烟台近海,盐度30±1,pH 7.9~8.1,经砂滤后使用。
扑草净标准品(纯度>98.0%),德国Dr. Ehrenstorfer公司;M-MLV Reverse Transcriptase (Promega);SYBR®Premix Ex TaqTM(Tli RNaseH Plus) (Takara);dNTP Mix (Takara);RNase Inhibitor (BBI);TRIzol (Invitrogen);实验用引物均由华大基因合成;实验用水均为灭菌一级水。
1.2 方法1.2.1 扑草净胁迫实验
扑草净胁迫实验参考刘丽娟等[17]的方法。选择健康、完整的四角蛤蜊,经新鲜海水清洗干净后,在实验条件下暂养7 d,连续充气,每天定时换海水1次、投喂实验室培养的小新月菱形藻藻液4次,及时清除死亡及状态不佳个体。
依据本项目组2018年4月、7月和10月开展的黄河口贝类增养殖区海水中除草剂污染特征调查结果,海水中扑草净平均检出浓度为0.24 μg·L-1,最高检出浓度1.09 μg·L-1,设计扑草净胁迫浓度为0.2、1.0和10.0 μg·L-1。实验设置3个实验组和1个对照组,每组3个平行水箱,每个实验水箱内注入新鲜海水100 L,实验组加入扑草净储备液至质量浓度为0.2、1.0和10.0 μg·L-1,对照组仅加相同体积的助溶剂乙醇,各放入经暂养的健康四角蛤蜊100 只,实验水温(15±1) ℃。采用半静态水质接触染毒法,每24 h换一半相同扑草净质量浓度的海水。
1.2.2 取样与cDNA制备
分别在胁迫实验开始6、24、48、96、144、240、360和504 h取样,每次从每个实验平行水箱内随机取四角蛤蜊3只,放于冰盘上解剖,从每只贝取等量消化腺、鳃丝组织,按组织分别放入标记清楚的2.0 mL冻存管中混匀密封,液氮冷冻,-80 ℃保存。
保存的样品用冷冻研磨仪液氮研磨成粉末,取适量用Trizol法提取总RNA,核酸测定仪测定总RNA浓度,选择A260/A280>1.8且A260/A230>1.8的样品,按照M-MLV Reverse Transcriptase使用说明进行反转录。转录后的cDNA稀释10倍,保存于-20 ℃作为qPCR模板备用。
1.2.3 引物设计与筛选
实验所用引物均为自行设计,由华大基因合成。参考鲍相渤等[23]和曹滕飞等[24]对海洋贝类内参基因研究方法,选择β-肌动蛋白(beta-Actin,β-Actin)、甘油醛-3-磷酸盐脱氢酶(glyceraldehydes-3-phosphate dehydrogenase, GAPDH)、β-微管蛋白(beta-tublin,β-Tub)、转录延伸因子1α(elongation factor 1α, EF1α)、亲环素A(cyclophilin A, CPA)、泛素蛋白(ubiquitin protein, UQP)和18S核糖体RNA(18S rRNA) 7种基因作为备选管家基因。按照本项目组对四角蛤蜊消化腺转录组测序结果,用Primer Premier 6.0软件分别设计7种基因的特异性引物。以对照组、1.0 μg·L-1、10.0 μg·L-1扑草净胁迫48 h的四角蛤蜊消化腺、鳃样品cDNA稀释50倍,分别作为模板进行qPCR检测,用geNorm软件进行参比基因筛选[23]。选择20≤Ct值≤30的基因进行稳定性排序,消化腺中各基因稳定性β-Tub=β-Actin>GAPDH>UQP>18SrRNA,鳃中各基因稳定性β-Actin=18SrRNA>GAPDH>β-Tub,因此选择β-Actin作为本实验的参比基因。
CAT基因克隆参考常悦[25]的方法,从NCBI蛋白库中搜索CAT的双壳软体动物的蛋白核苷酸序列,用j-CODEHOP设计兼并引物,用兼并引物对四角蛤蜊cDNA进行PCR扩增、产物纯化、克隆、测序、产物测序、BLAST比对,获得四角蛤蜊CAT基因序列。从NCBI Genbank中搜索获得四角蛤蜊β-Actin、SOD、CYP4、GSH-Px、MT和GST等6个基因mRNA的cDNA序列,用Primer Premier 6.0软件分别设计特异性引物。
选择qPCR熔解曲线峰值单一、Ct值≤30的引物,进行扩增效率测定。反转录产物经4倍梯度稀释,共设5个系列浓度,测定每种基因的引物扩增效率,筛选R2≥0.99、扩增效率为90%~110%的引物,用于后续qPCR研究。相关引物如表1所示。

表1 四角蛤蜊解毒相关基因的荧光定量PCR引物Table 1 Primers used for qPCR analysis of genes related to detoxification
1.2.4 指标测定
以β-Actin为参比基因,采用2-△△ct法进行qPCR相对定量。每个样品设3个重复,20 μL反应体系包括:SYBR®Premix Ex TaqTM(2×) 10 μL、上下游引物(10 μmol·L-1)各0.4 μL,cDNA模板2 μL、ddH2O 7.2 μL。qPCR反应条件为94 ℃预变性3 min,94 ℃变性15 s,53 ℃退火15 s,72 ℃延伸20 s(采集荧光信号),共计40个循环。扩增完成后根据扩增曲线情况人工调节基线阈值,分析每个样品、基因的相对表达量(relative quantity, RQ)值。
1.2.5 数据处理与分析
用Excel软件进行数据统计,所有数据均以3个平行组数据的平均值表示。用SPSS 20.0软件进行单因素方差(ANOWA)分析和Duncan’s多重比较,分析数值的差异显著性。以胁迫时间为横坐标,参考栾伟[26]的方法稍加改动,以目的基因相对表达量的对数值log2(RQ)为纵坐标,用WPS office软件分析作图。其中0.2 μg·L-1扑草净胁迫504 h和1.0 μg·L-1扑草净胁迫240 h的四角蛤蜊消化腺样品总RNA质量不符合要求,未进行后续qPCR测定分析。
2 结果(Results)
2.1 扑草净对四角蛤蜊SOD基因表达的影响
由图1可知,四角蛤蜊消化腺中,扑草净胁迫6 h、24 h时3个实验组SOD表达量均显著上调(P<0.01),且1.0 μg·L-1组表达量高于其他2组;48 h及以后各实验组均以下调为主,总体呈波动变化趋势并逐渐接近对照组。0.2、1.0和10.0 μg·L-1组均在6 h时上调量最高,表达量分别达对照组的7.4倍、24.6倍和14.1倍;最大下调量分别为对照组的0.160倍(48 h)、0.340倍(96 h)和0.019倍(48 h)。

图1 扑草净胁迫下四角蛤蜊消化腺(a)、鳃(b)组织SOD mRNA相对含量注:数据(0 μg·L-1)=0,数据>0表示基因表达量上调,数据<0表示基因表达量下调;*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异显著(P<0.01)。Fig. 1 Relative quantity of SOD mRNA in digestive gland (a), gill (b) of Mactra veneriformis after prometryn exposureNote: Data (0 μg·L-1)=0, data>0 indicates increased expression level, and data<0 indicates decreased expression level; *indicates a significant difference compared with the control group (P<0.05), and **indicates a significant difference compared with the control group (P<0.01).
鳃中,胁迫6 h时3个实验组四角蛤蜊SOD表达量均有所上调,但仅有10.0 μg·L-1组上调显著(P<0.01),表达量为对照组的4.9倍;24 h时1.0 μg·L-1组上调显著,表达量为对照组的3.3倍,其他2组下调;48 h及以后各实验组均以下调为主,总体呈波动变化趋势并逐渐接近对照组。0.2、1.0和10.0 μg·L-1组下调最大值分别为对照组的0.150倍(24 h)、0.043倍(96 h)、0.10倍(48 h)。
2.2 扑草净对四角蛤蜊CAT基因表达的影响
由图2可知,扑草净胁迫下,四角蛤蜊消化腺CAT表达量总体呈现先上调后下调的变化规律,其中,6 h、24 h时3个实验组CAT基因表达量均显著上调(P<0.01),且1.0 μg·L-1组表达量高于其他2组;48 h及以后各实验组均以下调为主且呈波动变化。扑草净胁迫6 h时,0.2、1.0和10.0 μg·L-1组CAT基因表达量均上调至最大值,分别达对照组的29.1倍、48.0倍和20.2倍;下调最大值分别为对照组的0.13倍(48 h)、0.12倍(504 h)和0.004倍(48 h)。
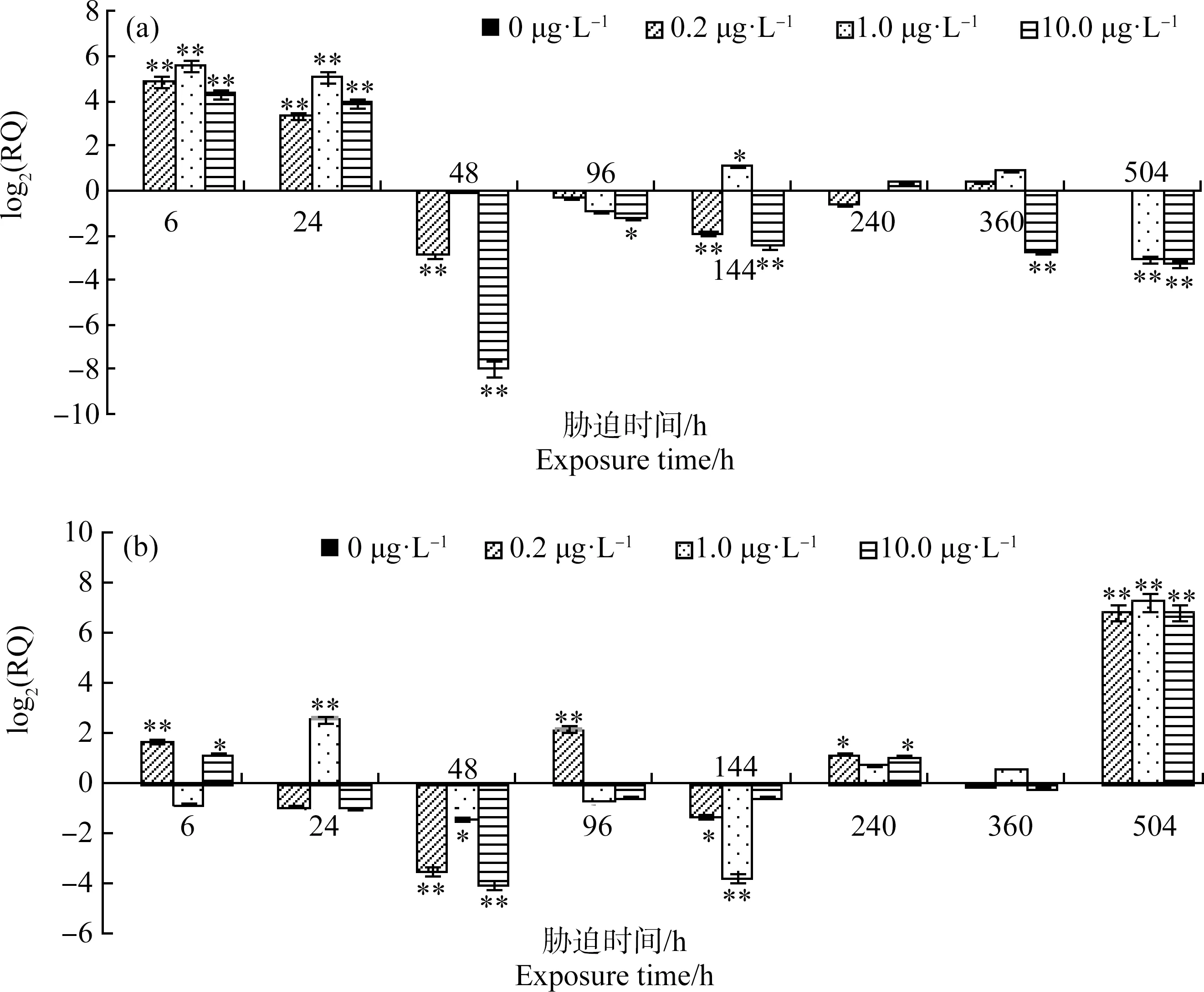
图2 扑草净胁迫下四角蛤蜊消化腺(a)、鳃(b)组织CAT mRNA相对含量注:数据(0 μg·L-1)=0,数据>0表示基因表达量上调,数据<0表示基因表达量下调;*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异显著(P<0.01)。Fig. 2 Relative quantity of CAT mRNA in digestive gland (a), gill (b) of Mactra veneriformis after prometryn exposureNote: Number (0 μg·L-1)=0, number >0 indicates increased expression level, number <0 indicates decreased expression level; *indicates a significant difference compared with the control group (P<0.05), **indicates a significant difference compared with the control group (P<0.01).
鳃中,扑草净胁迫6 h,0.2 μg·L-1组CAT基因表达量显著上调(P<0.01),1.0 μg·L-1组有所下调但与对照组差异不明显、10.0 μg·L-1组显著上调;24 h时,0.2 μg·L-1和10.0 μg·L-1组CAT基因表达量有所下调但与对照组差异不明显,1.0 μg·L-1组显著上调(P<0.01);随着胁迫时间的延长,各实验组CAT基因表达量不断上下波动,0.2、1.0和10.0 μg·L-1组上调最大值均出现在504 h,分别为对照组的112.1倍、151.9倍和112.2倍,下调最大值分别为对照组的0.091倍(48 h)、0.074倍(144 h)和0.061倍(48 h)。
2.3 扑草净对四角蛤蜊GSH-Px基因表达的影响
由图3可知,扑草净胁迫下,四角蛤蜊消化腺GSH-Px表达量总体呈现先上调后上调的变化规律,其中,6 h、24 h时3个实验组GSH-Px基因表达量均显著上调(P<0.01),之后以下调为主。0.2、1.0和10.0 μg·L-1组上调最大值分别为对照组的4.0倍(6 h)、5.0倍(24 h)和4.3倍(24 h);下调最大值均低于对照组的0.001倍(144、360和504 h)。

图3 扑草净胁迫下四角蛤蜊消化腺(a)、鳃(b)组织GSH-Px mRNA相对含量注:数据(0 μg·L-1)=0,数据>0表示基因表达量上调,数据<0表示基因表达量下调;*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异显著(P<0.01)。Fig. 3 Relative quantity of GSH-Px mRNA in digestive gland (a), gill (b) of Mactra veneriformis after prometryn exposureNote: Number (0 μg·L-1)=0, number >0 indicates increased expression level, number <0 indicates decreased expression level; *indicates a significant difference compared with the control group (P<0.05), **indicates a significant difference compared with the control group (P<0.01).
鳃中,扑草净胁迫6 h,0.2 μg·L-1组GSH-Px基因表达量显著上调(P<0.01),1.0 μg·L-1和10.0 μg·L-1组有所上调但与对照组差异不明显;24 h时,0.2 μg·L-1和10.0 μg·L-1组均显著上调,1.0 μg·L-1组GSH-Px基因表达量不明显下调;随着胁迫时间的延长,各实验组GSH-Px基因表达量不断上下波动,0.2、1.0和10.0 μg·L-1组上调最大值分别为对照组的22.4倍(360 h)、6.4倍(240 h)和207.3倍(504 h);下调最大值分别为对照组的0.008倍(504 h)、0.02倍(504 h)和0.01倍(48 h)。
2.4 扑草净对四角蛤蜊GST基因表达的影响
由图4可知,消化腺中,扑草净胁迫6 h,3个实验组GST基因表达均上调,且上调量随着扑草净浓度的升高而下降,GST基因相对表达量(RQ)与胁迫浓度(ρ)呈显著相关关系:ρ=86.688RQ5.445(R2=0.9616)。0.2、1.0和10.0 μg·L-1组上调最大值分别为对照组的3.155倍(6 h)、2.241倍(360 h)和2.143倍(240 h);下调最大值分别为对照组的0.053倍(48 h)、0.461倍(48 h)和0.036倍(360 h)。
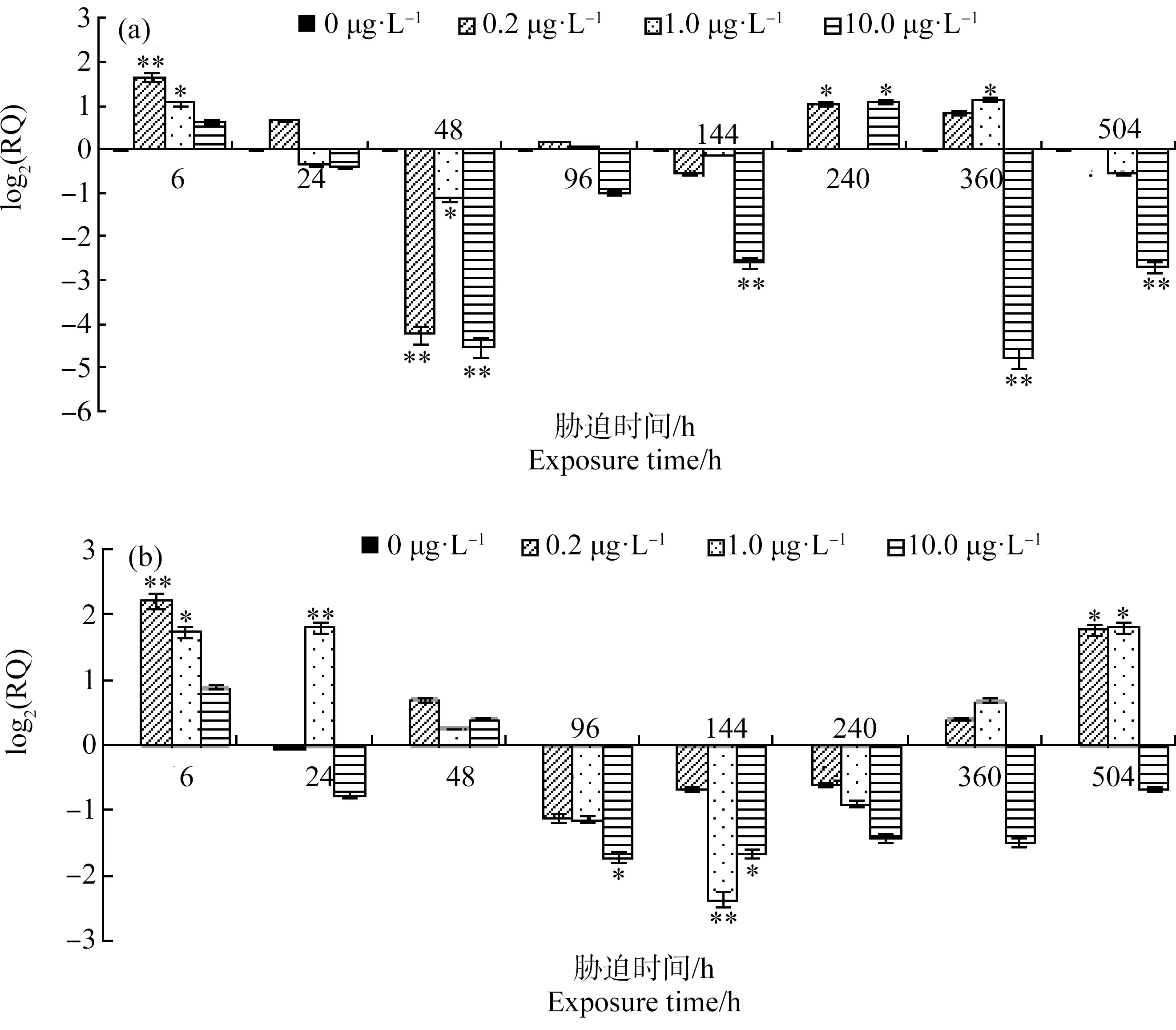
图4 扑草净胁迫下四角蛤蜊消化腺(a)、鳃(b)组织GST mRNA相对含量注:数据(0 μg·L-1)=0,数据>0表示基因表达量上调,数据<0表示基因表达量下调;*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异显著(P<0.01)。Fig. 4 Relative quantity of GST mRNA in digestive gland (a), gill (b) of Mactra veneriformis after prometryn exposureNote: Number (0 μg·L-1)=0, number >0 indicates increased expression level, number <0 indicates decreased expression level; *indicates a significant difference compared with the control group (P<0.05), **indicates a significant difference compared with the control group (P<0.01).
鳃中,扑草净胁迫6 h,3个实验组GST基因表达均上调,且上调量随着扑草净浓度的升高而下降,GST基因RQ值与胁迫浓度(ρ)呈显著相关关系:ρ=146.53RQ4.262(R2=0.9963)。0.2、1.0和10.0 μg·L-1组上调最大值分别为对照组的4.605倍(6 h)、3.459倍(24 h)和1.856倍(6 h);下调最大值分别为对照组的0.463倍(96 h)、0.195倍(144 h)和0.308倍(96 h)。
四角蛤蜊GST基因表达调控与扑草净胁迫浓度相关:胁迫6 h消化腺和鳃的GST相对表达量与胁迫浓度呈显著相关关系;且在扑草净胁迫24、96和360 h,消化腺GST基因表达均表现为0.2 μg·L-1促进、10.0 μg·L-1抑制;扑草净胁迫24、360和504 h,鳃的GST基因表达均表现为1.0 μg·L-1促进,10.0 μg·L-1抑制,有低浓度促进、高浓度抑制现象。因此认为四角蛤蜊GST基因有作为扑草净污染分子标记的潜质。
2.5 扑草净对四角蛤蜊CYP4基因表达的影响
由图5可知,3个实验组中,四角蛤蜊消化腺和鳃组织CYP4基因表达量均显著下调至一个低值(P<0.01),然后逐步上升,升高到一定程度后逐渐下降,然后又上升,总体呈现反复波动变化趋势。
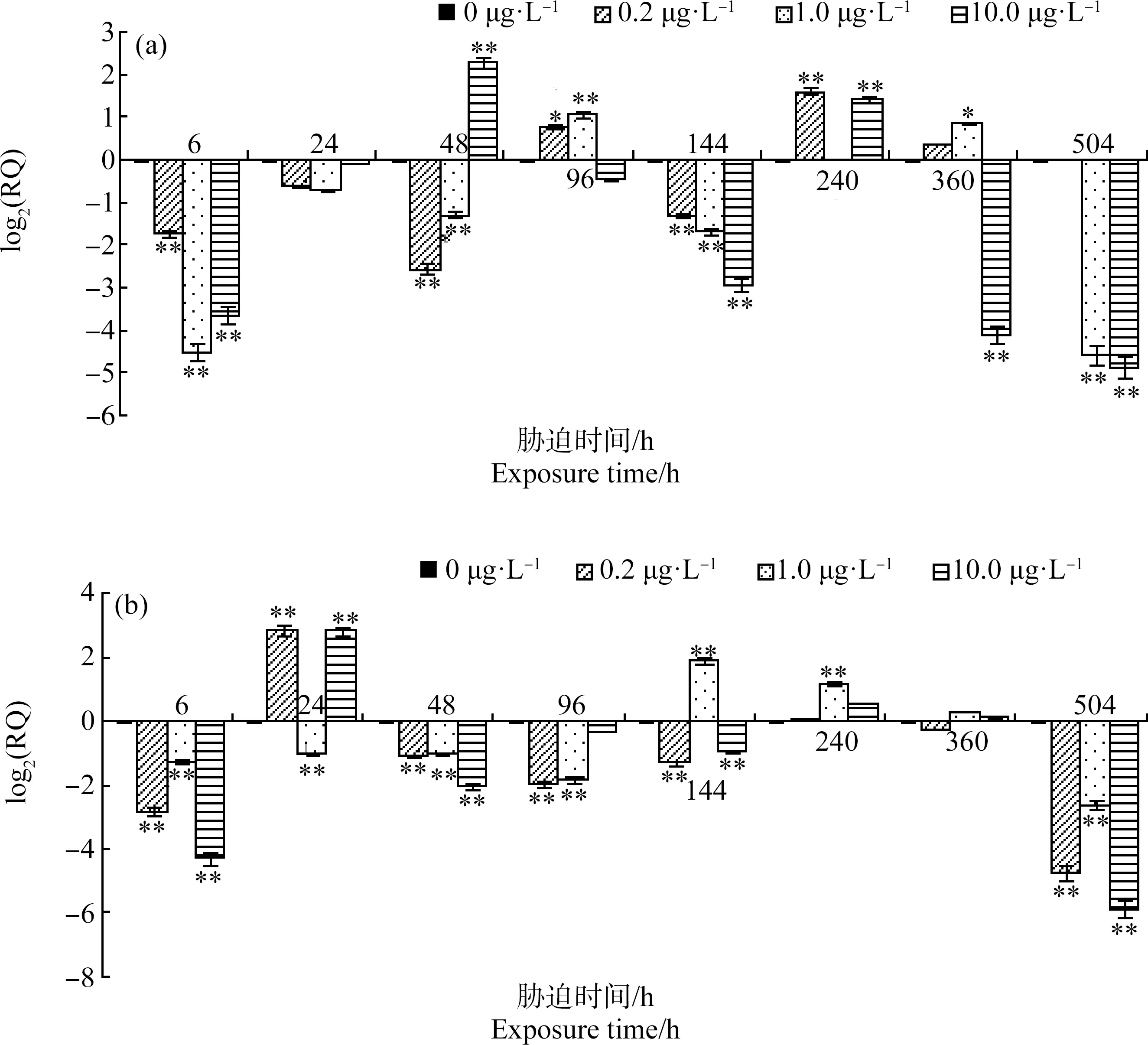
图5 扑草净胁迫下四角蛤蜊消化腺(a)、鳃(b)组织CYP4 mRNA相对含量注:数据(0 μg·L-1)=0,数据>0表示基因表达量上调,数据<0表示基因表达量下调;*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异显著(P<0.01)。Fig. 5 Relative quantity of CYP4 mRNA in digestive gland (a), gill (b) of Mactra veneriformis after prometryn exposureNote: Number (0 μg·L-1)=0, number >0 indicates increased expression level, number <0 indicates decreased expression level; *indicates a significant difference compared with the control group (P<0.05), **indicates a significant difference compared with the control group (P<0.01).
消化腺中,扑草净胁迫6 h时3个实验组CYP4基因表达量均显著下调(P<0.01),且1.0 μg·L-1组表达量低于其他2组;0.2、1.0和10.0 μg·L-1组下调最大值分别为0.303倍(6 h)、0.042倍(504 h)和0.034倍(504 h);上调最大值分别为对照组的3.078倍(240 h)、2.102倍(96 h)和4.896倍(48 h)。
鳃中,胁迫6 h时3个实验组CYP4基因表达量均显著下调(P<0.01),其中1.0 μg·L-1组表达量高于其他2组;0.2、1.0和10.0 μg·L-1组下调最大值均出现在504 h,分别为0.038倍、0.164倍和0.017倍;上调最大值分别为对照组的7.282倍(24 h)、3.720倍(144 h)和7.220倍(24 h)。
2.6 扑草净对四角蛤蜊MT基因表达的影响
由图6可知,扑草净胁迫6 h,3个实验组四角蛤蜊消化腺中MT基因表达量均上调,其中1.0 μg·L-1组表达量显著上调且达到最大值(P<0.01),为对照组的3.292倍。0.2 μg·L-1和10.0 μg·L-1组在整个实验过程中上调均不显著。0.2、1.0和10.0 μg·L-1组下调最大值分别为对照组的0.267倍(144 h)、0.413倍(504 h)和0.084倍(48 h)。
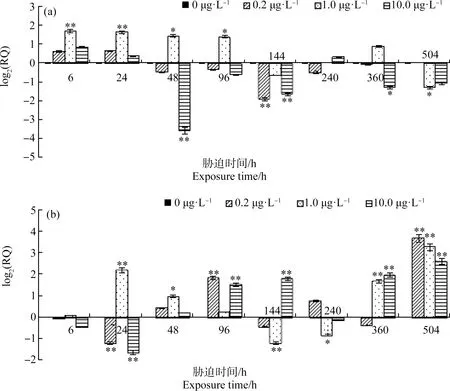
图6 扑草净胁迫下四角蛤蜊消化腺(a)、鳃(b)组织MT mRNA相对含量注:数据(0 μg·L-1)=0,数据>0表示基因表达量上调,数据<0表示基因表达量下调;*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异显著(P<0.01)。Fig. 6 Relative quantity of MT mRNA in digestive gland (a), gill (b) of Mactra veneriformis after prometryn exposureNote: Number (0 μg·L-1)=0, number >0 indicates increased expression level, number <0 indicates decreased expression level; *indicates a significant difference compared with the control group (P<0.05), **indicates a significant difference compared with the control group (P<0.01).
鳃中,扑草净胁迫6 h,MT基因表达均无显著变化;24 h,1.0 μg·L-1组表达量显著上调(P<0.01),而0.2 μg·L-1和10.0 μg·L-1组显著下调(P<0.01)。0.2、1.0和10.0 μg·L-1组上调最大值均出现在504 h,分别为对照组的12.764倍、9.569倍和6.104倍;下调最大值分别为对照组的0.430倍(24 h)、0.436倍(144 h)和0.322倍(24 h)。
3 讨论(Discussion)
3.1 四角蛤蜊应对扑草净胁迫解毒代谢相关基因表达调节分析
细胞色素P450(cytochrome P450, CYP)酶系是一个超基因家族,参与多种亲脂外源物和内源物质在生物体内的转化与代谢过程,在解毒和激活食物链中的卤代、非卤代烃中起着重要的作用[27]。CYP4是CYP家族中的一个重要亚族。有研究表明,持久性有机污染物(persistent organic pollutants, POPs)进入生物体细胞内后,其中一部分与受体蛋白结合进入细胞核内,介导Ⅰ相代谢酶基因如CYP4基因的表达,将污染物转化为更具极性的代谢中间产物,诱导Ⅱ相代谢酶基因如GST-pi的表达,加速代谢物排出体外[28]。GST催化外源化合物分子或经第Ⅰ相反应的代谢产物以及氧化应激引起亲脂性过氧化损伤化合物与还原型谷胱甘肽(glutathione, GSH)的巯基(—SH)结合,保护生物大分子免受侵袭[29]。与多
氯联苯(PCB)对翡翠贻贝CYP4基因表达具有显著的诱导作用不同[30],在扑草净胁迫实验过程中,最初四角蛤蜊消化腺和鳃组织中CYP4基因相对表达量呈现显著下调(P<0.01),而后其表达量反复上下波动变化。可能是由于污染物不同,对四角蛤蜊CYP基因家族中不同亚族的基因表达影响不同所致,具体规律需开展进一步研究。胁迫实验开始后,四角蛤蜊消化腺和鳃组织GST基因表达均先上调,而后呈现以下调为主的波动变化趋势,相同实验组不同组织中表达量变化不完全同步,但均显示GST有作为扑草净对四角蛤蜊污染的生物标志物的潜力。
许多外源性化学物质是通过诱导机体产生大量活性氧,从而诱发其多种损伤。生物体的抗氧化防御系统在消除活性氧、降低机体损伤方面发挥着重要作用。扑草净胁迫24 h,四角蛤蜊消化腺中3种重要的抗氧化酶SOD、CAT和GSH-Px基因表达均被显著诱导(P<0.01),而同时检测的SOD、CAT酶活性无显著变化,GSH-Px酶活性被显著诱导[20],显示生物体中的基因表达调控与酶活性调控不同步,二者没有明确的对应关系。0.2 μg·L-1和1.0 μg·L-1扑草净胁迫下,四角蛤蜊的消化腺组织中SOD基因表达量最高分别达对照组的7.4倍和24.6倍,而SOD酶活性诱导率最高为29.0%和34.9%[20],基因表达水平的变化程度比酶活性变化显著,可见与蛋白水平相比,基因的表达水平是更为灵敏的污染物暴露作用的生物标记物[31]。SOD、CAT、GSH-Px和MT是抗氧化防御系统的重要成员,其中SOD可催化超氧阴离子与氢离子反应生成过氧化氢,从而解除活性氧对机体的损伤[32];CAT催化H2O2分解为H2O与O2,在减轻活性氧自由基对机体细胞的氧化损伤方面起着重要作用[33];GSH-Px可清除机体内的H2O2及脂类氢过氧化物,防止细胞膜和其他生物组织免受过氧化损伤[34];MT是一类分子量较小的富含巯基和半胱氨酸的蛋白质,对多种重金属具高亲和性,在体内具有显著和广谱的抗氧化作用效果。扑草净胁迫实验中,四角蛤蜊消化腺呈现SOD、CAT、GSH-Px和MT基因表达均先上调,而后呈现以下调为主的波动变化趋势;鳃中,SOD、GSH-Px基因表达均先上调,1.0 μg·L-1组的CAT基因表达先下调其他组先上调,MT基因表达先上调其他组先下调,而后反复波动变化。因此推断扑草净胁迫使四角蛤蜊体内产生活性氧,诱导了抗氧化防御系统相关基因表达,这是生物体适应环境变化的一种应急性解毒措施。随着扑草净胁迫时间的延长,四角蛤蜊不同组织中抗氧化防御系统的部分基因表达受到不同程度的抑制,可能导致机体抗氧化能力下降,引起机体对环境中其他威胁的防御能力下降。
本研究发现,相同实验时间不同浓度扑草净胁迫下,四角蛤蜊相同组织的同一基因表达调节趋势不尽相同,分析认为由于生物体解毒代谢是一个动态调节的过程,基因表达调节与底物种类、浓度、胁迫时间和代谢产物浓度等因素密切相关,该结果与菲律宾蛤仔对扑草净的生物富集规律研究结果一致[17]。扑草净胁迫504 h,3个实验组四角蛤蜊鳃组织的CAT、GSH-Px、CYP4和MT基因,和消化腺组织的CAT、GSH-Px和CYP4基因相对表达量与对照组相比均出现显著变化(P<0.01)。黄会等[21]研究发现,在0.2、1.0和10.0 μg·L-1扑草净胁迫下15 d和21 d时,四角蛤蜊鳃组织形态与对照组相比均发生不同程度变化,且时间-效应和浓度-效应明显。因此认为,长时间扑草净胁迫超出四角蛤蜊抗氧化防御系统调节能力,导致其组织结构损伤,从而引起部分组织的基因表达调控异常。
3.2 以贝类解毒基因作为扑草净污染生物标记物在近岸海域研究中应用的可行性
研究发现,四角蛤蜊的基因表达调控对扑草净胁迫十分敏感,即使在最低胁迫浓度0.2 μg·L-1,所测6种解毒有关基因表达量均在短时间内发生变化。徐雄等[35]调查了我国8个重点流域水体农药污染情况,扑草净的检出率达59.3%,浓度范围ND~104.2 ng·L-1;张望等[36]对海州湾沿岸水体调查结果显示,扑草净检出率80%,浓度最大值31.9 ng·L-1;乔丹[37]调查发现乳山湾、东营河口区和东营广饶县海域海水中扑草净最高值分别为342、538和196 ng·L-1;郑磊等[38]调查南四湖流域扑草净在地表水中广泛存在,浓度介于0~667.7 ng·L-1之间,且推导扑草净水环境基准值为82.4 ng·L-1。本项目组在黄河口贝类增养殖区调查发现,海水中扑草净检出率为100%,平均检出浓度0.24 μg·L-1,最高检出浓度1.09 μg·L-1。可见我国近岸海域扑草净残留广泛存在,山东近岸多个监测点扑草净质量浓度远高于水环境基准值,且足以对四角蛤蜊基因表达产生影响,证明以双壳贝类解毒代谢相关基因作为扑草净污染生物标记物,在近岸海域研究中的应用具有可行性。本研究填补了在mRNA水平上扑草净对海洋生物影响研究的空白,为评价扑草净残留对海洋生态环境安全风险提供了参考依据。

