澄迈冬季蔬菜种植区地表水体中新烟碱类杀虫剂的分布特征、影响因素及其生态风险评估
谭华东,王传咪,吴秋敏,崔艳梅,武春媛,#
1. 中国热带农业科学院环境与植物保护研究所,海口 571101 2. 国家农业环境儋州观测实验站,儋州 571737 3. 海南大学热带作物学院,海口 570228 4. 华中农业大学资源与环境学院,武汉 430070
新烟碱类杀虫剂(neonicotinoid insecticides, NNIs)属植物内吸性杀虫剂,可有效地防治蓟马、蚜虫、白粉虱和叶蝉等刺吸式口器害虫,是全世界使用最广泛一类新型杀虫剂。目前,NNIs有超过120个国家注册使用,占全球杀虫剂市场销售的25%[1]。近10年来,已报道NNIs可造成严重的生态环境负面效应,如可对水生无脊椎动物个体生理生化和群体行为造成不利影响,甚至影响整个水生生态系统的结构和功能[2-3]。加之,NNIs具有环境伪持久性、随水流远距离迁移和生物毒性等特点,能够在食物链与食物网中传递,可对人体健康造成不利影响[4-5]。
NNIs广泛用于种子包衣处理和虫害防治,据估算其中有超过80%~90%的NNIs是直接进入到土壤环境中,且随着灌溉、地表降水和淋滤等方式持续污染周围环境介质[6]。研究显示,NNIs在水体中被普遍检出,如Mahai等[7]在长江中游水中检出6种NNIs,其中吡虫啉(imidacloprid, IMI)与啶虫脒(acetamiprid, ACE)检出率高达100%;有26.7%水体超过荷兰规定IMI水质标准(0.0083 μg·L-1),呈现显著的水生生物风险。Chen等[8]对我国主要水系河口处水体中7种NNIs进行分析,普遍检出IMI、氯噻啉和噻虫嗪(100%),且NNIs总浓度处于0.00896~1.8627 μg·L-1,其中有27%和84%水体超过急性和慢性生态风险的阈值。近年来,越来越多研究证实NNIs也存在于其他环境介质中,如沉积物[9-11]、土壤[11-12]、大气颗粒物[13]、蔬菜[14]、人体头发[12]和尿液[15]等,呈现极高的检出率。因此,NNIs的多介质污染已成为全球重要的环境问题。然而,关于NNIs水体污染的报告大多来自发达国家和中国温带及亚热带等地区,仅少有研究关注我国热带农业区,且仅涉及IMI、ACE报道[16-17]。
海南澄迈县农业发达,稻菜轮作普遍,冬季盛行蔬菜种植,是我国冬季蔬菜重要的来源地之一[16, 18]。该区域地处热带地区,病虫害频发,NNIs是该区域冬季蔬菜种植过程中首要使用的杀虫剂类型。随着高频次、大量应用,NNIs可能会持续残留水体中,将对产地环境安全构成潜在威胁,但目前尚未对该区域水体中NNIs污染进行系统调查,且对其生态毒理效应知之甚少[16-17]。本研究旨在通过调查澄迈县冬季蔬菜种植区地表水中5种常见NNIs残留特征与其空间分布规律,利用冗余分析识别分布特征关键影响因素,同时利用物种敏感度分布(species sensitivity distribution, SSD)评估NNIs在水生生态系统中的生态风险。据我们所知,这是第一份系统记录澄迈县农业区地表水体中NNIs赋存和风险评估的研究报告,该研究结果将为区域农药管理与风险管控提供有用信息。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
1.1.1 仪器设备
超高液相色谱三重四极杆串联谱仪(ACQUITY UPLC-Xevo TQ-S,Waters公司,美国),配有ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);电子天平(Mettler XS205,梅特勒-托利多仪器(上海)有限公司,中国);OA-sys氮吹仪(Organomation公司,美国);台式冷冻离心机(Centrifuge 5417R,Eppendorf公司,德国);HPLC级甲醇、乙腈、二氯甲烷(dichloromethane, DCM)购买自Thermo Fisher公司(美国);Milli-Q纯水(Milli-pore,美国)。其他常规化学试剂(分析纯)均购买麦克林生化科技有限公司(上海,中国)。
1.1.2 试剂材料
啶虫脒(ACE;99%)、噻虫胺(clothianidin, CLO;99%)、噻虫啉(thiacloprid, THA;99%)、吡虫啉(IMI;99%)和噻虫嗪(thiamethoxam, THM;99%)标准品均购自Aladdin试剂有限公司(上海,中国)。氘代物噻虫胺-d3(clothianidin-d3, CLO-d3)、吡虫啉-d4(imidacloprid-d4, IMI-d4)和噻虫嗪-d3(thiamethoxam-d3, THM-d3)作为内标物(纯度≥98%)购自C/D/N同位素公司(魁北克,加拿大)。
1.1.3 色谱分析条件
采用Waters-ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),柱温为30 ℃,进样量5 μL,流动相A 乙腈,流动相B 0.2%甲酸铵溶液;流速0.20 mL·min-1。梯度洗脱程序为:0~2.0 min,20% A;3.0~4.0 min,90% A;4.0~5.0 min,90%~20% A;5.0~6.0 min,20% A。运行时间6.0 min。
离子源为电喷雾离子源(electrospray ionization, ESI)正离子模式;离子源温度为150 ℃;毛细管电压为3.2 kV;雾化器用N2;脱溶剂温度为500 ℃;脱溶剂气流量为1 000 L·h-1;锥孔气为150 L·h-1;多离子反应监测模式(multiion reaction monitoring, MRM)。5种目标物质及内标物的质谱参数及测定方法特性如表1所示。
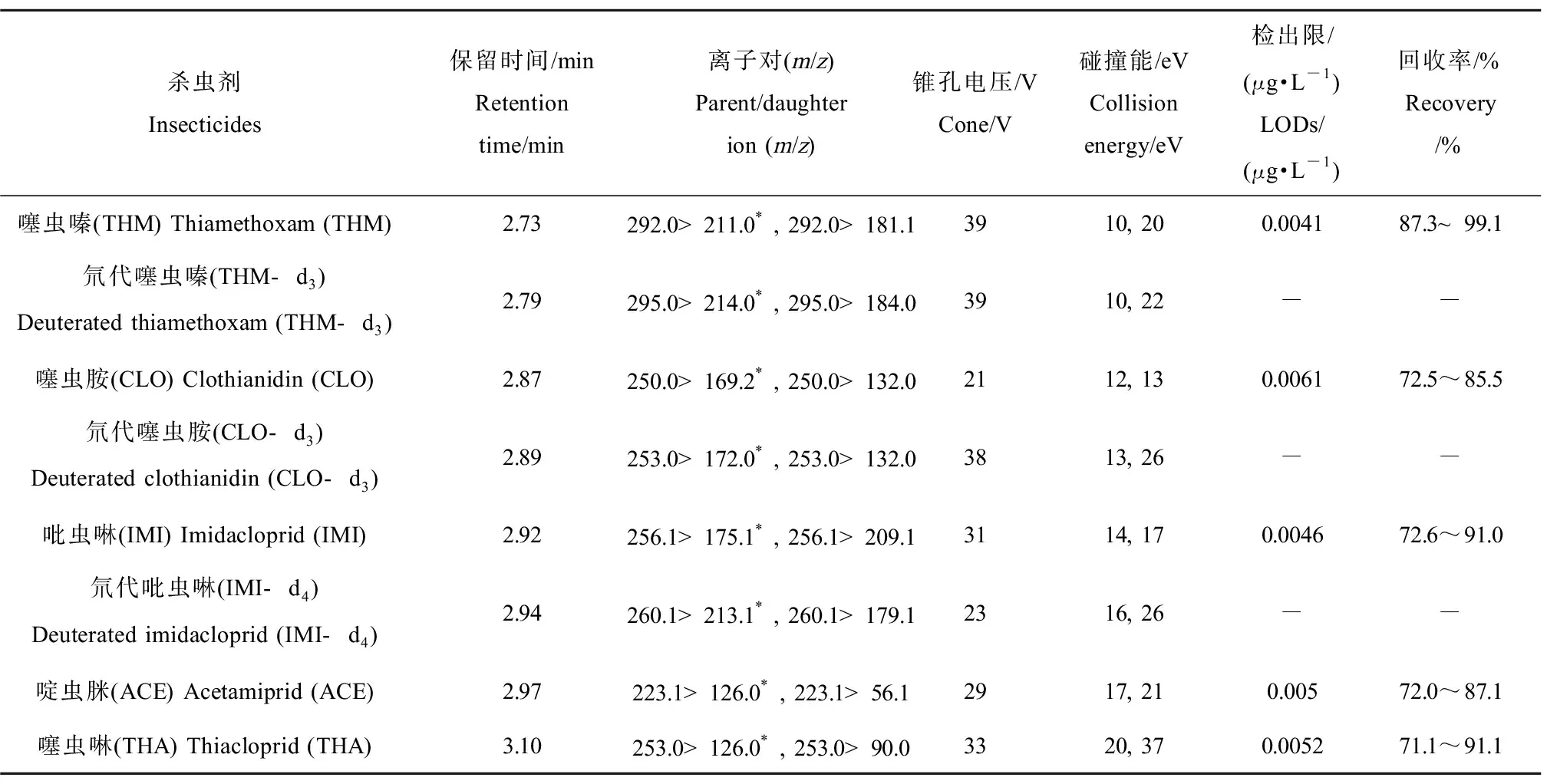
表1 5种新烟碱类杀虫剂(NNIs)物质及3种内标物的质谱参数和方法特性Table 1 Mass spectra parameters of neonicotinoid insecticides (NNIs) and their three deuterated compound and analytical performance of the used method
1.2 样品采集
于海南澄迈县(109°00' E~110°15' E,19°23' N~20°00' N)冬季蔬菜种植区设置28个采样点位(S1~S28),如图1所示。采样过程中,采集水面下方10~20 cm处水样,将河流/沟渠入水口、中间段和出水口处水样等体积混合,取1 L水于棕色玻璃瓶内,采样时间为2020年1月。采样点经纬度及当季种植作物如表2所示。
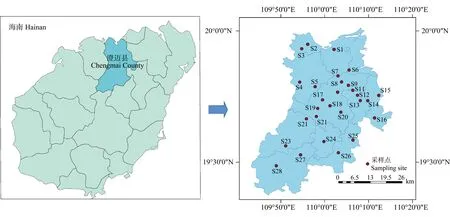
图1 采样示意图Fig. 1 Sampling sites of Chengmai County
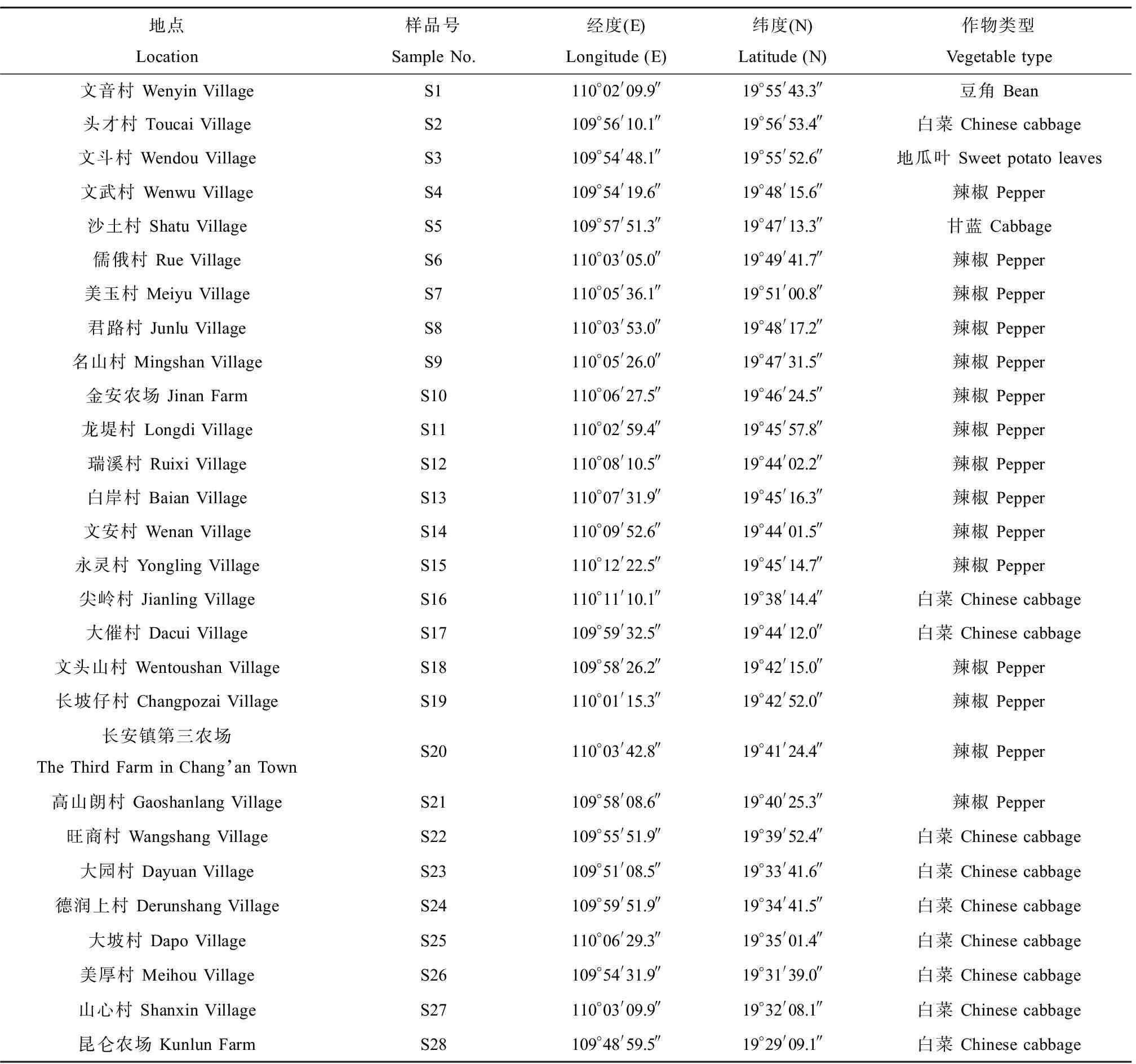
表2 采样点位经纬度与当季种植作物Table 2 Longitude and latitude of sampling sites and crops type planted in the field
1.3 样品前处理
参考文献[19]方法对水体中NNIs进行检测,即使用DCM通过液-液萃取来提取水样中的NNIs。实验过程为:将10 μL内标物(1 000 μg·L-1)加入到30 mL的水样中,加入2.0 g NaCl,溶解混匀。加入10 mL DCM震荡提取1 min,重复萃取3次。合并所有提取液,加入3 g无水硫酸钠干燥,并以4 000 r·min-1离心5 min,将所有上清液旋转蒸发至近干。采用1 mL乙腈复溶,经0.22 μm尼龙滤膜过滤,转移至色谱瓶中以待UPLC-MS/MS分析。
1.4 水体理化性质分析
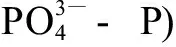
1.5 质量保证和质量控制(QA/QC)
在样品分析过程中,采用方法空白、加标空白和平行样进行质量保证和质量控制,即实验过程中每14个样品设置3个平行基质空白样和3个平行基质加标回收样。采用内标法定量,校正曲线相关系数均≥0.9915。加标空白水样预处理后无目标物检出。基质效应不显著,纯水加标样品中NNIs回收率处于为71.1%~91.1%(表1)。以信噪比(S/N)为3和10分别计算方法检出限(limits of detection, LODs)和定量限(limit of quantitations, LOQs),目标物LOQs和LODs分别为0.0041~0.0061 ng·L-1和0.0123~0.0183 μg·L-1。实验过程中玻璃器皿如锥形瓶、梨形瓶等先用乙醇溶液中浸泡,再用去离子水反复清洗,于105 ℃烘干后使用。
1.6 风险评估方法
参考文献[19]中的生态风险评估(ecological risk assessment, ERA)方法评估NNIs的水生生态风险,即SSD曲线和风险商(risk quotient, RQ)联合评估。评估过程为:先通过文献及美国ECOTOX数据库(https://cfpub.epa.gov/eco-tox/)获取目标物的急性与慢性毒性效应数据(包括半最大效应浓度(concentration for 50% of maximum effect, EC50)/半致死浓度(semilethal concentration, LC50)和最大无影响浓度(NOEC)),采用数学模型(log-normal、log-logistic、Sigmoid和Gaussian等)拟合构建SSD曲线,并获得曲线中的5%危害质量浓度(hazardous concentration for 5% of the species, HC5)值。其次,采用评估因子法计算无效应浓度(predicted no effect concentration, PNEC; μg·L-1),即PNEC=HC5/FA,FA为评估因子(取值范围为1~5)。基于“最坏情况”原则,FA取值5进行计算。最后,利用RQ评估生态风险程度。RQ计算公示为RQ=MEC/PNEC,其中MEC为实际测定化合物浓度,PNEC为无效应浓度。当RQ<0.1时,表示风险较低;当0.1≤RQ≤1时,表示存在一定的风险;当RQ>1时,表明存在不可接受的风险,急需风险消减措施与方案。
因NNIs在分子结构、理化性质及作用效应具有相似性,使用相对效能因子法(relative potency factor, RPF)[7, 21-22]将水样中总体NNIs暴露效应均转化为IMI等效暴露效应(IMIeq),计算如公式(1)所示,每一种NNI的RPF值来源于文献[22]。因此,以IMI毒性数据SSD曲线通过IMIeq来评估水体中NNIs的复合生态风险。
IMIeq=∑NNIi×RPFi=IMI+THM×9.5+
THA×14.3+CLO×5.82+ACE×0.8
(1)
式中:IMIeq是以IMI为等效当量总的NNIs累积暴露水平(μg·L-1),NNIi是第i个NNI的浓度(μg·L-1)。
1.7 数据统计分析
2 结果与讨论(Results and discussion)
2.1 NNIs的赋存与组成特征
研究区域水体中NNIs的残留浓度和检出频率显示(表3),NNIs总浓度(∑5NNIs)范围为0.30 μg·L-1(S3)至14.70 μg·L-1(S13)(中位数2.30 μg·L-1,平均浓度3.38 μg·L-1),水体中100%检出NNIs。IMI浓度范围为0.04 μg·L-1(S5)至12.7 μg·L-1(S13),检出中位数浓度均最大,占总浓度的70.5%,均高于ACE、THM和CLO,是水体中最主要的NNI残留种类。同样地,ACE浓度为0.05 μg·L-1(S17)至6.30 μg·L-1(S24),中位数浓度低于IMI,占总浓度的17.9%,也是水体中主要的NNI残留种类。THA在水体的检出浓度最低(中位数浓度0.01 μg·L-1),检出频率仅为10.7%。值得注意的是,除了THA外,所有水体中检出的浓度均高于美国设定的0.010 μg·L-1慢性阈值[22-23],表明NNIs污染普遍存在于冬季蔬菜种植周围地表水体中。此外,利用加拿大“水生生物保护水质指南:吡虫啉”(0.230 μg·L-1,CCME,2007)[24]评价NNI污染,观察到78.6%、50%水样中IMI、ACE残留浓度超过CCME指导值,显示研究区域水体面临较高的生态风险。
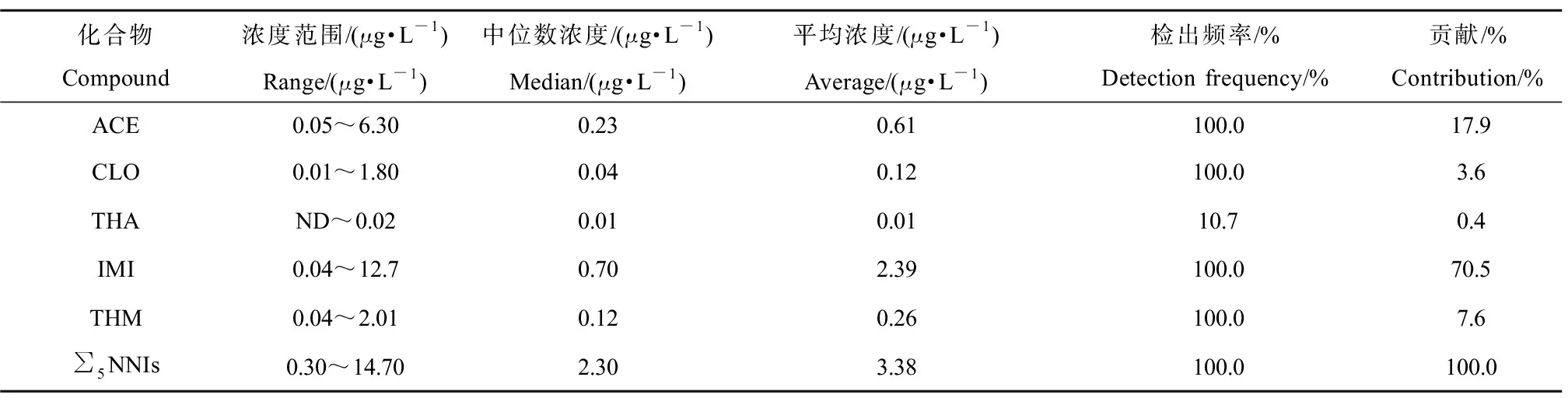
表3 澄迈冬季蔬菜种植区周围地表水体中NNIs残留浓度Table 3 Concentrations of NNIs in surface water from winter vegetable planting area in Chengmai County
就单体贡献而言,平均贡献顺序为:IMI(70.5%)>ACE(17.9%)>THM(7.6%)>CLO(3.6%)>THA(0.4%),其中IMI和ACE占NNIs总浓度达85%以上,显示水体中IMI和ACE是主要NNIs污染物。一方面,IMI是研究区域冬季蔬菜种植过程中最早使用的NNIs种类,且持续使用多年,易长期残留水体中(水体、水体-沉积物中半衰期(DT50)为30 d、129 d[25]);ACE也是冬季蔬菜种植中经常使用的NNIs种类,自2006年注册使用以来,已逐步成为与IMI使用相当的NNIs种类。另一方面,因冬季温度适宜、蔬菜密集种植,该区域虫害高发,IMI和ACE是当地农户偏好使用的NNIs类型(价格低廉且防虫效果好),使用极为频繁,二者通过作物种子处理或者直接叶面喷施,并随着农户灌溉用水、天气降水进入到周围水体中。这些因素都极有可能造成该区域水体呈现IMI和ACE普遍残留。此外,在研究水体中也观察到一定含量的THM、CLO等NNIs的类型,平均浓度贡献为7.7%和3.6%,这可以部分解释为其注册使用较晚且使用没有IMI和ACE频繁所致。
研究区域水体中IMI浓度最高,其次是ACE和THM,三者呈现较高检出频率与我国长江、珠江流域水体和松花江中报告非常相似(近100%检出)[9-11, 22]。这也显示研究水体中受到了第一代NNIs(IMI、ACE)和第二代NNIs(THM、CLO)的影响,这与我国大部分地区包括热带地区的NNIs经历了极为相似市场化销售模式和农药使用历史密切相关。此外,澄迈县农资店销售情况调查也证实ACE、IMI和THM是主要的使用种类,三者占据了当前注册销售>85%以上NNIs活性成分和制剂,而其他如CLO、THA构成的数量较少,这也解释了为什么ACE、IMI和THM是该区域水体中常见的NNIs残留种类,而CLO、THA检出浓度低或较少检出,这与我国长江、珠江流域水体中主要的NNIs残
留种类一致[9-11]。就残留水平及检出情况而言,该区域水体中面临更严重的NNIs污染,原因在于冬季蔬菜种植过程中NNIs既参与拌种也作为叶面喷施,且因冬季降雨不足较多依靠人工灌溉,这直接增加了种植过程中NNIs进入到周围水体,形成高残留和高检出。
从检出浓度来说,检出NNIs总浓度(0.30~14.70 μg·L-1,平均浓度3.4 μg·L-1,中位数2.3 μg·L-1)远高于美国中西部玉米、大豆种植区域水体(∑6NNIs中位数浓度0.0092 μg·L-1)[26]和澳大利亚悉尼农业区水体(∑5NNIs浓度0.06~4.5 μg·L-1,平均浓度0.118 μg·L-1)[27]及菲律宾稻田和附近水体(甜豌豆、水稻、香蕉和柑橘周围水体中NNIs平均浓度为未检出(ND)、0.00318、0.00318和0.00541 μg·L-1)[12],低于美国南部高原农业种植区水体(ACE、THM平均浓度为2.3、3.6 μg·L-1)[28]和加拿大玉米种植期周围地表水体(NNIs浓度范围0.01~63 μg·L-1,CLO和THM平均浓度为4.6、7.7 μg·L-1)[29]。此外,水中NNIs组成类似于我国南方主要河流水体[9-11, 17]和松花江水体[22],IMI、ACE和THM为优势物质,但这显著不同于美国中西部玉米、大豆种植区域水体(以CLO和THM为主)[26]和加拿大魁北克省玉米种植周围水体(以THA和IMI为主,而ACE和CLO检出较少)[29]。总体而言,澄迈冬季蔬菜种植周围水体中呈现中等程度的NNIs污染。
2.2 NNIs空间分布特征
地表水体中NNIs空间分布情况显示(图2),∑5NNIs、NNI单体之间空间分布呈现一定的差异。对于ACE(图2(a)),东部地区呈现最高残留,其次是中部区域,污染水平最低为西北区域。对于CLO(图2(b)),中部地区呈现最高残留,其次西南地区,东北部地区污染最低。对于IMI(图2(c)),中部地区的污染最为严重,其次是东北、西南区域,污染水平最低的是西北区域,分布特征与∑5NNIs分布高度相似,这与IMI是水体中主要的NNIs残留种类且贡献占比超过70%密切相关。对于THM(图2(d)),最高污染出现中部地区,其次东北和西南区域,污染水平最低出现在西北区域。对于THA,有少数污染出现在西北和东部区域,其他区域呈现较低污染,显示澄迈冬季蔬菜种植过程中THA使用较少,这与其他NNIs种类明显不同。值得注意的是,就分布区域来说,ACE、IMI和THM在空间分布上具有较高的空间一致性,整体呈现由中部地区向周围区域污染降低的趋势,最低污染出现在西北区域,且与∑5NNIs相一致,这与IMI、ACE和THM是主要的NNIs种类结果一致。
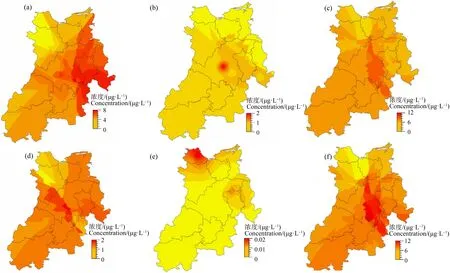
图2 澄迈县冬季蔬菜种植区地表水体NNI的空间分布特征注:(a) ACE;(b) CLO;(c) IMI;(d) THM;(e) THA;(f) ∑5NNIs。Fig. 2 Spatial distribution of individual NNI and their total concentration in surface water around winter vegetable planting area from Chengmai CountyNote: (a) ACE; (b) CLO; (c) IMI; (d) THM; (e) THA; (f) ∑5NNIs.
研究区域呈现IMI、ACE和THM、∑5NNIs在中部地区(集中规模化种植区,单一蔬菜种植面积>13.3 hm2)较东北、东南(中等或者分散种植区域,单一蔬菜种植面积<6.67 hm2)和西南地区(分散种植,单一蔬菜种植面积<3.33 hm2)更为严重。这可能与该区域冬季蔬菜种植规模和农民农药使用方式(包括使用偏好)和交通运输等有关。实地调研显示,澄迈县中部地区(S6~S20)呈现集中且大面积冬季蔬菜种植,是澄迈县主要的冬季蔬菜种植区域(以农场种植和农户大规模种植为主)。该区域处于海南第一大河流南渡江流域,且靠近322国道,河流灌溉用水和交通方便,是澄迈县重要的冬季蔬菜供应地。在施药行为上,该区域采用无人机与人工喷药相结合的方式防治高发的病虫害,而其他区域(种植面积中等且部分较为分散,单一蔬菜种植面积<6.67 hm2),以个体农户种植为主)多数采用人工喷药,可能导致水体中NNIs污染较中部区域低。
2.3 NNIs分布的影响因素分析
2.3.1 理化性质
NNIs在研究区域水体中呈现较高的检出浓度、检出频率可能与冬季蔬菜种植过程中田间大量使用NNIs防治害虫有关,同时也与NNIs这些物质本身具有较高的水溶性、亲水特性密切相关,这些特性使得田间土壤中的NNIs能够随水流快速迁移到周围水体中[5, 9-11]。根据NNIs的溶解度(solubility in water,Sw)、辛醇-水分配系数(octanol-water partition coefficient, logKow)与水体中半衰期(half-degradation time in water, DT50)(数据来源Pesticide Properties DataBase),Sw呈现THM(4 100 mg·L-1)>ACE(2 950 mg·L-1)>IMI(610 mg·L-1)>CLO(340 mg·L-1)>THA(184 mg·L-1)、NNIs亲水性(logKow)顺序为THM(-0.13)>IMI(0.57)>ACE(0.8)>CLO(0.905)>THA(1.26)和水体中持久性呈现THA(1 000 d)>CLO(40.3 d)>THM(30.6 d)>IMI(30 d)>ACE(4.7 d),这与本研究水体中NNIs污染呈现IMI>ACE>THM>CLO>THA(表2)顺序均不一致,显示除了NNIs的理化性质外,其他因素如蔬菜种植类型和水质参数也会影响到水体中NNIs的残留特征[10-11, 17]。
2.3.2 蔬菜种植种类
根据当季种植蔬菜特点,评估NNIs残留与作物之间的关系。Mann-Whitney U检验结果表明∑5NNIs残留浓度(平均浓度,中位数浓度)呈现为辣椒(3.890 μg·L-1,2.340 μg·L-1)>白菜(2.690 μg·L-1,0.84 μg·L-1)>豆角(1.520 μg·L-1,1.127.7 μg·L-1)>地瓜叶(0.30 μg·L-1,0.205 μg·L-1)(图3),这显示不同蔬菜种植周围水体中NNIs的残留浓度不同,表明当季种植蔬菜及相应的虫害防治影响了到周围水体中的NNIs残留水平。然而,不同作物种植下水体中NNIs的主要残留种类相同,揭示该区域农户在防治虫害上选择NNIs种类偏好较一致。值得注意的是,地瓜叶种植周围水体中THA残留较其他蔬菜不同,显示地瓜种植过程中有一定量的THA用于虫害防治。另外,中部地区有辣椒、白菜种植(有规模化种子包衣或拌种处理与叶面喷施(>333.3 hm2),普遍人工灌溉),直接反映了市场需求,而其他地区主要是白菜、豆角和地瓜叶等,反映的是个体农户自己对蔬菜的需求,种植规模总体较小。因此,这些特点造成了农药施加频率和使用量中部区域远高于其他地区,进而导致中部区域NNIs残留高于其他区域。
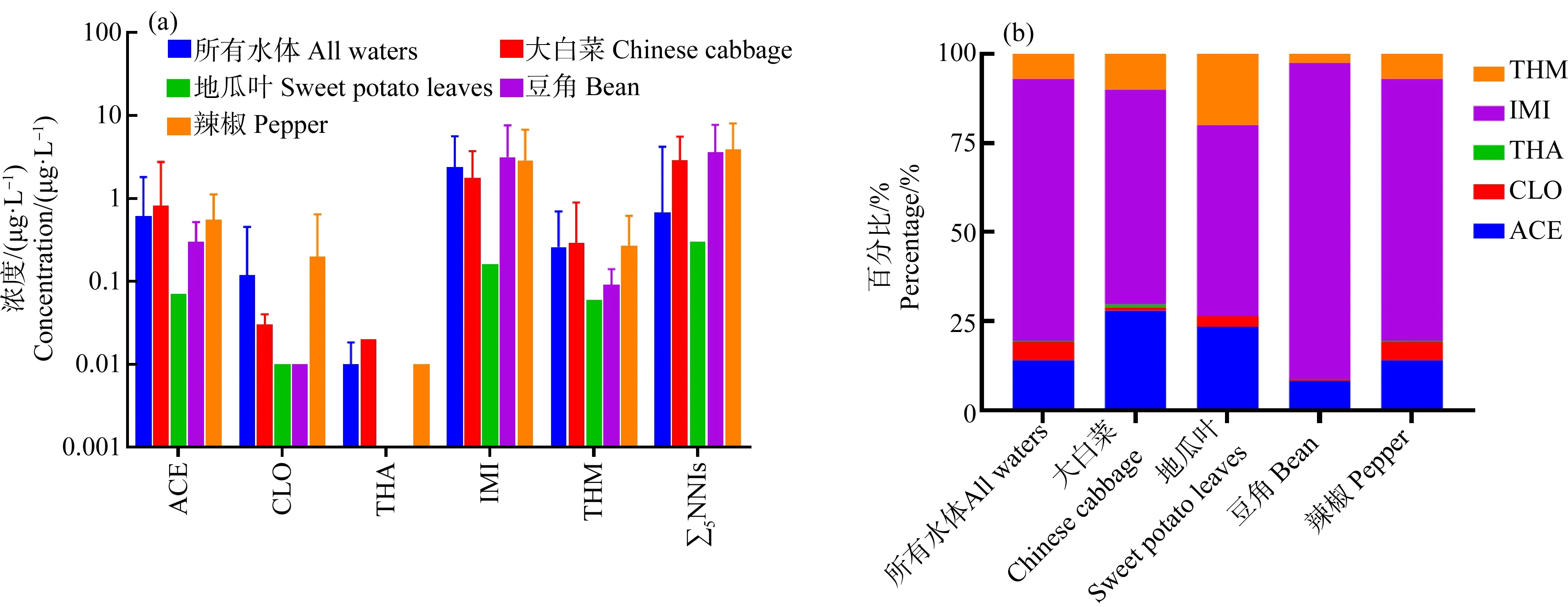
图3 澄迈不同蔬菜种植周围地表水体中NNIs残留浓度(a)及组成(b)Fig. 3 Concentration (a) and composition (b) of NNIs in surface water from different vegetable planting area in Chengmai County
2.3.3 环境参数的影响
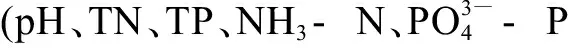
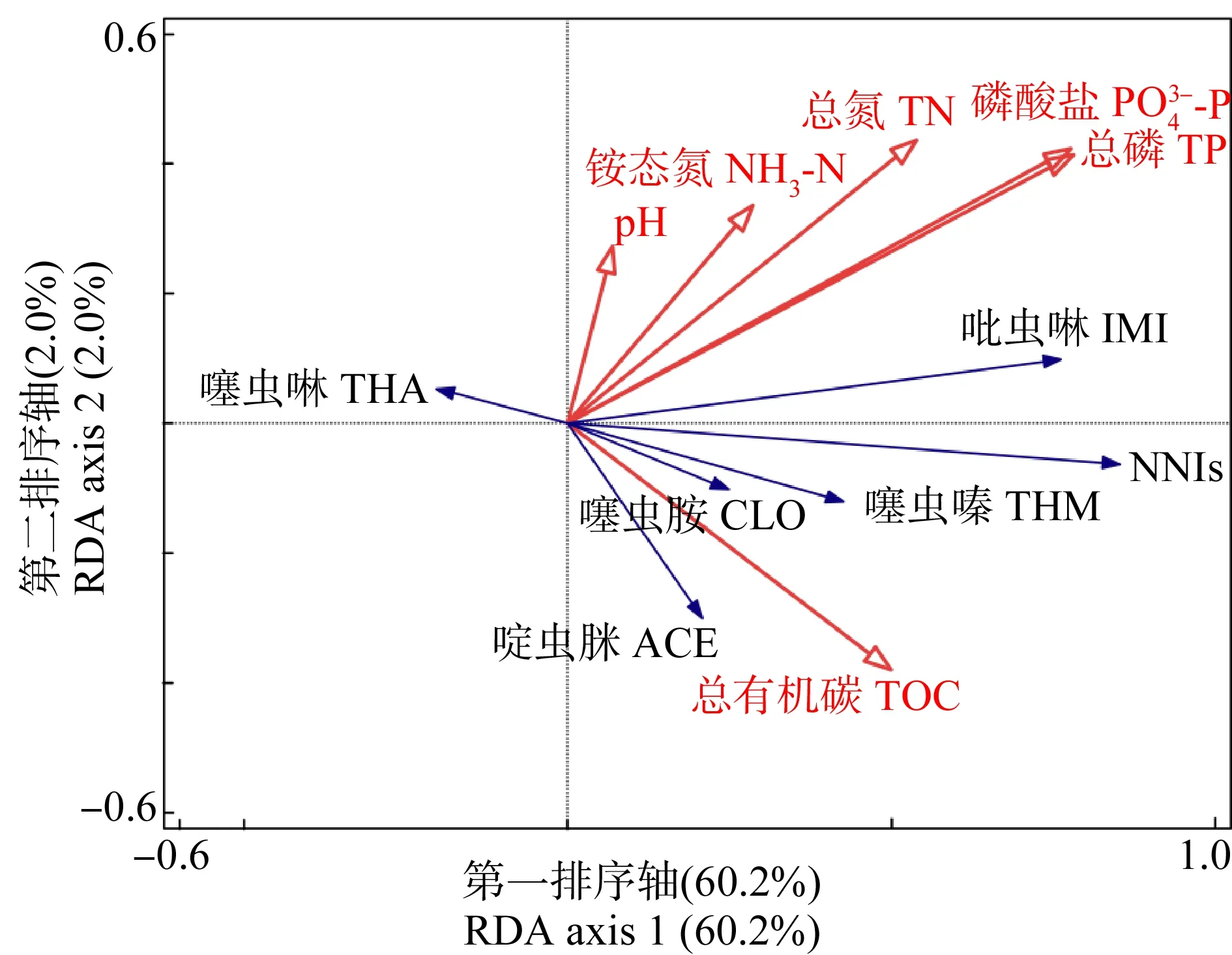
图4 NNIs和水质参数和TOC)的冗余分析Fig. 4 Redundancy analysis of NNIs and water quality parameters (pH, TN, TP, NH3-N, and TOC)
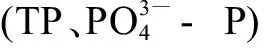
2.4 生态风险评价
水体中高检出、高残留的NNIs可能会对水生生物产生不利影响[3, 8, 13],因此选择IMI的101项急性(LC50或EC50,急性毒性测试期为4 d)试验(33种水生物种)和187项慢性(NOEC,慢性毒性测试期不少于4 d)试验(15种水生物种)生成急性和慢性SSD曲线(图5,同一个物种具有多个毒性效应值,用其几何平均值进行拟合)。在测试水生物种中,IMI急性毒性最敏感的生物是Cloeonsp.,急性毒性浓度为1.400 μg·L-1,而Misgurnusanguillicaudatus对IMI急性毒性耐受最强,急性毒性浓度为145 800 μg·L-1;慢性毒性测试中,最敏感的生物是Ceriodaphniadubia(0.305 μg·L-1),耐受性最强的水生生物是Labeorohita(120 mg·L-1)。本研究中,SSD对应的急性HC5(R2=0.942)值为1.140 μg·L-1,95%置信区间(CI)为0.19~9.34 μg·L-1,而慢性HC5(R2=0.968)值为0.105 μg·L-1,95%置信区间为0.008~0.173 μg·L-1。本研究中,将单个NNI标准化为IMI含量,以此计算每个采样点的标准化NNIs的总和(∑5IMIeq),并与急性和慢性HC5比较,评估该区域的生态风险。结果显示,∑5IMIeq为0.843~25.149 μg·L-1,超过95%、100%的水体高于急性和慢性HC5(95% CI),这表明NNIs对水体中的水生生物均有显著急性与慢性毒性风险。
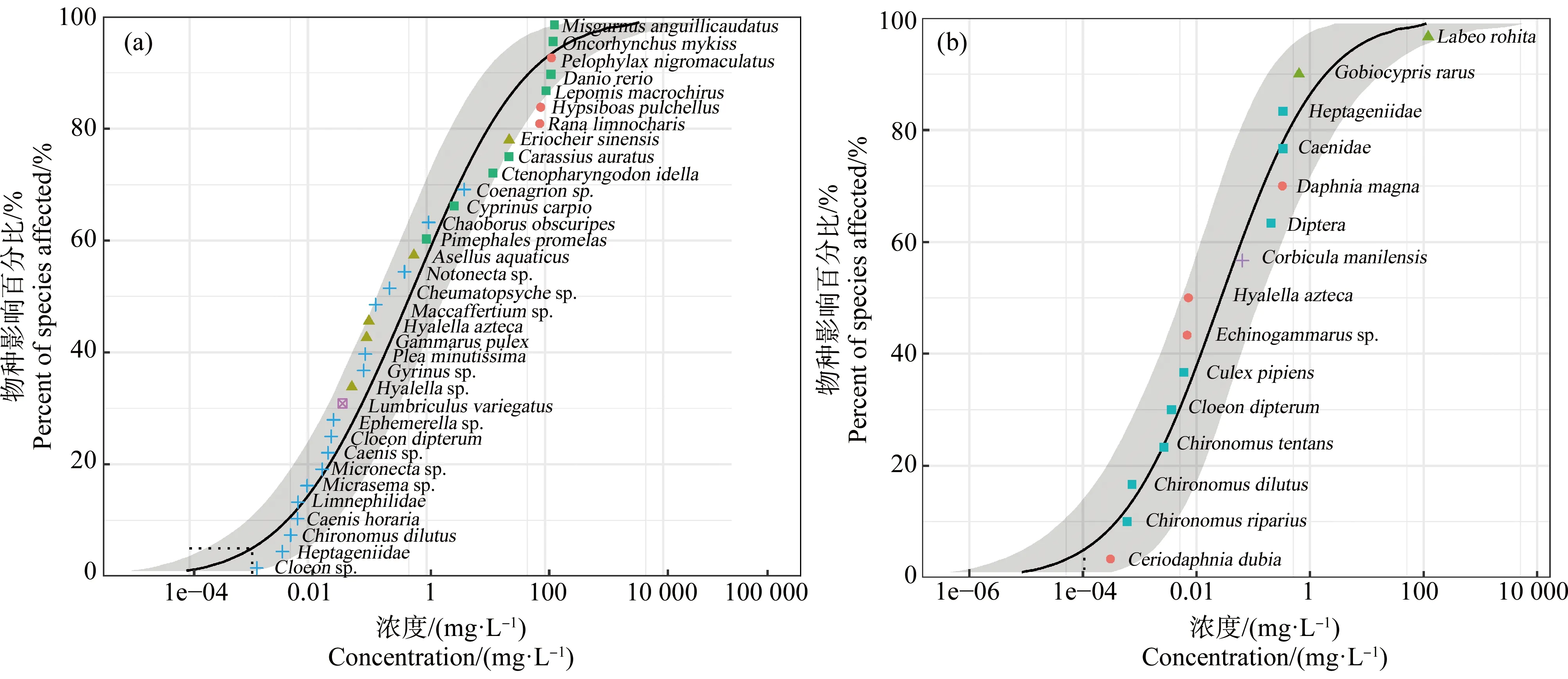
图5 水体中IMI的(a)急性毒性(EC50/LC50)和(b)慢性毒性(NOEC)物种敏感度分布曲线Fig. 5 Species sensitivity distribution (SSD) for (a) acute toxicity (EC50/LC50) and (b) chronic toxicity (NOEC) of IMI to aquatic organisms in surface water
基于急性、慢性SSD分布曲线结合风险商值法(RQ)结果表明,急性毒性效应中所有的水体呈现RQ>1。与此同时,慢性毒性效应中所有的水体也呈现RQ>1,显示研究区域在冬季蔬菜种植过程中NNIs会对水生生物造成不可接受的风险。此外,Morrissey等[3]提出,地表水NNIs生态安全浓度需要控制在0.2 μg·L-1以下 (短期急性)或0.035 μg·L-1(长期慢性),以避免对敏感水生无脊椎动物产生负面影响,然而研究区域水体中NNIs浓度100%水体中超过了短期急性与长期慢性推荐值。因此,急需风险消减措施及方案。
2.5 风险消减措施
当前,冬季蔬菜种植是该区域农民保产增收的重要保障,持续且密集的冬季蔬菜种植对NNIs等杀虫剂需求仍旺盛,促使该区域仍然面临NNIs高污染风险。结合冬季蔬菜种植实际,提出了如下NNIs风险消减措施。(1)强化NNIs源头管理。澄迈农业植保/环保等有关部门可定期/不定期开展对当地农户农药的安全使用宣传;同时,可建立专家驿站,形成扎根于基层植保队伍,指导/引导农户科学地、合理地使用NNIs,特别是在农户科学用药、蔬菜虫害及时识别和适时用药方面。此外,考虑到澄迈冬季蔬菜种植过程中多采用人工喷洒与无人机相结合的方式,因此需强化喷药设备质量,形成高效的喷药策略。(2)推广使用可替代新型农药,包括生物源/纳米胶囊包裹缓释农药试剂,实行多类型农药交替使用以减少抗药性。(3)推广生物防治措施/策略,定期释放特定作物常见害虫天敌(如蓟马中可使用白僵菌生物菌剂、寄生蜂等措施)以减少NNIs等农药的使用。(4)农户可利用好生物有机肥、生物炭等农业实践,通过科学地调控这些物质的施用规模、施用周期及施用模式(单一/复合)等因素加速田块间NNIs快速消减。(5)可在种植区与受纳水体之间构建缓冲区,如种植水草、浮萍等高耐受性植物。

