过量硒-L-蛋氨酸对青鳉鱼胚胎的毒性作用及与氧化应激机制的关联
周旖妮,王欢,杨景峰,于永利,2,#,董武,*
1. 内蒙古自治区毒物监控及毒理学重点实验室,内蒙古民族大学动物科技学院,通辽028000 2. 内蒙古民族大学生命科学与食品学院,通辽 028000
硒(selenium, Se)是人和动物正常生长和发育所需的一种天然微量元素。但当其浓度较高时,会产生毒性作用[1-2]。硒经由农业灌溉排水、采矿作业和燃煤残留物进入淡水环境[3]。令人担忧的是,富硒煤灰排放到附近水域,导致硒积累的增加,并对居民和各种动物产生负面影响。美国北卡罗来纳州贝勒斯湖和萨顿湖受到含硒煤灰的污染,也造成湖内鱼类组织中的硒含量超标,硒含量远超毒性阈值[4-5]。
硒代蛋氨酸(seleno-L-methionine,SeMet)是水生食物链中有机硒的主要形式,有机硒对胚胎发育作用明显[6-7]。当亲代(F0)饮食中的SeMet在体内积累到一定程度时会影响鱼卵的发育,甚至导致畸形[8-9]。许多鱼类的早期生命阶段对环境污染物非常敏感[10]。鱼类对硒的敏感性可能与其硒蛋白含量高有关[11]。在盐度水平较高的环境下,青鳉鱼(Oryziaslatipes)对SeMet毒性尤为敏感,可导致死亡率、孵化率和畸形率增加[12-13]。
有关硒毒性机制,有2种假说:(1)蛋白质组装过程中硫被取代导致分子结构和功能改变;(2)氧化应激导致蛋白质、脂质和DNA损伤[6,14]。后者最受关注。氧化应激是有机体对外来或者内部代谢化学物质的应激反应。很多化学物质导致氧自由基和脂质过氧化物的过量产生,进而有机体会应激产生过量的抗氧化剂或自由基清除酶,对细胞造成损害[15-16]。有机硒是否影响超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)等抗氧化酶,并增加活性氧(reactive oxygen species, ROS)和丙二醛(malondialdehyde, MDA)的产生,从而对多个器官造成氧化损伤还有待研究。ROS过量产生,或抗氧化剂减少,导致生物大分子受损,危及细胞的健康[17]。ROS激活涉及转录因子NF-E2相关因子2(Nrf2),它与抗氧化反应元件(antioxidant response element, AREs)结合,并调节对氧化剂和亲电试剂的适应性反应[18]。宿主代谢将SeMet转化为能够氧化谷胱甘肽(glutathione,GSH)的硫醇等化合物以产生超氧化物,进而导致氧化应激[19-20]。而谷胱甘肽过氧化物酶4(glutathione peroxidase4,GPx4)是谷胱甘肽过氧化物酶(GPx)蛋白质家族的成员,通过还原GSH催化过氧化氢和脂质过氧化物的还原,从而保护细胞免受氧化损伤[21]。Arnold等[22]报道斑马鱼(Daniorerio)胚胎暴露于SeMet造成氧化应激以及GSH关联基因表达的增加。
青鳉鱼作为发育生物学模式生物有着悠久的历史[23]。研究表明青鳉鱼更有利于生命早期发育阶段的胚胎毒性研究[24-25]。相比于斑马鱼的发育,青鳉鱼有相对较长的发育时期,且早期胚胎透明,可以通过透明绒毛膜看到胚胎的发育状态[26-27]。此外,有大量的分子工具可用于研究毒性机制,包括与氧化应激相关的基因[28-29]。
本研究的目的是确定SeMet水溶液对青鳉胚胎生存和发育的影响,特别是SeMet造成的形态学变化。为了确定SeMet的毒性作用机制,探讨了SeMet的氧化应激机制和特定基因表达的变化。
1 材料与方法(Materials and methods)
1.1 青鳉鱼和暴露方法
青鳉鱼在循环水系统中繁育和维护。温度维持在24 ℃,在pH 7.2的循环水条件下饲喂,并以14 h∶10 h的光∶暗循环进行光线调节。每天2次喂食饲料(Otohimeβ1 diet, Pentair Aquatic Eco-Systems, USA),并补充丰年虾(90% Great Lakes Strain, Pentair Aquatic Eco-Systems, USA)。在早晨喂食约1 h后收集受精卵。通过在湿润纸巾上轻轻滚动来清洁和分离受精卵,当胚胎发育至6~7 hpf(hours post-fertilization),青鳉卵被转移到6孔组织培养板(VWR, Corning)实施暴露,暴露至10 dpf (day post fertilization),期间每24 h更换一次暴露液,每个孔10个受精卵(3~10个重复)。每孔含有5 mL 0.1%(m/V)盐水、0.1%(V/V)二甲基亚砜(DMSO, Sigma-Aldrich, USA)或者SeMet(Sigma Aldrich, USA)的水溶液(0、0.1、1、10、100、500和1 000 μmol·L-1)。
1.2 胚胎观察和影像学
根据Iwamatsu[26]和Kinoshita等[27]的研究方法,使用尼康SMZ1500立体显微镜进行检查(Nikon Instruments, Inc., USA),每天检测直至10 dpf,记录各种表型的改变[30-31,9]。通过检测确定存活率和孵化率,并且根据改良寇式计算法计算LC50[32]。表型改变包括:心包水肿(心包腔内有液体滞留导致心脏与心脏外膜之间空间变大);腹部水肿(发育中的内脏与卵黄囊背缘之间有清晰的空间);颅面异常、颌部或眼睛大小和/或形状改变;脊索畸形;脾脏颜色变化、身体表皮颜色缺乏或变化;胆囊颜色缺乏或变化;尾部血液循环迟缓,尾部血流停滞;血液颜色苍白程度(红色减少或缺乏);鳔的发育和充盈程度(孵化后鳔的充气或未充气);运动状态的改变(活动能力缺乏或减少);以及上面未列出其他表型。观察时,鱼体在解剖学上被定位于右侧侧卧位,并尽量避免倾斜,从而使鱼头部指向左侧。每天检测拍照,直至第10天对所有图片和数据进行统计分析。
LC50的95%可信限=log-1(logLC50±1.96×SX50)
式中:i表示组距,即相邻2组剂量对数剂量之差;Xm表示最大剂量对数;p表示各剂量组死亡率;pm表示最高死亡率;q表示各剂量组存活率;pn表示最低死亡率;∑p表示各剂量组死亡率之和;n表示各组动物数;SX50表示logLC50的标准误。
1.3 胚胎样品前处理及硒浓度测定
为了评估硒通过绒毛膜的渗透,将青鳉鱼胚胎(6~7 hpf)放置于6孔板中,并暴露于10 μmol·L-1SeMet。当胚胎发育到6 dpf时,将整个胚胎清洗后放在预先清洁、有盖的玻璃瓶中称量,并添加1 mL微量金属级浓硝酸(HNO3, Sigma-Aldrich, USA)。将小瓶放置在85 ℃的金属浴上过夜直到内容物消失变清。然后将小瓶从金属浴中取出并在室温下冷却约15 min。冷却后,用9 mL 2%HNO3和0.5%盐酸(HCl, Sigma-Aldrich, USA)溶液稀释消化液。使用6 mL·min-1的H2流速,高纯度标准(High Purity Standards, USA)控制实验用水。采用电感耦合等离子体质谱法(Agilent 7700X ICP-MS equipped with an Octopole Reaction System)测定硒浓度。
1.4 组织切片和苏木精-伊红(HE)染色
青鳉鱼胚胎发育至10 dpf后收集到离心管中,用4%的多聚甲醛(PFA)固定过夜,然后用一系列浓度乙醇脱水,二甲苯透明处理后用石蜡包埋,并制作5 μm切片,放置于37 ℃恒温箱中烘干用于HE染色。当染色时,切片首先经过二甲苯脱蜡10 min,接着用一系列浓度乙醇(100%、95%、90%、80%和70%)浸泡各2 min;然后进行常规HE染色并封片镜检。
1.5 总RNA提取
从对照组(10 dpf)、暴露组(0.1、1、10和100 μmol·L-1)的整个胚胎中提取RNA。收集后,使用匀浆仪(Kinematica, GT10-35,瑞士)将胚胎在1mL TRIzol®RNA试剂(Life Technologies, USA)中均质分散组织并获取RNA。接下来,按照Dong等[30]的方法分离出总RNA。在样品洗脱前,DNA用DNAase酶切,并根据制造商的说明(Qiagen, USA)用无RNase和无DNase水进行洗脱。使用NanoDropND-1000分光光度计(Thermo Fisher Scientific, Inc., USA)测定RNA含量和260 nm/280 nm的比值。
1.6 实时荧光定量PCR
采用高容量cDNA逆转录试剂盒(Applied Biosystems, USA),使用250 ng总RNA合成互补DNA(cDNA),反应体系为20 μL。采用实时荧光定量PCR(qPCR)检测胚胎中Nrf2、GPx4和18S转录水平。使用PrimerQuest(Integrated DNA Technologies, USA)设计了青鳉特异性qPCR引物(表1)。采用96孔PCR板和ABIPlus One(Applied Biosystems)分别对Nrf2、GPx4和18ScDNA进行PCR扩增。每20 μL qPCR反应,用6 μL(0.1 ng·μL-1)first strand cDNA、2 μmol·L-1forward primer、2 μmol·L-1reverse primer和10 μL QuantiTect SYBR Green PCR Master Mix扩增cDNA(Qiagen, Inc., USA)。qPCR反应条件为95 ℃、15 min,实施40个循环,94 ℃、15 s,60 ℃、30 s。以18S的mRNA表达量作为标准,使用2-ΔΔCt计算相对表达量[33]。
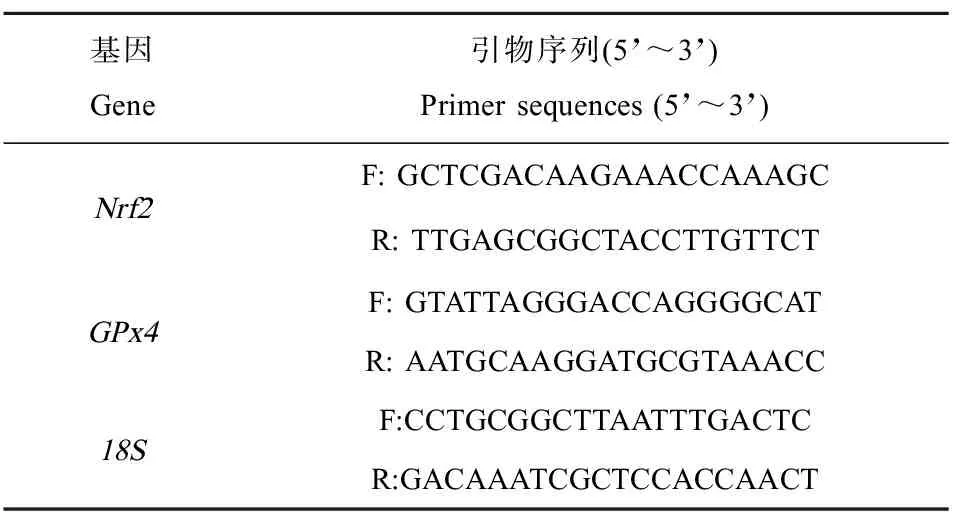
表1 实时荧光定量PCR引物Table 1 Primer sequences for RT-qPCR
1.7 SOD、MDA和ROS的检测
青鳉鱼胚胎从6~7 hpf暴露至10 dpf进行SOD、MDA和ROS的检测。SOD的检测利用高度水溶性四唑盐(MTT)法,其与超氧阴离子(·O2-)反应生成一种水溶性染料,在基于黄嘌呤氧化酶偶联反应的基础上检测。使用钼酸铵法检测CAT活性,使用碘巴比妥酸技术在532 nm处测定MDA含量,通过检测细胞内二氯荧光素(DCFH)的荧光强度来确定ROS水平,荧光发射波长为485 nm,激发波长为525 nm。使用BCA蛋白检测试剂盒检测每个样品的总蛋白水平。
1.8 统计分析
所有结果的分析采用t-test、one-way ANOVA和post-hoc Tukey-Kramer测试的方法(GraphPad Software, Inc. USA)。分析采用95%(α=0.05)可信限,P<0.05表示差异显著。
2 结果(Results)
2.1 有机硒暴露在青鳉鱼胚胎中的残留
ICP-MS分析显示,硒的暴露造成青鳉鱼胚胎中硒浓度显著升高(P<0.05)。对照组胚胎的硒浓度为0.294 mg·kg-1(以湿质量计),暴露于10 μmol·L-1SeMet的胚胎的硒浓度为1.17 mg·kg-1(图1(b))。暴露胚胎绒毛膜的硒明显高于对照组(P<0.05)。
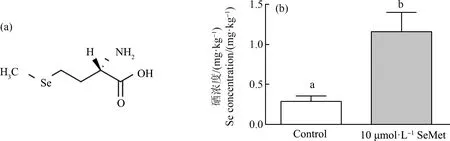
图1 硒代蛋氨酸(SeMet)分子式及其在青鳉鱼胚胎中的残留注:(a)有机硒分子式;(b) 10 μmol·L-1 SeMet暴露在青鳉鱼胚胎中的残留,浓度以单位湿质量计;通过t检验检测2组之间的差异,不同字母表示暴露组与对照组之间的显著差异(P<0.05)。Fig. 1 Seleno-L-methionine (SeMet) molecules and SeMet residues in medaka embryosNote: (a) Molecular of SeMet; (b) Effect of 10 μmol·L-1 SeMet exposure on selenium content in medaka embryos, and the content is expressed based on wet mass; differences between the two groups were detected by the t-test, and the different letters indicate significant differences between the exposure and control groups (P<0.05).
2.2 有机硒对青鳉鱼胚胎死亡率和孵化率的影响
当胚胎发育到9 dpf时,对照组生存率维持在98.6%,而当SeMet暴露(0.1、1、10、100、500和1 000 μmol·L-1)时,随着浓度的升高时生存率也逐渐降低,生存率分别是92.5%、90%、32.5%、41.3%、52.5%和0%)(图2(a))。0.1 μmol·L-1和1 μmol·L-1暴露组的生存率在1~10 d时接近,没有显著差异(P>0.05)。有趣的是,10 μmol·L-1暴露组的生存率从6 d开始显著低于100 μmol·L-1和500 μmol·L-1暴露组(P<0.01)。当染毒到9 d和10 d时,10、100、500和1 000 μmol·L-1暴露组的生存率都显著低于对照组的(P<0.01)(图2(a))。通过改良寇式方法得出9 dpf的LC50为11.0739 μmol·L-1,其95%置信范围为10.3777~11.8168 μmol·L-1。孵化率也是体现胚胎发育状态的重要指标。对照组的孵化率在第10天达到88.5%,而0.1、1、10、100、500和1 000 μmol·L-1SeMet暴露组的孵化率分别为87.9%、86.9%、80%、63.8%、0%和0%(图2(b))。与对照组相比,100、500和1 000 μmol·L-1SeMet显著降低了青鳉鱼的孵化率(P<0.05)。考虑生存率和孵化率的原因,采用0.1、1、10和100 μmol·L-1的SeMet进行进一步研究。
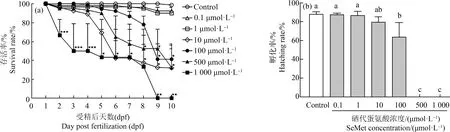
图2 不同浓度SeMet暴露对青鳉胚胎(幼鱼)生存率和孵化率的影响注:(a)存活率;(b)孵化率;6~7 hpf青鳉鱼胚胎暴露SeMet的水溶液后,每天观察胚胎,计算存活和孵化数直到10 dpf;每组包含10个胚胎,每组3个重复;(a)中*P<0.05、**P<0.01、***P<0.001,与对照组相比;(b)中不同字母表示2组之间的显著差异(P<0.05)。Fig. 2 Effect of different concentrations of SeMet exposure on survival rate and hatching rate of medaka embryos (larva)Note: (a) Survival rate; (b) Hatching rate; embryos developing 6~7 hpf were exposed to SeMet aqueous solution; embryos were observed each day and survival or hatching numbers were counted until 10 dpf; each group contains 10 embryos, with 3 replicates in each group; *P<0.05, **P<0.01, ***P<0.001, compared with the control in figure (a); different letters indicate significant differences (P<0.05) in figure (b).
2.3 有机硒对青鳉鱼胚胎表型的影响
有机硒造成青鳉鱼胚胎发生多种畸形,首先观察到心包水肿。在对照组中只有0.71%的胚胎出现心包水肿,而在10 dpf时,0.1、1、10和100 μmol·L-1SeMet暴露组的心包水肿发生率分别为1.3%、7%、3.9%和5%(图3(b)、(d)和(e))。随着SeMet暴露浓度的增加,心包水肿率有增加的趋势,但各组之间没有显著差异。但通过组织切片和HE染色进一步确认发生心包膜水肿的幼鱼,发现心脏被牵拉成为细长试管形状,心脏内壁变薄,甚至呈现单细胞状态(图3(d))。其次,在6 dpf时发现SeMet暴露造成血液变淡(白血)。对照组出现血液变淡的比例为0%,而0.1、1、10和100 μmol·L-1组分别为0%、2.5%、50%和46.8%。与对照组相比,10 μmol·L-1和100 μmol·L-1组中该表型个体百分比显著增加(P<0.05)(图4(d)~(g))。此外,还观察到腹部水肿、颅面异常、脊索畸形、脾脏和胆囊颜色的改变、尾部血液循环的改变、SeMet暴露组的鱼鳔改变和其他改变,并有剂量依赖性增加的趋势。虽然没有定量,但做了总的畸形率统计。对照组的总改变率为4.1%。与对照组相比,0.1、1、10和100 μmol·L-1SeMet暴露组的总变化率分别增加了1.4倍、12.5倍、28.4倍和24.9倍。0.1 μmol·L-1和1 μmol·L-1SeMet暴露组的发生率较低,与对照组相比没有统计学意义。但10 μmol·L-1组和100 μmol·L-1组的总变化率明显高于对照组(P<0.05,图5(a))。
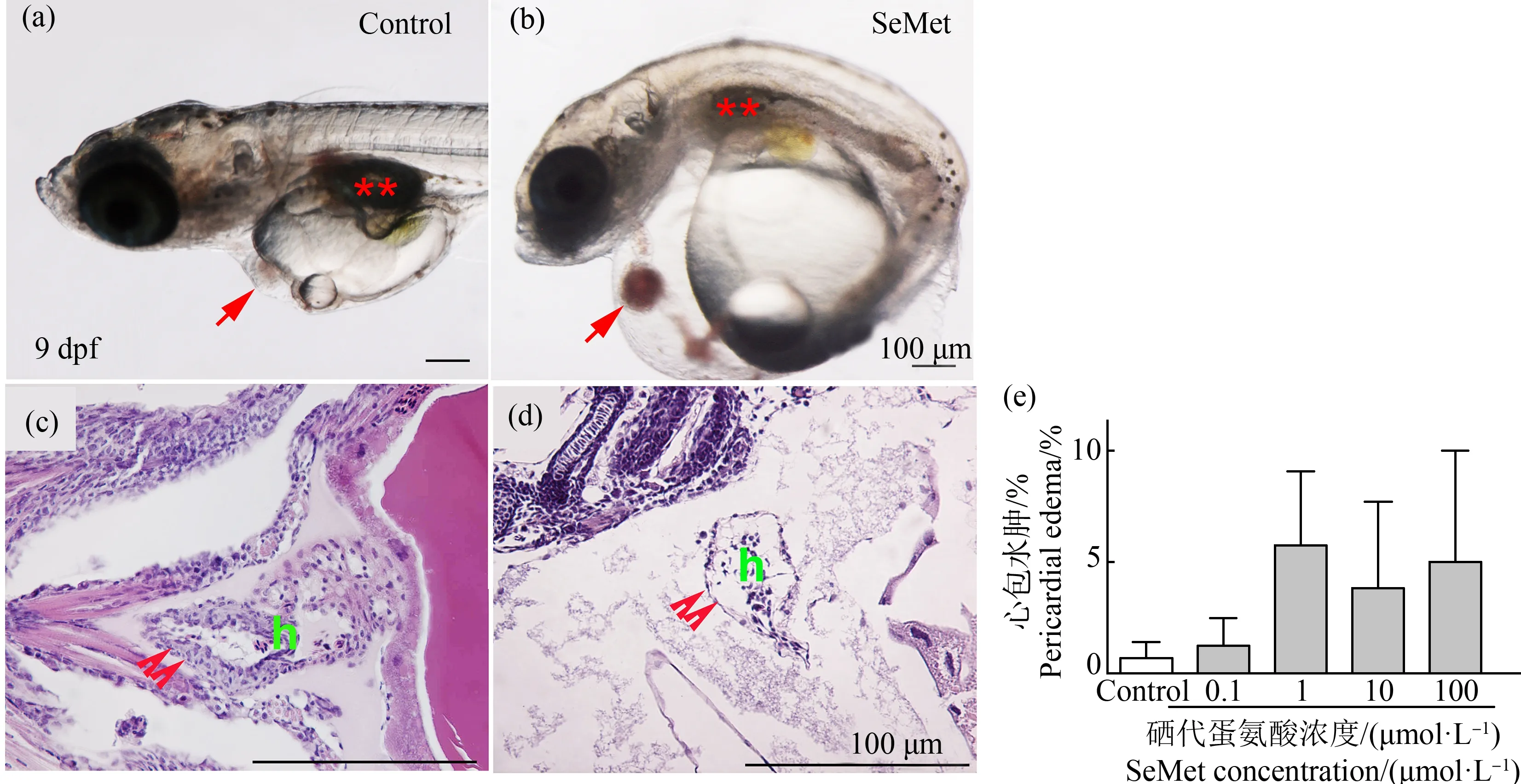
图3 不同浓度SeMet暴露对青鳉胚胎(幼鱼)心包水肿的影响注:(a)和(c) 对照组胚胎;(b)和(d) SeMet暴露组;(c)和(d) HE染色;(e)10 dpf时心包水肿的发生率图;(a)和(b)中的红色箭头表示心脏,**表示鱼鳔;(c)和(d)中的双箭头表示心脏壁;h表示心脏;每组包含10个胚胎,每组3个重复。Fig. 3 Effect of different concentrations of SeMet exposure on pericardial edema of medaka embryos (larva)Note: (a) and (c) Control embryos; (b) and (d) SeMet exposed group; (c) and (d) HE staining; (e) Plot of the incidence of pericardial edema at 10 dpf; the red arrow indicates the heart, and **indicates the swim bladder, in (a) and (b); double arrows indicate the heart wall, and h indicates heart, in (c) and (d); each group contains 10 embryos, with 3 replicates in each group.
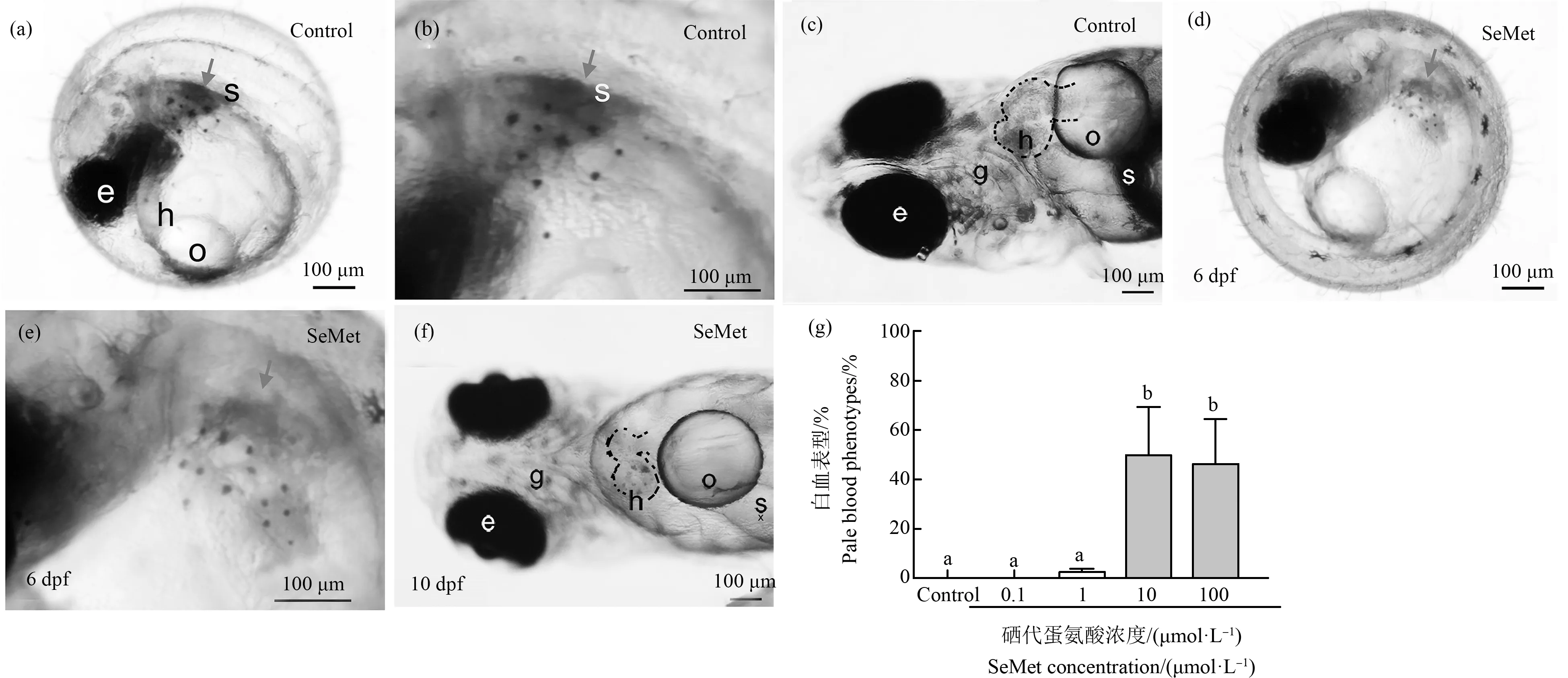
图4 不同浓度SeMet暴露后青鳉胚胎(幼鱼)出现的白血表型注:(a)~(c)对照组;(d)~(f) 100 μmol·L-1 SeMet暴露组;(b)和(e)分别是(a)和(d)的高倍放大图;(g)白血表型的发生;e表示眼睛,h表示心脏,o表示心包,s表示鱼鳔,g表示鳃;每组包含10个胚胎,每组3个重复;不同字母表示2组之间的显著差异(P<0.05)。Fig. 4 Effect of different concentrations of SeMet exposure on white blood phenotype of medaka embryos (larva)Note:(a)~(c) Control group; (d)~(f) 100 μmol·L-1 SeMet exposed group; (b) and (e) are high magnification figure of (a) and (d), respectively; (g) Occurrence of white blood phenotype; e indicates eye; h indicates heart; o indicates oil drop; s indicates swim bladder; g indicates gill; each group contains 10 embryos, with 3 replicates in each group; different letters indicate significant difference (P<0.05).
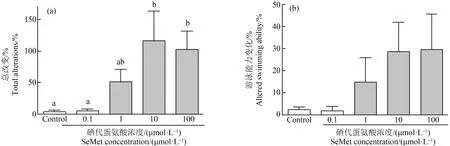
图5 不同浓度SeMet暴露后青鳉胚胎(幼鱼)出现的表型注:(a)10 dpf时所有表型改变的比率;(b)计算游泳表现发生改变的比率;每组包含10个胚胎,每组3个重复;不同字母表示2组之间的显著差异(P<0.05)。Fig. 5 Effect of different concentrations of SeMet exposure on the phenotype of medaka embryos (larva)Note: (a) The rate of all altered phenotypes at 10 dpf were counted; (a)The rate of individuals showing alterations in swimming performance were counted; each group contains 10 embryos, with 3 replicates in each group; different letters indicate significant difference (P<0.05).
2.4 有机硒对青鳉幼鱼行为学的影响
观察了孵化后个体行为学的变化。对照组幼鱼鱼鳔开始发育,表现出快速运动、在水柱内的一致位置和垂直方向。然而,当暴露于SeMet后,一些胚胎显示出异常改变,对照组、0.1、1、10和100 μmol·L-1组中异常改变比率分别为2.5%、2%、15%、28.7%和29.9%。暴露造成的运动改变显示出不规则的剂量依赖性增加趋势,差异不显著(图5(b))。
2.5 有机硒对氧化应激关联基因表达的影响
考察有机硒的暴露与氧化应激相关的基因表达的变化关系,与对照组相比,Nrf2在1、10和100 μmol·L-1组中的表达量分别增加了0.96倍、0.92倍和2.1倍。100 μmol·L-1暴露组的Nrf2表达量显著高于对照组和0.1 μmol·L-1组(P<0.05)。GXP4在1、10和100 μmol·L-1组中的表达量分别为1.5倍、2.1倍和3.7倍(图6)。虽然没有统计学意义,但暴露组GPx4表达呈剂量依赖性增加趋势。
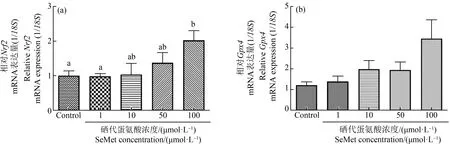
图6 不同浓度SeMet暴露后青鳉胚胎(幼鱼)氧化应激基因表达注:(a) Nrf2;(b) Gpx4;从6~7 hpf到10 dpf,胚胎暴露于SeMet水溶液,并收集幼鱼进行RT-qPCR分析;每组包含10个胚胎,每组至少3个重复;不同字母表示2组之间的显著差异(P<0.05)。Fig. 6 Effect of different concentrations of SeMet exposure on oxidative stress gene of medaka embryos (larva)Note:(a) Nrf2; (b) Gpx4; embryos were exposed to SeMet aqueous solution from 6~7 hpf until 10 dpf and collected the larva for the RT-qPCR analysis; each group contains 10 embryos, with 3 replicates at least in each group; different letters indicate a significant difference (P<0.05).
2.6 有机硒暴露对青鳉鱼造成氧化应激
当胚胎发育到10 dpf时测定SOD、CAT活性和MDA、ROS含量。与对照组相比,0.1 μmol·L-1和1 μmol·L-1的有机硒没有引起SOD活性的变化,但10 μmol·L-1和100 μmol·L-1有机硒降低了SOD活性,分别显著降低了31.1%和32.8%(P<0.05)(图7(a))。有机硒有引起CAT活性降低的趋势,但没有显著变化(P>0.05)(图7(b))。同样0.1 μmol·L-1和1 μmol·L-1有机硒没有引起MDA和ROS的变化,但10 μmol·L-1和100 μmol·L-1的有机硒暴露显著增高了MDA含量(1.39倍,P<0.05;1.40倍,P<0.05),也增高了ROS(1.37倍,P<0.05;1.23倍,P>0.05)含量(图7(c)和(d))。
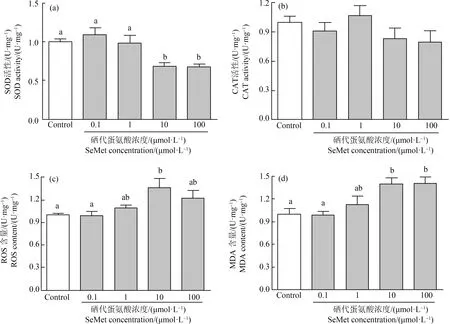
图7 不同浓度SeMet暴露后青鳉胚胎(幼鱼)氧化应激指标注:(a) SOD活性;(b) CAT活性;(c) ROS含量;(d) MDA含量;胚胎在6~7 hpf至10 dpf期间暴露于SeMet水溶液;不同字母表示显著差异(P<0.05);每组包含10个胚胎,每组3个重复。Fig. 7 Effect of different concentrations of SeMet exposure on oxidative stress measurement of medaka embryos (larva)Note: (a) SOD activity; (b) CAT activity; (c) ROS content; (d) MDA content; embryos were exposed to a range of SeMet aqueous solution from 6~7 hpf to 10 dpf; different letters indicate significant differences (P<0.05); each group contains 10 embryos, with 3 replicates in each group.
3 讨论(Discussion)
暴露于SeMet水溶液会影响青鳉鱼胚胎的发育。SeMet(10~1 000 μmol·L-1)暴露造成胚胎的存活率和孵化率的降低,10 μmol·L-1和100 μmol·L-1SeMet引起的总表型变化明显多于对照组。本研究发现SeMet暴露增加了异常表型,并呈现浓度-效应依赖性。有趣的是,10 μmol·L-1组与最高暴露组(100 μmol·L-1)有相似的反应,表现出中剂量效应。此外,氧化应激相关基因表达的增加可能是造成SeMet毒性作用的起因。
青鳉鱼的绒毛膜只有轻微的渗透性,可对水溶性外源毒性物质造成一定程度的阻隔[31,34]。ICP-MS能够确定胚胎暴露的硒的量,并确定绒毛膜的保护作用。研究认为,在对照组胚胎中检测到的硒在微量营养素水平,胚胎中的硒被认为是从母体饮食获得[35]。在暴露胚胎中观察到硒含量的升高,表明SeMet穿过绒毛膜到达胚胎并影响其发育。
本研究观察到有机硒造成青鳉胚胎存活率的下降,并有一定的浓度依赖性,在10 μmol·L-1SeMet时具有中剂量效应。Arnold等[22]发现100 μg·L-1和400 μg·L-1SeMet暴露造成斑马鱼胚胎死亡率的增加。Kupsco和Schlenk[12-13]也报道,在5~6 hpf时5 μmol·L-1SeMet暴露会造成青鳉胚胎存活率下降,即使在胚胎的1~8 dpf时暴露也会造成存活率的下降。本研究也发现存活率的降低,并通过改良寇式方法得出9 dpf的LC50为11.0739 μmol·L-1。而5~6 dpf后观察到的存活率下降可能是由于孵化前绒毛膜通透性增加,允许SeMet的额外流入[22,34]。然而,本研究结果还不能解释为什么在10 μmol·L-1时观察到如此高的死亡率。SeMet暴露由3位不同的研究人员实施重复实验,结果相同。同时还观察到,SeMet也造成10 dpf青鳉胚胎孵化率下降的总体趋势,同样,Villalobos等[31]也有报道,持续暴露SeMet导致孵化减少。确定孵化延迟或缺失的确切原因需要探讨包括宿主的生理过程和/或酶活性与硒相关的特定变化,这在未来有必要深入研究。
本研究对6~7 hpf胚胎的暴露显示出与Kupsco和Schlenk[12-13]在5~6 hpf暴露时相似的表型变化,他们观察到了更大的心脏和颅面畸形,并且硒组织浓度为5~6 μg·g-1时孵化率降低。虽然没有统计学意义,但本研究早在3 dpf时就观察到心包水肿,直到胚胎发育到5~9 dpf(结果未展示)。在早期阶段,水肿的出现与心脏生长和分化的主要发育相一致[26]。在斑马鱼胚胎的硒暴露实验中也出现心包水肿,包括纳米硒、四氯化硒(SeCl4)和亚硒酸钠(Na2SeO3)[36-38]。
本研究首次发现有机硒造成血液颜色变浅的表型。硬骨鱼的造血功能已经非常明确,血液参数(即离子浓度、血红蛋白和红细胞压积)也已被用作污染物引起生理反应的指标[39]。硒可以与血红蛋白结合,使其不能携带氧气,导致红细胞死亡和呼吸能力下降[40]。已有研究表明,成鱼以及胚胎硒暴露会造成血液的变化[38-39];在斑马鱼体内,硒蛋白在胚胎中胚层和血细胞中特异性的表达[41]。已有研究证实了GPx在血液中的重要性,它被GSH还原为硒化物,然后运输到血浆,选择性地与白蛋白结合,最后转移到肝脏[42]。本研究虽不能将观察到的血液体颜色变浅的表型归因于特定的血液学指标异常,但这可能与GSH和氧化应激相关,未来有必要深入探索青鳉造血的机制[43]。
本研究还观察了SeMet暴露对幼鱼运动的影响。成年斑马鱼饲喂含硒饲料可造成其后代的临界游泳速度(Ucrit)、尾波振幅和运动活动的降低[44]。本研究未直接测试游泳指标,而是观察了幼鱼在水中移动和定位的能力。鱼鳔完全或部分缺失可能是游泳活动减少的主要原因。这些变化意味着青鳉幼鱼必须不断移动以保持在水中的位置,从而增加其氧气和能量消耗,导致青鳉鱼幼鱼的下沉和极度消瘦,甚至死亡[45]。
在鱼类中,硒的毒性机制仍不清楚。氧化应激是这2种机制假说中研究最多的一种。在本实验中,当青鳉胚胎暴露于SeMet时,Nrf2和GPx4均增加。已知多种化学物质和环境制剂可以通过Nrf2诱导抗氧化反应元件(AREs)基因[46]。在斑马鱼胚胎中,SeMet暴露导致的畸形与超氧化物歧化酶(sod2)和谷氨酸半胱氨酸连接酶催化亚基(gclc)基因表达以及总谷胱甘肽(TGSH)、还原谷胱甘肽(RGSH)和TGSH/氧化谷胱甘肽(GSSG)比率有关[21]。Penglase等[44]报道称,经膳食暴露硒的亲代斑马鱼所产子代(F1)增加了GPx蛋白(GPx1a、GPx1b、SEPP1a和SEPP1b)表达,可能是对硒产生的超氧阴离子的抗氧化反应。GPx4是一种抗氧化酶,可以直接还原磷脂和胆固醇的氢过氧化物,将有毒的过氧化物修饰为无毒的羟基化合物,以保护膜的结构和功能[47]。研究表明,氢过氧化物可触发细胞凋亡,在细胞增殖和分化中发挥作用,并促进红细胞成熟,维护氧化还原的平衡[48]。本实验结果显示硒诱导Nrf2表达的增高,这种增高可能是由于斑马鱼胚胎对抗氧化应激反应的一种保护作用。未来的工作有必要检测细胞凋亡和其他关联GPx蛋白的表达。
总之,本研究发现SeMet水溶液暴露会导致生命早期青鳉胚胎的发育毒性,并呈浓度依赖性。在10 μmol·L-1和100 μmol·L-1SeMet暴露组中,暴露导致存活率和孵化率下降,包括心包水肿、血液颜色和运动行为的改变。有趣的是,在众多表型类别中,10 μmol·L-1暴露组造成的影响最大,这表明有机硒存在中剂量效应。此外,有机硒造成氧化应激关联指标的增加可能是造成青鳉胚胎毒性的作用机制。未来有必要与其他种类硒的暴露进行比较,加强对硒所引起胚胎毒性的认识。此外,延长低浓度有机硒持续暴露时间,可进一步了解早期暴露对青春期或者成年的影响。

