不同粒径商品聚乙烯微塑料对2种蔬菜种子发芽和幼苗生长的影响
栗敏,刘强,曹东东,邵梦莹,刘一帆,罗先香,2,李锋民,2,郑浩,2,*
1. 中国海洋大学近海环境污染控制研究所,海洋环境与生态教育部重点实验室,青岛 266100 2. 青岛海洋科学与技术国家实验室,海洋生态与环境科学功能实验室,青岛 266237
微塑料(MPs)是指环境中<5 mm的塑料碎片或颗粒[1-2],按其来源分为初生MPs和次生MPs[1]。初生MPs指直接排入环境中的塑料颗粒,如个人洗护产品中的塑料微珠和工业研磨剂等,次生MPs指环境中的塑料在物理、化学、生物因素的作用下破碎分解形成的小碎片和微粒[3]。由于其独特的非天然聚合物结构以及含有丰富的异生物质,MPs具有“不易消亡或环境持久”的物理和化学综合效应[4],可能对全球生态环境健康构成重大风险,已经成为全球性的热点环境问题。最早MPs的研究主要聚焦于海洋和淡水生态系统[5],陆地生态系统中MPs污染的研究起步较晚。然而,与水生生态系统相比,陆地生态系统可能更容易受到MPs的污染。据估计,每年释放到陆地生态系统中的MPs丰度可能是释放到水生生态系统中的MPs的4倍~23倍[6]。另外,陆地生态系统中的MPs也是水生生态系统中MPs污染的重要来源[7]。土壤MPs的污染现象广泛存在,已在耕地、林地、草地和建设用地等土壤中均被检出[8]。其中,农田土壤系统被认为是MPs的关键源汇之一[9],也是MPs与土壤动物、植物及微生物作用的热点区域[10]。农业地膜的残留[11]、废水灌溉[12]、土壤改良剂的使用[13]和大气沉降[14]等是MPs进入农田土壤的主要途径。聚乙烯(PE)地膜因其农艺效益而被广泛应用于现代农业。据估计,20世纪末全世界每年有1.0×106t地膜用于农业生产[15]。仅在美国,2004年就使用了1.3×105t地膜[16]。在中国,地膜使用量在2015年增加到1.5×106t,地膜覆盖面积达到1.8×107hm2以上[17]。地膜的大规模使用造成了土壤中MPs的广泛残留[10]。研究表明,MPs颗粒的累积及其化学添加剂(如抗氧化剂、稳定剂和着色剂等)的浸出可显著改变土壤理化性质(如降低土壤容重、促进水分蒸发和改变土壤结构等)[18],影响土壤碳(C)、氮(N)和磷(P)等养分元素的生物地球化学循环过程[19],改变微生物群落结构和土壤酶活性[20],影响植物生长[21],危害土壤动物生存[22],进而影响土壤生态系统的结构和功能。因此,关注MPs尤其是聚乙烯微塑料(PE-MPs)对土壤生态系统的影响,明确其潜在生态效应对评估MPs的生态风险具有重要意义。
植物在生态系统的物质循环、能量流动和信息传递中发挥关键作用,是土壤生态系统的重要组成部分,也是人类食物的重要来源。因此,了解MPs对植物,尤其是蔬菜等农作物的影响,是MPs风险评估的关键环节和目前研究的热点[23]。近年来,越来越多的研究表明,MPs可通过直接或间接作用促进或抑制植物生长[21-28]。Qi等[21]率先关注了土壤MPs污染对作物生长的影响,发现大颗粒(7 mm×6 mm)和小颗粒(0.05~1 mm)MPs暴露均显著抑制了小麦(Triticumaestivum)的营养生长和生殖生长,且可生物降解地膜的抑制程度强于聚乙烯地膜。Boots等[22]随后发现聚乳酸MPs(65.6 μm)可以抑制黑麦草(Loliumperenne)的发芽和地上部的生长。更有甚者,Lozano和Rillig[24]发现MPs污染会改变植物群落结构,影响植物物种的优势度。然而,一些研究也发现MPs污染促进了植物的生长。例如,de Souza Machado等[25]发现聚酰胺和聚酯MPs均不同程度地促进了洋葱(Alliumfistulosum)的生长。Lian等[26]通过发芽和水培实验发现聚苯乙烯纳米塑料(PS-NPs)对小麦种子萌发没有影响,但通过调节能量代谢和氨基酸代谢促进了幼苗的生长。植物根系由于具有固着、吸收和储藏等多方面的功能,在植物生长发育及对环境胁迫的响应中发挥着至关重要的作用[27]。Sun等[28]首次发现带正电荷的PS-NPs会在拟南芥(Arabidopsisthaliana)根系聚集,诱导活性氧的积累和根系分泌物的产生,抑制植物生长和幼苗发育;然而带负电的PS-NPs对拟南芥的影响较小,但会通过质外体途径进入维管束并在植物根系累积。Li等[23]发现微米及亚微米的塑料颗粒可以通过植物根系裂缝进入根系,并通过蒸腾作用传输到植物的茎和叶中。可见,除对植物的直接毒性外,小粒径的MPs还可能进入植物体,破坏植物内各细胞和分子的稳态调节。因此,植物毒性研究中关注MPs的粒径效应至关重要。另外,MPs对植物的影响也与其形状、表面性质、内源污染物、浓度和植物类型等密切相关[24-28]。但是,目前MPs对植物生长的影响及机制尚存在很多不确定性,MPs对土壤中高等植物特别是典型农作物的直接毒性研究相对较少,对蔬菜种子发芽和幼苗生长综合影响的研究仍处于起步阶段。
西红柿(Lycopersiconesculentum)和辣椒(CapsicumannuumL.)是世界上最重要的蔬菜作物之一,在全球范围内的使用量逐年升高[29-30]。且其作为双子叶植物的代表,研究MPs对其不同生长阶段的影响具有重要的科学意义。因此,本研究以PE-MPs为代表,利用发芽实验和盆栽实验探究不同粒径的PE-MPs在不同污染浓度下对典型蔬菜西红柿和辣椒种子发芽和幼苗生长的影响。研究结果将为农业土壤生态系统中MPs生态风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验用PE-MPs购于上海阳励机电科技有限公司,其由塑料原料微粒研磨制得。塑料粒径分别为1 000目、250目和80目,分别命名为PE-S、PE-M和PE-L。供试土壤采自山东省招远市(37.43N, 120.33E)农田表层土(0~20 cm)。土壤经自然风干后过2 mm筛备用。土壤pH为4.98,总碳(TC)为1.37%,总氮(TN)为0.17%。供试西红柿和辣椒种子购买于青岛崂山区北龙口种子站。
1.2 MPs的表征
利用ATR-FTIR光谱仪(Tensor 27,Bruker Optics,德国)确定塑料类型。利用贝克曼分析仪(LS I3 320,Beckman Coulter,美国)测定PE-MPs颗粒的粒径分布。利用HITACHI S-4800扫描电镜分析3种PE-MPs的表面形态结构特征。利用元素分析仪(MicroCube,Elementar,德国)测定PE-MPs中C和H的含量。每个样品设置3个平行,取平均值并计算PE-MPs样品中的H/C的原子比。利用物理化学吸附仪(Autosorb-1C-TCD Ready,Quantachrome,美国)通过N2吸附-解吸法测定其比表面积、孔体积和平均孔径[31]。PE-MPs浸出液的提取和分析采用如下方法[32]:土壤和超纯水以1∶5的比例在室温下150 r·min-1震荡30 min,静置8 h,用0.45 μm醋酸纤维滤膜过滤得到土壤溶液。之后分别向含有30 mL超纯水和土壤水溶液(土水比为1∶5)的顶空瓶中添加0.75 g PE-MPs,在室温下150 r·min-1振荡14 d,过0.45 μm醋酸纤维滤膜,收集滤液,以备溶解性有机碳(DOC)测定。分别使用pH计(AB150,Thermo Fisher Scientific,美国)和TOC分析仪(Elementar TOC-Vcpn,Shimadzu,日本)以超纯水和土壤溶液作为空白对照,测定浸出液pH值和DOC的含量。
1.3 发芽实验
本研究选取西红柿和辣椒为受试植物进行发芽实验。发芽试验具体步骤如下:将种子浸泡在30%的H2O2中30 min进行表面消毒,用蒸馏水冲洗5次后,于饱和CaSO4溶液中浸泡过夜后,用蒸馏水冲洗3次后备用。分别取不同质量的PE-MPs配制浓度依次为0%、0.1%、0.5%、1%、2%和5%(m%)的悬浮液。于含有双层无菌滤纸的培养皿(90 mm)中,分别放入20粒受试种子,随后分别加入5 mL不同浓度的PE-MPs悬浮液。每个处理设置4个平行。所有培养皿置于25 ℃的生物培养箱(KRC-250CL,Keelrein,中国)中黑暗培养。西红柿和辣椒分别培养12 d和14 d。每天补充水分,同时记录西红柿和辣椒种子的发芽数并在培养结束后量取幼苗的根长和茎长。种子发芽势(RE)、发芽率(GR)和种子活力指数(SVI)的计算利用如下公式[28]:
(1)
(2)
(3)
式中:M1为发芽过程中日发芽种子数最大时的发芽数量;M2为发芽试验结束时发芽种子的数量;M为供测种子总数;S为发芽种子茎长;R为发芽种子根长。
1.4 盆栽实验
选取上述西红柿和辣椒种子进行盆栽实验。具体步骤为:向供试土壤中分别加入不同质量的PE-MPs,使其浓度依次为0%、0.1%、0.5%、1%、2%和5%(m%)。PE-MPs的浓度是依据农田土壤中MPs的环境浓度(0.004%~1.88%)和植物毒理学试验暴露浓度(0~16%)确定的[8,33-34]。将80 g混匀后的土壤装于预清洗的花盆(60 mm×28 mm×53 mm)中,加入蒸馏水使其达到最大持水量(WHC)的60%,活化2 d后,在每个花盆中播3粒种子。每个处理设3个重复。置于温室中光照培养30 d。每天定时称量浇水至60%WHC,且定期随机改变花盆位置,尽量减小光照带来的系统误差。培养结束后,采集植物幼苗,分为地上部和地下部根系,记录生物量鲜质量。用蒸馏水将植株根系冲洗干净,滤纸吸干水分,利用根系扫描仪(10000XL,Epson Scanning,日本),运用WinRHIZO软件(Prp.2005,Regent,加拿大)分析根系形态。之后地上部和地下部于105 ℃下杀青30 min后,于60 ℃烘干至恒质量,记录生物量。
1.5 数据处理
使用Excel 2016和Origin 2018进行实验结果的处理分析及图表绘制。雷达图可以用来反映某种污染物对生物相关参数的影响[35]。使用Origin 2018绘制PE-MPs对植物生长综合影响的雷达图。采用SPSS 20.0软件对实验数据进行显著性差异分析(Duncan检验,P=0.05)。使用R 4.0.3软件(Corrplot 软件包)对PE-MPs的性质和植物的各项生长指标进行Pearson相关性分析。
2 结果(Results)
2.1 微塑料的基本性质
PE-MPs的FTIR光谱如图1(a)所示。3种粒径的PE-MPs均在2 920 cm-1和2 852 cm-1出现了较强的吸收峰,这主要是由于PE聚合物中—CH2—的C—H的不对称振动和C—H的对称伸缩振动引起[36]。此外在1 466 cm-1和723 cm-1处也出现了2个较小的吸收峰,分别归因于—(CH2)n—中的C—H的变形振动和—(CH2)n—中的C—C的摇摆振动。这些特征峰的出现与PE的标准红外谱峰[36]及文献报道中PE的特征峰一致[37],说明所购买的受试材料种类符合要求。另外,元素分析结果发现PE-MPs的整体C含量达到了84.9%~85.3%,H含量为13.6%~16.2%(表1),说明其含碳量较高,且与其他2种粒径相比,PE-M的含碳量最大。3种PE-MPs的H∶C比为1.91~2.29,与根据其分子式计算的理论值非常接近[38],进一步说明这3种粒径的塑料颗粒均为PE-MPs。通过粒径分析发现PE-S、PE-M和PE-L的平均粒径分别为23、54和155 μm(图1(b)~(d)),符合预期的粒径要求。SEM的结果进一步证实了粒径的差异(图1(e)~(j))。且观察表面形貌可发现,PE-S表面褶皱,大多为不规则的微米级颗粒,片层状及孔隙结构较多,许多粒径较小的颗粒聚合在一起形成粒径略大的微球。PE-M的形状大多数为近似球形,个别呈棒状,表面有裂痕。PE-L多为近似球形或棒状颗粒,但其表面相对光滑平整,裂隙结构较少。这与比表面积分析的结果一致(表1)。PE-MPs的比表面积相对较小,整体约在0.543~1.363 m2·g-1,其中PE-S的比表面积最大。此外,PE-MPs的微孔体积和平均孔径分别为0.0016~0.0120 cm3·g-1和9.06~35.1 nm,且随粒径降低,其微孔体积和平均孔径逐渐增大(图1(k)~(l))。
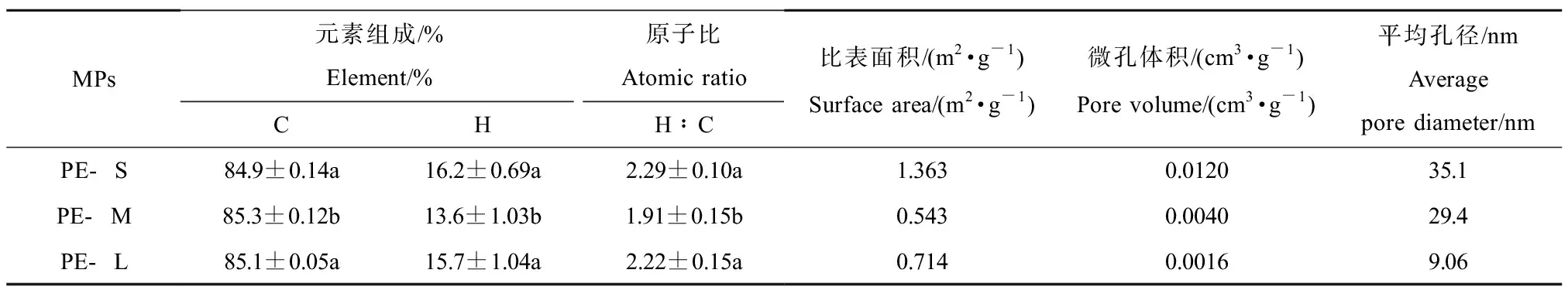
表1 聚乙烯微塑料(PE-MPs)的物理化学性质Table 1 The physicochemical properties of polyethylene microplastics (PE-MPs)
此外,不同粒径的PE-MPs在超纯水中浸出液的pH存在差异(图1(m))。与PE-M、PE-L相比,PE-S的pH较高,这可能是由于小粒径的PE-MPs中的抗氧化剂和稳定剂等添加剂(如二苯甲酮-3)更易释放导致的[39]。土壤溶液中,不同粒径的PE-MPs浸出液pH无显著差异,这主要是因为土壤溶液具有一定的缓冲能力。PE-MPs在超纯水中DOC的释放量为0.02~0.08 mg·g-1(以C计)(图1(n))。PE-S释放的DOC浓度远高于PE-M和PE-L。Romera-Castillo等[40]在PE浸出液中检测到低浓度的DOC(0.26~8.9 μg·cm-2(以C计)),这与我们的研究结果一致。另外,PE-MPs在土壤溶液中DOC的释放量(0.14~0.32 mg·g-1(以C计))远高于超纯水体系,这可能是由于土壤复杂的环境加剧了PE-MPs中添加剂的释放。
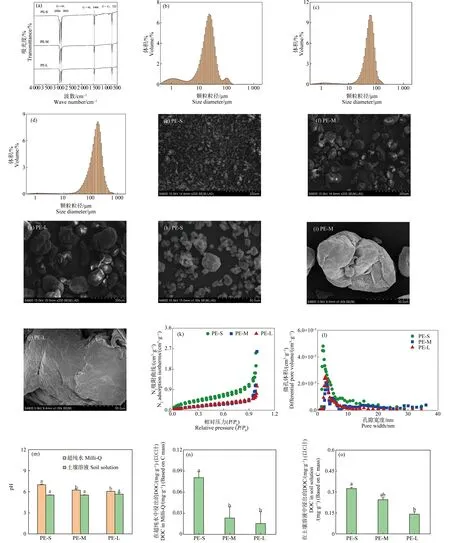
图1 PE-MPs的基本性质注:(a) FTIR;(b)~(d) 粒径分布;(e)~(j) SEM;(k) PE-MPs的N2吸附曲线;(l) PE-MPs的孔径分布;(m) pH;(n)~(o) 溶解性有机碳(DOC);不同字母表示不同处理之间存在显著差异(P<0.05)。Fig. 1 Characterization of PE-MPsNote: (a) FTIR; (b)~(d) Size diameter; (e) ~(j) SEM; (k) N2 adsorption isotherms of PE-MPs; (l) Pore distribution of PE-MPs; (m) pH; (n)~(o) Dissolved organic carbon (DOC); different letters indicate significant difference between different treatments (P<0.05).
2.2 微塑料对西红柿和辣椒种子发芽的影响
PE-MPs对2种作物种子发芽的影响如图2所示。对西红柿而言,PE-S仅在5%的暴露浓度下显著抑制了种子RE和GR,抑制程度分别为31.1%和25.1%(图2(a)~(b))。0.1%、1%、2%和5%暴露浓度下,西红柿种子的茎长显著降低(图2(c)),而在1%~5%的暴露浓度下,其根长受到显著抑制(图2(d))。SVI可反映GR和生长量的综合状况。PE-S仅在高浓度(5%)下显著抑制了西红柿的SVI,抑制率达到50.8%(图2(e))。与PE-S相比,PE-M在1%~5%的暴露浓度下均显著抑制了西红柿种子的RE(图2(a)),但仅在2%的暴露浓度下抑制西红柿种子的GR,抑制率达到14.2%(图2(b))。与RE类似,西红柿的茎长在1%~5%的暴露浓度下受到显著抑制,抑制率为11.5%~34.7%(图2(c))。但仅5%暴露浓度的PE-M显著降低了其根长(图2(d))。此外,2%和5%浓度的PE-M暴露显著降低了西红柿的SVI(图2(e))。对于PE-L,0.5%~5%浓度的MPs暴露均显著抑制了西红柿的RE、GR和种子根长,抑制程度分别为16.1%~24.5%、13.7%~17.8%和7.82%~16.3%(图2(a)~(b), 图2(d))。但PE-L对西红柿茎长的影响呈现低促高抑的趋势,在0.1%的浓度下显著促进了西红柿茎长,在2%和5%的暴露浓度下则对西红柿茎长呈现抑制效果(图2(c))。此外,PE-L在1%~5%的暴露浓度下均不同程度降低了西红柿的SVI,降低程度达到17.8%~33.7%(图2(e))。且不同粒径的PE-MPs在不同浓度下对西红柿种子萌发的影响存在差异。在0.1%的暴露浓度下,PE-M显著提高了西红柿种子的GR。但在0.1%、1%和5%的暴露浓度下,与PE-L相比,对PE-S对西红柿茎长的抑制程度更大。而仅在5%的暴露浓度下,PE-MPs对西红柿根长的影响表现出相似的趋势。
对辣椒而言,PE-S仅在0.1%的暴露浓度下显著提高了其RE,但在0.5%和5%的暴露浓度下显著抑制了其GR(图2(f)~(g))。且PE-S在5%的暴露浓度下均显著抑制了辣椒的茎长、根长和SVI(图2(h)~(j))。区别于PE-S,PE-M对辣椒RE无显著影响(图2(f)),但在5%的浓度下显著降低了辣椒的GR、茎长和根长(图2(h)~(i)),且在0.1%、0.5%、2%和5%浓度的PE-M暴露下均显著抑制了其SVI,抑制程度为9.27%~45.4%(图2(j))。对PE-L而言,仅在5%的浓度下促进了辣椒的RE(图2(f)),但对其GR无显著影响(图2(g))。PE-L在高浓度(2%和5%)下均显著抑制了辣椒种子茎的生长(图2(h)),但对根长的影响呈现低浓度促进高浓度抑制的趋势(图2(i))。此外,高浓度的PE-L也显著抑制了辣椒的SVI,且在5%暴露浓度下抑制程度最大(图2(j))。
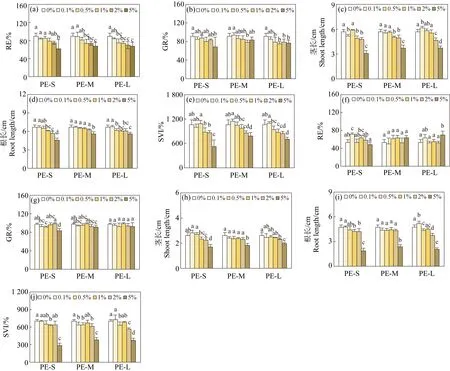
图2 PE-MPs对西红柿(a)~(e)和辣椒(f)~(j)种子萌发的影响注:RE表示种子发芽势;GR表示发芽率;SVI表示种子活力指数;不同字母表示不同处理之间存在显著差异(P<0.05)。Fig. 2 Effect of PE-MPs on seed germination of tomato (a)~(e) and pepper (f)~(j)Note: RE stands for germination potential; GR stands for germination rate; SVI stands for seedling vigour index; different letters indicate significant difference between different treatments (P<0.05).
不同粒径的PE-MPs在不同浓度下对辣椒种子萌发的影响存在差异。在5%的暴露浓度下,与PE-M和PE-L相比,PE-S显著降低了辣椒种子RE和SVI。此外,高浓度(5%)暴露下,PE-M和PE-S对辣椒根长的影响也存在显著差异,与PE-M相比,PE-S对其抑制程度更大。
2.3 微塑料对农作物幼苗生长的影响
为了更好地模拟植物在MPs污染土壤中的生长状况,本研究通过盆栽实验,探究了3种粒径PE-MPs对农作物幼苗生长的影响(图3)。结果显示,对西红柿而言,仅5%暴露浓度的PE-S显著抑制了其株高和地上部鲜质量,抑制程度分别为19.1%和28.7%。但对地下部鲜质量和植物干质量无显著影响(图3(a)~(c))。而不同浓度的PE-M暴露对西红柿幼苗生长无显著影响。此外,不同浓度PE-L暴露对西红柿株高和幼苗干质量无显著影响,但0.5%暴露浓度的PE-L会显著促进西红柿地上部鲜质量,且在0.1%、1%和2%的暴露浓度下对其地下部分鲜质量的抑制程度最大(图3(a)~(c))。对辣椒而言,不同浓度的PE-S暴露对其株高、幼苗鲜质量和地下部鲜质量无显著影响,但5%暴露浓度的PE-S会显著抑制辣椒地上部鲜质量,抑制程度达到40.1%(图3(d)~(f))。而PE-M和PE-L对辣椒幼苗生长无显著影响。
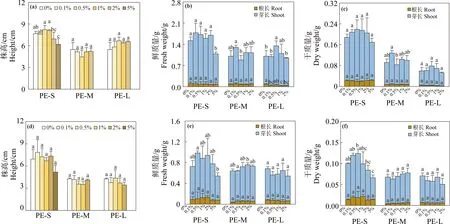
图3 PE-MPs对西红柿(a)~(c)和辣椒(d)~(f)幼苗生长的影响注:不同字母表示不同处理之间存在显著差异(P<0.05)。Fig. 3 Effect of PE-MPs on seedling growth of tomato (a)~(c) and pepper (d)~(f)Note: Different letters indicate significant difference between different treatments (P<0.05).
2.4 微塑料对植物根系的影响
PE-MPs对幼苗根系形态的影响如表2所示。在2%和5%的暴露浓度下,PE-S会显著促进西红柿的根长,促进程度分别为57.4%和39.2%。但不同浓度的PE-S暴露对西红柿根体积、根面积和根尖数均无显著影响。此外,不同浓度下PE-M和PE-L暴露对西红柿根系形态无显著影响(表2)。对辣椒而言,在不同暴露浓度下,不同粒径的PE-MPs对辣椒根系形态均无显著影响(表2)。
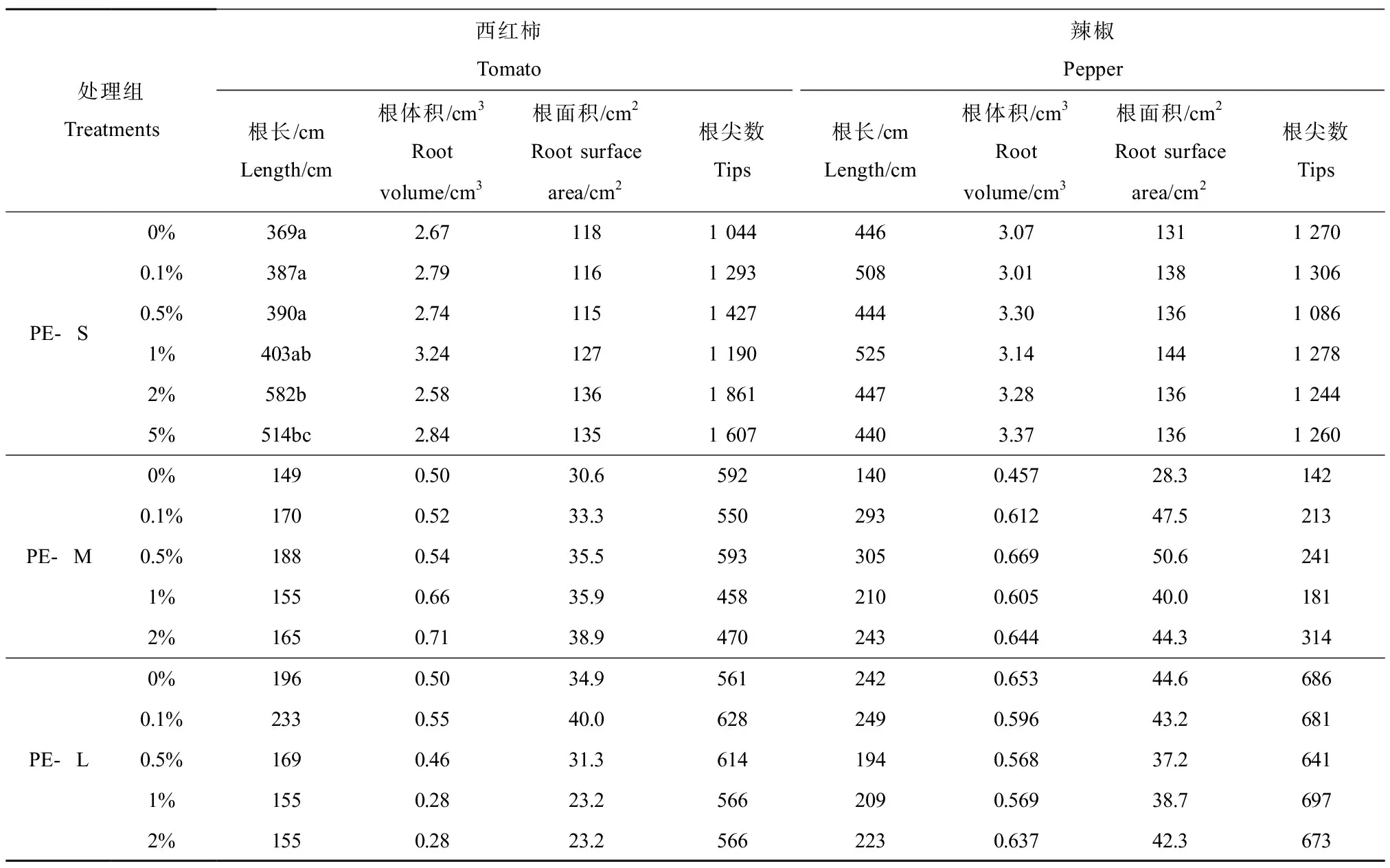
表2 PE-MPs对西红柿和辣椒根系发育的影响Table 2 Effects of PE-MPs on root development of tomato and pepper
不同粒径PE-MPs对作物发芽和幼苗生长阶段的综合影响如图4所示。不同浓度PE-MPs暴露下,西红柿和辣椒的生长状况存在差异。对西红柿而言,高浓度的PE-S和PE-L暴露均抑制了其生长,而PE-M对其影响程度较小。对辣椒而言,在高浓度下不同粒径的PE-MPs均显著抑制其生长,且PE-S对其影响程度较大。PE-MPs对作物的影响与培养环境相关,在更为复杂的土壤环境中,PE-MPs对作物的影响程度减弱。这一结果与发芽和盆栽实验的研究结果一致。对PE-MPs特性与植物生长参数进行相关性分析(图5),发现PE-MPs粒径与RE呈显著负相关,与发芽茎长呈显著正相关,平均孔径影响程度与之相反,这说明在发芽实验中粒径越小、平均孔径越大,对种子萌发的影响程度越大。此外,在幼苗生长阶段,PE-MPs的比表面积与株高呈显著正相关,微孔体积与地下鲜质量和地上干质量呈显著正相关,这说明在土壤环境中MPs的孔隙越多,可能越有利于植物生长。
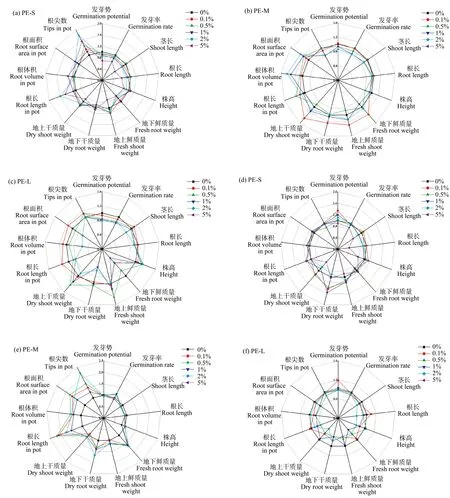
图4 PE-MPs对西红柿(a)~(c)和辣椒(d)~(f)种子发芽和幼苗生长影响的总览图Fig. 4 Overview of the effects of PE-MPs on germination and seedling growth of tomato (a)~(c) and pepper (d)~(f)
3 讨论(Discussion)
3.1 微塑料对西红柿和辣椒种子发芽的影响
种子萌发是植物生长、发育繁殖的决定性过程,是植物生命周期中最关键的阶段[41],对生物多样性的形成具有重要的生态意义。污染物对种子萌发的影响是判断其对植物毒性效应的首要指标。本研究发现随着暴露浓度的增加,PE-MPs对植物种子萌发率和活力抑制程度增强(图2)。这可能是由于PE-MPs在种子表皮和根毛上积累,造成物理堵塞,降低种子活性导致的(图2)。这与Bosker等[42]的研究结果一致,其发现MPs可能在水芹种子(LepidiumsativumL.)的表皮和根系积累,抑制种子萌发和根系生长。此外,PE-MPs对种子发芽的抑制效果也可能与其有毒添加剂的浸出高度相关。在发芽后期,高浓度(5%)MPs对幼苗茎长和根长抑制最显著,这可能是由于PE-MPs有毒添加剂的释放导致了活性氧积累[26],诱导植物产生氧化应激[20],且碳水化合物相关代谢酶活性受限,损害了植物自身的调节网络[43]。Pearson相关性分析发现MPs粒径与种子RE呈显著负相关,与发芽种子茎长呈正相关,说明PE-MPs的粒径对种子萌发具有重要影响(图5)。导致这种现象的原因可能是由于PE-MPs粒径越大,在种子表皮越易聚集,物理堵塞效果更强,导致发芽势显著降低。但随根系的伸长及根毛的发育,物理堵塞对其影响程度逐渐减小。MPs添加剂的积累诱导的氧化损伤成为抑制种子发芽的主要因素。PE-MPs的粒径越小,其浸出液的pH越高、DOC含量越大,对植物根系的损伤可能越剧烈。此外,小粒径的MPs更易进入植物组织[23],并在根中积累,堵塞营养物质的运输,因而,粒径越小,对发芽种子茎长的抑制程度越强。目前已有大量研究表明,纳米(1~100 nm)、亚微米(100 nm~1 μm)和微米(1~5 μm)尺寸的MPs可被拟南芥、小麦等植物根系吸收,并通过蒸腾作用在植物体内迁移扩散[22, 28]。微塑料进入植物体的方式主要包括质外体途径、木质部通路和裂缝进入模式[22, 26, 28]。本研究发现,在5%的暴露浓度下,与其他2种粒径相比,PE-S对种子萌发的抑制程度更大,这可能是由于PE-S中存在的亚微米级塑料(图2(a)~(b)),通过质外体通路及裂缝进入模式在作物中积累,进而抑制植物生长[22, 28]。然而,Lian等[26]研究发现0.01~10 mg·L-1的PS-NPs对小麦种子萌发没有影响,且对其幼苗生长呈现促进效果。这主要是由于PS-NPs暴露调节了小麦能量代谢和氨基酸代谢水平,加速了能量的产生过程。这种差异可能与植物和MPs的类型差异有关。不同植物具有不同的种皮结构和根结构,对外界胁迫的响应存在差异。而不同种类的MPs由于颗粒本身化学结构及添加剂的不同对植物的影响存在差异。因此,为了更好地了解土壤-植物系统中塑料残留对植物萌发的影响,需要进一步研究不同粒径和类型的MPs暴露对不同植物的生态效应。
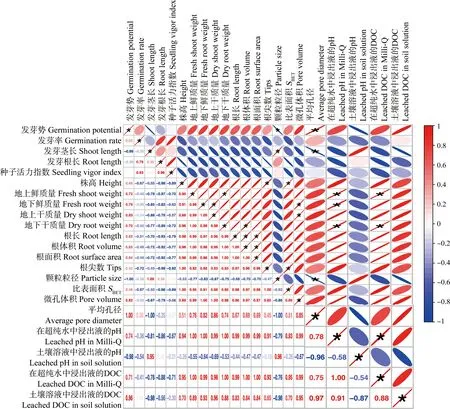
图5 PE-MPs特性与植物生长参数的相关性分析注:从蓝色到红色代表皮尔逊相关系数从-1到1的变化,*表示P<0.05。Fig. 5 Pearson correlation analysis of basic properties of PE-MPs and plant growthNote: Colors from blue to red represent changes in the Pearson correlation coefficient from -1 to 1, and * represents P<0.05.
3.2 微塑料对作物幼苗生长的影响
作物幼苗期是其生长发育的关键环节,幼苗期作物的生长发育直接影响果实的产量和品质,是植物生命周期中的重要阶段。由于幼苗期作物的脆弱性和敏感性,探究该阶段污染物对幼苗生长发育的影响对于明确污染物的生态风险具有重大意义。大量的研究发现氧化锌、氧化钛等纳米颗粒暴露可以内化到植物中,在植物幼苗和细胞水平上造成毒性效应[44]。区别于纳米材料,MPs具有非天然聚合物结构以及含有丰富的异生物质,具有物理和化学综合效应,其对幼苗生长发育的影响不容忽视[4]。本研究发现,5%暴露浓度的PE-S会显著抑制西红柿和辣椒幼苗的生长。这可能是由于PE-MPs在植物根部聚集,阻碍植物对水分及营养物质的吸收进而抑制植物生长[45](图6)。此外,MPs添加剂如抗氧化剂(三亚磷酸酯、二十八烷基二硫化物)、稳定剂(氧化钙、碳酸镁)、阻燃剂(氢氧化铝、三氧化二锑)和着色剂(铜、不溶性有机颜料)等的浸出也是抑制植物生长的重要因素[46]。这些化学物质可能改变幼苗中活性氧(ROS)代谢酶的活性[28],扰乱植物中的氧化还原稳态[20]、碳水化合物代谢和植物激素调节网络进而抑制其生长[43]。此外,进入土壤中的MPs还可以通过改变土壤结构,影响土壤肥力和养分,改变土壤微生物的群落结构影响植物生长[18-20]。本研究中,与发芽实验相比,盆栽实验PE-MPs对作物的毒性显著降低(图2和图3)。这可能是由于土壤作为一个较复杂的生态体系,作物在其中的生长受到土壤理化性质、酶和微生物等多种因素的调节。PE-MPs暴露后,能有效促进土壤团聚体的形成,降低植物根部的穿透阻力,改善土壤通气性,进而降低PE-MPs对植物的毒性[18]。目前大量的研究基于水培体系[26, 41, 44],由于培养体系相对单一,忽视了MPs在复杂土壤环境中的生态效应,可能高估了MPs的生态毒性。此外,微生物在植物生长发育过程中发挥重要作用,PE-MPs暴露可能缓解其他污染物对土壤微生物群落结构的影响,进而缓解植物微生物组的变化,调节植物生长发育[47]。Dong等[48]发现聚苯乙烯、聚四氟乙烯和砷共同暴露降低了土壤中变形菌门(Proteobacteria)的丰度,增加了绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)的丰度,且MPs的加入抑制了砷对根际土壤微生物和化学性质的影响。MPs对土壤的影响很大程度上取决于MPs的浓度和暴露时间[9]。本研究中,可能由于土壤复杂的物理环境,微生物的作用促进了土壤C、N、P等养分循环,提升了土壤的养分有效性[19]。土壤作为一个复杂的生态系统,残留的MPs也可能富集其他污染物(如抗生素、有机污染物)[49],部分耐药菌及人类致病菌也可能在其上定殖,从而加剧MPs的植物毒性[4],这需要未来进一步研究。
图6 PE-MPs对植物生长的影响Fig. 6 Effect of PE-MPs on plant growth
植物多样性是陆地生态系统的关键属性,有超过30万种可食用的植物,构成了人类的主要食物来源[50]。因植物具有较高的遗传多样性,它们对外界刺激和环境胁迫的反应可能不同,因此预期会出现物种依赖性反应[51]。本研究发现,PE-MPs对西红柿和辣椒的毒性效果存在差异(图3)。不同植物的种皮结构和根系结构(木质部和韧皮部)的差异可能会影响种皮对污染物的渗透能力,这可能是导致物种依赖反应的关键因素之一[44]。不同植物除了遗传多样性的差异外,种子大小也可能是影响种子萌发和生长的重要因素。粒径较小的种子因具有较高的表面积与体积比而有助于促进植物与污染物的相互作用[51]。另外,目前的研究大多只关注了MPs暴露对单一植物生长的影响,忽视了MPs对植物群落的影响。当前仅有一篇文章报道了MPs暴露会改变温带草原生态系统中植物群落的结构,影响植物物种的优势度,但对于其他环境尤其是农业生态系统中植物群落的影响尚无报道。因此,在以后的实验中要关注不同种类植物对MPs的响应,尤其应关注MPs对植物群落的影响,以加深对MPs在土壤-植物生态系统中的环境行为和生态风险的认识。
3.3 微塑料对植物根系的影响
根系是植物的重要组成部分,它具有固着、支撑、吸收、输导、合成、储藏和繁殖等多方面的功能,在生态系统物质和能量循环中发挥着十分重要的作用[27]。植物面对环境胁迫时可以通过促进根系延伸来应对压力环境[52]。本研究发现,随着暴露浓度的增加,PE-S会显著促进西红柿幼苗根系的伸长,而对辣椒而言,PE-M对其影响更大(表2)。这可能是由于进入土壤中的PE-MPs降低了土壤容重,增加了土壤孔隙度和通气性[18],促进了植物根系在土壤中的延伸,诱导根系胁迫导致的。此外,也有大量研究表明MPs暴露会降低植物根系水通道蛋白的活性,诱导氧化应激,改变根系抗氧化酶的含量,降低根系生物量[20, 42]。如Sun等[28]研究发现PS-NH2纳米塑料可以诱导根系分泌物的形成,促进根中活性氧的积累,改变根表皮细胞的形状,促进根成熟区肿胀,加剧根系损伤。MPs对植物根系的影响可能与塑料类型、粒径、浓度以及植物种类有关。因此,在以后的实验中要关注不同种类和粒径的MPs对植物根系形态及发育的影响,以明确MPs对植物生长的潜在胁迫。
本研究采用不同浓度的PE-MPs探究其对不同植物种子萌发和幼苗生长的影响。然而,本研究未测定PE-MPs暴露前后土壤相关指标的变化情况以及微生物群落结构的变化,不能确定影响幼苗生长的直接或间接因素,也未考虑MPs颗粒本及其添加剂对植物生长影响的贡献。因此。未来的研究应进一步揭示MPs特性及其添加剂释放的规律,明确MPs性状与毒性效应之间的内在机制,揭示MPs颗粒本身与添加剂对植物生长影响的贡献度。此外,本研究的另一个局限是选取单一塑料在实验室规模进行实验,未来的研究中应该选取不同类型的MPs进行田间实验,确定不同种类的微塑料对自然条件下植物生长的影响。

