重症监护病房耐碳青霉烯类肺炎克雷伯菌分子流行病学研究
杨程茹,王 英,李 莹,张吉生,曾令怡,胡可望,张晓丽
(1. 佳木斯大学附属第一医院检验科,黑龙江 佳木斯 154007;2. 重庆医科大学附属永川医院检验科,重庆 402160;3. 重庆医科大学附属永川医院核医学科,重庆 402160)
肺炎克雷伯菌(Klebsiellapneumoniae, KP)是一种临床常见病原体,可引起伤口、呼吸道、泌尿道和胸腔积液多种感染[1]。由于碳青霉烯类抗生素的使用,导致耐碳青霉烯类肺炎克雷伯菌(carbape-nem-resistantKlebsiellapneumoniae, CRKP)已在全球范围内流行。据报道,北美、南美、欧洲和亚洲CRKP的病死率分别为33.24%、46.71%、50.06%和44.82%,严重威胁着全球公共安全[2]。产碳青霉烯酶是CRKP主要的耐药机制,因编码碳青霉烯酶基因可位于基因组(染色体)DNA或质粒上,并可通过质粒进行水平转移,所以在同一医院同一病区更易发生CRKP克隆传播和水平传播。本研究分析重症监护病房(ICU)临床CRKP菌株,明确其耐药机制及快速传播途径,为医院感染控制提供分子流行病学依据。
1 对象与方法
1.1 研究对象 重庆医科大学附属永川医院2018年7月—2020年7月ICU患者分离的51株CRKP,无重复分离株。
1.2 菌株鉴定及药敏试验 采用法国生物梅里埃公司VITEK 2 Compact 全自动微生物分析仪鉴定菌株以及进行药敏试验,根据美国临床和实验室标准协会(CLSI)2020年版指南的规定,选取对碳青霉烯类(亚胺培南、美罗培南或厄他培南)耐药的临床分离株。所有患者信息均从电子病历中获得,包括年龄、性别、入住ICU的时间、诊断和转归等信息。微量肉汤稀释法检测亚胺培南(IMP)、美罗培南(MEM)、左氧氟沙星(LEV)、阿米卡星(AK)、多粘菌素B(PB)、替加环素(TIG)和头孢他啶/阿维巴坦(CAZ/AVI)的最低抑菌浓度(MIC)。ATCC 25922、ATCC 700603和BAA-1705作为质控菌株,3次平行检测。TIG药敏结果根据欧洲抗菌药物敏感性试验委员会(EUCAST)的标准判读,其他抗菌药物的药敏结果根据2020年版CLSI标准判读。接合菌株EC600由浙江邵逸夫医院俞云松教授团队惠赠。
1.3 高黏液表型及耐药表型检测 采用拉丝试验方法,用接种环挑取血琼脂平板上新鲜菌落进行牵拉,黏液丝形成且长度≥5 mm则判断为高黏液表型阳性,反之判断为阴性。同时采用mCIM和eCIM方法检测CRKP中碳青霉烯酶。按2020年版CLSI操作。
1.4 碳青霉烯酶等耐药基因和毒力基因检测 采用煮沸法[3]提取菌株DNA。参照文献[4-7]设计引物,引物由上海生工生物工程公司合成,包括碳青霉烯酶基因(blaKPC、blaNDM、blaIMP-4、blaIMP-8、blaVIM-1、blaVIM-2和blaOXA-48)、ESBLs基因(blaSHV、blaTEM、blaCTX-M-1和blaCTX-M-9)、AmpC β-内酰胺酶基因(blaDHA和blaACC)、喹诺酮类耐药基因[qnrA、qnrB、qnrS、qepA和aac(6’)lb-cr],以及质粒介导的多粘菌素耐药基因(mcr-1和mcr-9),染色体介导的多粘菌素耐药基因(mgrB、pmrA、pmrB、phoP和phoQ)。毒力基因包括:fim-H、magA、aero、allS、iroNB、kpn、mrkD、rmpA、uge和wcaG。阳性扩增产物送上海生工生物工程公司进行测序,并在BLAST中比对测序结果(https://blast.ncbi.nlm.nih.gov/Blast.cgi) 。
1.5 质粒接合试验 供体菌(CRKP)和受体菌(大肠埃希菌EC600)1∶3混合于LB肉汤中,将混合物置于贴有滤膜的血平板上,在双抗LB平板(含利福平600 μg/mL,美罗培南1 μg/mL)上筛选接合子。双抗平板上生长的菌株检测16S rRNA确认为大肠埃希菌,并检测耐药基因。
1.6 同源性分析 采用多位点序列分型(MLST)和脉冲场凝胶电泳(PFGE)进行同源性分析。 扩增肺炎克雷伯菌7个管家基因进行MLST分析(http://bigsdb.pasteur.fr/klebsiella/primers_used.html)。将PCR扩增阳性产物的测序序列上传至MLST数据库(https://bigsdb.pasteur.fr/klebsiella/klebsiella.html)。限制性内切酶Xba1在37℃下酶切,用Bio-Rad Chef Mapper系统在1%脉冲场认证的琼脂糖凝胶上分离,18 h,14℃,电压6 V/cm,使用BioNumerics软件分析条带图谱。分析采用未加权对组法和算术平均法(UPGMA),用dice系数判断菌株的亲缘关系,聚类定义为相似度≥80%。
2 结果
2.1 菌株来源及药敏结果 51株CRKP标本来源分别为痰31株(60.8%),肺泡灌洗液13株(25.5%),尿4株(7.8%),血2株(3.9%),分泌物1株(2.0%)。根据ICU分布图(图1),标本来源Ⅰ区13株(25.5%),Ⅱ区6株(11.8%),Ⅲ区8株(15.7%),Ⅳ区13株(25.5%),Ⅴ区5株(9.8%),Ⅵ区0株以及Ⅶ区6株 (11.8%)。45例(88.2%)患者有肺部疾病,其中44例(86.3%)接受了侵入性手术治疗(气管插管或有创通气)。51株CRKP对IMP、MEM、头孢他啶(CAZ)、LEV、AK、PB和TIG的耐药率分别为96.1%(49株)、98.0%(50株)、100.0%(51株)、98.0%(50株)、49.0%(25株)、64.7%(33株)和3.9%(2株),对CAZ/AVI敏感率100%,见图2。
2.2 毒力及耐药表型检测 51株CRKP中,仅4株(7.8%)在拉丝试验中表现为高黏液表型。mCIM试验阳性率为96.1%(49/51),其中mCIM阳性的CRKP中,1株eCIM阳性。见图3。
2.3 耐药基因和毒力基因检测结果 51株CRKP检出1种碳青霉烯类耐药基因blaKPC-2,3种ESBLs基因(blaSHV、blaTEM、blaCTX-M-65),未检出AmpC β-内酰胺酶基因(blaDHA、blaACC)。质粒介导的喹诺酮类耐药基因(PMQR)仅检出qnrS和aac(6’)lb-cr,均为1株。33株PB耐药菌株未检出质粒介导的PB耐药基因mcr-1和mcr-9,而染色体介导的PB耐药基因pmrA、pmrB、phoP和phoQ均表达,其中pmrA基因中未发现突变;但在pmrB基因发现了N8T、T228A、R256G、L254F、A246T 5种不同类型的突变,在phoP基因中发现了I201F突变,在phoQ基因中发现了D150G的突变;在mgrB基因中,也发现了IS3、IS1341和IS5不同类型的插入序列。检出毒力基因uge、mrkD、kpn和fim-H,未检测到wcaG、iroNB、allS和magA。仅1株菌(CRKP59)同时检出aero和rmpA。见表1。
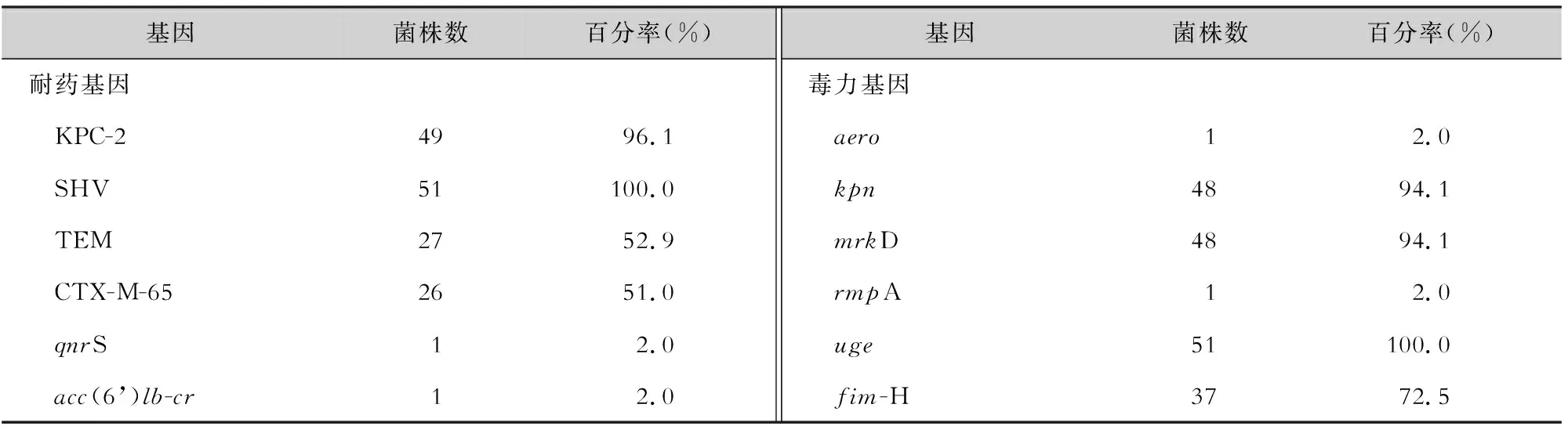
表1 51株CRKP菌株耐药基因和毒力基因检出情况
2.4 同源性分析 51株CRKP依据MLST分析共鉴定出2种ST分型,其中ST11型50株(98.0%),ST1373型1株(2.0%)。根据国际标准对PFGE结果进行解释,将所有分离物分为5个不同的克隆群(A~E),A群32株(62.7%),B群11株(21.6%),C群4株(7.8%),D群3株(5.9%),以上均属于ST11;E群(2.0%)1株,属于ST1373。两种检测方法均显示ICU中CRKP具有很高的同源性。见图2。
2.5 接合试验结果 49株携带blaKPC-2基因的菌株进行接合试验,6株CRKP接合成功,接合成功率为12.2%。采用PCR检测接合子耐药基因携带情况,采用药敏试验检测接合子药敏情况,原始菌株与接合子在接合前后各基因的携带情况及MIC值变化见表2。
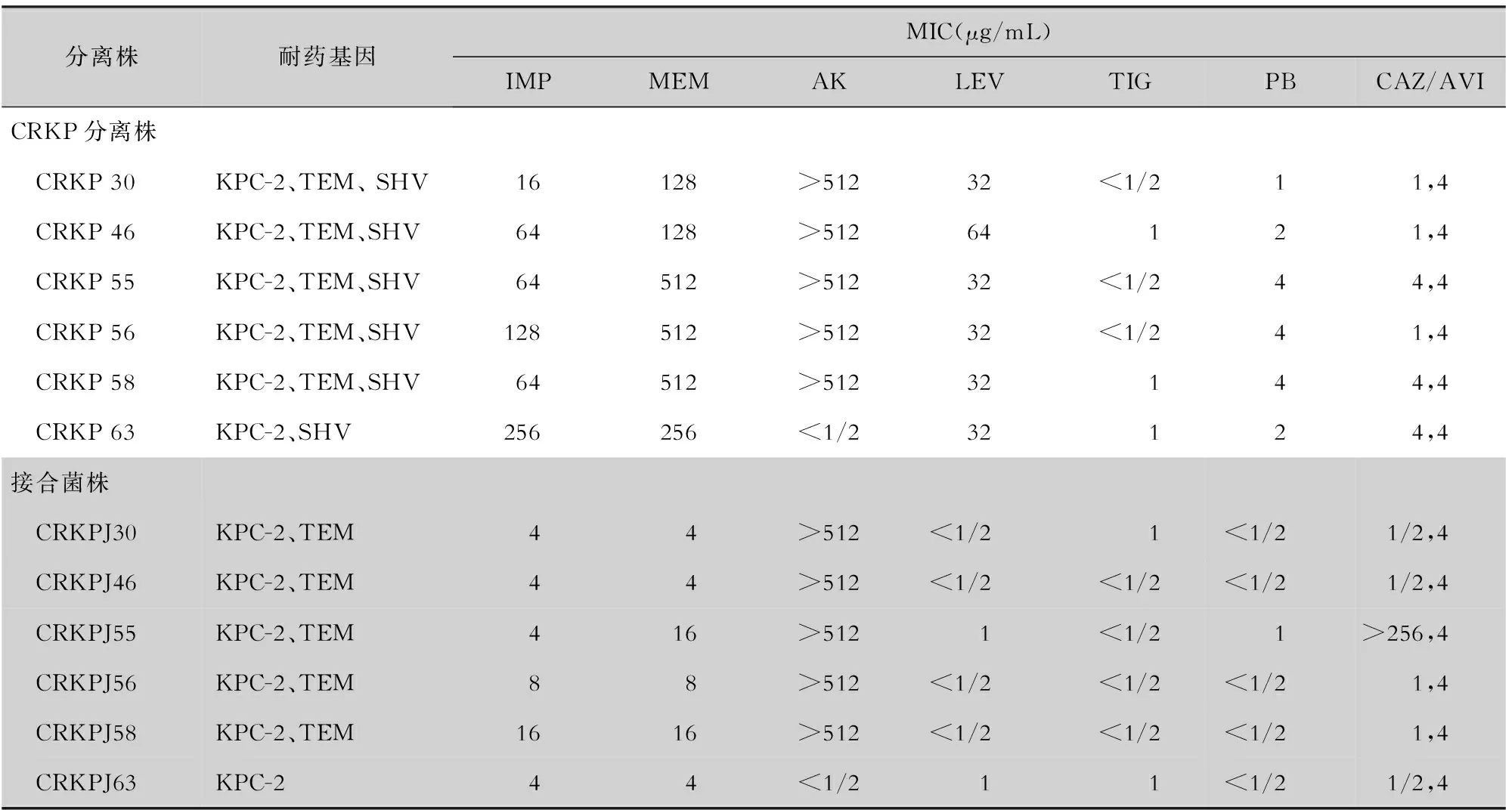
表2 CRKP原始菌株及接合子的耐药基因携带情况及药敏结果
3 讨论
2019年CHINET细菌耐药检测网报道,全国、重庆和ICU CRKP检出率分别由2014年的6.4%、2.5%和14.7%上升至2019年的10.9%、5.5%和23%[8],应加强抗菌药物合理使用的管理以及医院感染防控工作,减缓CRKP检出率的持续上升。本研究针对2018年7月—2020年7月重庆医科大学附属永川医院ICU CRKP暴发进行回顾性分析,为感染控制及其治疗提供实验室数据。
国内流行的CRKP主要以携带blaKPC-2基因的ST11为主[9-10],ICU患者CRKP感染率以及病死率均很高[11]。本研究中,49株mCIM阳性的菌株均携带KPC-2耐药基因,且MLST均属于ST11,与我国流行的基因型及克隆型一致[9]。同时所有菌株通过PFGE分成五簇,其中A、B、C、D四个簇的同源性非常高,均是ST11型。在两种同源性分析方法中CRKP59均独立成一型,分别为ST1373和E簇。分析ICU空间位置分布及患者感染时间图(图1、3)得出,携带blaKPC-2和blaSHV基因的ST11耐药菌首先出现在Ⅳ区,并逐渐扩散到除Ⅵ区(可能与该区床位较少有关)外的其他相邻区域,在Ⅰ区停留的时间最长,其中Ⅰ和Ⅳ区检出数最高(均为13株),以A簇为主(20株)。单独成一型的CRKP59菌株在Ⅲ区检出,并且与该区上次耐药菌检出时间间隔大约6个月。携带blaKPC-2基因的ST11型CRKP暴发时间主要集中在2019年1月—10月,持续10个月之久。医院受新型冠状病毒肺炎疫情的影响,从2020年1月开始患者量有所下降,CRKP主要集中在Ⅰ区。针对此次ST11型CRKP在ICU暴发流行可追溯到某一菌株在不同区域间的水平传播,需重视对耐药菌的监测及追踪,及时与病区工作人员沟通,加强医院感染防控意识,以及病区的卫生与仪器设备的清洁消毒及医护工作者手卫生的管理,更好地控制CRKP的播散。
此次暴发的菌株中,均对至少一种碳青霉烯类药物耐药,表型结果提示ICU内CRKP的耐药机制以产丝氨酸酶为主,仅有1株(CRKP52)eCIM阳性,但PCR方法未检测到本研究所用引物覆盖范围内的金属β-内酰胺酶基因(MBLs),因此推测该细菌可能会产生其他超出范围的MBLs,如blaSPM、blaGIM、blaSIM和blaAIM。KPC-2是本研究中的关键酶,其余耐药基因也有检出,与之前报道[12]一致,表明携带多种灭活酶是多重耐药的主要机制。携带blaKPC-2基因是ICU中大多数CRKP产生耐药的主要原因,blaKPC-2是一种典型的质粒介导的耐药基因,广泛分布于不同大小和类型的质粒中,这些质粒通常包含几个编码对氨基糖苷类、喹诺酮类、四环素类等耐药的其他耐药基因,并且高风险克隆促进不同的质粒、移动元件和耐药基因在CRKP中传播[13],接合试验的成功证明耐药质粒的可转移性。blaTEM基因通常是blaKPC-2基因遗传环境的一部分[14],结果显示,这两个基因都在质粒内转移。在欧洲和美国,携带blaKPC基因的移动元件以Tn4401转座子为主,而我国ST11 CRKP以Tn1721转座子为主,说明blaKPC基因周围环境存在一定的可变性及多样性,是blaKPC基因在全球有效传播的主要原因[15]。耐药质粒的水平传递可以加速多重耐药基因的扩散,介导多重耐药菌的产生。接合试验结果还表明,接合子的碳青霉烯类抗生素MIC值降低,说明还有其他耐药原因,如膜蛋白、外排泵等不随质粒转移。
除碳青霉烯类药物外,ICU患者对头孢菌素类、AK、LEV表现出不同程度的耐药。值得注意的是,由于未检测到很高的PMQR,推测可能与染色体介导的喹诺酮类药物耐药决定区(QRDR)有关[16],这些CRKP可能在gyrA、parC基因和其他位点有突变,同时接合子对喹诺酮类药物敏感性提高也证实了该假设,说明耐药性基因没有随质粒转移,而是可能存在其他的耐药原因,如靶位染色体突变或者孔蛋白丢失等等。同时检出较高的多粘菌素耐药性(PR),由于多粘菌素被认为是治疗CRKP感染的最后手段,尽管多粘菌素具有毒性强等不良反应,但由于效果好,在过去的几年中还是被广泛地使用[17]。多粘菌素暴露是PR出现的主要原因[17],但本研究中,仅1例患者接受了PB的治疗。所以检测了多粘菌素相关耐药基因,未检测到mcr-1及mcr-9基因,但与染色体介导的双组份调节基因phoP/phoQ以及pmrB的突变、mgrB基因中插入序列的存在,其他学者的研究[18-19]也发现了类似结果,并且CRKP接合子对多粘菌素的敏感性提高,均表明研究中染色体变化是介导多粘菌素耐药的重要原因之一。本研究中所有菌株对CAZ/AVI均敏感,该药可作为该院产KPC酶CRKP的一种有效治疗选择。鉴定出的接合子CRKPJ55对CAZ/AVI产生耐药,而供体菌并未表现耐药,KPC-2没有发生氨基酸变异,后续研究将进一步分析其与抗生素压力下转录组表达的差异是否有关。
由于拉丝试验对CRKP的毒力检测敏感率低,有学者[20]将拉丝试验和rmpA基因均阳性的菌株定义为高毒力肺炎克雷伯菌(hvKP)。本组研究发现,ICU中仅检出1株(2.0%)hvKP(拉丝试验阳性的基础上同时携带rmpA和aero),低于其他报道[21]。研究鉴定的ST1373 hvKP对IMP、LEV、AK和TIG保持敏感性,可能是由于携带的耐药基因数量较少所致。然而,除了ST1373 hvKP以外的其他菌株,与细菌定殖、菌毛黏附相关的fimH、mrkD和kpn,与细菌脂多糖相关的uge毒力基因检出率高,表明毒力风险依然存在。88.2%的患者患有肺部疾病,60.8%的标本来自痰,由于患者呼吸受阻,44例(86.2%)患者接受了气管插管和气管切开等侵入性手术。研究[22]指出,有创机械通气和肠外营养≥48 h是感染的危险因素。因此,应尽早拆除ICU中不必要的侵入性操作,预防医院获得性感染,并尽快建立肠内营养,以减少危险因素。
总之,针对此次 ST11 CRKP在该院ICU的暴发流行,耐药机制主要为携带blaKPC-2基因,并可以通过接合水平传播,虽然未对ICU污染区域进行长期、系统的抽样,但有必要了解CRKP的动态分布和传播,这是临床治疗中不容忽视的问题。及时、有效地采取感染控制措施对于减轻和控制医院感染传播和暴发的风险至关重要。根据欧洲临床微生物学和传染病学会(ESCMID)的指南,应实施手卫生教育计划,采取接触预防措施,并使用警告码及时识别CRKP感染患者,并应隔离感染患者。此外,应实施积极筛查培养和抗菌药物使用管理计划,以减少多重耐药革兰阴性菌在医院患者中的传播,特别是在ICU中[23]。
利益冲突:所有作者均声明不存在利益冲突。

