河南地区猪源沙门菌血清型4,[5],12:i:-的分离鉴定及耐药性分析
蒋增海,王成龙,冯兰珠,胡敏杰,邓同炜,徐耀辉,何启盖
(1.河南牧业经济学院动物医药学院,河南 郑州 450046;2.河南省猪病防控工程技术研究中心,河南 郑州 450046;3.华中农业大学农业微生物国家重点实验室,湖北 武汉 430070)
沙门菌血清型4,[5],12:i:-,缺乏2 相鞭毛抗原表达,是一种鼠伤寒单相变种[1],也是近年来感染人类最普遍的沙门菌血清型之一[2]。在20 世纪90 年代中期以前,很少分离到沙门菌血清型4,[5],12:i:-。然而,在过去的十多年里,沙门菌血清型4,[5],12:i:-已经成为欧洲和美国主要的公共卫生威胁,在全球多个国家的检出率大幅度增加,并引起多次危害严重的沙门菌病疫情的暴发[3]。最近研究表明,沙门菌血清型4,[5],12:i:-已经在河南省病人中的流行,首次超过鼠伤寒沙门菌,排在第二位,仅次于肠炎沙门菌[4]。
美国爱荷华州兽医诊断实验室检测结果表明,自从2014 年开始,沙门菌血清型4,[5],12:i:-已经成为从猪临床样品中鉴定出的最主要血清型,而鼠伤寒沙门菌成为排在第二位的血清型[5];通过猪临床病例分析,已经证实沙门菌血清型4,[5],12:i:-的阳性分离与其出现肠道沙门菌病病变之间呈强正相关,表明该菌型具有与鼠伤寒沙门菌相似的致病潜力[6],但是沙门菌血清型4,[5],12:i:-在我国猪群中的感染情况尚无相关报道。为了调查沙门菌血清型4,[5],12:i:-在河南地区猪的流行状况,本研究于2015 年9 月~2018 年12 月,从河南地区猪场送检的63 个临床病例中,分别采集肺、心血、肝等病料样品,进行沙门菌的分离鉴定、血清型分型和耐药性检测。
1 材料与方法
1.1 病料样品来源2015 年9 月~2018 年12 月,从河南郑州、新乡、鹤壁、许昌、商丘、平顶山、周口、洛阳、开封、驻马店、南阳和漯河等地送检的病猪或死猪,采集肺、心血、肝等病料样品,进行沙门菌的分离鉴定。
1.2 主要试剂胰蛋白酶大豆琼脂(TSA)、胰蛋白酶大豆肉汤(TSB)购自美国BD 公司;S.S 琼脂购自北京奥博星生物有限公司;5%鲜血琼脂平板购自江门市凯林贸易有限公司;MH 肉汤购自英国Oxoid 公司;烟酰胺腺嘌呤二核苷酸(NAD)购自索宝来公司;PremixTaqTM、DL2000 DNA Marker 购自TaKaRa公司;核酸染料购自天恩泽公司;快速革兰氏染色液购自珠海贝索生物技术有限公司;沙门菌属诊断阳性血清购自宁波天润生物药物有限公司;鼠伤寒沙门菌鞭毛抗原诱导血清购自日本生研株式会社;各种抗菌药物均由浙江大学乐敏教授惠赠。
1.3 细菌的分离培养在严格无菌操作条件下,采集病猪或死猪的肺、心血、肝等病料样品,分区划线接种于TSA 平板(加有5%犊牛血清和0.01% NAD),37 ℃恒温培养12 h~24 h,挑取疑似为沙门菌的单菌落(要求在第一代平板上菌落生长均匀一致,无其他杂菌生长,保证为单一病原菌的感染),分别划线接种于血琼脂平板、S.S琼脂平板,如此纯化2~3代;再挑取纯化后的单菌落,接种于TSB肉汤,37 ℃摇床培养8 h~12 h,利用灭菌的20%甘油溶液,保存于-80 ℃备用。挑取在S.S 琼脂平板上生长为均匀一致的疑似沙门菌的单菌落,进行抹片,火焰固定后,采用革兰氏染色液染色,在油镜下观察分离细菌的形态特征。
1.4 分离菌的PCR 鉴定挑取纯化后的疑似沙门菌的单菌落,接种于5 mL TSB 肉汤,37 ℃摇床振荡培养4 h~8 h,取1 mL 菌液经煮沸法提取分离细菌的DNA 作为模板,利用文献[7]的沙门菌肠毒素Stn基因的引物(Stn-F: 5'-CTTTGGTCGTAAAATAAGGC G-3'/Stn-R: 5'-TGCCCAAAGCAGAGAGATTC-3')经PCR 鉴定。PCR 反应条件:94 ℃5 min;94 ℃1 min,55 ℃45 s,72 ℃30 s,共30 个循环;72 ℃10 min。PCR 产物经1%琼脂糖凝胶电泳检测。
1.5 分离菌的血清分型和沙门菌血清型4,[5],12:i:-的鉴定采用玻片凝集法对分离的沙门菌进行血清分型,以生理盐水为阴性对照,具体操作按照说明进行,根据Kauffmann-White 抗原表[8]检索沙门菌分离菌株的血清型,另外根据分离菌株的部分生化特征和培养特征,进一步确认某些分离菌株是猪霍乱沙门菌,还是猪霍乱沙门菌孔成道夫变种。对于初步鉴定为沙门菌血清型4,[5],12:i:-的菌株,通过鞭毛相抗原诱导转化方法[9],进一步验证第2 相鞭毛抗原表达的缺失,即利用沙门菌1 相鞭毛i 抗原的阳性血清与被检菌株共培养,通过搭建纸桥的方法,被检菌通过纸桥迁移后,生长在桥的另一端;这些生长在纸桥另一端的被检菌,就可能会发生鞭毛相抗原的转化,再利用血清型方法,进一步鉴定其2 相鞭毛抗原表达是否缺失。
通过Tennant 等建立的双重PCR 法[10],进一步验证分离菌株的血清型。如果分离菌株为鼠伤寒沙门菌,或者沙门菌血清型4,[5],12:i:-,则均能扩增出长度为1 000 bp 的IS200 基因的目的条带,其他沙门菌则扩增出250 bp 的IS200 基因的目的条带和1 380 bp 的第2 相鞭毛基因(fljB)条带;如果分离菌株为鼠伤寒沙门菌,也能够扩增出1 380 bp 的fljB基因条带,而沙门菌血清型4,[5],12:i:-由于缺乏fljB基因,不能扩增出1 380 bp 的fljB基因条带。
1.6 药敏试验选取氨苄西林(AMP)、阿莫西林/克拉维素(AMC)、头孢噻呋(EFT)、头孢曲松(CRO)、头孢西丁(CX)、庆大霉素(GEN)、卡那霉素(K)、链霉素(STR)、四环素(TE)、环丙沙星(CIP)、萘啶酸(NAL)、磺胺甲恶唑/甲氧苄啶(SXT)、磺胺甲基异恶唑(SF)、粘杆菌素(CT)、阿奇霉素(AZI)、 氯霉素(CHL)16 种药物,以大肠杆菌(ATCC25922)为质控菌株,依据参考文献[11-12],采用微量稀释法检测分离菌对上述16 种药物的最低抑菌浓度(MIC),测定分离菌株的耐药性。
2 结 果
2.1 细菌的分离培养结果针对送检的63 个仔猪病例,分别采集肺、心血、肝等病料样品,划线接种于TSA 平板,经24 h~48 h 培养,在TSA 平板上生长出圆形、湿润、半透明、直径约1 mm~2 mm大小一致的菌落(图1A);在血琼脂平板上则生长为无色透明、圆形、边缘整齐、湿润的大小约为0.5 mm~2 mm菌落,且无溶血现象;在S.S 琼脂平板上生长为中央有黑心的湿润圆形菌落(图1B)。分离菌通过革兰氏染色后,在显微镜下观察,均为革兰氏阴性、短小、中等大小杆菌。上述结果初步表明,从63个送检仔猪病例的病料样品中共分离到6 株疑似沙门菌,阳性分离率为9.52%(6/63),分别命名为Sep1、Sq2N、Qxo1L、Xinmi、SwG、Pyx(表1)。

图1 分离菌株菌落生长特征Fig.1 Colonial characteristics of the isolates
2.2 分离菌的PCR 鉴定结果采用水煮法,提取分离菌株DNA 作为模板,PCR 扩增沙门菌属肠毒素基因stn。结果显示,扩增出约为260 bp 的目的片段,与预期扩增结果一致(图2),表明6 株分离菌均为沙门菌。

图2 沙门菌的PCR鉴定结果Fig.2 PCR identification results of Salmonella isolates
2.3 分离菌的血清分型和沙门菌血清型4,[5],12:i:-的鉴定结果通过玻片凝集法血清分型、部分生化特征及生长特征和2 相鞭毛抗原诱导方法鉴定分离菌的血清型。结果显示,分离菌Sep1为猪霍乱沙门菌孔成道夫变种,分离菌株Qxo1L、Pyx 为猪霍乱沙门菌,分离菌Sq2N、Xinmi、SwG 为沙门菌血清型4,[5],12:i:-(表1)。通过Tennant等建立的双重PCR法,对分离菌进一步鉴定,结果显示,分离菌株Sq2N、Xinmi、SwG 仅可扩增出长度为1 000 bp 的IS200 目的条带,不能扩增出1 380 bp 的fljB基因条带(图3),表明分离菌株Sq2N、Xinmi、SwG 均为fljB基因阴性菌株,进一步确定分离菌株Sq2N、Xinmi 、SwG 为沙门菌血清型4,[5],12:i:-。

表1 猪源沙门菌分离菌株的相关信息Table 1 Information on Salmonella isolates from pigs

图3 沙门菌血清型4,[5],12:i:-的双重PCR鉴定结果Fig.3 Identification of Salmonella serotype 4,[5],12:i:-isolates using duplex PCR
2.4 药敏试验结果采用微量稀释方法进行沙门菌分离菌的药敏试验。结果显示,分离的沙门菌对氨苄青霉素、磺胺甲基异恶唑、萘啶酸和氯霉素均耐药,呈多重耐药表型,其中沙门菌血清型4,[5],12:i:-分离菌对卡那霉素、庆大霉素、阿奇霉素、四环素均耐药,而对卡那霉素、庆大霉素、阿奇霉素、四环素耐药的猪霍乱沙门菌孔成道夫变种和猪霍乱沙门菌分离菌的菌株数分别为0、0、0和2株(表2)。表明沙门菌血清型4,[5],12:i:-分离菌比猪霍乱沙门菌孔成道夫变种和猪霍乱沙门菌分离菌对上述这4 种药物的耐药性更强。药敏试验结果还显示,分离的猪源沙门菌对头孢曲松、头孢西丁等人类专用药均敏感。表明,临床上猪源沙门菌对某些常用兽药如氨苄青霉素、磺胺甲基异恶唑等的耐药性比某些人类专用药物如头孢曲松等的耐药性更强,因此注意防范人类专用抗菌药物在动物上的使用,以免耐药菌株的产生。
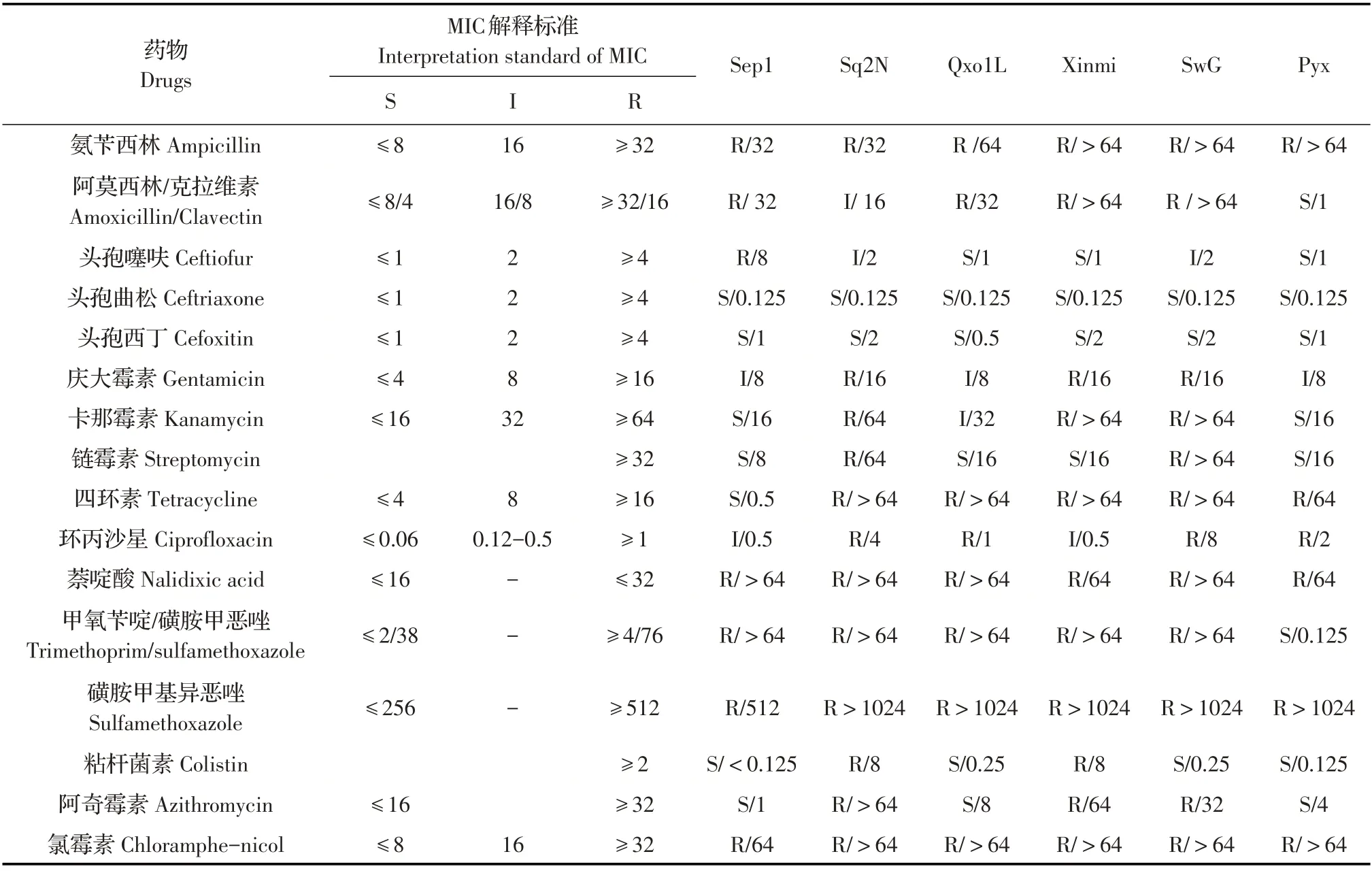
表2 分离沙门菌的药敏试验结果Table 2 Results of drug sensitivity test for Salmonella isolates
3 讨 论
猪沙门菌病,又称为猪副伤寒,其主要病原有猪霍乱沙门菌、猪伤寒沙门菌、鼠伤寒沙门菌、德尔卑沙门菌等[13]。本研究的沙门菌阳性病猪表现为高热,排稀便,消瘦,皮肤出血,呼吸困难等,甚至死亡,剖检病变主要是淋巴结肿大、出血,有的病例肝脏呈白色坏死小点,药物治疗效果不佳,主要是外购仔猪、季节交替天气突变等多发(文中未显示相关信息),符合猪沙门菌病发病症状和流行特点,这些特征对于诊断猪沙门菌病具有参考依据。本研究从临床送检63 病例中,共分离到6 株沙门菌,阳性分离率为9.52%,其中3 株为沙门菌血清型4,[5],12:i:-,另外3 株为猪霍乱沙门菌及猪霍乱沙门菌孔成道夫变种,第一次证明了沙门菌血清型4,[5],12:i:-在我国猪病临床上的流行,且为沙门菌感染的主要血清型。
大多数沙门菌是借助于周生的鞭毛才能运动,这些鞭毛是由细菌染色体上的两种不同鞭毛蛋白基因—fliC和fljB分别编码,其中fliC基因表达产物是1 相鞭毛抗原,fljB基因表达产物是2 相鞭毛抗原[2]。本研究通过Tennant 等建立的双重PCR 扩增结果显示,血清分型鉴定为沙门菌血清型4,[5],12:i:-菌株,均未能扩增出1 380 bp 的fljB基因条带,表明这些分离菌株缺乏2 相鞭毛抗原,是进一步对血清学分型方法正确性的验证。
虽然,我国学者已经报道沙门菌血清型4,[5],12:i:-在病人、食品中的流行,但目前还没有沙门菌血清型4,[5],12:i:-在我国病猪中流行的相关文献报道。Liang 等报道,从广东地区40 572 位腹泻病人粪便样品中,分离获得沙门菌1 826 株,其中鼠伤寒沙门菌占30%(550/1 826),排在第一,沙门菌血清型4,[5],12:i:-占14%(254/1826)超过肠炎沙门菌13%(245/1 826),排在第二位[14]。Yang 等首次报道沙门菌血清型4,[5],12:i:-在我国食品中的存在[15]。Jiang 等从1441 份猪肉、猪肝和猪胆汁样品中共分离到219株沙门菌,其中沙门菌血清型4,[5],12:i:-超过鼠伤寒沙门菌,排在第4 位[16]。
沙门菌血清型4,[5],12:i:-在进化过程中,产生了严重的多重耐药(Multidrug resistance,MDR)现象,其耐药菌株在全球多个国家被报道,该菌对氨苄西林(A)、氯霉素(C)、链霉素(S)、卡那霉素(K)、磺胺甲基异恶唑(Su)、四环素(T)等均表现不同的敏感性,产生泛耐药和多重耐药[3]。沙门菌血清型4,[5],12:i:-,通过2 相鞭毛抗原表达的缺失,进化为有利于获取各种耐药基因[4],可能有助于该菌在欧洲猪场和生产链中广泛的传播。本研究从63 个猪病例中,共分离到6 株沙门菌,其中3 株沙门菌血清型4,[5],12:i:-显得更耐药,均呈多重耐药性,表明该种沙门菌血清型之所以能够广泛传播和流行,可能与其严重的耐药性有一定关系。
沙门菌病是重要的人畜共患病,严重危害人类健康和畜禽养殖业。该病原沙门菌属有超过2 500种已知的血清型沙门菌,这些血清型菌的致病性与其宿主特异性不一[17]。本研究表明沙门菌血清型4,[5],12:i:-对仔猪具有一定的致病性,导致典型的猪沙门菌病,为主要流行血清型,且具有严重耐药性,造成猪病临床用药治疗失败。另外,如果该种血清型沙门菌通过病猪与人类接触,或者食物链传播,对公共卫生安全构成潜在威胁,应引起重视。

