弥散加权成像在95例宫颈腺癌病理分级/分型及临床分期中的应用
张 洁,赵心明,陈 雁
国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院 北京协和医学院 肿瘤医院影像诊断科,北京 100021
宫颈癌是女性生殖系统最常见的肿瘤之一,位居妇科恶性肿瘤的第2位。宫颈腺癌作为宫颈癌第二大病理类型,近年来发病率逐渐上升[1]。相对于最常见的宫颈鳞癌,宫颈腺癌放化疗疗效不理想,预后较差[2],因此有必要对其组织学特点进行深入研究。随着磁共振功能成像技术的发展,弥散加权成像(diffusion weighted imaging,DWI)在宫颈癌诊断及疗效评估中的应用越来越广泛。前期已有研究表明,宫颈鳞癌和宫颈腺癌两种病理类型的表观弥散系数(apparent diffusion coefficient,ADC)值存在差异,不同分化程度的宫颈鳞癌,其ADC值亦有不同[3- 5]。但是关于不同分化程度、不同病理亚型及临床分期的宫颈腺癌,ADC值是否具有诊断价值,相关研究少有报道,这可能与宫颈腺癌病例收集较为困难有关[6]。本研究回顾性分析中国医学科学院肿瘤医院经病理证实的95例宫颈腺癌患者的影像学资料,旨在探讨DWI对不同病理分级、分型及临床分期宫颈腺癌的诊断价值。
对象和方法
对象回顾性收集2011年5月至2018年2月中国医学科学院肿瘤医院收治的宫颈腺癌患者95例。纳入标准:(1)原发性宫颈癌;(2)经手术或活检病理诊断为宫颈腺癌;(3)术前2周内行盆腔磁共振成像(magnetic resonance imaging,MRI)检查,所有患者均无MRI检查禁忌证,在检查前均了解检查内容并签署知情同意书。排除标准:(1)肿瘤最大径<1.0 cm;(2)检查前做过放化疗或者锥切的患者。临床分期参照2018年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)标准[7],本研究通过中国医学科学院肿瘤医院伦理委员会批准(伦理审查编号NCC2021C- 270)。
MRI检查方法采用美国GE公司Signa Excite HDx 3.0T磁共振扫描仪,8通道体部线圈行盆腔MRI检查。患者检查前10 min肌内注射丁溴东莨菪碱20 mg,阴道放置阴道栓。检查时患者取仰卧位,扫描范围包全盆腔及腹膜后。扫描序列包括矢状面及横轴面快速自旋回波序列T2加权成像(T2 weighted imaging,T2WI):重复时间(repetition time,TR)5100 ms,回波时间(echo time,TE)106.6 ms,层厚5 mm,层间距1 mm,激励次数2;横轴面小视野薄层快速恢复快速自旋回波序列T2WI:TR 5360 ms,TE 130 ms,层厚4 mm,层间距0.4 mm,视野(field of view,FOV)26×26 cm,激励次数4,矩阵320×256;横轴面T1WI:TR 620 ms,TE 8.2 ms,层厚5 mm,层间距1 mm,FOV 38×38 cm,激励次数2,矩阵512×512;横轴面自由呼吸平面回波成像序列DWI:TR 5500 ms,TE 62.7 ms,层厚5 mm,层间距1 mm,FOV 38×38 cm,激励次数4,矩阵256×256,b=0、800 s/mm2。
图像分析应用GE ADW4.6后处理工作站Functool软件重建出ADC图,2名放射科医生在不知晓患者病理及临床分期相关资料的前提下,独立测量宫颈腺癌病灶最大层面的ADC值。感兴趣区(region of interest,ROI)的选取:结合轴位压脂T2WI图像,在ADC图上沿病灶边缘尽可能大地绘制ROI,每个感兴趣区至少≥50个体素,避开病灶内的囊变、坏死区,共测量3次,取平均值。
统计学处理采用SPSS 22.0软件进行统计分析。符合正态分布的计量资料采用均数±标准差表示,两组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析(One-way ANOVA),LSD(least significant difference procedure)法进一步作均数之间的两两比较。计算组内相关系数(interclass correlation coefficient,ICC),评价2名医师测量结果的一致性,ICC≥0.81一致性好;0.61~0.80一致性中等;0.41~0.60一致性一般;0.11~0.40一致性差;0.10以下无一致性。绘制组间差异有统计学意义的ADC均值的受试者工作特征(receiver operating characteristic,ROC)曲线,并计算诊断的最佳截断值。P<0.05为差异有统计学意义。
结 果
一般情况95例宫颈腺癌患者年龄17~67岁,平均(42.2±9.8)岁。临床分期包括ⅠB1期39例,ⅠB2期15例,ⅠB3期9例,ⅡA期19例,ⅡB期8例,Ⅲ B期3例,ⅣA期1例,ⅣB期1例。病理诊断子宫颈管腺癌(普通型)63例(图1、2),黏液腺癌21例(图3、4),子宫内膜样腺癌3例,绒毛状腺癌2例,中肾管癌2例,混合性腺癌4例[包括透明细胞腺癌+子宫内膜样腺癌1例,子宫颈管腺癌(普通型)+透明细胞腺癌1例,子宫颈管腺癌(普通型)+神经内分泌癌1例,子宫内膜样腺癌+浆液性癌1例]。其中低分化39例,中分化37例,高分化19例。
测量结果一致性评价2名医师测量宫颈腺癌ADC值的ICC值为0.983,95%置信区间为0.975~0.989,一致性较好。
ADC值与不同分化程度宫颈腺癌的关系宫颈腺癌高、中、低分化组间ADC均值差异有统计学意义(F=5.642,P=0.005),其中,低分化组ADC均值为(1.00±0.25)×10-3mm2/s,中分化组ADC均值为(1.09±0.25)×10-3mm2/s,高分化组ADC均值为(1.22±0.20)×10-3mm2/s,低分化组与高分化组病灶ADC均值差异有统计学意义(P=0.002),而低分化组与中分化组、中分化组与高分化组病灶的ADC均值差异均无统计学意义(P=0.308,P=0.097)。ADC均值诊断高、低分化组宫颈腺癌的ROC曲线下面积为0.794,当ADC均值取1.21×10-3mm2/s时,诊断的灵敏度和特异度分别为63.2%和89.7%。
ADC值与不同病理类型宫颈腺癌的关系95例宫颈腺癌患者中,子宫内膜样腺癌、绒毛状腺癌、中肾管癌及混合性腺癌患者病例数少,无法进行统计学分析,仅分析病例数较多的子宫颈管腺癌(普通型)及黏液腺癌患者。子宫颈管腺癌(普通型)组ADC均值为(1.04±0.24)×10-3mm2/s,黏液腺癌组ADC均值为(1.21±0.26)×10-3mm2/s,差异有统计学意义(t=2.875,P=0.005)。ADC均值诊断子宫颈管腺癌(普通型)组与黏液腺癌组的ROC曲线下面积为0.696,当ADC均值取1.04×10-3mm2/s时,诊断的灵敏度和特异度分别为81.0%和58.7%。
ADC值与不同FIGO分期宫颈腺癌的关系95例宫颈腺癌患者中,因ⅡB期及以上分期的患者均无法采用手术治疗,故将例数较少的ⅢB期、ⅣA期、ⅣB期与ⅡB期进行合并,统称为ⅡB期及以上组。ⅠB1期、ⅠB2期、ⅠB3期、ⅡA期、ⅡB期及以上组宫颈腺癌患者病灶的ADC均值分别为(1.11±0.26)×10-3mm2/s、(0.95±0.26)×10-3mm2/s、(1.11±0.30)×10-3mm2/s、(1.07±0.18)×10-3mm2/s、(1.11±0.24)×10-3mm2/s,差异均无统计学意义(F=1.312,P=0.272)。
讨 论
DWI对恶性肿瘤的检出和诊断具有重要价值,本研究发现宫颈腺癌分化程度越差其ADC均值越低,与前期研究结果相一致[8- 9]。分化程度低的癌灶,其内肿瘤细胞密度增加,细胞内细胞器数目增多,膜性结构的屏障作用更显著;同时,分化较差的肿瘤其细胞的异型性更明显,细胞核大而深染,核分裂象增多,细胞内间隙减小,导致细胞内水分子扩散运动受限,ADC值降低。本研究中高分化组宫颈腺癌与低分化组宫颈腺癌的ADC均值差异显著,中分化组宫颈腺癌ADC均值虽低于高分化组、高于低分化组,但组间差异无统计学意义,分析原因可能与各组内的样本量较少有关,此外,高、中、低分化组内各病理亚型的宫颈腺癌比例存在差异。
本研究发现宫颈黏液腺癌的ADC均值高于子宫颈管腺癌(普通型)。宫颈黏液腺癌来源于宫颈内膜柱状黏液细胞,是宫颈腺癌较少见的病理类型,可细分为宫颈管型、肠型、胃型及印戒细胞型4个亚型[10]。肿瘤可持续分泌大量黏液或水样分泌物,肿瘤细胞分布比较分散、稀疏,弥散扩散受限不明显,导致其ADC均值较高。

T2WI:T2加权成像;ADC:表观弥散系数
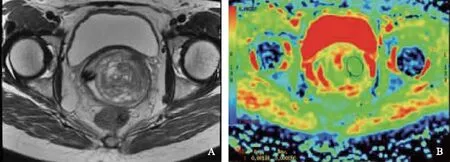
图2 宫颈高分化黏液腺癌,T2WI呈稍高、高混杂信号(A),ADC均值为1.38×10-3 mm2/s(B)
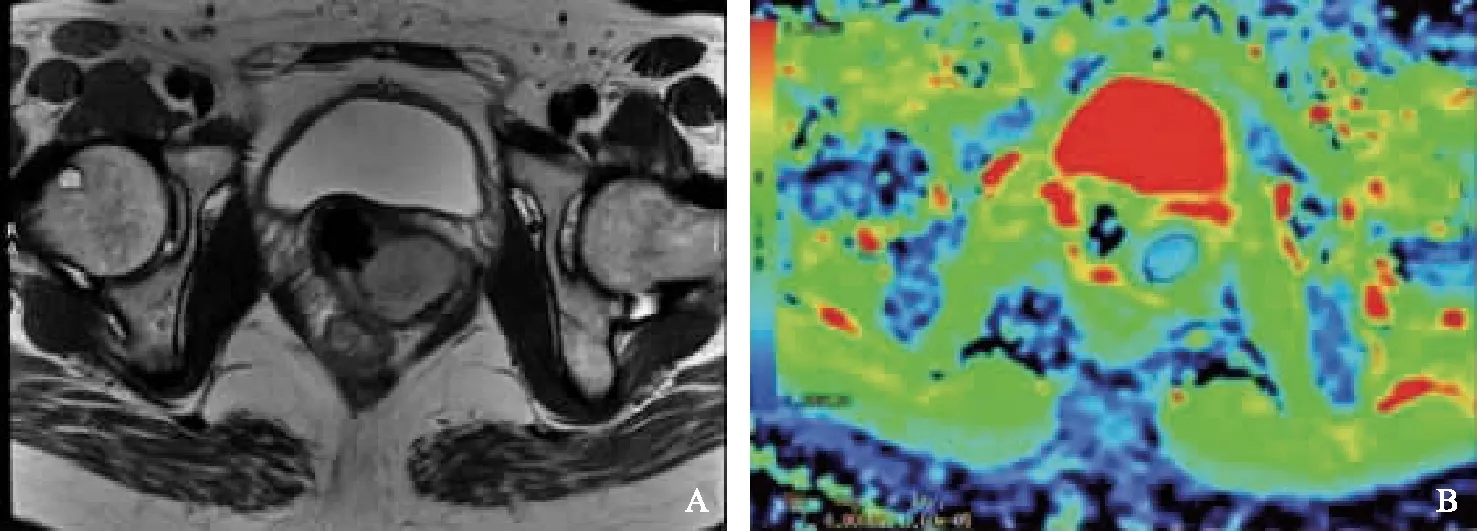
图3 低分化子宫颈管腺癌(普通型),T2WI呈稍高信号(A),ADC均值为0.66×10-3 mm2/s(B)

图4 高分化子宫颈管腺癌(普通型),T2WI呈稍高信号(A),ADC均值为1.28×10-3 mm2/s
鉴于MRI检查具有良好的软组织分辨率、多方位成像及功能成像,2018年FIGO分期已经明确MRI检查对于分期的价值。目前MRI对于宫颈癌的分期主要依赖T2WI图像及DWI扩散受限的范围,并没有一个量化的指标进行衡量。本研究中,通过量化指标ADC均值,来探讨其能否帮助有效评估宫颈腺癌分期。依据2018年FIGO分期标准,本研究将宫颈腺癌分为ⅠB1期、ⅠB2期、ⅠB3期、ⅡA期、ⅡB期及以上5个组,各组间ADC均值差异均无统计学意义(P=0.272),与前期有关宫颈鳞癌分期的研究结果相一致[8]。
本研究存在一定的局限性:(1)本研究为回顾性研究,部分宫颈腺癌患者DWI序列采用的b值为0、1000 s/mm2,剔除掉该部分病例,导致入组病例数较少。(2)收集的宫颈腺癌中,子宫内膜样腺癌、绒毛状腺癌、中肾管癌及混合性腺癌所占比例少,无法进行统计分析。(3)本回顾性研究采用的是已经普遍应用的DWI技术,后期会在此基础上,增加新的影像技术或人工智能算法(如影像组学、深度学习等)[3,11],并针对临床比较关注的宫颈癌的疗效及预后开展进一步研究。
综上,对于宫颈腺癌患者,ADC均值能够反映病灶分化程度的不同,有助于鉴别宫颈黏液腺癌及子宫颈管腺癌(普通型)。

