环状RNA hsa_circ_0067582对胃癌细胞增殖及侵袭能力的影响
陆蓉丹,黄 哲,陆佳敏,张海强,邵永富
宁波大学医学院附属医院 1消化内科 2急诊科 3胃肠外科,浙江宁波 315020
胃癌是最常见恶性肿瘤之一,死亡率居所有恶性肿瘤的第3位[1],其中东亚国家发病率约占一半,死亡率高于其他地区国家[2-3]。大多数胃癌患者被确诊时往往已处于晚期,伴有远处转移,预后不良,5年生存率仅为20%~30%[4- 5]。而早期胃癌若能及时发现治疗,其5年生存率可达90%[6]。胃癌的发生发展受多因素的影响[7],但其确切病因机制尚不清楚,极大程度限制了对其的进一步治疗。环状RNA(circular RNA,circRNA)是一类5’端和3’端共价结合形成环状结构的非编码RNA分子[8- 9],其具有表达丰富、结构稳定、进化保守、竞争内源性等特点,成为RNA领域的研究热点[10- 16]。CircRNA在细胞生物学中通过发挥多种重要作用,如在细胞中作为微小RNA(microRNA,miRNA)的分子海绵、RNA结合蛋白、蛋白质翻译模板和免疫调节器等[17- 18],参与人类肿瘤的发生发展。此外,circRNA可在组织、血液、尿液和唾液中稳定表达,使其在临床上具有成为生物标志物的巨大潜力[18]。因此,寻找胃癌相关特异性circRNA分子,探究其在胃癌发生发展中的机制具有重大意义。本课题组前期研究发现hsa_circ_0067582只在胃癌组织中,尤其是早期胃癌组织中呈现显著性低表达,显示出良好的胃癌组织特异性[19]。hsa_circ_0067582(chr3:141231004- 141259451)是由RAS p21蛋白激活因子2(RAS p21 protein activator 2,RASA2)基因转录本中第2~5外显子通过反向剪接环化形成的,全长394 nt。但目前尚不清楚hsa_circ_0067582对胃癌细胞的调控作用及潜在机制。因此,本研究拟进一步探究hsa_circ_0067582对胃癌细胞增殖、侵袭能力的重要调控作用及其关键分子机制,以期为胃癌的治疗提供新思路。
材料和方法
材料人胃癌细胞系AGS、SGC- 7901购自上海中国科学院细胞库。6周龄雄性BALB/c裸鼠购自上海斯莱克实验动物有限责任公司,动物生产许可证号SCXK(沪)2017- 0015,饲养于杭州鹰旸生物科技有限公司动物中心,动物使用许可证号为SYXK(浙)2020- 0024。胎牛血清(批号42Q1782K)、RPMI 1640培养基(批号31870082)和Ham’s F- 12K培养基(批号21127022)购自美国Gibco公司;CCK- 8试剂盒(货号C0037)、RIPA裂解液(货号P0013K)、BCA蛋白浓度测定试剂盒(货号P0012)、BeyoClickTMEdU- 555细胞增殖检测试剂盒(货号C0075S)、ECL显色试剂盒(货号P0018FS)、Annexin V/PI细胞凋亡检测试剂盒(货号4136994)均购自美国BD公司;Trizol试剂(货号15596026)购自美国Invitrogen公司;PrimeScriptTMRT Master Mix(货号RR036A)、SYBR®Premix Ex TaqTMⅡ(货号RR820A)购自日本TaKaRa公司;半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)3(货号ab2302)、Caspase 7(货号ab255818)、Caspase 9(货号ab32539)、E-钙黏蛋白(E-cadherin)(货号ab235682)、波形蛋白(Vimentin)(货号ab137321)、N-钙黏蛋白(N-cadherin)(货号ab76011)、GAPDH(货号ab8245)均购自美国Abcam公司;辣根过氧化物酶标记的驴抗兔IgG抗体(货号1531671)购自美国 Life Technologies公司;辣根过氧化物酶标记的山羊抗小鼠IgG抗体(货号ab1501115)购自美国Abcam公司;hsa_circ_0067582过表达(Oe-circ_0067582)质粒及其阴性对照均购自吉玛基因(上海)股份有限公司;Lipofectamine 2000(货号11668019)购自美国Invitrogen公司。
细胞培养人胃癌细胞株AGS及SGC- 7901分别使用含10%胎牛血清和1%双抗(100 U/ml青霉素和100 μg/ml链霉素)的F- 12K培养基及RPMI 1640培养基,置于37 ℃、5% CO2细胞培养箱内培养,细胞融合度达80%时进行细胞传代。
实时荧光定量PCR(qRT-PCR)检测检测AGS及SGC- 7901细胞中hsa_circ_0067582的表达水平,以GAPDH作为内参进行相对定量:采用Trizol法提取细胞总RNA,用分光光度计检测RNA浓度,当A260/A280值介于1.8~2.0间时可进一步行RNA反转录。采用PrimeScriptTMRT Master Mix反转录试剂盒进行hsa_circ_0067582反转录。运用SYBR®Premix Ex TaqTMⅡ 试剂盒在CFX96实时定量PCR仪(美国Bio-Rad公司)完成qRT-PCR扩增,采用2-ΔΔCt法计算hsa_circ_0067582相对表达量,每个样品设置3个复孔,实验重复3次。引物序列:hsa_circ_0067582上游引物:5’-CACAGT-GGCAAAGAAACTTGGT- 3’,下游引物:5’-TGTGGGGT-CCAAGATATGGC- 3’;GAPDH上游引物:5’-ACCCAC-TCCTCCACCTTTGAC- 3’,下游引物:5’-TGTTGCTGTA-GCCAAATTCGTT- 3’。
细胞转染将hsa_circ_0067582全长编码序列克隆到pLO-ciR载体中,以空白pLO-ciR载体作为阴性对照。将AGS及SGC- 7901细胞接种于6孔板(1×105个/孔),37℃细胞培养箱内常规培养至细胞融合度达60%时,按照转染试剂Lipofectamine 2000说明书的操作步骤,将含Oe-circ_0067582质粒及pLO-ciR载体的无血清培养基分组加入到6孔板中。转染细胞48 h后,收集细胞并进行qRT-PCR检测质粒的过表达效率。
CCK- 8法检测细胞活力将转染Oe-circ_0067582质粒的AGS及SGC- 7901细胞以5×103个/孔均匀铺于96孔板中,置于37 ℃、5% CO2条件下分别培养24、48、72、96 h后,每孔加入10 μl CCK- 8溶液混匀,将培养板在培养箱内继续孵育4 h后,用酶标仪测定各孔细胞在450 nm处的吸光度值,每组设置6个复孔。
克隆形成实验收集转染后的各组AGS及SGC- 7901细胞,以5×102个/孔接种于24孔板中,培养箱中孵育,每3 d更换1次培养液,14 d后肉眼可见细胞克隆形成,吸弃培养液,加入PBS洗涤3次,加入0.1%结晶紫染色15 min,纯净灭菌水洗涤,观察细胞克隆形成数。
EdU实验检测细胞增殖接种至24孔板的AGS及SGC- 7901细胞转染48 h后,4%多聚甲醛固定30 min,2 mg/ml甘氨酸脱色摇床温育5 min,0.5% TritonX- 100脱色摇床温育10 min,根据BeyoClickTMEdU- 555试剂盒说明书对细胞进行Apollo染色及DAPI染色,经抗荧光淬灭剂封片后置于荧光倒置显微镜下拍照。
Transwell实验检测细胞侵袭AGS及SGC- 7901细胞分别转染Oe-circ_0067582质粒和空白pLO-ciR载体,细胞培养箱中培养48 h后,0.25%胰酶常规消化后收集细胞,PBS清洗后用无血清培养基重悬制成单细胞悬液,调整细胞浓度为1×105个/ml,接种到铺有基质胶并用无血清培养基水化基底膜后的Transwell小室内,每孔加入100 μl单细胞悬液,下室内每孔加入600 μl含有20% FBS条件培养基。置于37 ℃、5% CO2细胞培养箱孵育48 h后,取出Transwell小室并用PBS清洗1遍,4%多聚甲醛固定15 min、结晶紫染色10 min后用PBS清洗2遍,棉球擦去小室基底膜上方表面的细胞后,显微镜下观察拍照,统计穿过小孔的细胞数量。
流式细胞术观察细胞凋亡将转染Oe-circ_0067582质粒和空白pLO-ciR载体的AGS及SGC- 7901细胞培养24 h,用不含EDTA的胰酶消化细胞后,加入培养基终止消化,收集细胞,PBS清洗2遍,收集细胞调整为1×109个/ml细胞悬液,每个Falcon试管中加入100 μl细胞悬液,再加入5 μl PI和5 μl Annexin V-FITC,避光孵育15 min后,加入结合缓冲液,于1 h内用流式细胞仪检测细胞凋亡情况。
Western blot检测凋亡及上皮间质转换相关蛋白的表达收集转染48 h后AGS及SGC- 7901细胞,采用RIPA裂解液试剂盒提取总蛋白,并通过BCA蛋白定量试剂盒测定细胞蛋白质浓度。取相同蛋白上样量,10% SDS-PAGE分离蛋白质,恒流350 mA湿法将蛋白转移至PVDF膜上。室温下用5%脱脂牛奶封闭2 h,TBST清洗后,分别加入一抗:Caspase 3(1∶2000)、Caspase 7(1∶1000)、Caspase 9(1∶1000)、E-cadherin(1∶2000)、Vimentin(1∶2000)、N-cadherin(1∶1000)和GAPDH(1∶5000),4 ℃孵育过夜。TBST缓冲液洗膜3次,每次5 min。随后加入二抗室温孵育2 h。采用化学发光法显色,凝胶成像系统采集成像,利用Image J软件分析蛋白条带灰度值。
异种移植瘤实验6只裸鼠采用随机数字法分为Oe-circ_0067582组和pLO-ciR组,每组3只。分别将转染Oe-circ_0067582质粒和空白pLO-ciR载体的SGC- 7901细胞用无血清培养基制备成单细胞悬液,以5×106个(100 μl)浓度注射于裸鼠左腋下皮内。每天观察裸鼠一般状况及肿瘤生长情况,每5 d用游标卡尺测量1次肿瘤的长径与短径,并记录下相关数据,绘制肿瘤生长曲线,观察至第30 d,处死荷瘤小鼠,取皮下瘤称重并拍照。
竞争性内源RNA网络的构建及功能富集分析通过TargetScan(http://www.targetscan.org/vert_72/)和miRnada(http://www.microrna.org/)数据库预测可能与hsa_circ_0067582相互作用的miRNA,构建hsa_circ_0067582-miRNA关系对。利用Tarbase(https://www.tarbase.com/)数据库预测miRNA的下游靶点,构建miRNA-mRNA的调控关系。整合hsa_circ_0067582-miRNA及miRNA-mRNA关系对构建circRNA-miRNA-mRNA 竞争性内源RNA(competing endogenous RNA,ceRNA)调控网络,并利用Cytoscape软件对调控网络进行可视化。进一步使用DIANA-miRPath软件(http://snf- 515788.vm.okeanos.grnet.gr/)对miRNA靶基因进行GO和KEGG信号通路分析,探索靶基因行使的生物学功能。
统计学处理采用SPSS 22.0统计软件,计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素ANOVA分析。P<0.05为差异有统计学意义。
结 果
过表达hsa_circ_0067582对AGS及SGC- 7901细胞活力及增殖能力的影响与pLO-ciR组相比,Oe-circ_0067582组的AGS(17.28±1.24比1.08±0.24;t=7.986,P=0.003)及SGC- 7901细胞(12.47±1.15比1.04±0.35;t=5.581,P=0.008)中的hsa_circ_0067582表达水平均显著升高。与pLO-ciR组相比,Oe-circ_0067582组的AGS细胞在转染过表达hsa_circ_0067582质粒48 h(0.61±0.13比0.86±0.14;t=3.765,P=0.030);72 h(0.85±0.16比1.25±0.18;t=5.356,P=0.016)和96 h(1.05±0.14比1.76±0.21;t=7.883,P=0.001)的细胞活力显著降低;SGC- 7901细胞在转染72 h(0.82±0.12比1.15±0.18;t=4.584,P=0.010)和96 h(1.16±0.18比1.72±0.25;t=5.679,P=0.005)的细胞活力显著降低(图1A)。细胞克隆形成及EdU染色实验结果显示,与pLO-ciR组相比,Oe-circ_0067582组AGS细胞(15.33±2.51比37.66±4.72;t=6.709,P=0.003)及SGC- 7901细胞(22.41±3.05比53.42±6.50;t=5.857,P=0.003)克隆形成数目显著降低(图1B),且AGS(35.60±3.49比60.00±5.89;t=4.528,P=0.01)及SGC- 7901(28.48±5.27比71.60±7.54;t=9.847,P=0.001)的细胞DNA复制活性明显降低(图1C)。
过表达hsa_circ_0067582对AGS及SGC- 7901细胞侵袭能力的影响Transwell实验结果显示,与pLO-ciR组相比,Oe-circ_0067582组AGS(72.67±9.29比149.78±16.26;t=7.782,P=0.002)及SGC- 7901细胞(114.35±14.64比184.65±19.50;t=6.342,P=0.003)穿过小室的细胞数明显减少(图2)。
过表达hsa_circ_0067582对AGS及SGC- 7901细胞凋亡及上皮间质转换过程的影响流式细胞术检测结果显示,与pLO-ciR组相比,Oe-circ_0067582组的AGS[(19.92±1.13)%比(7.82±1.05)%;t=7.225,P<0.001]和SGC-7901[(22.44±1.18)%比(5.67±1.07)%;t=11.509,P=0.001]的细胞凋亡百分比均显著增加(图3)。Western blot检测结果显示,与pLO-ciR组相比,Oe-circ_0067582组的AGS和SGC- 7901细胞Caspase 3(3.83±0.24比1.00±0.09;t=6.863,P=0.002和4.68±0.27比1.00±0.09;t=7.024,P=0.001)、Caspase 7(1.84±0.22比1.00±0.11;t=3.295,P=0.04和2.44±0.12比1.00±0.10;t=6.008,P=0.004)、Caspase 9(1.40±0.07比1.00±0.06;t=4.408,P=0.012和1.46±0.11比1.00±0.09;t=6.278,P=0.004)和E-cadherin(3.11±0.20比1.00±0.09;t=12.453,P=0.002和4.36±0.22比1.00±0.15;t=10.867,P=0.001)表达水平均显著升高;而Vimentin(0.28±0.02比1.00±0.09;t=7.242,P=0.002和0.38±0.04比1.00±0.10;t=5.694,P=0.004)、N-cadherin(0.23±0.03比1.00±0.08;t=6.480,P=0.003和0.33±0.04比1.00±0.10;t=7.446,P=0.001)蛋白表达水平明显降低(图4)。
过表达hsa_circ_0067582对SGC- 7901细胞在裸鼠体内生长的影响裸鼠皮下成瘤实验结果显示,与pLO-ciR组相比,Oe-circ_0067582组小鼠皮下肿瘤体积从第20 d开始增量缓慢,差异具有统计学意义[(0.41±0.12)cm3比(0.64±0.07)cm3;t=7.862,P=0.002](图5)。第30 d,Oe-circ_0067582组小鼠皮下肿瘤重量明显低于pLO-ciR组[(0.48±0.25)g比(1.36±0.13)g;t=3.526,P=0.017]。

与pLO-ciR组比较,aP<0.05,bP<0.01

图2 Transwell检测Oe-circ_0067582质粒对AGS及SGC- 7901细胞侵袭能力的影响(0.1%结晶紫染色,×200)
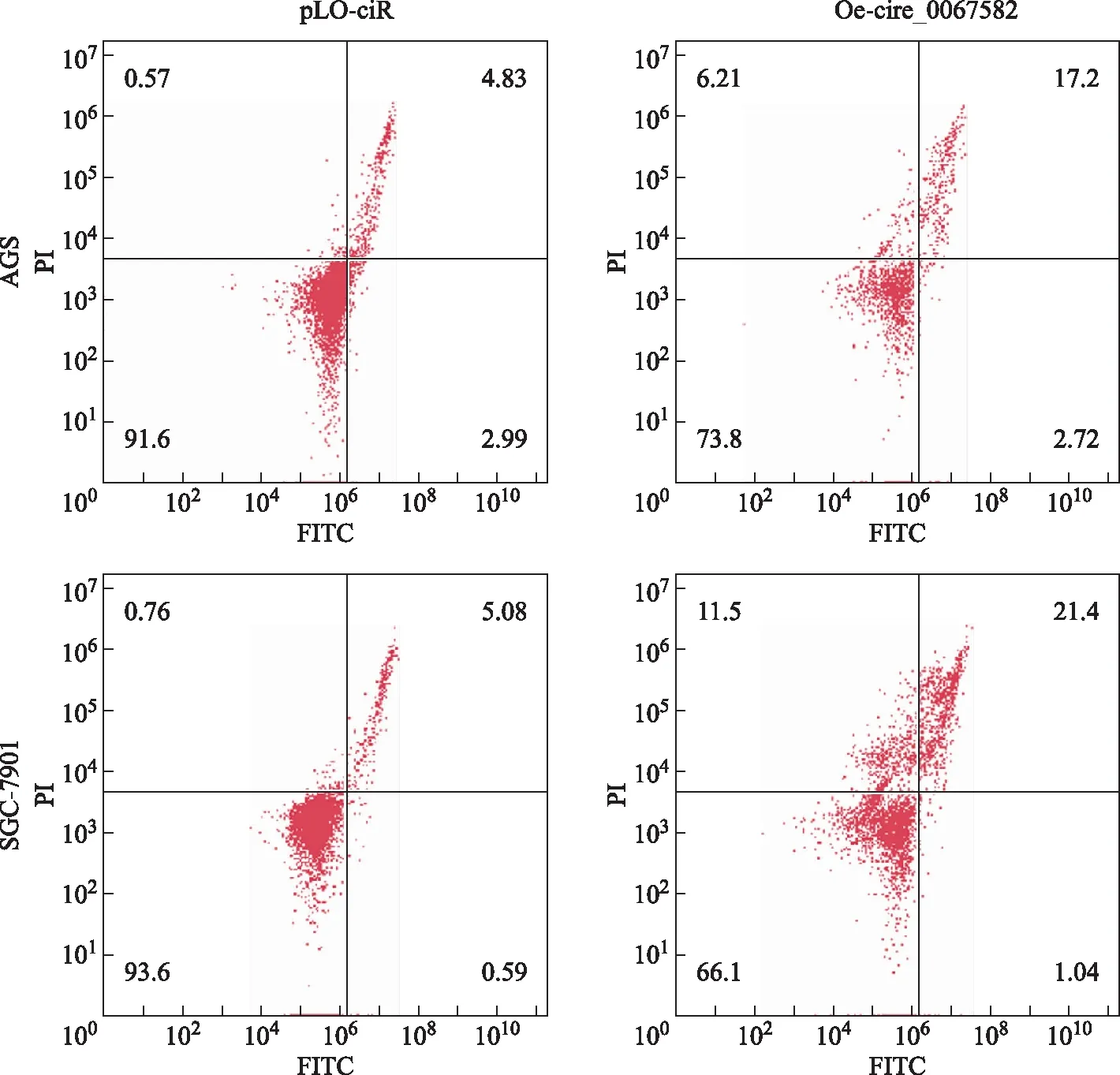
图3 流式细胞术检测Oe-circ_0067582质粒对AGS和SGC- 7901细胞的影响
ceRNA网络构建及功能富集分析通过TargetScan和miRnada数据库预测发现,hsa_circ_0067582可通过种子序列与hsa-miR- 181b- 3p、hsa-miR- 337- 3p、hsa-miR- 421、hsa-miR- 548d- 3p相匹配(图6A)。从Tarbase数据库中分别获取上述miRNA的下游靶点,同时利用Cytoscape软件构建hsa_circ_0067582-miRNA-mRNA网络图(图6B)。采用Venny 2.1软件构建韦恩图结果显示,不同的miRNA连接多个共同的下游靶点(图6C)。功能富集分析结果显示,miRNA的预测靶点参与多样的生物功能过程,如细胞凋亡负调控、RNA结合、基因表达等(图6D),并与多种癌症相关途径如蛋白多糖、mRNA监测途径、癌症中的转录失调、转化生长因子-β(transforming growth factor-β,TGF-β)、p53信号通路等密切相关(图6E)。

Caspase:半胱氨酸天冬氨酸蛋白酶;Mr:相对分子质量
讨 论
CircRNA是一类由1个或1个以上剪接的外显子或内含子反向共价连接构成的新型非编码RNA成员,具有保守性、丰富性和组织特异性等特点,使其可能在某些疾病(如肿瘤)中发挥特殊的分子标记作用[4,20]。circRNA可通过选择性剪接、调控亲本基因的表达、充当蛋白质复合物组装的支架以及RNA-蛋白相互作用来调控基因表达,影响肿瘤的发生和发展[17]。
前期研究发现hsa_circ_0067582与胃癌密切相关,具有作为预防及诊断胃癌生物标志物的潜能[19]。本研究结果显示,hsa_circ_0067582过表达能够抑制AGS和SGC- 7901细胞的细胞活力、增殖和侵袭能力,并促进AGS和SGC- 7901细胞的凋亡。此外,AGS和SGC- 7901细胞的hsa_circ_0067582过表达伴随着Caspase 3、Caspase 7和Caspase 9凋亡相关蛋白表达水平的升高。上皮间质转换(epithelial-mesenchymal transition,EMT)是上皮细胞失去极性、经过细胞骨架重塑转变成具有迁移能力的间充质表型的过程。越来越多的研究表明EMT是肿瘤侵袭转移的一个重要环节[21- 22],促进胃癌细胞的侵袭及迁移能力[22],其主要的特征为Vimentin表达增加和E-cadherin表达减少等。本研究发现,hsa_circ_0067582过表达显著提高AGS和SGC- 7901细胞E-cadherin的表达水平,且明显降低Vimentin及N-cadherin的表达水平,提示hsa_circ_0067582过表达可能通过抑制EMT进程从而抑制AGS和SGC- 7901细胞的侵袭能力。同时,过表达hsa_circ_0067582的SGC- 7901细胞在裸鼠皮下移植瘤生长过程中速度有所放缓。上述结果提示hsa_circ_0067582在胃癌的发生发展中可能发挥重要的作用,hsa_circ_0067582有希望成为新的胃癌治疗靶点。

与pLO-ciR组比较,aP<0.05,bP<0.01

A.TargetScan和miRnada数据库预测hsa_circ_0067582相互作用的微小RNA;B.hsa-miR- 181b- 3p、hsa-miR- 337- 3p、hsa-miR- 421和hsa-miR- 548d- 3p靶基因的韦恩图;C.hsa_circ_0067582-miRNA-mRNA调控网络,红色六边形代表hsa_circ_0067582,绿色棱形代表miRNA,蓝色矩形代表miRNA靶基因,黄色矩形代表miRNA共同调控的靶基因;D.靶基因GO功能富集图;E.靶基因KEGG功能富集图
研究表明,circRNA可以直接或者间接在肿瘤的发生发展过程中发挥重要的作用。CircRNA可通过作为miRNA海绵或ceRNA的方式发挥作用[9,18,23- 24]。通过TargetScan和miRnada数据库预测可知,hsa_circ_0067582可能竞争性结合多个miRNA,分别为hsa-miR- 181b- 3p、hsa-miR- 337- 3p、hsa-miR- 421和hsa-miR- 548d- 3p。有文献报道hsa-miR- 421与胃癌密切相关。Chen等[25]研究结果表明血浆中hsa-miR- 421的表达水平升高可以明显区分正常人群、胃癌早期及胃癌病例,特别是在胃癌早期。然而,hsa-miR- 181b- 3p、hsa-miR- 337- 3p和hsa-miR- 548d- 3p在胃癌中未见报道,值得进一步研究其与hsa_circ_0067582的相互作用。通过对miRNA靶基因进行功能富集分析发现,靶基因显著富集到细胞凋亡负调控、RNA结合、基因表达、mRNA监测途径、癌症中的转录失调、TGF-β、p53信号通路等。其中,大部分通路已有文献支持与肿瘤发生机制密切相关,如TGF-β信号通路介导胃癌细胞EMT而促进胃癌细胞迁移、侵袭的能力[26]。以上结果提示,hsa_circ_0067582介导的ceRNA网络参与了胃癌发生发展的多个生物学过程。
综上,本研究结果发现过表达hsa_circ_0067582可以显著抑制AGS和SGC- 7901细胞的增殖及侵袭能力,并促进细胞凋亡。本研究进一步揭示了hsa_circ_0067582在胃癌中的作用及其发生发展过程中潜在的分子机制,为探究胃癌防治新靶点提供新方向。
——一道江苏高考题的奥秘解读和拓展

