缺氧微环境下仙连解毒方通过调控HIF-1α影响结直肠癌细胞迁移的作用及机制研究*
姜瑞阳 ,徐长亮 ,2,程海波 ,2**,沈卫星 ,2,余成涛 ,2,谭佳妮 ,2,范旻旻 ,2
(1.南京中医药大学第一临床医学院 南京 210023;2.江苏省中医药防治肿瘤协同创新中心 南京 210023)
结直肠癌(CRC)是消化道最常见的恶性肿瘤之一,具有发病率高、死亡率高、预后差等特点[1]。在过去的十年里,由于早癌筛查、手术及治疗水平的提高,CRC的存活率有所上升,但转移性结直肠癌(Metastatic colorectal cancer)的预后较差,5年生存率在10%以下,主要由于术后复发和转移所致[2]。因此,探究结直肠癌转移的分子生物学机制至关重要。
在结直肠癌进展至转移的过程中,癌细胞被认为获得了间充质表型,使其能够离开原发部位,侵入周围组织,并迁移到远端脏器组织[3]。接种后,这些细胞转换回上皮表型并增殖形成转移瘤,细胞在上皮和间充质表型之间转换的过程被称为上皮-间充质转化(EMT)[4]。低氧是多数实体瘤微环境的特征之一,在肿瘤细胞的血管形成、治疗耐药、细胞增殖等方面至关重要[5]。缺氧诱导因子(HIF-1α)是一种控制血管生成基因表达的高度保守的转录因子,通过激活转录程序,触发关键基因如血管内皮生长因子(VEGF)、葡萄糖转运蛋白1(GLUT1)等表达,从而促进侵袭性肿瘤表型[6-7]。HIF介导的通路被认为是缺氧诱导的EMT中最重要的通路之一,在早期的研究中,HIF-1α与肝纤维化过程中肝细胞和人脐静脉内皮细胞中转化生长因子β(TGF-β)的激活有关,TGF-β还可以抑制PHD2的mRNA和蛋白质表达,从而增加HIF-1α的稳定性[8-9]。此外,HIF-1α与肿瘤细胞中免疫抑制分子的表达有关,这可以通过激活TGF-β信号传导,诱导EMT进程[10]。
国医大师周仲瑛教授首倡癌毒病机理论,癌毒病机理论认为正气亏虚,癌毒随血脉流窜走注是癌症转移之因。因此确立“扶正培本、抗癌解毒”为恶性肿瘤的主要治法[11],仙连解毒方是岐黄学者程海波教授基于“癌毒”病机理论创制的临床验方,方由仙鹤草、黄连、炙黄芪、生薏苡仁等药物组成,具有“清热化湿、祛瘀解毒、健脾益气”之功。本研究旨在探究缺氧微环境下仙连解毒方对结直肠癌细胞HCT-116迁移能力的影响,并进一步探究仙连解毒方调控HIF-1α,抑制TGF-β/smad信号通路,改善EMT的可能机制,以期为仙连解毒方治疗转移性结直肠癌(Metastatic colorectal cancer)提供现代分子生物学依据。
1 材料
1.1 细胞株
人结直肠癌细胞HCT-116购自中科院上海细胞所。
1.2 药品
仙连解毒方(仙鹤草12 g,黄连5 g,生薏苡仁30 g等)由南京中医药大学药理教研室负责药材鉴定与复方制备。以10倍和8倍体积的水煎煮两次,每次2 h,减压浓缩,水滴醇沉后抽滤浓缩至3 mg·mL-1,保存于-20℃备用。处理细胞前,将药物置于4℃解冻并离心(9600r·min-1,10 min),取上清液并用0.22 μm滤膜过滤除菌。加入仙连解毒方后将培养基pH值调整至7.2-7.4。
1.3 试剂与仪器
厌氧细胞培养箱(美国Thermo公司,HERAcell 150i);荧光倒置显微镜(日本Nikon公司,ECLIPSE Ti-5);ProwerPacTM Basic 凝胶电泳仪(美国Bio-Rad公司);Tanon-5500化学发光凝胶成像仪器(天能科技有限公司)。RPMI-1640培养基(上海源培生物技术有限公司,货号:L210KJ);胎牛血清(美国Gibco公司,货号:10099-141C);(MTT,Sigma公司,货号:SP1080);RIPA细胞裂解液(Biosharp公司,货号:6503595);PAGE凝胶快速制备试剂盒(翌圣生物科技股份有限公司,货号:20325ES),ECL化学发光超敏显色试剂盒(翌圣生物科技股份有限公司,货号:36222);SYBR®Green Premix Pro Taq HS qPCR Kit II(湖南艾科瑞生物,货号:AG11702)Evo M-MLV Mix Kit with gDNA Clean for qPCR试剂盒(湖南艾科瑞生物,货号:AG11728);过表达慢病毒构建(吉凯基因,订单号:GXDL0244356);Beta-Tubulin抗体(美国abcam公司,货号:6046)、HIF-1α抗体(美国abcam公司,货号:ab179483)、E-cadherin抗体(美国Santa Cruz公司,货号:sc-8426)、N-cadherin抗体(美国Santa Cruz公司,货号:sc-59987)、Vimentin抗体(美国abacm公司,货号:ab92547)、p-Smad3抗体(美国abcam公司,货号:ab52903)、Smad3抗体(美国CST公司,货号:9523)。
2 方法
2.1 细胞培养
HCT-116细胞用RPMI-1640高糖培养基(培养基含10% FBS,100 U/mL青霉素及100 U/mL链霉素)培养,将细胞置于缺氧培养箱(该培养箱内条件为95%N2和5% CO2,O2浓度维持在1%以下)中,以实现缺氧条件。
2.2 细胞转染
取对数生长期的HCT-116细胞, 消化处理后配置细胞悬液并计数,取5×104个/孔细胞密度接种到24孔板上,置于37℃、5% CO2的培养箱中培养24 h。细胞转染前,更换孔内培养基为含HitransG P的完全培养基(1∶24的比例稀释HitransG P),24孔板每孔500 μL。据预实验结果以MOI=100加入病毒,孵育12 h后弃掉上层转染液,加入含10% FBS的RPMI-1640培养基培养继续培养。并根据细胞生长情况及时更换培养基,在培养72 h后,可在荧光显微镜下检测细胞的转染效率。
2.3 细胞形态观察
将处于对数生长期的结肠癌细胞用胰酶消化后接种到培养皿中,待细胞贴壁后分别加入浓度为1.7 mg·mL-1、3.4 mg·mL-1、6.8 mg·mL-1的 XLJDF 醇提物,置于缺氧培养箱中,孵育48 h,倒置于显微镜下观察细胞形态。
2.4 MTT法检测细胞活力
取对数生长期的细胞接种于96孔板,浓度为每毫升1×104个,每孔100 μL,并设立6个复孔,待细胞贴壁后加入XLJDF醇提物置于缺氧培养箱中48 h。药物干预结束后,每孔加入20 μL MTT(5 mg·mL-1)试剂后继续培养3 h。反应结束后,吸取孔内培养液,加入DMSO 150 μL,用酶标仪检测490 nm波长处的吸光度(OD值),计算细胞增殖抑制率。细胞增殖抑制率=1-(药物处理组-空白组)/(对照组-空白组)×100%。
2.5 伤口愈合实验和Transwell法检测细胞迁移能力
伤口愈合实验:将细胞接种在6孔板中,每孔细胞数为4 × 105个,置于缺氧培养箱中培养。待细胞几乎达到100%融合,使用10 μL枪头在培养板底部划线,使用PBS洗涤1-2次以去除细胞残渣并添加不含FBS的培养基。然后在0 h、24 h和48 h的时间点观察细胞并拍照。
Transwell实验:在上室加入200 μL无血清培养基悬浮的细胞,数量为3×104个,下室加入600 μL含10%FBS的完全培养基。细胞在缺氧培养箱中孵育48 h。4%多聚甲醛固定后,用结晶紫染料染色。使用棉签轻轻去除内室上的细胞。随机选择三个视野,使用光学显微镜拍照并计数。
2.6 qRT-PCR检测基因mRNA的表达
收集HCT16细胞,TRIzol法提取样品中的总RNA,测定RNA浓度后,使用Evo M-MLV RT Mix Kit with gDNA Clean for qPCR(AG11728,ACCURATE BIOTECHNOLOGY,HUNAN,Co.,Ltd)进行逆转录反应,使用SYBR Green Premix Pro Taq HS qPCR Kit(AG11701,ACCURATE BIOTECHNOLOGY,HUNAN,Co.,Ltd)进行RT-PCR扩增反应。HIF-1α以betaactin为内参,采用2-ΔΔCt法计算HIF-1α的表达。所需引物序列如下: HIF-1α F:5'-GAACGTCGAAAAGA AAAGTCTCG-3', R:5'-CCTTATCAAGATGCGAACTC ACA-3';β-actin F:5'-TTTGTCAACCCTCAATCCCA-3',R:5'-GCAACACTCAGTAACCTCCCAC-3'。
2.7 蛋白免疫印迹法(Western blot)检测蛋白表达
取对数生长期的结肠癌HCT-116细胞,在缺氧环境下予仙连解毒方干预48 h后提取包浆总蛋白。每孔上样量为20 μL进行SDS-PAGE凝胶电泳分离蛋白(80 V),接着将蛋白转移至 PVDF膜(200 mA,90 min),5%脱脂牛奶于室温下封闭2 h。然后将膜与特异性一抗4℃孵育过夜。将膜用PBST洗涤3次,与二抗(PBST稀释,稀释倍数为1∶10000)室温孵育1 h。最后用PBST洗膜3次,通过化学发光检测蛋白质表达水平,Image J软件进行条带灰度值分析。
2.8 统计学分析
统计学处理使用Graph Pad Prism 8.0软件,实验数据以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
3 结果
3.1 HIF-1α在缺氧CRC细胞中高表达

图1 HIF-1α在缺氧CRC细胞HCT-116中高表达(,n=3)
缺氧诱导因子1(HIF-1)是一种由缺氧激活的转录因子,HIF-1由α和β两个亚基组成[12],HIF-1α亚基可受氧浓度调节,其表达与缺氧程度呈正相关[13]。基于此,研究结直肠癌细胞HCT-116在常氧、缺氧条件下分别培养6 h、12 h、24 h,细胞内HIF-1α蛋白的表达情况,Western blot结果显示,与常氧组相比,缺氧条件下细胞内HIF-1α蛋白表达水平显著升高(P<0.05或P<0.01)。与缺氧干预6 h组相比,缺氧干预12 h和24 h HIF-1α蛋白表达水平显著升高(P<0.05或P<0.01),呈时间依赖性。见图1。
表1 仙连解毒方对缺氧CRC细胞活力的影响(,n=3)

表1 仙连解毒方对缺氧CRC细胞活力的影响(,n=3)
注:与空白对照组相比,1)P<0.05,2)P<0.01。
组别空白时间48 h浓度/mg·mL-1 IC50/mg·mL-1仙连解毒方48 h 0 2 4 6 8 1 0 6.75±0.93 12 14 16存活率/%100±4.82 95.99±1.842)70.99±2.512)68.81±4.082)58.98±5.412)53.75±3.072)37.75±1.292)30.00±1.481)29.34±0.761)
3.2 仙连解毒方对缺氧CRC细胞活力的影响
MTT结果示:缺氧培养箱XLJDF干预48 h后,在2、4、6、8、10、12、14、16 mg·mL-1浓度下均可抑制缺氧HCT-116细胞活力(P<0.05或P<0.01),IC50=6.75 mg·mL-1,因此选用低、中、高浓度分别为1.7 mg·mL-1、3.4 mg·mL-1、6.8 mg·mL-1进行后续实验。见表1。
3.3 仙连解毒方对缺氧CRC细胞形态的影响
如镜下所示:空白对照组HCT-116细胞生长良好,形态舒展,轮廓清晰规则,呈多边形分布,细胞间有相互重叠、连接生长,密度较大。给药后细胞形态变尖,部分细胞变圆皱缩,细胞密度降低,漂浮细胞数量增多。随着药物浓度的增加变化较为显著。见图2。

图2 仙连解毒方对缺氧CRC细胞HCT-116细胞形态的影响
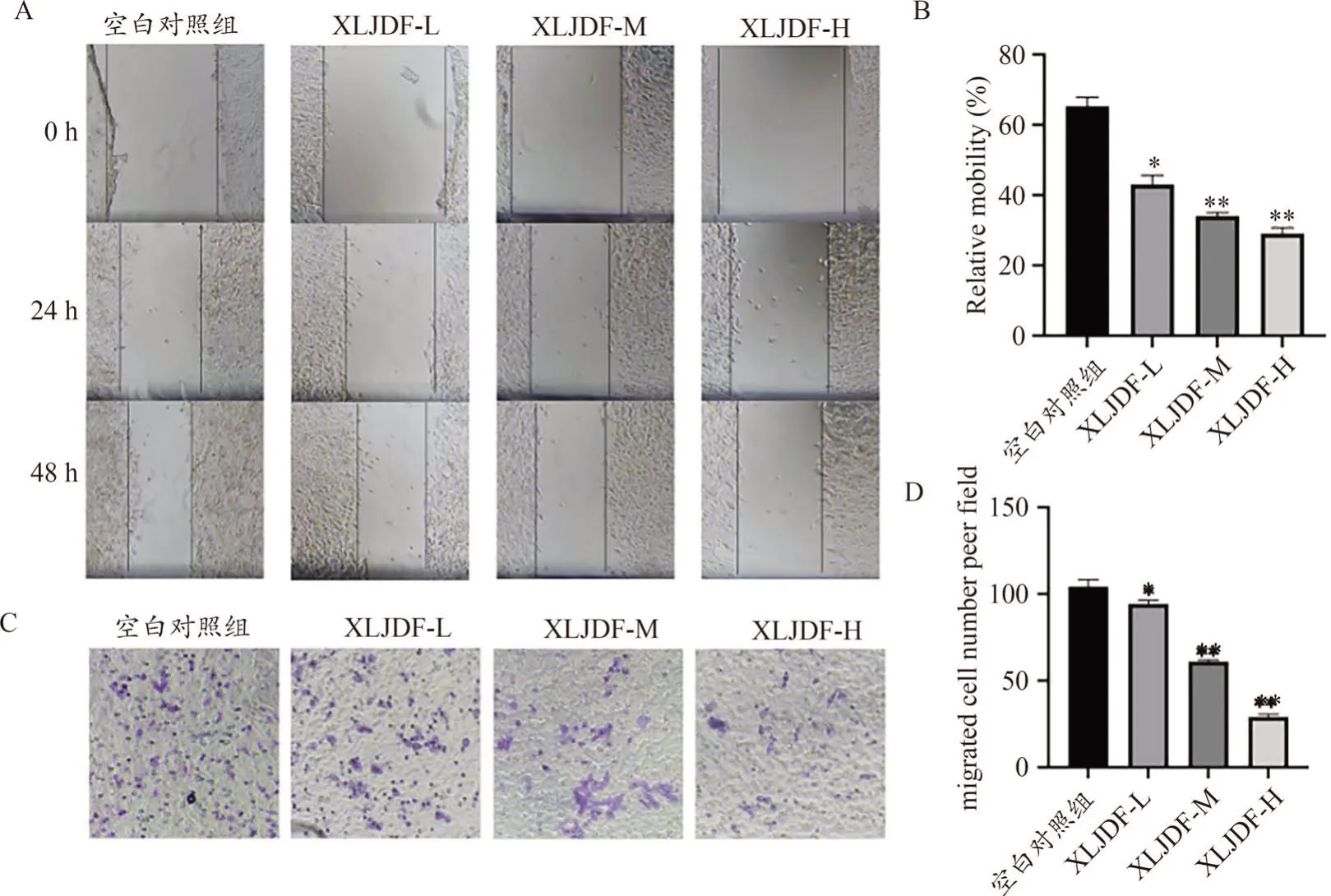
图3 仙连解毒方对HCT-116细胞迁移的影响
3.4 仙连解毒方在体外抑制缺氧CRC细胞迁移
细胞划痕实验示(图3A、3B),与对照组相比,XLJDF各浓度组干预48 h后,细胞迁移率显著减弱(P<0.05或P<0.01),Transwell迁移实验示(图 3C、3D),与对照组相比,XLJDF给药组细胞迁移到下室的数量明显减少(P<0.05或P<0.01)。
3.5 仙连解毒方调控CRC细胞的EMT
已有研究证明,缺氧通过HIF-1α上调E-钙粘蛋白(E-cadherin)的转录抑制因子,诱导EMT,促进结直肠癌的进展及转移[14]。在此基础上进一步研究以验证XLJDF是否能够通过调节HIF-1α,影响EMT进程,从而抑制CRC转移。Western blot检测结果显示,与缺氧空白对照组相比,XLJDF低、中、高浓度给药组能显著抑制HIF-1α、N-钙粘蛋白(N-cadherin)的蛋白表达水平,升高E-钙粘蛋白(E-cadherin)的表达水平,(P<0.05或P<0.01);XLJDF中、高剂量组能降低波形蛋白Vimentin的蛋白表达水平(P<0.05)。这些结果表明,XLJDF抑制了CRC细胞转移,其机制可能与抑制HIF-1α,改善缺氧微环境,逆转EMT过程有关。见图4。
3.6 仙连解毒方通过抑制HIF-1α的表达抑制缺氧CRC细胞迁移
3.6.1 HIF-1α过表达细胞株的构建
基因名称:HIF1A(NM_001530),物种:Human,载体名称:GV358,元件顺序:Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin。载体图谱见图5A。RT-PCR(图5B)和Western blot(图5C、5D)结果显示,与空载体组相比,HIF-1α过表达组细胞HIF-1α mRNA和蛋白表达均显著上调(P<0.05或P<0.01)。
3.6.2 XLJDF减弱HIF-1α过表达细胞的迁移能力
细胞划痕实验(图5E、图5F)和Transwell细胞迁移实验(图5G、图5H)结果显示,与空载体组相比,HIF-1α过表达组细胞伤口愈合速率和迁移到下室的细胞数显著上调(P<0.05),与HIF-1α过表达组对比,XLJDF+HIF-1α组细胞迁移速率和迁移到下室的细胞数均降低(P<0.05)。提示XLJDF逆转了上调的HIF-1α在促进HCT-116细胞迁移中的作用。
3.7 仙连解毒方对TGF-β/smad信号通路的影响
Western blot检测结果显示,与空白对照组相比,XLJDF各浓度干预后,HCT-116细胞内TGF-β、p-Smad3/Smad3的比值显著下调(P<0.05或P<0.01),XLJDF高浓度组干预后Smad3表达量降低(P<0.05),中、低浓度组表达无明显改变(P>0.05)。见图6。

图4 缺氧微环境下仙连解毒方对EMT过程的影响

图5 仙连解毒方通过抑制HIF-1α的表达抑制HCT-116细胞迁移
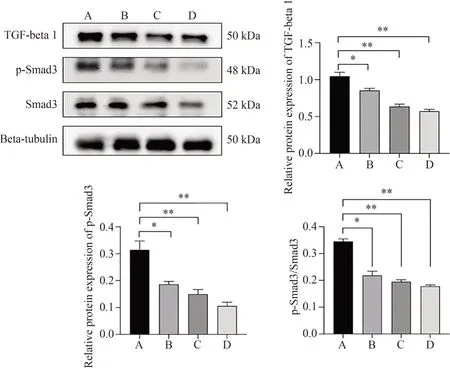
图6 仙连解毒方对TGF-β/smad通路相关蛋白的影响
4 讨论
目前,中医对于肿瘤转移的病机理论研究尚不成熟。郭子瑗等[15]认为三焦形质异常是肿瘤转移的关键因素,张玉人[16]认为“伏毒”学说与肿瘤转移的病机联系紧密。肿瘤中晚期,人体脏腑功能减退,气血阴阳失调,正气亏虚,而癌毒日盛,突破正气束缚,随经络、血脉等流窜走注,并于最虚之处停积,形成肿瘤的复发转移。“癌毒”病机理论认为,“正气亏虚,癌毒流注”是肿瘤转移的基本病机,从而确立了“扶正培本,抗癌解毒”为防治肿瘤转移的主要治法[17]。
上皮细胞通常被定义为具有分泌功能的表面屏障细胞,显示出由粘附和紧密连接建立的不同顶端与基底外侧极化。间充质细胞具有“锚定”功能,通常具有更高的“流动性”,在组织修复和伤口愈合中起重要作用。胚胎发育过程中,分化的极化上皮细胞根据细胞外信号,发生形态的改变,统称为EMT,癌症发展过程中的EMT促使肿瘤细胞更具侵袭性表型。在分子水平上,EMT的显著特点是上皮细胞标志物E-钙粘蛋白(E-cadherin)下调,间充质标志物如N-钙粘蛋白(N-cadherin)上调[18-19]。
缺氧是实体瘤微环境的特征之一,缺氧诱导因子1α(HIF-1α)的表达增加是其标志之一。在正常组织中,氧分压为通常为10-80 mmHg,而肿瘤组织中通常包含严重缺氧(<0.5 mmHg)和中度缺氧(0.5-20 mmHg)的低氧浓度区域,这与肿瘤转移、耐药、放射抗性、不良预后密切相关[20]。缺氧可稳定诱导HIF-1α,已知HIF-1α介导TGF-β1依赖性途径,而TGF-β是EMT的广泛诱导剂[21]。TGF-β信号传导在细胞形态改变、细胞增殖、细胞分化、上皮间质转化、再生和免疫调节中发挥重要作用[22]。癌细胞来源的TGF-β可以通过触发血管生成、上皮间质转化和基质金属蛋白酶(MMP)系统来促进肿瘤生长,从而促进ECM降解[23]。有文献报道[24-25],TGF-β信号传导促进了促肿瘤微环境的生成,Smad3是经典TGF-β信号通路的关键介质,在TGF-β1介导的转录调控中发挥重要作用[26]。
本研究通过缺氧培养条件下的细胞实验,探讨仙连解毒方抑制结直肠癌细胞HCT-116迁移的有效性及可能机制。用MTT比色法验证仙连解毒方醇提物对缺氧条件下HCT-116细胞活性的抑制作用(P<0.05或P<0.01)。已有广泛研究表明,缺氧诱导因子HIF-1α在缺氧CRC中高表达,本实验验证了结直肠癌细胞HCT-116在缺氧条件下干预6 h、12 h、24 h时细胞内HIF-1α的蛋白表达情况,缺氧组HIF-1α蛋白表达水平显著高于常氧组,且24 h内随时间的延长而增加(P<0.05或P<0.01)。伤口愈合实验和Transwell细胞迁移实验验证了仙连解毒方醇提物对缺氧CRC细胞迁移能力的影响,迁移能力随作用时间的延长而增加(P<0.05或P<0.01);EMT在结直肠癌转移中意义重大,因此推测仙连解毒方是否通过EMT过程影响缺氧CRC细胞迁移能力,通过Western blot实验检测EMT相关的关键指标——E-cadherin、N-cadherin、Vimentin,结果示缺氧条件下仙连解毒方可以逆转EMT进程。构建HIF-1α过表达细胞株,通过Transwell细胞迁移实验和伤口愈合实验证实,HIF-1α过表达增强了缺氧HCT16细胞的迁移能力,接着给予XLJDF中剂量(3.4 mg·mL-1)组干预,逆转了这一过程。缺氧条件下TGF-β/smad通路与EMT密切相关,因此用Western blot实验检测TGF-β/smad通路相关蛋白,结果提示仙连解毒方可以抑制TGF-β/smad信号通路。
课题组前期采用中药复方含药血清[27]及水滴醇沉剂[28-29],在体外初步探讨仙连解毒方的作用及机制。长期以来,中药复方细胞实验给药方法在学术界存在争议,本实验采用水滴醇沉法给药,也具有一定局限性。Huang等[30-31]采用含药血清去蛋白离体方法学进行中药复方离体实验,减少粗制剂中金属离子、杂质等对结果的影响,消除了氧化应激源H2O2诱导的细胞对药物体外假阳性反应,具有广泛借鉴意义。在后续的实验中,我们将进一步开展实验研究,不断完善给药方式,深入探讨仙连解毒方抑制结直肠癌转移的作用及机制。
综上,XLJDF通过调控 HIF-1α,抑制 TGF-β/smad信号通路,影响EMT进程,从而在体外抑制结直肠癌细胞转移。

