持续水分胁迫对丹参茎叶酚酸含量及其抗氧化活性的影响
周 正,白 玲,余 燕,杨在君,吴一超,2*,彭正松,3
(1 西华师范大学 生命科学学院, 四川南充 637009;2 西华师范大学组织修复材料工程技术协同创新中心, 四川南充 637002;3 西昌学院, 四川西昌 615000)
丹参(SalviamiltiorrhizaBge.)为唇形科(Labiatae)鼠尾草属(Salvia)多年生草本植物,其根肥厚、肉质,表皮朱红色、内白色[1],其酚酸类成分主要为单酚酸(原儿茶醛、咖啡酸、丹参素)和多酚酸(迷迭香酸、丹酚酸A、丹酚酸B)[2],具有显著的抗氧化、抗肝损伤、抗肿瘤和保护脑组织[3-6]等作用。‘川丹参1号’(CDS-1)(川审药2011002)是经审定的第一个川丹参品种,有效成分含量高,生育期长,株高60~75 cm,根粗短、肥厚,易折断,在一定的区域内抗逆性以及适应性较强[7-8]。
全球气候变化不断加剧,干旱成为抑制植物生长最严重的非生物胁迫[9]。干旱会引发药用植物一系列形态、生理、生化和分子水平的变化,对药用植物的生长和次生代谢物的积累造成严重影响[10]。药用植物对干旱等逆境的响应可以有效促进次生代谢产物的产生和积累,影响品质的形成。有研究发现干旱胁迫早期黄芩苷含量在黄芩茎叶中不断上升,而根系中则随胁迫加重持续增加[11];七叶一枝花根茎中总皂苷含量随土壤水分含量的降低先增加后减少[12];干旱胁迫会使丹参植株矮化,生物量降低,但促使叶片中酚酸含量增加[13];轻度干旱可提高丹参生物量,对丹参酮和丹酚酸B积累有促进作用[14]。对大多数药用植物而言,适度干旱胁迫可增加次生代谢产物的积累,提高药用植物的品质,川丹参道地产区四川中江等地每年干旱频发,春旱和伏旱尤甚,对丹参的产量和品质有显著影响。
川丹参是川产大宗中药材,近年来市场需求不断增加,种植规模不断扩大,产生大量非传统药用部位物质(茎、叶),未得到利用,造成巨大的资源浪费。丹参地上部分占全株生物量的60%~70%,总酚酸含量可达干重5%~8%,川丹参冬季不倒苗,地上部分具有较高的开发价值。因此,本研究以CDS-1为材料,采用土壤水分胁迫法,研究丹参在持续水分胁迫下,不同月份茎叶酚酸含量和抗氧化活性的变化规律,初步明确丹参茎叶中酚酸及其抗氧化能力对土壤水分胁迫的响应行为,为丹参茎叶的开发利用提供科学的理论指导,也为后续进一步开展丹参抗旱性和生态种植技术研究奠定基础。
1 材料和方法
1.1 材料和处理
材料为四川农业大学张利教授课题组提供的‘川丹参1号’(CDS-1),采用土壤水分胁迫法对丹参进行长期水分胁迫。将土壤和营养土按体积比4∶1拌匀,装盆(直径28 cm,高20 cm),每盆8 kg左右。采用烘干法测定土壤绝对含水量,本次试验土壤最大持水量为22.9%,以此为基础设定每个水分胁迫处理组的土壤相对含水量(SRWC)。
于2020年3月10日,选择粗细均匀的CDS-1种根,种植于花盆中,统一管理,种植过程中定量施肥2次。丹参植株30%以上开始长出花序时(2020年6月17日),选取长势一致的25盆,随机分为5个处理组,开始水分胁迫,至12月底收获。以田间最大持水量记为100%,设置土壤相对含水量75%(偏湿)、65%(适宜)、55%(轻度干旱)、45%(中度干旱)和35%(重度干旱)5个水分胁迫处理组,计算每一盆对应水分胁迫处理的总质量,每天下午6:00补足失水质量。分别于9月1日、10月1日和11月1日每组随机取样3株茎叶进行酚酸含量测定和抗氧化活性评价。
1.2 试剂与仪器
BR级1 mol/L福林酚购自源叶生物;96% DPPH和98% ABTS购自Macklin;98.38%丹参素(Batch No.19060920)、99.52%(+)-儿茶素(Batch No.19080110)、99.88%原儿茶醛(Batch No.19071608)、99.48%咖啡酸(Batch No.19032003)、99.02%迷迭香酸(Batch No.19053107)、98.95%丹酚酸A(Batch No.19072411)和99.79%丹酚酸B(Batch No.19062808)标准品均购买于成都曼斯特生物科技有限公司。主要仪器包括22331 Hamburg离心机(Eppendorf AG)、酶标仪(Gene Company Limited)、Agilent 1200-LC高效液相色谱仪(Agilent Technologies Inc.)、Dura12FV实验室超纯水机(泽拉布仪器科技上海有限公司)、PS-60A超声波清洗机(东莞市浩康超声波设备有限公司)。
1.3 丹参茎叶酚酸提取
分别于2020年9月1日、10月1日及11月1日,采集各胁迫处理的丹参茎叶,分别记为SL-8、SL-9、SL-10,-80 ℃保存。精密称取丹参茎叶1.00 g,用均质器磨碎,置三角瓶中,加入80%乙醇100 mL,室温超声提取30 min,静置。取上清液,0.22 μm的微孔滤头滤过,取续滤液用于HPLC分析,另取1 mL提取液稀释30倍,作为总酚酸(TPA)含量测定和抗氧化活性评价供试品溶液。
1.4 丹参茎叶TPA含量的测定
采用福林酚法参考Wang等[15]的方法优化后测定SL-8、SL-9、SL-10的TPA含量。取0.3 mL样品溶液,加入0.25 mol·L-1的福林酚溶液0.3 mL混匀,静置3 min后加入15% Na2CO30.6 mL混匀静置30 min,4 000 r·min-1离心5 min,取上清液,加入96孔板,每孔300 μL,以15% Na2CO3作空白对照,在760 nm波长下测定吸光度。每个样品重复测定3次,每次3孔,以丹酚酸B当量计算TPA含量,结果取平均值。
1.5 丹参茎叶主要酚酸成分含量的HPLC测定
丹参茎叶8种酚酸成分含量采用HPLC同时测定,使用Agilent 1200-LC高效液相色谱仪在岛津ODS-3(5 μm,4.6×250 mm)色谱柱上完成。流动相为0.1%磷酸-水(A)—乙腈(B),流速1 mL/min,柱温40 ℃,进样量10 μL,检测波长280 nm。梯度洗脱程序:0~10 min,15%~20% B;10~11 min,20%~25% B;11~20 min,25%~50% B;20~21 min,50%~90% B;后运行6 min。
标准曲线绘制:分别取没食子酸、丹参素、(+)-儿茶素、原儿茶醛、咖啡酸、迷迭香酸、丹酚酸B、丹酚酸A标准品适量,分别制得浓度为0.092 0、0.123 0、0.093 3、0.095 0、0.084 0、0.095 0、0.079 8和0.038 5 mg/mL的混标溶液,并稀释为一系列浓度梯度。取不同浓度混标进样,按上述色谱方法进行HPLC分析,以浓度(X,mg/mL)为横坐标,峰面积(Y)为纵坐标,拟合标准曲线(表1)。另取1.3中样品溶液在相同条件下进行HPLC分析,采用标准曲线法计算各样品中酚酸含量,平行测定3次,结果取平均值。

表1 8种酚酸标准曲线
1.6 丹参茎叶抗氧化活性评价
1.6.1 DPPH·清除率的测定将Wu等的方法[16]改进,测定DPPH·清除率。在96孔板中加入0.1 mg·mL-1的DPPH-乙醇溶液200 μL,然后依次加入1.3节稀释30倍的样品溶液0、10、20、30、40、50、60和70 μL,用80%乙醇补足300 μL,室温避光反应30 min,并在517 nm处测定溶液吸光度。VC作阳性对照,所有试验重复测定3次。按下式计算DPPH·清除率:
式中,A1为样品+DPPH·溶液的吸光度;A2为样品+80%乙醇的吸光度;A0为80%乙醇+DPPH·溶液的吸光度。
1.6.2 ABTS·+清除率将Wu等的方法[16]改进后进行ABTS·+清除率测定。在96孔板中加入ABTS·+工作液(734 nm处吸光度A734在0.700左右)200 μL,然后依次加入1.3节稀释30倍的样品溶液0、10、20、30、40、50、60和70 μL,用80%乙醇补足300 μL,避光室温静置10 min,在734 nm处测定吸光度。以VC作阳性对照,所有试验重复测定3次。按下式计算ABTS·+清除率:
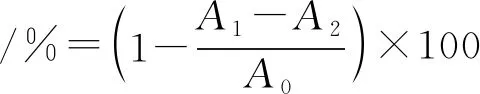
式中,A1为样品+ABTS·+的吸光度;A2为样品+80%乙醇的吸光度;A0为80%乙醇+ABTS·+的吸光度。
1.7 数据处理
使用Excel 2016对原始数据进行汇总、整理,采用SPSS statistics 20进行单因素方差分析(Duncan’s multiple range tests,P<0.05)、计算抗氧化的IC50值和进行相关性分析,所有数据为平均值±SD(n = 3)。
2 结果与分析
2.1 持续水分胁迫对丹参茎叶TPA含量的影响
从图1可知,在持续水分胁迫条件下,丹参8月份茎叶(SL-8)中总酚酸(TPA)的含量随着土壤相对含水量(SRWC)降低而逐渐增加,在SRWC为35%时(重度干旱)达到最高(11.86 mg·g-1),并显著高于SRWC为75%(偏湿)和65%(适宜)水分胁迫处理,而与SRWC为55%(轻度干旱)和45%(中度干旱)时无显著差异。丹参9月份茎叶(SL-9)TPA含量则随着SRWC降低先升后降,并在轻度干旱时达到最高(9.59 mg·g-1),此时显著高于其他4个水分处理组。丹参10月份茎叶(SL-10)的TPA含量随着SRWC的降低呈增加的趋势,并在中度干旱时达到最高(22.64 mg·g-1),但与轻度和重度干旱处理均无显著差异,而轻度到重度干旱胁迫处理均显著高于偏湿和适宜水分处理组。
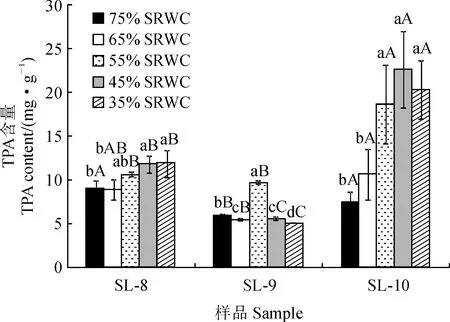
SL-8、SL-9和SL-10分别表示8、9、10月份的样品;小写字母表示相同月份内水分处理组间在0.05水平差异显著(P<0.05);大写字母表示相同处理组内不同月份在0.05水平差异显著(P<0.05)
同时,在相同水分处理条件下,各月份丹参茎叶样品TPA含量均以SL-9最低,仅为SL-8的41.4%~91.1%和SL-10的24.0%~79.9%;在偏湿处理组以SL-8最高,而在适宜水分和干旱胁迫下(SRWC为35%~65%时)均以SL-10最高。以上结果表明,丹参茎叶TPA含量对土壤水分响应敏感,不同月份样品TPA含量随着SRWC降低总体呈相似的增加趋势,但不同月份间差异显著,均以10月份样品含量较高。
2.2 持续水分胁迫对丹参茎叶主要酚酸含量的影响
土壤水分胁迫处理丹参茎叶样品中8种酚酸的含量测定结果(图2、表2)显示,迷迭香酸、丹酚酸B、咖啡酸和原儿茶醛在各月份和各处理组均有显著积累,而丹参素和丹酚酸A主要在SL-9的适宜水分和重度干旱处理组积累,(+)-儿茶素仅在SL-9的偏湿处理组有检出(0.005 mg·g-1),没食子酸在所有样品中均未检出。同时,通过不同月份样品对比发现,迷迭香酸、丹参素在SL-9中积累显著高于SL-8和SL-10,原儿茶醛在SL-8中积累较多,丹酚酸B在所有月份样品中均有积累。另外,随着SRWC降低,丹参茎叶迷迭香酸含量呈现V形变化,而丹参素含量却显著增加。
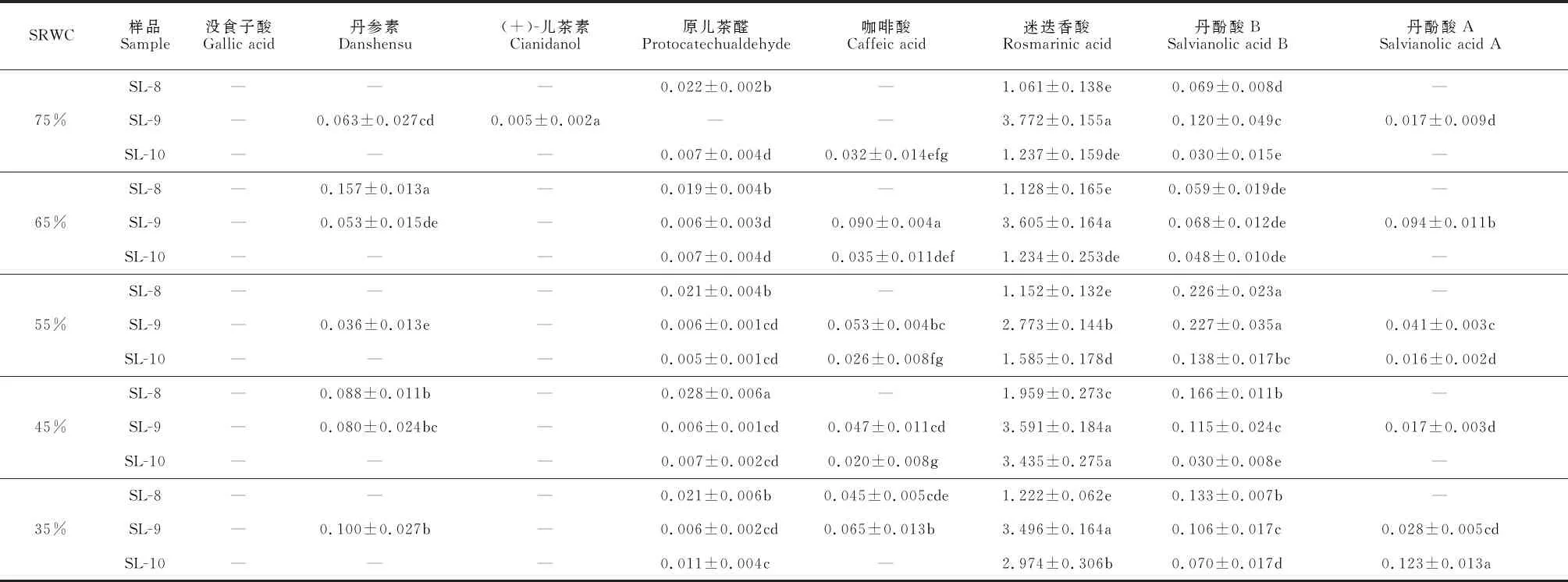
表2 不同月份水分胁迫对8种酚酸含量影响
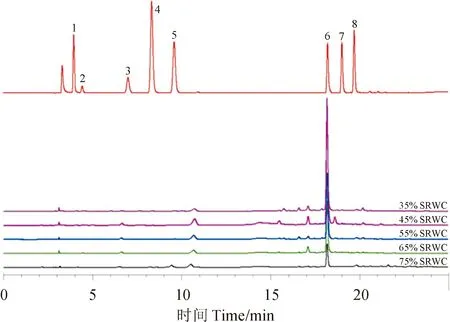
1.没食子酸;2.丹参素;3.(+)-儿茶素;4.原儿茶醛;5.咖啡酸;6.迷迭香酸;7.丹酚酸B;8.丹酚酸A
2.3 持续水分胁迫对丹参茎叶抗氧化活性的影响
图3显示,不同SRWC处理下各月份丹参茎叶提取物都具有较强的抗氧化活性,且其DPPH·和ABTS·+清除率具有显著的浓度依耐性。其中,SL-8的抗氧化活性从强到弱的依次是SRWC为45%、55%、65%、75%、35%水分处理组,表明SL-8在轻度和中度干旱胁迫下抗氧化活性最强,但在重度干旱胁迫下抗氧化活性最弱;不同SRWC处理的SL-9的ABTS·+、DPPH·清除能力差异不大,SL-9样品在偏湿或者适宜水分下的抗氧化活性强于干旱胁迫;SL-10的ABTS·+清除率随SRWC的降低逐渐增强,而对DPPH·的清除率从强到弱依次是SRWC为 45%、35%、65%、55%、75%水分处理组,表明在10月份丹参茎叶酚酸在中度和重度干旱下具有更强的抗氧化活性。
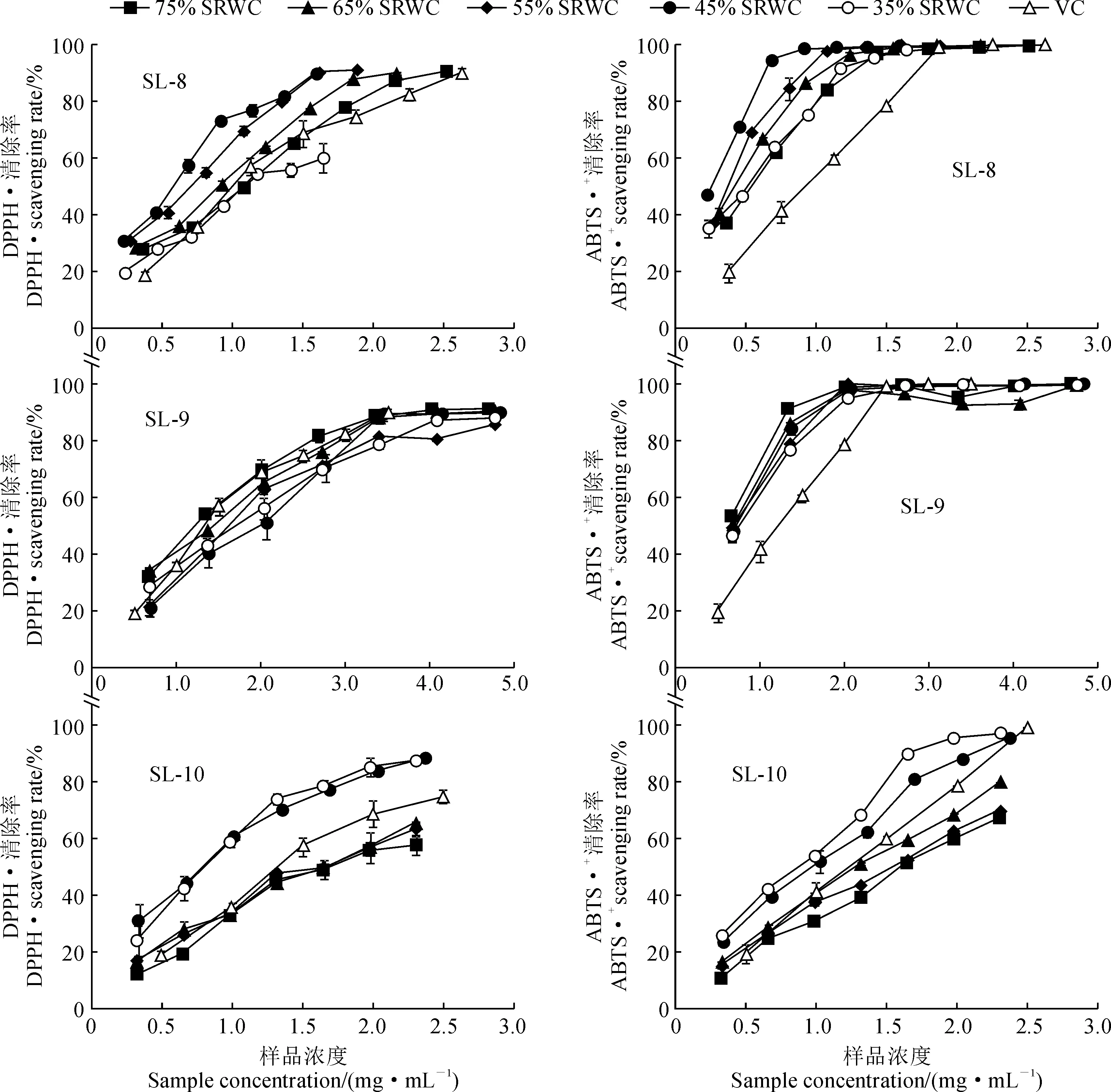
图3 不同月份水分胁迫样品的DPPH·和ABTS·+清除率
3 讨 论
3.1 持续水分胁迫与丹参茎叶酚酸含量的关系
干旱胁迫会在植物中诱导氧化应激反应,会产生过量活性氧(ROS)[17-18]。酚类(酚酸)是植物中适应性最强、分布最广泛的次级代谢产物之一,参与植物抵御外部环境压力,能够清除多余ROS[19]。酚酸在植物体内的生物合成通常是由逆境胁迫所引起,其中最重要的是干旱(水分)胁迫,干旱胁迫下卡琪花蒂玛(Labisiapumila)[20]、撒尔维亚(Salviaofficinalis)[21]和锡那罗亚鼠尾草(Salviasinaloensis)[22]中酚类化合物的生物合成有所增加。丹参的酚酸类化合物主要由苯丙烷类代谢途径产生,除丹参素和咖啡酸可由氨基酸直接氧化脱氨基生成外,其余均可看作二者的衍生物[23]。苯丙氨酸解氨酶(PAL)是苯丙烷类途径的关键限速酶,催化L-苯丙氨酸转化为酚酸合成主要中间体反式肉桂酸[24]。酚酸类化合物的积累可能与水分胁迫下PAL的活化有关,PAL的活性增加了对胁迫的反应,通过增加酚酸的含量来增强抗氧化能力,在植物对非生物胁迫的耐受性方面发挥重要作用[25-26]。
本研究结果表明丹参对干旱的耐受性可能与叶片中丰富的酚酸有关,当土壤的相对含水量降低到一定程度达到干旱水平时,丹参会启动酚酸相关代谢途径关键酶系统,激活其中的关键酶,从而影响酚酸类物质的合成与积累[27]。可能是由于适当干旱胁迫提高了酚酸合成相关酶的活性,而偏湿或适宜水分下的酶活性不如中、重度干旱时的酶活性;但是严重干旱反而会降低酶活性,不利于酚酸的合成与积累[28]。干旱下丹参通过增加具有抗氧化活性的酚酸类物质含量而适应环境变化[29]。
3.2 持续水分胁迫与丹参茎叶抗氧化活性的关系
干旱会在植物中诱导氧化应激反应,产生大量ROS,打破植物体内氧化还原平衡,影响植物正常生长,酚酸类化合物能够有效清除ROS,对植物起到保护作用[26]。本研究通过不同程度持续水分胁迫下丹参茎叶酚酸的抗氧化活性分析发现,它们都具有较强清除DPPH·和ABTS·+的能力,与VC活性接近。其中,SL-8中度干旱处理组的DPPH·清除活性较偏湿处理组显著提高40.5%,ABTS·+清除活性提高了39.3%;SL-10中度干旱处理组的DPPH·和ABTS·+的清除活性较偏湿处理组分别显著提高了58.7%和53.8%。在轻、中度干旱胁迫下,丹参茎叶酚酸的抗氧化活性大于偏湿或重度干旱处理,表明适度干旱有利于提高丹参茎叶抗氧化活性,但过度干旱或偏湿反而会降低抗氧化活性。
同时,在持续水分胁迫下,丹参茎叶总酚酸(TPA)含量变化的趋势与其抗氧化活性变化的趋势一致,酚酸积累多的丹参处理组其抗氧化活性也较高。李晶等[30]研究发现南丹参的抗氧化活性是其多个化学成分共同作用的结果,其研究结果表明丹酚酸B、原儿茶醛、丹参素、咖啡酸等与抗氧化活性的相关性较大,且均与抗氧化活性呈正相关。由此可见持续水分胁迫对丹参茎叶抗氧化活性的影响可能表现在水分胁迫影响了丹参茎叶酚酸的含量的积累,从而影响其抗氧化活性能力。
此外,本研究结果还发现SL-8和SL-10的中度和重度干旱胁迫更利于丹参茎叶TPA的积累和抗氧化活性的提高,而SL-9中轻度干旱胁迫更利于TPA的积累和抗氧化活性的提高。对于相同土壤相对含水量处理组,丹参茎叶TPA含量和抗氧化活性时空(月份间)变化显著。就抗氧化活性而言,除重度干旱处理组外,其他处理组整体趋势为SL-8抗氧化活性最强,SL-9次之,SL-10最弱。引起相同处理的不同月份样品之间差异的原因可能是由于8月、9月、10月3个月的气候变化,可能是由于高温和低温胁迫与水分胁迫共同导致。有研究表明,温度的逐渐降低、日照时间减少等可能会影响到丹参植株的生长、酶的活性、代谢物的积累等[31]。后续还需要进一步研究温度等气候因子对丹参茎叶酚酸含量的影响,以期能充分利用丹参植物资源,促进产业发展。
4 结 论
本研究表明,持续水分胁迫对丹参茎叶酚酸含量和抗氧化活性有显著影响。但水分胁迫压力程度和时间段(8月、9月和10月)的不同,丹参茎叶总酚酸、主要酚酸含量及其抗氧化能力都存在差异。中度和重度干旱胁迫下丹参茎叶酚酸含量最高,10月份茎叶总酚酸含量最高,8月份茎叶的总体抗氧化活性最强。土壤相对含水量为45%时(中度干旱)8月份和9月份茎叶中主要酚酸含量最高,在9月份茎叶中不同处理组差异不大。本研究丹参茎叶酚酸含量的增加与文献中其他植物和丹参品种的数据基本一致,表明这可能是丹参对干旱诱导产生的ROS的一种应激反应。这些结果还表明,干旱可以成功地用于增强丹参茎叶中酚酸等抗氧化物质的合成和积累,并可以通过科学的灌溉技术来增加丹参茎叶中酚酸的含量,促进丹参的综合利用。

