乌头汤、四妙散对胶原诱导性关节炎DBA/1小鼠的作用研究
郑权发 张宇 陈芳 聂晶 于莨鉴 曾光
〔摘要〕 目的 研究中医“散寒除湿”和“清热祛湿”两种治法的代表方乌头汤和四妙散分别对胶原诱导性关节炎(collagen-induced arthritis, CIA)DBA/1小鼠的白细胞介素-17 (interleukin-17, IL-17)、转化生长因子-β (transforming growth factor β, TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)表达的影响,从“以方测证”角度探讨DBA/1小鼠CIA模型的中医证候属性。 方法 复制DBA/1小鼠CIA模型,将造模成功的小鼠随机分为模型组、乌头汤低剂量组、乌头汤高剂量组、四妙散低剂量组、四妙散高剂量组、甲氨蝶呤组,另设一组空白组,每组6只,连续给药35 d。观察记录关节炎指数的变化,ELISA法检测血清中IL-17、TGF-β及TNF-α的含量水平,免疫组化法检测炎症关节组织中IL-17、TGF-β及TNF-α的表达。结果 与空白组比较,模型组关节炎指数评分明显升高(P<0.01);模型组关节滑膜增生明显,软骨表面组织变性、坏死;关节组织、血清中IL-17、TNF-α、TGF-β表达显著增高(P<0.05或P<0.01)。与模型组比较,从第21天起给药组关节炎指数评分明显下降(P<0.05或P<0.01);关节滑膜增生、关节软骨表面损伤减轻;乌头汤低/高剂量组、四妙散高剂量组、甲氨蝶呤组关节组织中IL-17、TNF-α、TGF-β表达明显降低(P<0.05或P<0.01);烏头汤高剂量组、四妙散低/高剂量组、甲氨蝶呤组血清中IL-17、TNF-α表达明显降低(P<0.05或P<0.01)。各给药组之间相比较:与乌头汤高剂量组比较,甲氨蝶呤组、乌头汤低剂量组、四妙散低剂量组IL-17表达明显升高(P<0.05或P<0.01);乌头汤低剂量组TNF-α表达升高(P<0.05),其余均无统计学差异。结论 乌头汤及四妙散给药均能改善CIA小鼠模型的症状。对相关炎症因子的抑制,可能是乌头汤及四妙散的作用机制之一,推测DBA/1小鼠CIA模型或许兼有“寒痹”与“热痹”的属性。
〔关键词〕 胶原诱导性关节炎;四妙散;乌头汤;白细胞介素-17;转化生长因子-β;肿瘤坏死因子-α;中医证候
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.04.008
Effects of Wutou Decoction and Simiao Powder on collagen-induced arthritis DBA/1 mice
ZHENG Quanfa1, ZHANG Yu1, CHEN Fang2, NIE Jing3, YU Langjian1, ZENG Guang1*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 3. School of Chemistry and Chemical Engineering,
Central South University, Changsha, Hunan 410083, China)
〔Abstract〕 Objective To study the effect of the two representative methods of "dispersing cold and removing dampness"
and "clearing heat and removing dampness" in traditional Chinese medicine (TCM) Wutou Decoction and Simiao Powder on the expression of interleukin-17 (IL-17), transforming growth factor-β (TGF-β) and tumor necrosis factor-α (TNF-α) in DBA/1 mice with collagen-induced arthritis (CIA), and to explore the attribute of TCM syndrome of CIA model of DBA/1 mice from the angle of “measuring symptoms and signs with prescriptions”. Methods CIA model of DBA/1 mice was replicated, the successful modeling mice were randomly divided into model group, Wutou Decoction low-dose group, Wutou Decoction high-dose group, Simiao Powder low-dose group, Simiao Powder high-dose group and methotrexate group, another blank group was set up, with 6 mice in each group. After 35 consecutive days of drug administration, the changes of arthritis index were observed and recorded. The content levels of IL-17, TGF-β and TNF-α in serum were detected by ELISA, and the expression levels of IL-17, TGF-β and TNF-α in inflammatory joint tissue were detected by immunohistochemistry. Results Compared with the blank group, the arthritis index score of the model group was significantly increased (P<0.01), and there was significant synovial hyperplasia, as well as degeneration and necrosis of cartilage surface tissues. The expression levels of IL-17, TNF-α and TGF-β in the joint tissue and serum were significantly increased (P<0.05 or P<0.01). Compared with the model group, the arthritis index score of the medication administration
group decreased significantly from the 21st day (P<0.05 or P<0.01); synovial hyperplasia of joints, and alleviation of surface damage of articular cartilage were observed. The expression levels of IL-17, TNF-α and TGF-β in the joint tissues of the low-dose and high-dose groups of Wutou Decoction, the Simiao Powder high-dose group and methotrexate group were significantly decreased (P<0.05 or P<0.01). The expression levels of IL-17 and TNF-α in the serum of the Wutou Decoction high-dose group and the low-dose, high-dose groups of Simiao Powder and methotrexate group were significantly decreased (P<0.05 or P<0.01). Compared between medication administration group: compared with Wutou Decoction high-dose group, the expression of IL-17 in methotrexate group, Wutou Decoction low-dose group and Simiao Powder low-dose group was significantly increased (P<0.05 or P<0.01); the expression of TNF-α was increased in Wutou Decoction low-dose group (P<0.05), and there was no significant difference in other groups. Conclusion Both Wutou Decoction and Simiao Powder can improve the symptoms of CIA mice model. The inhibition of inflammatory factors may be one of the mechanisms of action of Wutou Decoction and Simiao Powder. It is speculated that CIA model of DBA/1 mice may have both “cold arthromyodynia” and “heat arthromyodynia” properties.
〔Keywords〕 collagen-induced arthritis; Simiao Powder; Wutou Decoction; interleukin-17; transforming growth factor-β; tumor necrosis factor-α; TCM syndrom
類风湿性关节炎(rheumatoid arthritis, RA)是难治性自身免疫性疾病之一,其基本病理改变为血管翳形成与滑膜增生,造成软骨下骨质及关节软骨的损坏和侵蚀,致畸率极高,严重影响患者的生活质量[1]。以甲氨蝶呤为基础的多种抗风湿药联合、中西药联合治疗是目前临床主要治疗手段[2]。
RA属于中医学“痹证”范畴。王建等[3]采集全国18家研究中心1602例类风湿关节炎患者信息的多中心横断面调查研究发现,RA中医证候分布特点为:湿热痹阻证比例最高,其他依次为寒湿痹阻证、肝肾不足证、痰瘀痹阻证、风湿痹阻证、气血不足证。而四妙散与乌头汤,分别是湿热痹阻证、寒湿痹阻证的常用方,也是中医“清热祛湿”和“散寒除湿”治法的代表方,目前广泛应用于临床治疗风湿性疾病[4-6]。本课题通过复制胶原诱导性关节炎(collagen-induced arthritis, CIA)模型DBA/1小鼠,探讨散寒除湿的代表方乌头汤、清热祛湿的代表方四妙散分别对CIA小鼠的治疗作用及分子机制。从CIA小鼠的关节炎指数评分、关节病理形态、血清及炎症关节组织中白细胞介素-17 (interleukin-17, IL-17)、转化生长因子-β (transforming growth factor-β, TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的表达,观察乌头汤、四妙散对DBA/1小鼠CIA模型的疗效,探讨DBA/1小鼠CIA模型的中医证候属性,从而进一步阐释中医寒、热不同治法治疗“痹症”的科学内涵。
1 材料
1.1 动物
5周龄雄性DBA/1小鼠54只;体质量18~22 g,购于上海斯莱克实验动物有限公司;实验动物生产许可证号:SCXK(沪)2017-0005。实验动物使用许可证号:SYXK(湘)2014-0012;湖南斯莱克景达动物伦理委员会,伦理审查编号:IACUC-SJA19029。饲养于湖南斯莱克景达实验动物有限公司SPF级动物实验室。
1.2 试剂与药品
牛Ⅱ型胶原(批号:190306,美国Chondrex);弗氏完全佐剂(批号:190208,美国Chondrex);甲氨蝶呤片[批号:H31020644,规格:2.5 mg×100片,上海医药(集团)有限公司信谊制药总厂];乌头汤免煎颗粒、四妙散免煎颗粒(批号:9060021、9060022,广东一方制药有限公司)。
1.3 仪器
玻璃微量注射器(瑞士Hamilton公司,250 μL);Basile 37140足肿测定仪(意大利 UGO公司);5810R型高速冷冻离心机(德国 Eppendorf 公司);动物永久标记仪(AIMS 公司);ATY224型电子天平(日本岛津公司);CDS9000型动物气体麻醉机(美国 Surgi Vet公司);YJD13-GL型自动煎药机(北京东华原医疗设备责任有限公司);ECLIPSE Ci-L型生物正置显微镜、DS-1600型成像系统(株式会社尼康)。
2 方法
2.1 DBA/1小鼠CIA模型的复制
取54只DBA/1雄性小鼠,随机选取6只作为空白对照组,其余48只小鼠均复制CIA模型:将溶于乙酸的牛Ⅱ型胶原与弗氏完全佐剂等体积混合,充分乳化制成Ⅱ型胶原乳剂。于小鼠的尾根部单点注射,每只0.2 mL。以初次免疫作为第1天,第21天在相同的位置再次使用相同剂量增强免疫[7],DBA/1小鼠在第二次增强免疫后第7天进行关节炎指数(arthritis index, AI)评分,累计总分大于4分或者单个肢体评估超过2分则视为造模成功[8],共成功42只。
2.2 动物分组与给药
筛选出36只CIA模型小鼠,随机分为模型组、乌头汤低剂量组、乌头汤高剂量组、四妙散低剂量组、四妙散高剂量组、甲氨蝶呤组,每组各6只。模型复制成功后开始灌胃,乌头汤的成人每日剂量:川乌6 g,麻黄、黄芪、白芍、炙甘草各9 g,小鼠每日灌胃给药的剂量7.5 g/kg(低剂量组,临床等效剂量的2倍)和15 g/kg(高剂量组,临床等效剂量4倍)。四妙散的成人每日剂量:黄柏12 g,牛膝12 g,苍术12 g,薏苡仁30 g。小鼠每日灌胃给药的剂量为6 g/kg(低剂量组,临床等效剂量的2倍)和12 g/kg(高剂量组,临床等效剂量4倍)。空白组和模型组小鼠分别给予等体积生理盐水灌胃,甲氨蝶呤组每日灌胃给药的剂量为0.33 mg/kg。给药第35天,各组小鼠麻醉,进行腹主动脉取血,3500 r/min离心15 min得血清,-80 ℃保存,取小鼠右足关节组织,4%甲醛溶液固定,待检测。
2.3 指标观察与检测
2.3.1 小鼠一般情况和发病时间 第2次增强免疫后每日观察小鼠进食、大小便、精神状态及一般活动情况至确认模型复制成功;观察记录小鼠体质量变化;每日观察各组小鼠发病情况,并记录开始发病时间。
2.3.2 AI评分 从给药第1天起,每隔7 d对各组小鼠关节炎状况进行1次评分,并评估结果,具体评分标准如下[8]:无红肿计0分,趾关节稍肿计1分,趾关节及足趾关节肿胀计2分,踝关节以下足爪肿胀计3分,包括踝关节在内的全部足爪肿胀计4分。每只小鼠最高积累评分为16分。
2.3.3 ELISA法检测外周血炎症因子含量 室温平衡20 min后从铝箔袋中取出所需板条,设置空白孔、标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔先加待测样本10 μL,再加样本稀释液40 μL。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物(horseradish peroxidase, HRP)酶标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃水浴锅或恒温箱温育60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液,静置l min,甩去洗涤液,吸水纸上拍干,重复洗板5次。每孔加入底物A、B各50 μL。37 ℃避光孵育15 min。每孔加入终止液50 μL,15 min内在450 nm波长处测定各孔的OD值。
2.3.4 关节组织病理检测方法 动物牺牲后剪下右后足炎症膝关节组织,福尔马林固定,10% EDTA脱钙液中脱钙21 d,乙醇逐级脱水,二甲苯透明,石蜡包埋,切片,脱蜡,进行苏木精-伊红(hematoxylin-eosin, HE)染色,封片。100倍光学显微镜下观察关节滑膜、软骨和骨病理改变,以及滑膜血管增生情况。
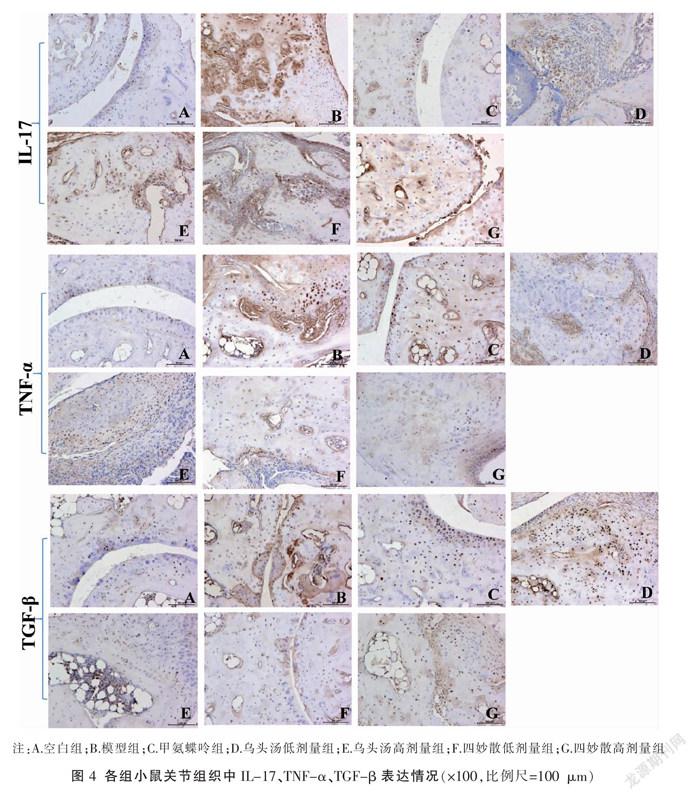
2.3.5 免疫组化检测关节组织IL-17、TNF-α、TGF-β的表达情况 切片常规脱蜡、水化后,缓冲液洗2次,每次3 min,将切片放在过氧化氢阻断剂(hydrogen peroxide block)中孵育10~15 min,缓冲液洗2次,每次5 min,滴加ultra V block(酶标一抗),在室温下孵育5 min以封闭非特异性的背景染色,缓冲液洗2次,每次5 min,滴加一抗工作液37 ℃孵育1.5 h,缓冲液洗2次,每次5 min,滴加primary antibody enhancer(增强子),在室温下孵育20 min,缓冲液洗2次,每次5 min,滴加HRP polymer(酶标二抗),在室溫下孵育30 min,缓冲液洗2次,每次5 min,向1 mL DAB plus substrate中滴加1~2滴DAB plus chromogen,混匀后滴加到切片上,孵育3~15 min,自来水充分冲洗,复染,脱水,透明,封片。用Image-Pro Plus 6.0图像处理分析系统进行图像分析,结果以累积光密度(IOD=阳性表达面积×平均光密度)表示,数值越大则阳性表达越多。
2.4 统计学方法
采用SPSS 25.0软件对实验所得数据进行统计学处理,计量资料以“x±s”表示,组间均数比较采用单因素方差分析,两两比较用LSD-t检验,方差不齐则用Kruskal-Wallis H检验,P<0.05为差异具有统计学意义,P<0.01为差异具有显著性统计学意义。
3 结果
3.1 CIA小鼠的一般情况
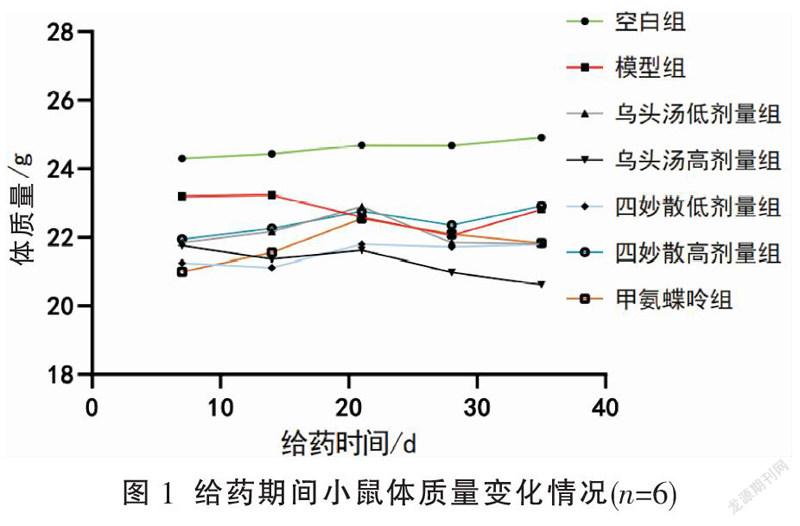
模型复制成功后,与空白组比较,各组CIA小鼠出现不同程度体质量增长缓慢,精神萎靡,喜扎堆,毛发枯黄,饮食、饮水、活动量减少,关节先后出现红肿。开始给药后,空白组小鼠体质量稳定增长,其余组CIA小鼠体质量增长依旧缓慢,甚至出现体质量持续下降现象,体质量下降阶段主要在第14~28 d期间。见图1。
3.2 乌头汤、四妙散对CIA小鼠AI评分的影响
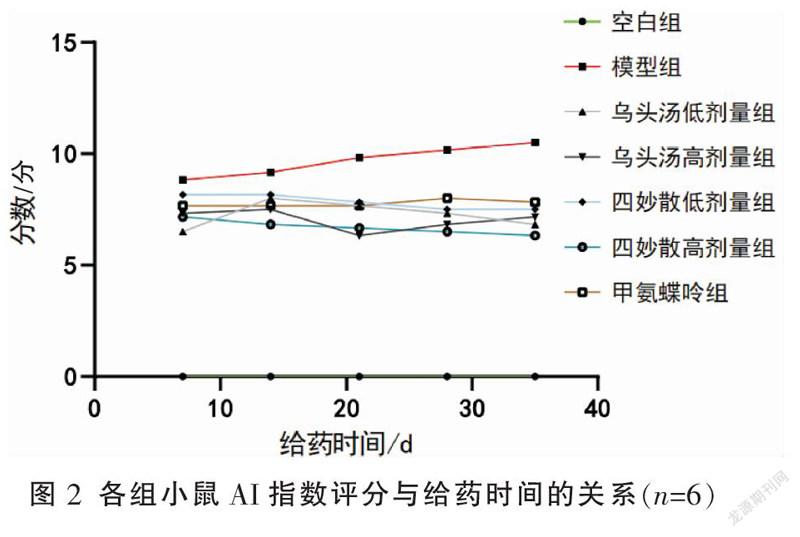
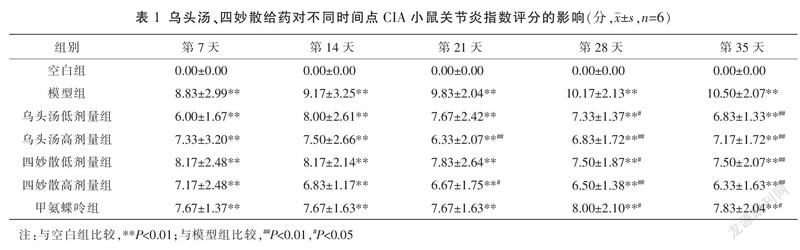
与空白组比较,第7、14、21、28、35 天模型组和各给药组关节出现不同程度肿胀,AI评分明显升高(P<0.01)。与模型组比较,从给药第21天开始,给药组小鼠AI评分与模型组出现差异,给药组小鼠AI评分明显下降(P<0.05或P<0.01),且随着给药时间的延长,AI评分差异越明显。其余给药组间差异均无统计学意义(P>0.05)。见表1和图2。
3.3 乌头汤、四妙散对CIA小鼠关节组织病理变化的影响
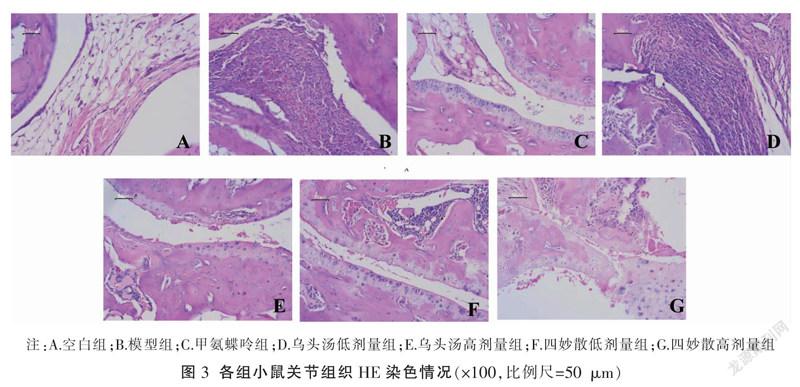
组织病理学检查显示,空白组小鼠关节结构正常,滑膜组织无充血水肿,关节软骨表面光滑平整(图3A)。模型组小鼠滑膜细胞增生明显,可见炎症细胞大量浸润,增生滑膜组织表面形成绒毛状,向软骨面爬行形成血管翳。软骨表面组织变性、坏死(图3B)。各给药组小鼠关节滑膜有部分增生,有少量炎症细胞浸润,关节软骨表面损伤较轻,见图3C-G。
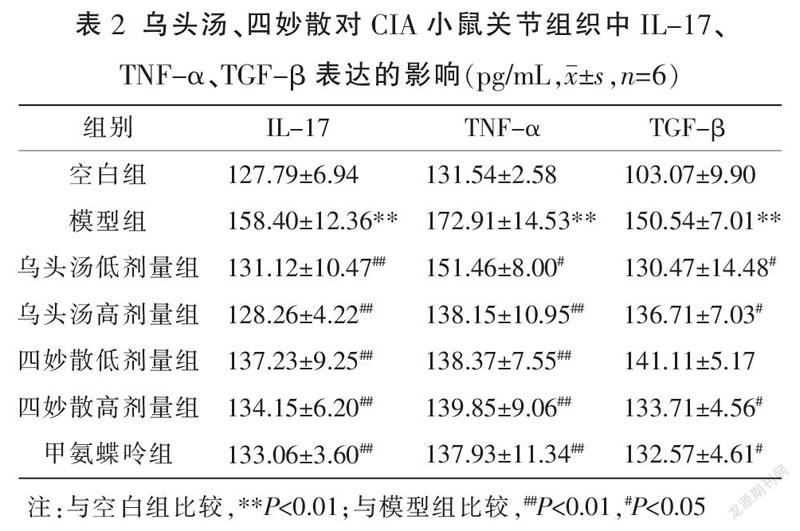
3.4 乌头汤、四妙散对CIA小鼠关节组织中IL-17、TNF-α、TGF-β表达的影响
右足关节组织切片经免疫组化处理并进行图像分析后(图4),与空白组比较,模型组小鼠关节组织中IL-17、TNF-α、TGF-β表达显著增高(P<0.01)。与模型组比较,乌头汤低/高剂量组、四妙散低/高剂量组、甲氨蝶呤组IL-17、TNF-α表达均降低(P<0.01或P<0.05);乌头汤低/高剂量组、四妙散高剂量组、甲氨蝶呤组TGF-β表达降低(P<0.05)。各给药组之间相比较,关节组织中IL-17、TNF-α、TGF-β表达差异无统计学意义(P>0.05)。见表2。
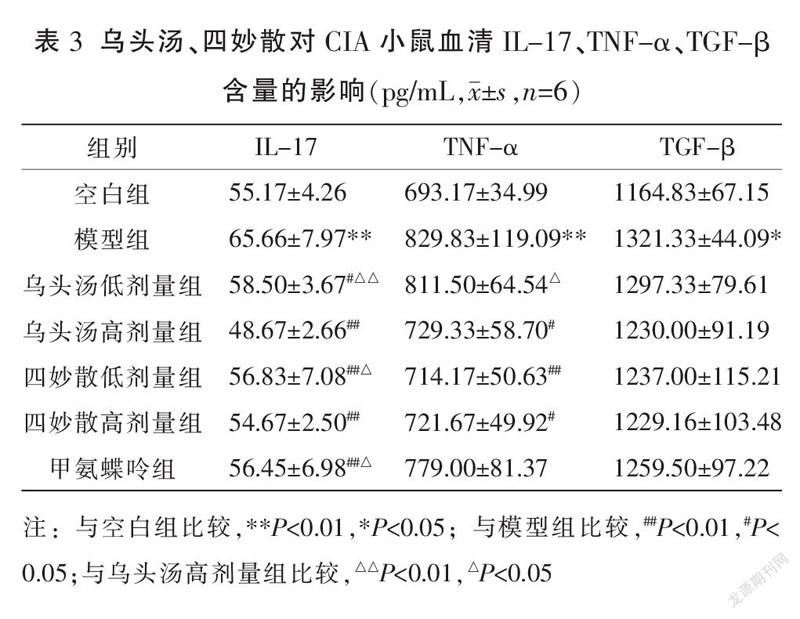
3.5 乌头汤、四妙散对CIA小鼠血清中细胞因子IL-17、TNF-α、TGF-β表达的影响
与空白组比较,模型组小鼠血清中IL-17、TNF-α、TGF-β表达显著增高(P<0.05或P<0.01)。与模型组比较,乌头汤低/高剂量组、四妙散低/高剂量组、甲氨蝶呤组IL-17表达明显降低(P<0.05或P<0.01);乌头汤高剂量组、四妙散低/高剂量组TNF-α的表达明显降低(P<0.05或P<0.01);各给药组TGF-β表达差异无统计学意义(P>0.05)。与乌头汤高剂量组比较,甲氨蝶呤组、乌头汤低剂量组、四妙散低剂量组IL-17表达明显升高(P<0.05或P<0.01);乌头汤低剂量组 TNF-α表达升高(P<0.05),其余给药组间差异均无统计学意义(P>0.05)。见表3。
4 讨论
RA为自身免疫系统介导的关节滑膜慢性炎症性反应,RA致病机制虽尚未完全阐明,但是已有大量研究表明,炎症因子浸润是RA疾病的主要特征表现之一。近年来,不少研究人员对炎症因子和中医病因病机进行归纳关联研究,临床中通过对RA患者进行不同证型与炎症因子表达联系的实验中发现,风寒湿痹证组、湿热痹证组和寒热错杂证组在IL-17和TNF-α等炎症因子的表达含量明显增高[9]。此外,动物实验中发现风寒湿痹证AIA模型大鼠IL-17A水平比普通AIA模型大鼠升高明显[10]。TNF-α、IL-17是驱动RA关节滑膜炎症反应及关节破坏的关键炎症细胞因子。TNF-α介导NF-κB通路活化,诱导VEGF、VCAM-1、IL-8等多种细胞因子生成,促进RA滑膜炎症和血管翳的形成,TNF-α促进滑膜细胞内核因子κB受体活化因子配体表达,激活破骨细胞前体细胞,使其分化为成熟的破骨细胞,介导RA骨侵蚀[11-14]。“风寒湿”外邪通过JAK/STAT信号通路激活Th17细胞分化,产生IL-17,诱导破骨细胞分化,活化基质金属蛋白酶MMPs,IL-17A不但诱导巨噬细胞产生IL-1β和TNF-α,又可诱导滑膜成纤维细胞分泌IL-6和IL-8,还可诱导RANKL表达[15-19]。一些调节性细胞因子(如TGF-β)和一些小分子蛋白酶类物质也共同参与RA的发生和发展。研究显示,RA患者以及RA模型小鼠血清和滑膜组织中IL-10和TGF-β表达水平增高,推测可能是Breg细胞引起小鼠血清和滑膜组织中的IL-10和TGF-β的升高,通过产生IL-10、TGF-β等炎症抑制因子,负向调控炎症反应,并抑制关节疾病的进展[20-22],说明RA患者可能更多处于病情活动期,其自身免疫处于活跃状态。中医理论则认为RA患者由于外感风寒、湿热之邪蕴结于内,或嗜食肥甘厚腻,脾为湿困,郁而化热,湿热壅盛,与正邪交争剧烈有关。
以甲氨蝶呤为基础的多种抗风湿药联合、中西药联合治疗是目前临床主要治疗手段[23]。《中药新药临床研究指导原则》将RA分为湿热痹阻、寒湿痹阻、痰瘀痹阻、瘀血阻络、肝肾两虚、氣阴两虚6个证型[24],而四妙散与乌头汤分别是湿热痹阻证、寒湿痹阻证的常用方,也是中医“清热祛湿”“散寒除湿”治法的代表方。
目前,关于RA的病证结合实验动物模型研究文献归纳起来有风寒湿痹证、风湿热痹证、寒邪痹阻证、血瘀痹阻证、肾虚证及脾虚证RA大鼠模型,均是在大鼠RA模型成功后再联合模拟外部刺激进行模型复刻[25]。这些大鼠关节炎病证模型仍存在部分争议:(1)动物模型很难实现四诊客观化,如恶风、汗出、肢体沉重、脉象等都无法在动物身上得到观察。(2)病证结合模型中是先建立“病”模型还是应该先建立“证”模型,亦或“病”“证”同时造模,这是一个争论的焦点。(3)目前,病证结合造模思路是将西医病理因素与中医病因因素强行叠加一起,病、证之间缺乏关联。在已有动物模型的基础上,结合中医类风湿关节炎特点,复制中医病证结合模型方法及评价标准虽然目前还有难度,是今后RA动物模型重要的发展方向。
检验中医动物模型最科学的方法是运用有拮抗或加强作用的方劑进行干预,根据症状及检测指标来推测该模型的中医证型属性[26]。乌头汤具有温经散寒、通络止痛的功效,是治疗寒痹的经典方剂;四妙散具有清热利湿、舒筋利痹的功效,是治疗热痹的经典方剂。胶原诱导的DBA/1小鼠RA模型是公认的成模率高、发病接近临床的动物模型[27],目前尚未见到有利用此模型进行病证结合RA研究的报道,本研究通过用乌头汤、四妙散对DBA/1小鼠CIA模型进行干预,验证DBA/1小鼠CIA模型的寒热属性,得出以下结论:乌头汤或四妙散对实验性CIA小鼠模型均有治疗作用,对炎症因子的抑制作用,可能是乌头汤或四妙散起作用的机制之一,推测胶原诱导的DBA/1小鼠CIA模型的天然发病状态,从中医证候来说,既有寒证的属性,也有热证的属性,要将此动物模型造成病证结合模型,有待进一步的深入研究。
参考文献
[1] 王 亮.类风湿关节炎免疫治疗药物的作用机制和应用进展[J].中国处方药,2020,18(4):25-26.
[2] 徐卫东,周 琦,郑 光,等.利用文本挖掘技术分析治疗类风湿关节炎中成药和西药使用基本规律[J].辽宁中医杂志,2012,39(3):425-427.
[3] 王 建,巩 勋,唐晓颇,等.1602例类风湿关节炎患者中医证候分布特点的多中心横断面调查[J].中医杂志,2018,59(11):963-967.
[4] 周 俭,曾 光,鲜瑶瑶.国医大师熊继柏辨治顽痹经验举隅[J].临床医学研究与实践,2020,5(13):133-134.
[5] 王康惠.四妙散加味治疗类风湿关节炎的临床疗效观察[J].中国医药科学,2018,8(21):54-56.
[6] 兰维娅,唐 芳,马武开,等.乌头汤联合常规西药治疗类风湿关节炎随机对照试验的Meta分析[J].风湿病与关节炎,2019,8(1):36-40,45.
[7] 张玲玲,刘云洁,童 彤,等.DBA/1小鼠胶原性关节炎模型建立方法及评价指标[J].中国药理学通报,2010,26(8):1108-1111.
[8] 周 俭,曾 光,鲜瑶瑶,等.熊果酸对CIA大鼠关节软组织RANKL、RANK、OPG mRNA表达的影响[J].亚太传统医药,2020,16(3):28-30.
[9] 侯 雷,元晓龙,曾 苹,等.类风湿关节炎中医证型与IL-17及其相关炎症因子表达的研究[J].中国民族民间医药,2019,28(3):81-86.
[10] 张 逢,戴宗顺,林 也,等.“风寒湿”外邪影响Th17/Treg失衡促进类风湿关节炎病证发生的分子机制研究[J].湖南中医药大学学报,2021,41(11):1657-1662.
[11] 曾 光,陈 芳,邵 峰,等.熊果酸对大鼠CIA模型关节TNF-α、IL-17、PGE2表达的影响[J].湖南中医药大学学报,2018,38(1):13-16.
[12] CALABRESI E, PETRELLI F, BONIFACIO A F, et al. One year in review 2018: Pathogenesis of rheumatoid arthritis[J]. Clinical and Experimental Rheumatology, 2018, 36(2): 175-184.
[13] SCHERER H U, H?魧UPL T, BURMESTER G R. The etiology of rheumatoid arthritis[J]. Journal of Autoimmunity, 2020, 110: 102400.
[14] KARAMI J, MASOUMI M, KHORRAMDELAZAD H, et al. Role of autophagy in the pathogenesis of rheumatoid arthritis: Latest evidence and therapeutic approaches[J]. Life Sciences, 2020, 254: 117734.
[15] 张 婷.基于炎症细胞因子表达谱的类风湿关节炎不同辨证分型临床与基础研究[D].长沙:湖南中医药大学,2021.
[16] BETTELLI E, CARRIER Y, GAO W, et al. Reciprocal develop?鄄
mental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006, 441(7090): 235-238.
[17] HONORATI M C, NERI S, CATTINI L, et al. Interleukin-17, a regulator of angiogenic factor release by synovial fibroblasts[J]. Osteoarthritis and Cartilage, 2006, 14(4): 345-352.
[18] AWASTHI A, MURUGAIYAN G, KUCHROO V K. Interplay between effector Th17 and regulatory T cells[J]. Journal of Clinical Immunology, 2008, 28(6): 660-670.
[19] ZHANG X, YUAN Y P, PAN Z P, et al. Elevated circulating IL-17 level is associated with inflammatory arthritis and disease activity: A meta-analysis[J]. Clinica Chimica Acta, 2019, 496: 76-83.
[20] ZHOU L, LOPES J E, CHONG M M W, et al. TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing RORgammat function[J]. Nature, 2008, 453(7192): 236-240.
[21] COOLES F A, ISAACS J D. Pathophysiology of rheumatoid arthritis[J]. Current Opinion in Rheumatology, 2011, 23(3): 233-240.
[22] SUN W K, BAI Y, YI M M, et al. Expression of T follicular helper lymphocytes with different subsets and analysis of serum IL-6, IL-17, TGF-β and MMP-3 contents in patients with rheumatoid arthritis[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(1): 61-69.
[23] SMOLEN J S, ALETAHA D, BARTON A, et al. Rheumatoid arthritis[J]. Nature Reviews Disease Primers, 2018, 4: 18001.
[24] 黃 晶,舒晓明,王 贵,等.甲氨蝶呤治疗类风湿关节炎的作用机制[J].中华临床医师杂志(电子版),2016,10(21):3276-3280.
[25] 张新伟,阿热艾·阿达力,豆江移,等.类风湿关节炎病证结合动物模型研究进展[J].现代中西医结合杂志,2021,30(34):3868-3871.
[26] 林 也,戴宗顺,张 婷,等.基于“以方测证”的类风湿关节炎风寒湿痹证动物模型的构建研究[J].湖南中医药大学学报,2021,41(5):668-672.
[27] 李爱民,李晓娟,李瑞生.类风湿性关节炎大小鼠动物模型的研究进展[J].中国比较医学杂志,2021,31(1):151-156.

