基于离心分配色谱技术制备Oleocanthal, Oleacein及其抗氧化活性研究
李文君, 王成章, 雷建都, 唐凤霞
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和 草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042;2.北京林业大学 材料科学与技术学院,北京 100083;3.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037)
特级初榨橄榄油作为地中海地区居民饮食的重要组成部分,可以预防Ⅱ型糖尿病、癌症、神经退行性疾病和心血管疾病[1],这主要归因于其丰富的单不饱和脂肪酸(C18:1,55%~83%),以及次要成分醇、甾醇、碳氢化合物、酚类化合物等,尤其是酚醇类和类环烯醚衍生物[2]。橄榄油中的总多酚浸膏(TPF)是一种复杂的混合物,包括简单的酚类、木脂素、类黄酮、裂环烯醚萜和三萜酸[3],其中最具特征的成分是羟基酪醇、酪醇、橄榄苦苷、2-(4-羟基苯基)乙基(E)-4-甲酰基-3-(2-氧代乙基)己基-4-烯酸酯(OLEO,俗名刺激醛)、2-(3,4-二羟基苯基)乙基(Z)-4-甲醛基-3-(2-氧代乙基)己基-4-烯酸酯(OLEA,俗名油精)等。OLEO由Montedoro等首次发现[4-5],是一种比布洛芬活性更强的非甾体抗炎药,也具有强抗氧化性、神经保护、抗癌、抑菌等作用[6-7];OLEA也具有强抗氧化、抗癌、抑菌等功能,同时对心血管疾病和细胞衰老具有预防和抑制作用[8-9]。但是,由于基因型、环境和加工技术等因素的相互作用,严重影响了橄榄油多酚产量和质量[10-11],导致OLEO和OLEA的分离、纯化十分困难。目前研究发现,相比于传统的液-液分离萃取、高效逆流色谱[12]、高真空辅助提取[13]等技术,利用离心分配色谱(CPC)技术可以对OLEO和OLEA进行高效分离纯化。CPC是一种由Nunogaki发明的现代逆流色谱技术[14-15],可用于分离TPF,以获得目标化合物的富集馏分[16],其原理是高速且连续性的液-液萃取[17],具有分离速度快、效率高、总样品回收率高(避免固体载体上不可逆的吸附)且重复性高、溶剂消耗少和容量高等特点[18]。CPC作为一种温和而通用的技术,其高选择性,也使得利用多种溶剂组合进行不同目标成分的分离纯化具有可能性[16,19]。因此,CPC技术在天然活性产物分离、纯化中的应用越来越广泛,而国内目前仍鲜有报道。本研究基于CPC技术,快速分离、纯化得到高纯度的OLEO和OLEA单体化合物,并考察了其对ABTS+·、DPPH·的清除能力和总抗氧化能力(T-AOC),以期为OLEO和OLEA单体的开发应用提供参考。
1 实 验
1.1 原料、试剂与仪器
特级初榨橄榄油总多酚浸膏(TPF)原料,实验室自制[12]。正己烷、乙酸乙酯、乙醇、二氯甲烷(DCM)、甲酸、浓硫酸均为分析纯;甲醇(MeOH)、乙腈(ACN)、水均为HPLC级;香兰素和丁香醛标准品(纯度≥98%),美国Sigma-Aldrich;TLC Silica gel 60 F254薄层层析硅胶板,美国默克公司;OLEO和OLEA标准品(纯度≥98%),实验室自制[20],结构如下图1所示。
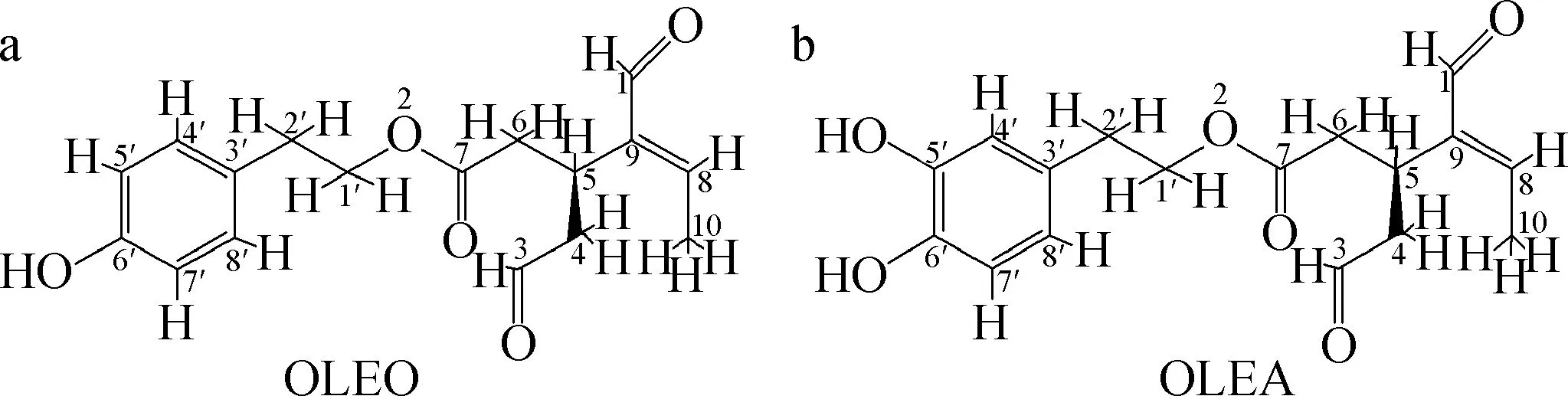
图1 OLEO和OLEA结构图Fig.1 The structures of OLEO and OLEA
ABTS自由基(ABTS+·)清除能力试剂盒、DPPH自由基(DPPH·)清除能力试剂盒、总抗氧化能力(T-AOC)测定试剂盒,南京建成生物工程研究所。
FCPC1000®快速离心分配色谱(CPC)仪,法国Kromaton公司;LC-20T高效液相色谱(HPLC)仪,日本岛津公司;Avance核磁共振(NMR)仪(配备TXI冷冻探针(Wissembourg,France)及600 MHz的AVIII-600光谱仪),德国Bruker公司;LTQ Orbitrap DiscoveryTM组合质谱仪、MULTISKAN酶标仪,美国Thermo公司。
1.2 OLEO/OLEA分析方法的建立
1.2.1HPLC色谱条件 色谱柱为SUPELCOSILTMLC-18(25 cm×21.2 mm, 5 μm),流动相A为体积分数1%甲酸水溶液,流动相B为5%甲醇和1%甲酸的乙腈溶液(即甲醇、甲酸和乙腈体积比5 ∶1 ∶94),流速0.8 mL/min,进样量5 μL,梯度洗脱,以80%A开始洗脱,7 min内流动相B调整为30%并保持18 min,之后10 min内增加流动相B到95%,并保持5 min,最后调节流动相B至20%并保持5 min,总运行时间45 min。
1.3 OLEO/OLEA分离纯化
1.3.1CPC初步分离 取9 g TPF浸膏,甲醇溶解后,注入到CPC柱体内,溶剂分离体系由体积比为3 ∶2 ∶3 ∶2的正己烷/乙酸乙酯/乙醇/水组成,固定相为该体系(体系混合后分层)的下层溶剂,流动相为其上层溶剂,设定流速50 mL/min,转速500 r/min,每10 mL收集一次分离溶液。
1.3.2薄层层析色谱(TLC)分析 对CPC各分离溶液在F254硅胶板上进行TLC分析,展开剂为DCM/MeOH(体积比95 ∶5)溶剂体系,然后分别在254和365 nm紫外光波长下进行观察。用质量分数5%的香兰素/乙醇溶液和体积分数50%的浓硫酸/甲醇溶液等体积混合成显色剂,再将显色剂在硅胶板上进行雾状喷洒,在100~120 ℃下加热2~3 min后各化合物显色。根据显色反应,找到相应的OLEO和OLEA馏分溶液;然后在40 ℃的真空条件下,分别将OLEO和OLEA馏分溶液以及其他馏分溶液进行浓缩,得到含有OLEO、OLEA及其他化合物的提取物浸膏,4 ℃下冷藏放置备用。
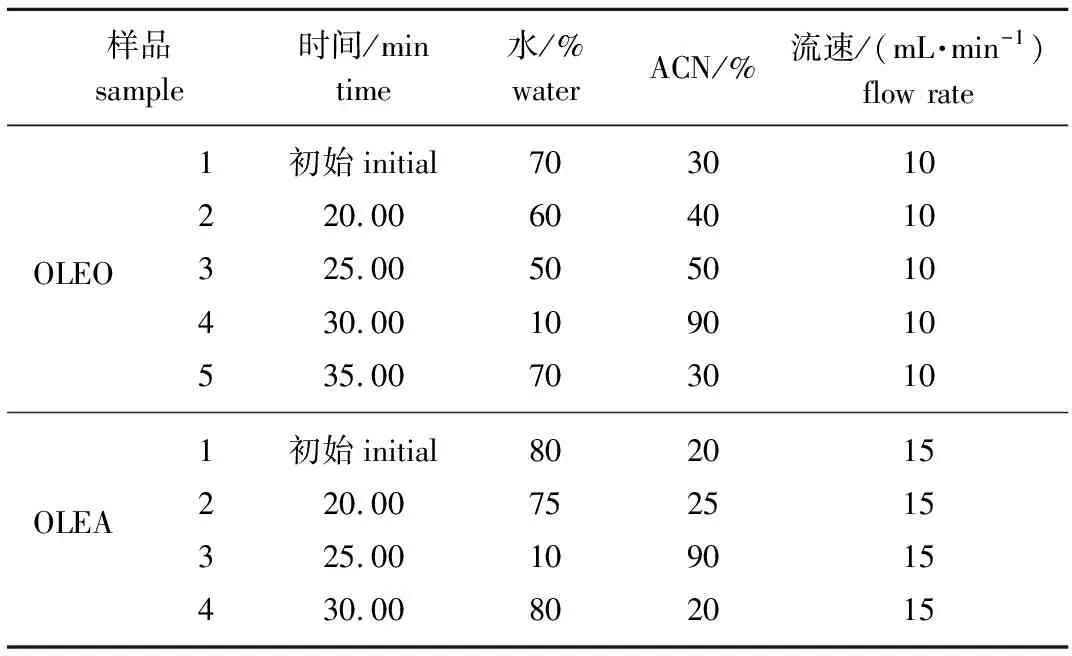
表1 OLEO和OLEA制备液相色谱梯度洗脱Table 1 The gradient elution of OLEO and OLEA of pre-HPLC
1.3.3制备高效液相色谱(Pre-HPLC) 取OLEO和OLEA提取物浸膏,甲醇溶解后,首先通过制备液相色谱进行纯化,色谱柱为C18(250 mm×4.6 mm, 5 μm),流动相为ACN和水,梯度洗脱程序见表1。根据相应标准品的保留时间确定需要收集的洗脱溶液,但由于OLEO和OLEA在水中不能长时间稳定存在,因此样品溶液最好迅速于40 ℃ 水浴温度下真空浓缩,然后置于真空干燥器中过夜干燥。
1.3.41H NMR分析 采用核磁共振仪进行1H NMR分析。取干燥后的OLEO和OLEA粗品,用氘代氯仿溶解后,利用OLEO和OLEA标准品的1H NMR图谱对该粗品进行初步的结构鉴定和纯度分析,纯度达到95%以上即可,否则重复1.3.3节步骤,最终得到OLEO和OLEA的高纯度样品。
1.3.5OLEO/OLEA的纯度确定 将高纯度的OLEO/OLEA样品按1.2节HPLC分析条件,经过0.45 μm滤膜过滤后依次进样5 μL检测(进样3次)。通过HPLC检测,由峰面积积分值的平均值和相应标准曲线方程计算得到样品质量浓度和得率,按峰面积归一化法计算OLEO/OLEA的纯度。
1.4 OLEO/OLEA的抗氧化活性评价
1.4.1DPPH·清除率的测定 使用DPPH·清除能力试剂盒测定质量浓度分别为1、 0.5、 0.1、 0.05、 0.01、 0.005、 0.001和0 g/L的纯度95%以上的OLEO和OLEA对DPPH·的清除能力,严格按照试剂盒说明书操作,设置对照管、测定管、空白管,无水乙醇调零,测定其517 nm处的吸光度(A517)值,平行测定3次。DPPH·清除率(ηDPPH·)按下式计算:
ηDPPH·=(1-(A测定-A对照)/A空白)×100%
式中:A测定—测定溶液在517 nm处的吸光度值;A对照—对照溶液在517 nm处的吸光度值;A空白—空白溶液在517 nm处的吸光度值。
1.4.2ABTS+·清除能力的测定 使用ABTS+·清除能力试剂盒测定质量浓度分别为1、 0.5、 0.1、 0.05、 0.01、 0.005、 0.001和0 g/L的纯度95%以上的OLEO和OLEA对ABTS+·的清除能力,严格按试剂盒说明书操作,设置空白孔、标准孔、测定孔,酶标仪测定其在405 nm处的光密度(OD)值,平行测定3次。样品对ABTS+·的清除能力可以用Trolox标准溶液的浓度来计算,即若样品溶液与某个浓度的Trolox对ABTS+·的清除率相同,计算时其对ABTS+·的清除能力用Trolox的浓度来表示。根据本试剂盒提供的方法和溶液,分别配制浓度为0.10、 0.20、 0.40、 0.80和1.00 mmol/L的Trolox标准溶液,以标准品OD值为横坐标,各OD值对应的样品浓度为纵坐标绘制标准曲线,然后把样品溶液的平均OD值代入计算公式,即可得结果。
1.4.3总抗氧化能力(T-AOC)的测定 使用T-AOC试剂盒测定质量浓度分别为1、 0.5、 0.1、 0.05、 0.01、 0.005、 0.001和0 g/L的纯度95%以上的OLEO和OLEA的体外T-AOC,严格按照试剂盒说明书操作,设置空白孔、标准孔、测定孔,酶标仪测定其在593 nm下的OD值,平行测定3次。T-AOC用FeSO4·7H2O标准溶液的浓度来表示,即样品测定的OD值与1 mmol/L的FeSO4·7H2O的OD值相同,则该样品总抗氧化能力为1 mmol/L。根据试剂盒提供的方法和溶液,分别配制浓度为0.15、 0.30、 0.60、 0.90、 1.20和1.50 mmol/L 的FeSO4·7H2O标准溶液,以标准品OD值为横坐标,各OD值对应的样品浓度为纵坐标绘制标准曲线,然后把样品溶液的平均OD值代入计算公式,即可得结果。
2 结果与讨论
2.1 OLEO和OLEA的分离纯化
2.1.1CPC馏分、得率及其TLC分析 TPF经过CPC的初步分离后,共得到了157组分离溶液,然后按照1.3.2节所述的TLC分析方法,将各个馏分进行分析,显色反应结果见图2~图4。
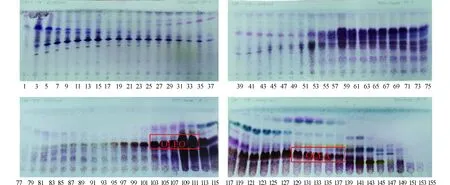
图2 CPC馏分的TLC分析结果Fig.2 The analytical results of fractions from CPC by TLC
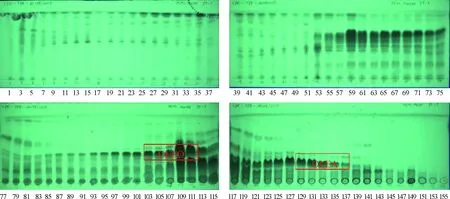
图3 CPC馏分在254 nm下的TLC分析结果Fig.3 The analytical results of fractions from CPC by TLC at 254 nm

图4 CPC馏分在365 nm下的TLC分析结果Fig.4 The analytical results of fractions from CPC by TLC at 365 nm
根据OLEO和OLEA的特定显色结果,迅速定位下一步要分析的馏分,即收集管103~111,含有OLEO,将其浓缩物定为馏分8(Fr.8),质量为1.987 0 g,得率为22.078%;收集管128~137,含有OLEA,将其浓缩物定为馏分10(Fr.10),质量为0.707 3 g,得率7.816%,其余CPC馏分的质量和得率结果见表2。相比Taticchi等[13]改变橄榄油提取阶段的真空系统来控制油橄榄细胞的机械和结构特性,改善油滴的聚集,使酚类物质从25.2%显著提高到48.6%,因此,在确定了特定的目标化合物OLEO和OLEA之后,说明通过CPC可实现对OLEO和OLEA快速、高效地初步分离,为进一步分离纯化得到更多的相应单体化合物创造了良好的基础。
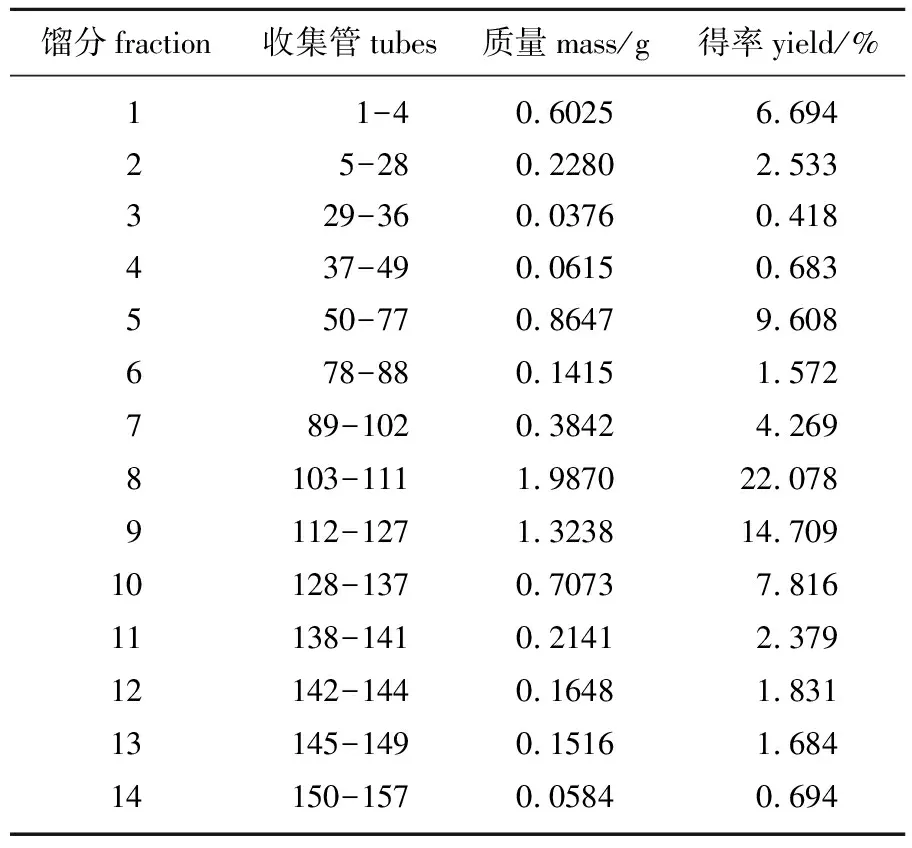
表2 CPC各组馏分的质量和得率Table 2 The quality and yield of fractions from CPC
2.1.2OLEO和OLEA的制备和1H NMR分析 通过Pre-HPLC,对含有OLEO的Fr.8和含有OLEA的Fr.10进一步分离纯化,发现OLEO的出峰时间在15.5~20.1 min,而OLEA的出峰时间在13.2~20.2 min, 收集对应色谱峰的洗脱溶液,立即于40 ℃下真空浓缩、干燥,分别得到纯化过的高纯度OLEO和OLEA样品。依据1.3.4节方法分别对其进行1H NMR分析,同时对应OLEO和OLEA标准品的1H NMR图谱,结果见图5。
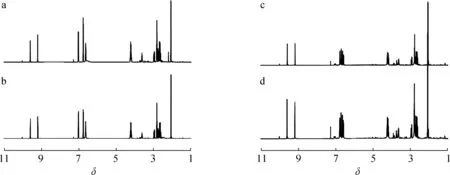
a.Pre-HPLC OLEO; b.OLEO标准品standard of OLEO; c.Pre-HPLC OLEA; d.OLEA标准品standard of OLEA图5 OLEO/OLEA的1H NMR图谱Fig.5 1H NMR spectra of OLEO/OLEA
根据文献[21~22]报道可知,由于该OLEO和OLEA样品与其标准品的1H NMR图谱的氢原子特征峰具有相同的化学位移,以及对应峰组面积的氢原子数目,且OLEO和OLEA标准品的纯度大于98%,因此,OLEO和OLEA的样品已达到较高的纯度,具体纯度数值需要进一步分析。
2.1.3Pre-HPLC制备的OLEO和OLEA的纯度测定 根据1.3.3节的Pre-HPLC方法分别制备OLEO和OLEA,结果见图6。
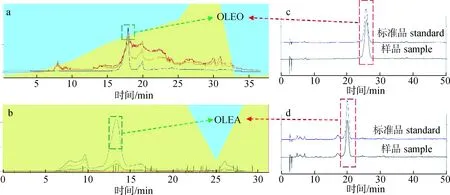
图6 OLEO/OLEA的Pre-HPLC(a,b)和HPLC(c,d)图Fig.6 Pre-HPLC(a,b) and HPLC(c,d) of OLEO/OLEA
为了得到高纯度的样品,收集其特征峰峰腰至峰顶时间段的制备溶液,浓缩后,根据1.3.5节方法,将配制的质量浓度为1 g/L高纯度的OLEO和OLEA粗品溶液进行HPLC分析,根据OLEO和OLEA标准曲线回归方程,故得到样品纯度分别为98.78%和97.75%,由于标准品纯度为大于等于98%,因此对应的实际纯度为大于等于96.80%和95.79%。因此,最终得到纯度在95%以上的高纯度OLEO和OLEA,质量分别为422.3 mg和OLEA 163.0 mg,得率分别为4.69%和1.81%。
2.2 OLEO/OLEA的抗氧化活性
2.2.1DPPH·清除能力 OLEO和OLEA对DPPH·的清除率结果见图7(a)。由图7(a)可以看出,在质量浓度0~0.10 g/L范围内,OLEO和OLEA对DPPH·的清除率不断增加,在低质量浓度时即0.10 g/L之前,两者的抗氧化能力均随质量浓度的升高迅速增加,但OLEO的抗氧化活性始终低于OLEA;当质量浓度为0.1~1 g/L时,OLEO的抗氧化能力增长缓慢,最高达到77.79%;而OLEA的抗氧化能力在0.1~1 g/L范围内趋于平稳,DPPH·的清除率基本稳定在90%左右。此外,OLEO对DPPH·的半数抑制质量浓度(IC50)值为0.029 g/L,OLEA对DPPH·的IC50值为1.85×10-11g/L,说明在低质量浓度下OLEA的抗氧化能力远大于OLEO。
2.2.2ABTS+·清除能力 首先测得Trolox的标准曲线回归方程为Y=-0.749 4X+1.183 4,R=0.995 6,OLEO和OLEA对ABTS+·的清除能力结果见图7(b)。由图7(b)可以看出,在质量浓度0~0.10 g/L范围内,以Trolox浓度表示的ABTS+·清除能力不断增加,在质量浓度较低(0~0.10 g/L)时,两者的抗氧化能力均随质量浓度的升高迅速增加,但OLEO的抗氧化活性始终低于OLEA;当质量浓度为0.1~1 g/L时,两者的抗氧化能力增长缓慢,OLEO的ABTS+·清除能力最高达到Trolox 0.765 5 mmol/L,而OLEA的ABTS+·清除能力最高达到Trolox 0.894 2 mmol/L。说明在整个质量浓度范围内,OLEA的抗氧化能力大于OLEO,且在质量浓度0.1~1 g/L时,质量浓度越大,差别越不明显。
2.2.3T-AOC 首先测得FeSO4的标准曲线回归方程为Y=0.182 5X+0.104 6,R=0.995 3,OLEO和OLEA的T-AOC结果见图7(c)。由图7(c)可以看出,以FeSO4·7H2O浓度表示的总抗氧化能力不断增加,在质量浓度较低(0~0.10 g/L)时,两者的总抗氧化能力均随质量浓度的升高缓慢增加,但OLEO的抗氧化活性始终低于OLEA;当质量浓度为0.1~1 g/L时,OLEO的总抗氧化能力并无明显增长,最高仅达到FeSO40.157 1 mmol/L,而OLEA的总抗氧化能力迅速增加,最高达到FeSO40.646 2 mmol/L。说明在整个质量浓度范围内,OLEA的总抗氧化能力大于OLEO,且在质量浓度为0.1~1 g/L时,质量浓度越大,差别越明显。

a.DPPH·清除率scavenging rate of DPPH·; b.ABTS+·清除能力scavenging ability of ABTS+·; c.T-AOC图7 OLEO/OLEA抗氧化活性Fig.7 The antioxidant activities of OLEO/OLEA
3 结 论
3.1以特级初榨橄榄油总多酚浸膏为原料,通过CPC初步分离和TLC分析得到14种馏分,其中对应OLEO和OLEA化合物的Fr.8和Fr.10质量分别为1.987 0和0.707 3 g,得率分别为22.078%和7.816%;利用Pre-HPLC、1H NMR等技术进一步纯化、分析,得到纯度95%以上的OLEO 422.3 mg和OLEA 163.0 mg,得率分别为4.69%和1.81%。
3.2考察了不同质量浓度的OLEO和OLEA的抗氧化能力,结果表明:随着质量浓度的增大,OLEO和OLEA的DPPH·清除率先快速增加后趋于稳定,IC50值分别为0.029和1.85×10-11g/L;而两者对ABTS+·的清除能力和T-AOC则先迅速增加后缓慢增加,OLEO和OLEA对ABTS+·的清除能力最高分别为0.765 5和0.894 2 mmol/L(以Trolox计),OLEO和OLEA的总抗氧化能力最高分别达到0.157 1和0.646 2 mmol/L(以FeSO4计)。整体上,OLEA具有比OLEO更强的抗氧化能力,尤其是OLEA的T-AOC 明显高于OLEO。

