高通量测序技术在探索芽菜微生物群落结构中的应用
王新惠,刘力嘉,丁悦,孙劲松,潘攀,张雅琳,庞紫琳,刘洋,
(1.成都大学 食品与生物工程学院,成都 610106;2.宜宾学院 固态发酵资源利用四川省重点实验室,四川 宜宾 644000)
芽菜是在我国四川南部较为盛行的一道传统酱腌菜,由新鲜的芥菜茎部通过清洗、划丝、晾晒、腌制、发酵等工艺制作而成[1]。芽菜发酵是芽菜制作过程中重要的环节,因为芽菜的风味主要来源于发酵环境中微生物代谢活动[2-3]。
芽菜自然发酵过程中会有微生物群落结构变化,这也是影响芽菜风味和食用安全性的关键点。但是,目前对于芽菜中的微生物菌群结构和多样性分析并未完全了解。在过去的研究中,主要有依赖微生物的培养特点和形态学的传统培养分离方法来探索发酵食品中菌群。马长路等[4]通过传统培养分离的方法从东北酸菜中分离出植物乳杆菌(Lactobacillusplantarum);尹曦等[5]用传统培养分离方法发现宜宾芽菜中主要有戊糖片球菌(Pediococcuspentosaceus)、植物乳杆菌。但依靠形态学来鉴定微生物常常不够全面,因为能通过培养基进行培养的菌群很少,所以传统的方式不能全面地认识发酵环境中的菌群结构。随后基于PCR的检测手段出现,主要有PCR-DGGE技术、EIRC-PCR技术和RFLP技术等。张先琴[6]通过PCR-DGGE技术分析了芽菜中的微生物群落结构,但无法有一个准确的定量;荆雪娇[7]通过PCR-DGGE技术发现短乳杆菌为泡菜和酸菜的优势菌群,弯曲乳杆菌在泡菜和浙江榨菜中为优势菌群,消化乳杆菌和食用糖乳杆菌分别为酸菜和酱菜的优势菌群,但基于PCR的技术手段往往因为要凝胶电泳,图谱复杂且存在工作量大、灵敏度有限等缺点。近几年,高通量测序技术的诞生为了解微生物菌群结构提供了新的解决方案,因其具有无需克隆、测序量大、速度快等特点[8-10]而广泛应用于检测植物病毒、畜禽、食源性病原体[11]等。杨柳等[12]利用高通量测序发现在辣白菜中Weissella菌属与菌落计数相距最近,同时也与总酸含量的呈味物质呈正相关,其贡献率最好,其他菌属呈负相关,说明Weissella菌属对主要呈味物质有重要作用。贾晶晶等[13]利用高通量测序技术对12%食盐浓度发酵的腌渍白菜液分析得出共有6个菌门。最优势菌门为变形菌门,其相对含量高达67.01%,丙型变形菌纲相对含量为99.17%,为其主要优势菌纲,其中普罗威登斯菌属为最优势菌属。由此可以看出高通量测序技术对微生物群落多样分析是较准确且完备的。
本研究重点在于利用高通量测序技术从门、种水平上研究市场上不同品牌的宜宾芽菜之间微生物群落结构差异性及是否存在有害菌,在检测市场产品的安全性的同时也为厂家在发酵过程中规避一些不必要的有害微生物繁殖起到提醒作用。
1 材料与方法
1.1 试验材料
宜宾芽菜:购于宜宾叙州区当地贸易市场,购买3种不同厂家的袋装芽菜,分别编号C1、C2、C3。所有样品均为无菌采样,使用无菌塑封袋包装后置于-80 ℃冰箱中保存待测。

图1 3种芽菜样品Fig.1 Three kinds of sprout samples
1.2 试验试剂与仪器
E.Z.N.ATMMag-Bind Soil DNA提取试剂盒 美国Omega公司;通用型恒压恒流电泳仪;Applied Biosystems®Gene Amp®PCR System 9700 PCR仪;QIAquick Gel Extraction Kit凝胶回收试剂盒 Qiagen公司;Qubit 2.0微量荧光核酸定量仪 ThermoFisher公司;X1R高速冷冻离心机 美国Thermo公司;HiSeq测序仪、HiSeq Rapid SBS Kit v2 (FC-402-4023 500 Cycle)测序试剂盒 美国Illumina公司;其他所需试剂均购自成都市科隆化学品有限公司。
1.3 DNA提取和PCR测序、扩增
使用特定的DNA提取试剂盒进行基因组DNA提取后,使用0.8%琼脂糖凝胶电泳检测DNA。引物引用:515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′),以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物进行PCR。每一个25 μL的体系包括1×PCR buffer、1.5 mmol/L MgCl2、0.4 μmol/L dNTPs、正向和反向引物各1.0 μmol/L、0.5 U KOD-Plus-Neo酶(Toyobo公司)和10 ng模板。PCR程序包括起始94 ℃ 1 min,然后30次循环(变性94 ℃ 20 s,退火54 ℃ 30 s和延伸72 ℃ 30 s),最后72 ℃ 5 min。 每个样本进行3个PCR技术重复。PCR与1/6体积的6 loading buffer混合,使用2%琼脂糖凝胶电泳检测。取目的条带用来回收,回收使用 QIAquick Gel Extraction Kit (Qiagen公司)。使用Qubit@2.0 Fluorometer (Thermo Scientific公司)定量。最后等摩尔量混合。建库使用 TruSeq DNA PCR-Free Sample Prep Kit,构建好的文库经过定量和文库检测合格后,使用HiSeq 2500平台PE250模式测序。
1.4 数据分析
首先使用FLASH[14]拼接双端序列,截去Barcode序列得到原始数据,然后使用Trimmomatic进行质控。在Usearch软件[15]基础上,使用UPARSE算法在97%水平上进行OTU聚类,再用R语言进行各种数据转换,最后用ggplot2包作图。对于Alpha多样性分析,PD指数的计算使用Picante包,其他指数使用Vegan包。对于Beta多样性分析,使用GUniFrac包计算UniFrac距离。
2 结果与分析
2.1 芽菜中细菌群落Alpha多样性分析
Alpha多样性指数主要有细菌菌群丰度指数Chao1指数和ACE指数,细菌菌群多样性指数Simpson指数和Shannon指数。3种不同品牌的宜宾芽菜中细菌菌群多样性结果见表1。
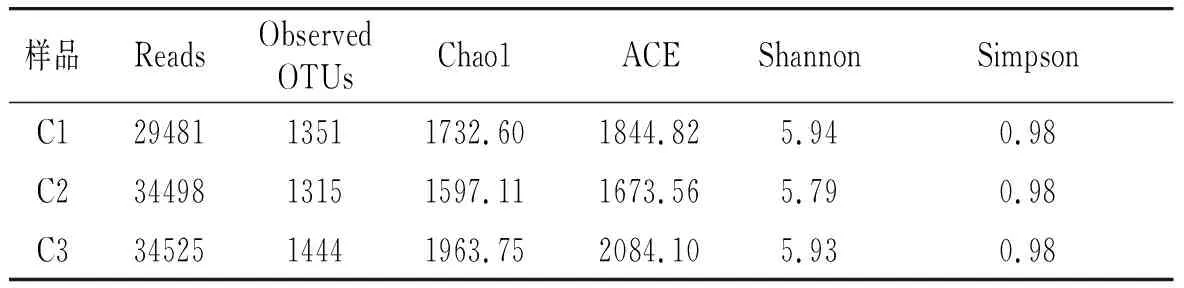
表1 3种宜宾芽菜中细菌群落丰度和多样性Table 1 The abundance and diversity of bacterial community in the three kinds of sprout samples
由表1可知,C3样本中细菌菌群丰度最高,而C2样本中细菌菌群的丰度最低。从芽菜中细菌菌群多样性指数的结果发现,C1样本中的细菌菌群多样性最高,C2样本中的细菌菌群多样性最低。3种芽菜在细菌菌群多样性和丰度上具有一定的差异,这可能是由于原料的选择、制作工艺以及灭菌条件的不同造成的。
2.2 细菌群落韦恩图分析
将细菌序列在97%相似水平上定义为一个OTU,对3种宜宾芽菜中细菌的OTU进行分析得到OTU韦恩图,见图2。
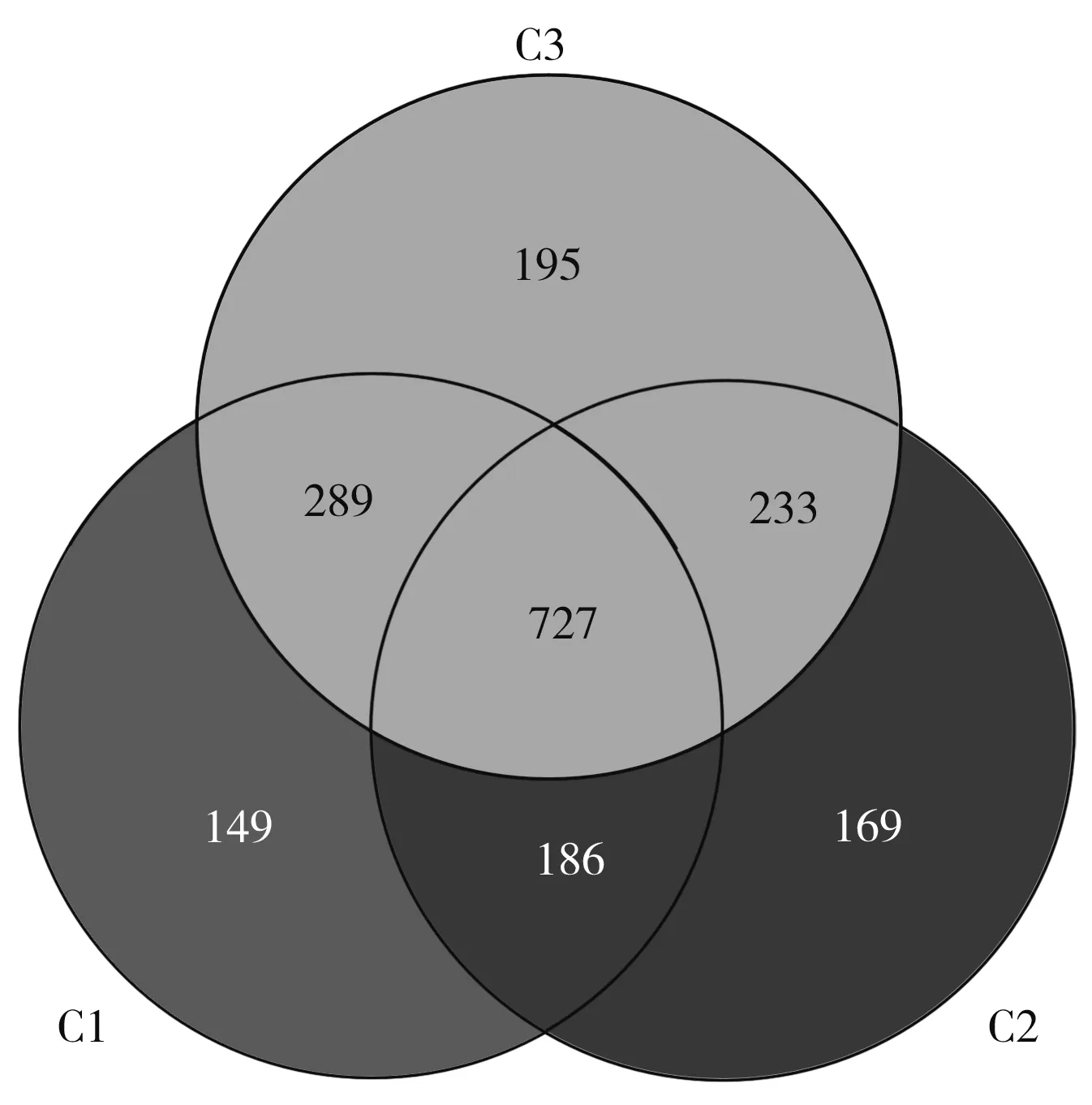
图2 3种包装宜宾芽菜的OTU韦恩图分析Fig.2 OTU Venn diagram analysis of three kinds of packaged Yibin sprouts
由图2可知,3个样品共测得1948个OTUs。C1中测得1351个OTUs,C2中测得1315个OTUs,C3中测得1444个OTUs,3种宜宾芽菜中共有727个OTUs,结果表明,3种芽菜细菌群落结构之间存在一定差异,但相比3种芽菜共有菌落,每种芽菜独有菌落占比更小。
2.3 微生物相对丰度曲线
根据OTU丰度,使用Rank-Abundance曲线对样本多样性进行评估,得到相对丰度曲线,见图3。

图3 3组样品的相对丰度曲线Fig.3 The relative abundance curves of three groups of samples
曲线的平滑程度反映了样本中物种的均匀度,可以看出随着测序加深,序列增加,各个样品的曲线斜率逐渐减小,呈现一个趋于平缓的态势,说明物种分布较均匀。而曲线在水平横轴上的范围越大,说明物种丰度越高,由图3可知C3样品的物种丰度最高,C1次之,C2最低。
2.4 细菌群落在门水平上的结构差异分析
在门的水平上对3种宜宾芽菜中细菌菌群结构进行分析,结果见图4。

图4 门水平上不同芽菜样品的细菌丰度Fig.4 The bacterial abundance of different sprout samples at phylum level
由图4可知,3种芽菜中优势菌门均是厚壁菌门(Firmicutes),C1样本中厚壁菌门占比为43.77%,在C2样本中占比为50.73%,在C3样本中占比为45.59%。厚壁菌门会参与膳食植物多糖代谢[16];其次是拟杆菌门(Bacteroidetes),拟杆菌门在C1、C2和C3样本中占比分别是22.53%、21.98%和23.77%。Ley等[17]发现厚壁菌门与拟杆菌门的比例降低对减轻体重有直接的影响,在肥胖受试者中通常厚壁菌门含量较高,拟杆菌门含量较低,因此在样本中若拟杆菌门比例较高,可能起到抑制人体脂肪沉积的积极作用。在样本中还检测出变形菌门(Proteobacteria),少数的奇古菌门(Thaumarchaeota)、绿弯菌门(Chloroflexi)、 广古菌门(Euryarchaeota)、放线菌门(Actinobacteria)、醋杆菌门(Acidobacteria)、螺旋体门(Spirochaetes)等。其中,变形菌门属于革兰氏阴性细菌,它们具有分泌脂多糖的能力,而脂多糖可以作为内毒素,容易引起肠道炎症[18]。对此,我们日常饮食可以注意多食用高纤维或碳水化合物改善肠道菌群来降低炎症发生的概率。
2.5 细菌群落在种水平上的结构差异分析
在种的水平上对3种宜宾芽菜中细菌结构进行分析,结果见图5。

图5 种水平上不同芽菜样品的细菌丰度热图Fig.5 The heat map of bacterial abundance of different sprout samples at genus level
由图5可知,在3组样品中丰度前三的优势菌种一致,分别为鼠乳杆菌(Lactobacillusmurinus)、禽乳杆菌(Lactobacillusaviariu)、格氏乳杆菌(Lactobacillusgasseri),共属于乳酸杆菌属(Lactobacillusspp.),乳酸杆菌具有嗜酸的特点,因此广泛分布于传统酱腌菜中。优势菌种鼠乳杆菌在3组样品中占比分别为10.51%、9.87%、11.92%。鼠乳杆菌在肠道中起着调节肠道菌群,增强肠道屏障的功能[19-20],Huang等[21]研究发现,鼠乳杆菌可以作为一种功能性的益生菌来对抗食物过敏。禽乳杆菌属于革兰氏阳性菌,具有产生细菌素和有机酸的能力,可以抑制病原体和炎症反应[22],它在3种芽菜样品中占比分别为4.70%、9.82%、5.05%,其中禽乳杆菌在C2中占比最大,而在C1中占比最小。格氏乳杆菌在3组样品中占比分别为2.56%、2.94%、2.42%,Kyoung等[23]研究发现格氏乳杆菌会影响体内代谢因子,与Cudraniatricuspidata协同作用调节代谢功能,发现了一种新的作为肥胖与消瘦的生物标志物。此外,还发现了弯曲乳杆菌(Lactobacilluscurvatus),有研究表明弯曲乳杆菌具有较高的稳定性,对单核增生细菌有显著的抑制作用,从而起到改善发酵香肠安全的作用[24-25]。同时,3个样品中均含有罗伊乳杆菌(Lactobacillusreuteri),它常用于婴幼儿保健食品益生菌使用,可以促进肠道蠕动,增加人体免疫力[26]。特别注意的是有腐败致病菌被检测出,其中一个是脑膜炎嗜冷杆菌(Psychrobactermeningitidis),它可以产生褐藻酸降解菌快速吸收水分从而导致紫菜出现病斑进而腐败[27],因此在芽菜中可能存在加速腐败的效果;此外还检测出荧光假单胞菌(Pseudomonasfluorescens),有研究表明荧光假单胞菌常附着于酱腌菜表面,存在还原硝酸盐生成亚硝酸盐的情况,因此可能对食品安全有不良影响[28]。另外,我们还检测到了产酸拟杆菌(Bacteroidesacidifaciens),Marques F Z等[29]发现Bacteroidesacidifaciens等肠道菌群数量会增加高血压小鼠发生心力衰竭概率, Kang Chil-sung等[30]发现Akkermansiamuciniphila、Bacteroidesacidifaciens的减少与DSS诱导的结肠炎相关。
总体上,在种水平上的有益功能菌主要有鼠乳杆菌(Lactobacillusmurinus)、禽乳杆菌(Lactobacillusaviariu)、格氏乳杆菌(Lactobacillusgasseri)、罗伊乳杆菌(Lactobacillusreuteri),腐败致病菌主要有脑膜炎嗜冷杆菌(Psychrobactermeningitidis)、荧光假单胞菌(Pseudomonasfluorescens)、产酸拟杆菌(Bacteroidesacidifaciens)。在传统工艺下生产的芽菜,发酵菌群主要来源于原辅料和生产环境中,如何减少腐败致病菌和扩大优势菌种是提高芽菜食用安全性和风味的关键点。
2.6 Beta多样性分析
对3种芽菜中细菌菌群结构进行主成分分析,结果见图6。
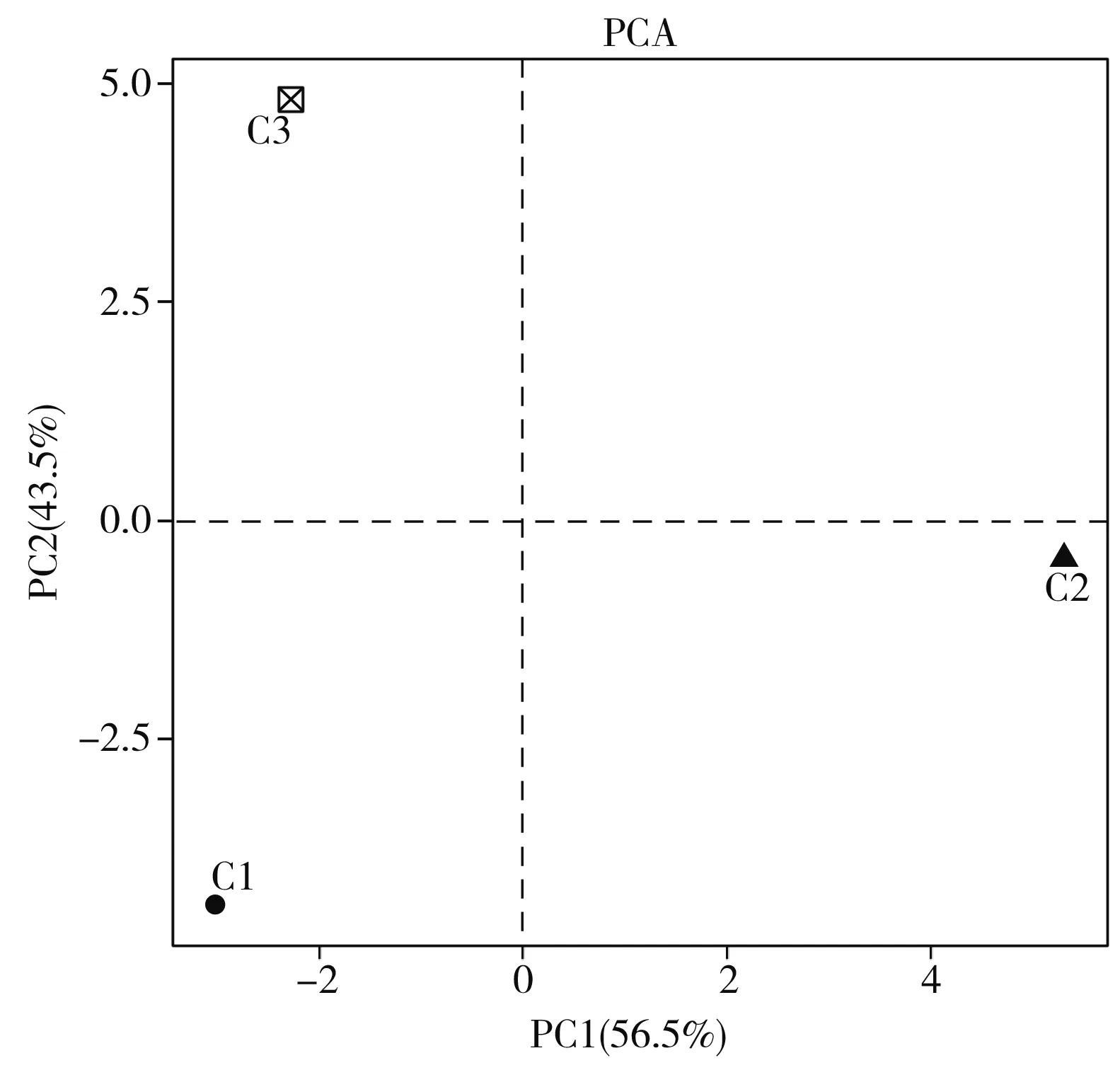
图6 不同芽菜样品的PCA分析Fig.6 PCA analysis of different sprout samples
横坐标PC1为第一主成分,它对3种样品差异的贡献值为56.5%,纵坐标PC2为第二主成分,它对3种样品差异的贡献值为43.5%。3个不同芽菜样本之间的距离较远,结果表明3个芽菜中细菌菌群结构相差较大。
3 结论
本文采用高通量测序技术对3种不同宜宾芽菜中的细菌菌群结构进行分析,结果表明,3种宜宾芽菜中,C3样本中细菌菌群丰度最高,而在C1样本中,细菌菌群多样性最高。此外,共检测到3种宜宾芽菜中共有727个OTUs,3种芽菜具有一定相似性。在门的水平上,对3种宜宾芽菜中细菌菌群结构分析,发现厚壁菌门是优势菌门,在C1、C2和C3中占比分别为43.77%、50.73%和45.59%。在种的水平上对3种宜宾芽菜中细菌菌群结构进行分析,发现鼠乳杆菌是3种宜宾芽菜中的优势菌种,它在C1、C2、C3中占比分别为10.51%、9.87%、11.92%。其次分别是禽乳杆菌(Lactobacillusaviariu)、格氏乳杆菌(Lactobacillusgasseri)。禽乳杆菌在C1、C2、C3中占比分别为4.70%、9.82%、5.05%,格氏乳杆菌在C1、C2、C3中占比分别为2.56%、2.94%、2.42%。
通过高通量测序技术,能快速、准确地分析芽菜发酵环境中的细菌菌群结构,本研究发现市面售卖的宜宾芽菜中主要功能菌是鼠乳杆菌(Lactobacillusmurinus)、禽乳杆菌(Lactobacillusaviariu)、格氏乳杆菌(Lactobacillusgasseri)、罗伊乳杆菌(Lactobacillusreuteri),但也存在部分腐败致病菌,如脑膜炎嗜冷杆菌(Psychrobactermeningitidis)、荧光假单胞菌(Pseudomonasfluorescens)、产酸拟杆菌(Bacteroidesacidifaciens)。本研究为芽菜的生产、包装、运输等过程中的微生物控制提供了参考,同时也为后期对芽菜的深入研究提供了理论基础。

