自然发酵过程中红树莓的微生物多样性及活性成分研究
武林芝,郝秀萍
(太原学院 材料与化学工程系,太原 030032)
树莓果富含多种营养物质和活性成分,这些物质具有强大的保健功效[1]。我国每年的红树莓产量已经超过了2万吨[2]。目前,红树莓被加工的产品主要为一些果酒和饮料,种类单一,并且加工的工艺简单[3]。随着我国红树莓产量的不断增加,传统加工工艺也需要升级。
红树莓的果实是浆果型,有特殊的香味,含有丰富的营养物质,主要包括糖类和多种矿物质元素[4-5]。相关的研究结果表明,在100 g的红树莓中含有240 mg的维生素和0.168 g钾,维生素中含量较高的是维生素C和维生素E[6]。红树莓中也富含酮类物质和酚类物质,这些物质具有抗氧化作用[7]。
当红树莓成熟之后,很容易腐烂,不易储存,所以大部分的红树莓被粗加工,制成一些红树莓果汁和果脯[8]。我国红树莓的加工还处于起步阶段,加工程度较低,随着树莓产量的不断增加,树莓的加工有待进一步升级和多样化[9]。
本试验通过对不同区域的红树莓发酵过程中的活性物质和微生物量变化进行研究,探究红树莓发酵过程中活性物质变化与微生物量变化的相关性,从而了解红树莓的自然发酵机理,并采用传统的菌株分离方式,分离并培养出发酵性能良好的菌株,以丰富我国的红树莓发酵微生物资源库。
1 材料与方法
1.1 试验原料与设备
1.1.1 试验原料和试剂
两种红树莓样品A和样品B分别从不同的市场上购得;化学试剂包括样品琥珀酸、PDA土豆培养基、苹果酸、真菌DNA提取试剂盒。
1.1.2 试验设备与仪器
奥林巴斯光学显微镜、离心机、灭菌锅、天平、振荡仪、紫外分光光度计、水浴锅和PCR仪。
1.2 试验方法
1.2.1 红树莓发酵液的制备
样品A和样品B红树莓分别放入体积为30 L的发酵罐中进行发酵,每间隔10 d取一次样品,取样的时间分别为0,10,20,30,40,50 d,取出的样品放置在4 ℃的条件下保存待用[10]。
1.2.2 红树莓发酵液理化指标的测定
1.2.2.1 红树莓中有机酸含量的测定
红树莓中有机酸的测定根据高效液相色谱法[11],色谱柱为4.5 mm×250 mm×5 μm;洗脱时间为10 min,柱温为38 ℃,有机酸的检测波长为210 nm。
1.2.2.2 红树莓发酵液中总酚含量的测定
红树莓发酵液中总酚的测定根据参考文献[12],采用福林酚法对红树莓发酵液中总酚进行测定,把没食子酸的质量浓度定为横坐标,吸光度定为纵坐标,并根据回归方程式Y=0.0125X+0.0076(R2=0.9998)进行计算。吸取1 mL的样品,在样品中添加2 mL的福林酚试剂,摇匀,避光1 h,在波长760 nm处测定吸光值,并计算总酚含量。
1.2.2.3 红树莓发酵液对DPPH自由基清除率的测定
称取0.005 g DPPH,将其溶解在100 mL的无水乙醇中,并制成DPPH自由基溶液。吸取1 mL稀释后的红树莓发酵液,与3 mL DPPH自由基溶液在遮光条件下反应25 min,测定波长在517 nm处的吸光值X1。取1 mL稀释后的红树莓发酵液和3 mL无水乙醇自由基溶液,反应25 min,并在波长517 nm处测定吸光值X2。取1 mL无水乙醇和3 mL DPPH自由基溶液混合,摇匀,反应25 min,在波长517 nm条件下测定吸光值X3,X3为空白对照。计算公式如下:
DPPH自由基清除率=[1-(X1-X2)/X3]×100%[13]。
1.2.2.4 红树莓发酵液中DNA的提取和检测
红树莓中真菌的基因组采用基因组的试剂盒进行提取,提取之后,DNA在电泳的条件下进行检测[14-15]。
1.2.2.5 红树莓发酵液中真菌的分离和纯化
真菌的分离和纯化:取少许发酵完成的红树莓发酵液,在无菌的环境条件下稀释,把稀释后的菌液涂于PDA平板上,将接种后的培养基放置在25 ℃恒温条件下,培养36 h,并挑取单个菌落进行分离纯化培养,在4 ℃的条件下保存备用[16]。
利用分子生物学鉴定:将分离纯化的菌株使用真菌提取试剂盒进行DNA提取,使用ITS5/ITS4引物对真菌的保守区域进行扩增[17]。
2 结果与讨论
2.1 红树莓发酵过程中有机酸含量的变化
利用高效液相色谱法,对红树莓发酵后的各种酸进行分析和测定,测定的样品由样品A和样品B混匀,混匀之后的红树莓发酵液中有机酸含量变化见图1。
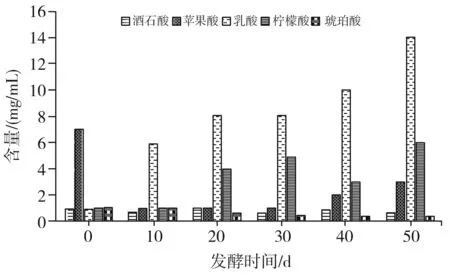
图1 红树莓发酵过程中有机酸含量的变化Fig.1 Changes of organic acid content in the fermentation process of Rubus idaeus L.
由图1可知,在红树莓发酵后,发酵液中有机酸变化明显,而随着发酵时间的增长,乳酸、柠檬酸和苹果酸的变化最为明显;琥铂酸和酒石酸的变化量较少。红树莓发酵50 d之后,发酵液中含量最多的乳酸由原来的1.52 mg/mL增加至14.0 mg/mL,其含量增大了8.2倍;柠檬酸在红树莓发酵过程中呈现先增高后降低然后再增高的趋势,当发酵至50 d结束时,红树莓中的柠檬酸含量为6 mg/mL,相比之前的0.8 mg/mL也增加了6.5倍。
红树莓发酵过程中有机酸含量的变化与红树莓发酵液中微生物的糖代谢有着密切的关系,随着发酵时间延长,发酵液中的氧气含量逐渐被消耗,使得柠檬酸转化为琥珀酸的氧化反应受到阻碍,造成柠檬酸在红树莓自然发酵的过程中逐渐积累,发酵液中的琥珀酸含量逐渐降低。在缺氧的条件下,发酵液中的丙酮酸被还原为乙醇或者乳酸,那么样品中的乳酸也会随着发酵时间的增长而逐渐升高。此外,在红树莓发酵液中可能存在一些将苹果酸转化为乳酸的细菌,从而将苹果酸降解,乳酸含量增高[18]。
2.2 红树莓发酵过程中总酚含量的变化
本试验通过Folin-Ciocalteau法对红树莓中总酚的含量进行测定,两种样品在不同时间段内的总酚含量变化见图2。
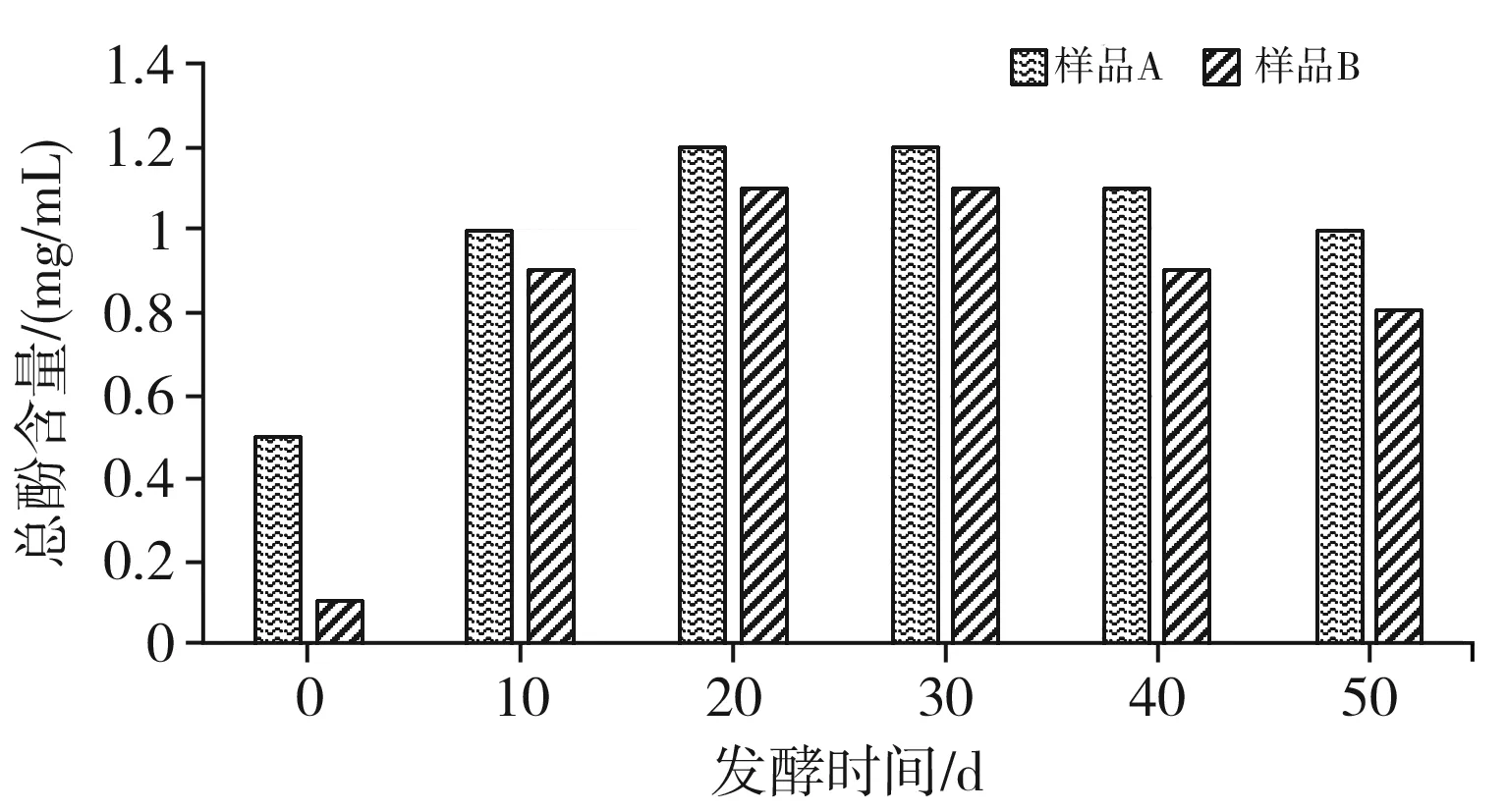
图2 两个样本发酵过程中总酚含量的变化Fig.2 Changes of total phenol content during the fermentation process of two samples
由图2可知,无论是样品A还是样品B,发酵后样品中的总酚含量明显增加。当发酵时间至30 d时,两个样品中的总酚含量均最高,其中样品A中的总酚含量为1.2 mg/mL,样品B中的总酚含量为1.14 mg/mL。当发酵时间超过30 d时,红树莓自然发酵液中的总酚逐渐呈现下降的趋势,但是下降的趋势并不明显。当发酵时间为50 d时,样品A中总酚含量为0.9 mg/mL,而样品B中总酚含量为0.7 mg/mL,分别是未经过发酵时的2倍和8倍。样品A和样品B在发酵过程中,样品A中的总酚一直高于样品B中的总酚,这是由于不同的生活环境导致红树莓中酚类物质的差异。
酚类物质是人们公认的抗氧化物质[19],经过发酵的红树莓发酵液中的酚类物质随着发酵时间的增长先增加后降低,在发酵结束时,发酵液中的酚类物质逐渐降低,这可能是由于发酵液中的酚类物质被分解,导致酚类成分降低。
2.3 红树莓发酵过程中自由基清除能力的变化
DPPH自由基为脂溶性自由基,以氮为中心,与羟基自由基和超氧自由基相比,其稳定性更高,是测定物质抗氧化活性最基本的方法之一。由图3可知,红树莓在发酵过程中,发酵液对DPPH自由基的清除率明显增强,随着发酵时间的延长,DPPH自由基的清除率更高。在红树莓发酵的过程中,样品A对DPPH自由基的清除率明显高于样品B对DPPH自由基的清除率。当发酵时间为50 d时,样品A对DPPH自由基的清除率为45%,样品B对DPPH自由基的清除率为33%,分别是未发酵时的1.8倍和1.32倍。
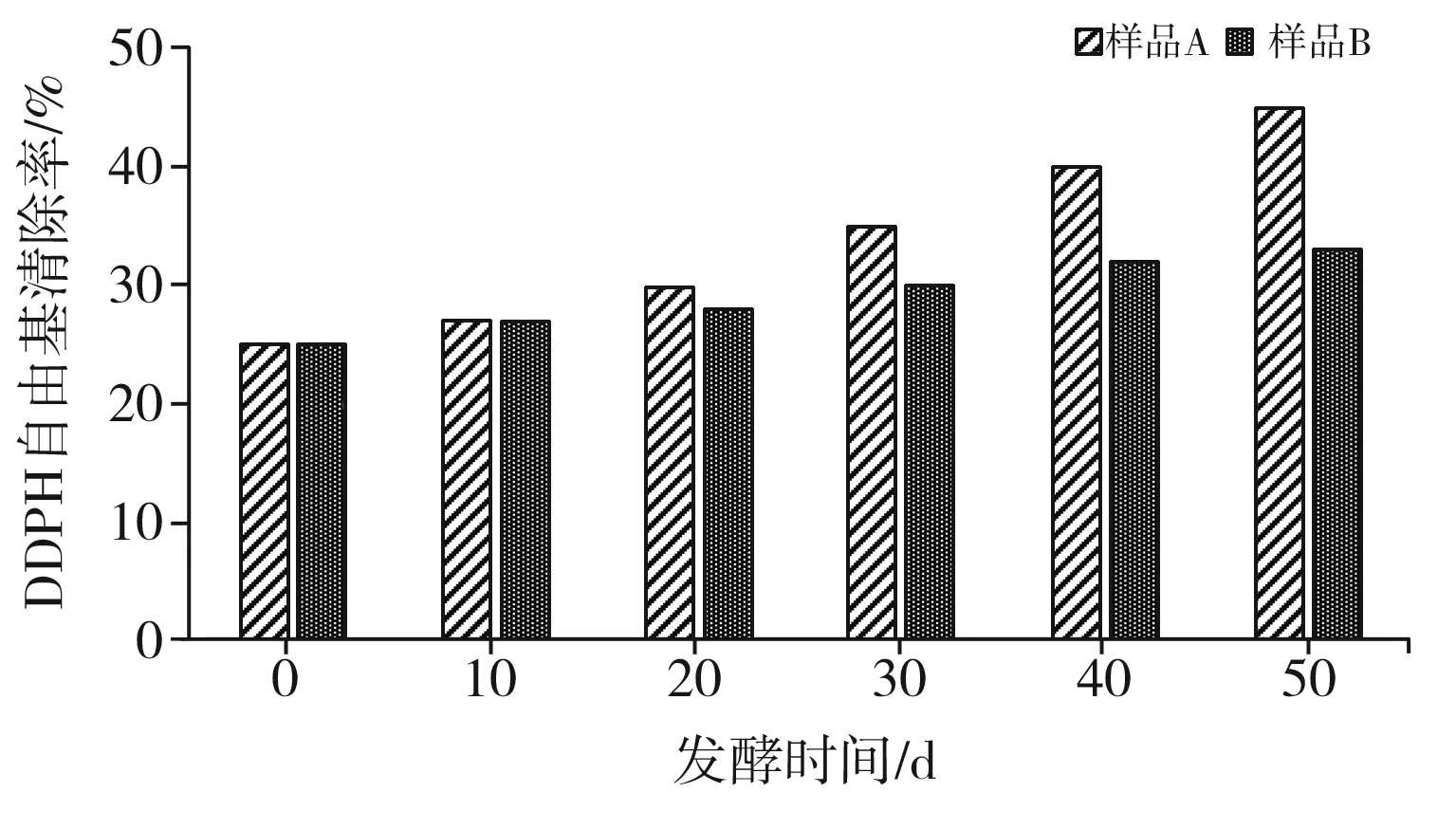
图3 两个样本发酵过程中DPPH自由基清除率的变化Fig.3 Changes of DPPH free radical scavenging rates during the fermentation process of two samples
2.4 红树莓发酵液中真菌群落α多样性分析
对于样品中的微生物多样性分析,常常使用α多样性分析[20],一般用于对物种丰富度和多样性分析。Ace、Sobs和Chao常常被用于估计微生物群落中的丰富度,香农指数(Shannon)和辛普森指数(Simpson)被用于计算微生物多样性,Shannon和Simpson表示微生物的多样性高低,Coverage表示对样本的覆盖率。
由表1可知,样品A和样品B中的真菌群落多样性和丰富度均存在一定的差异,样品A中的Ace、Chao、Sobs和Shannon数值均小于样品B中的数值,Simpson大于样品B中的数值,表明样品A中的真菌丰富度和多样性一直高于样品B中的丰富度和多样性。两个样品中的覆盖率均大于0.99,表明试验结果与真实值较接近。样品A中的真菌多样性明显多于样品B中的真菌多样性,这是由于样品A的采集地温度和湿度相对较高,适宜微生物的生长和繁殖,使得样品A中的外源微生物明显多于样品B中的外源微生物,所以导致样品A在自然发酵过程中微生物的含量明显高于样品B。
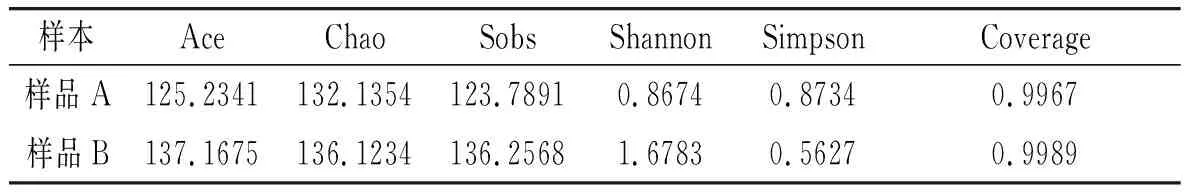
表1 红树莓自然发酵液中的真菌多样性分析Table 1 Analysis of fungal diversity in natural fermentation broth of Rubus idaeus L.
2.5 红树莓发酵完成后发酵液中真菌群落的分析组成
从红树莓发酵结束后的发酵液中一共鉴定到50个不同属,其中样品A中含有45个不同的属,样品B中含有30个不同的属,样品A中的真菌多样性明显多于样品B中的真菌多样性。
由图4可知,两种样品中的真菌优势属为Saccharomyces、Hanseniaspora、Kazachstania和Pichia。Hanseniaspora(汉森氏酵母)和Kazachstania、Pichia在两个样品中所占的比例相似。样品A中的Saccharomyces少于样品B。说明不同产地的红树莓样品A和样品B在发酵过程中微生物的物种量存在一定的差异。
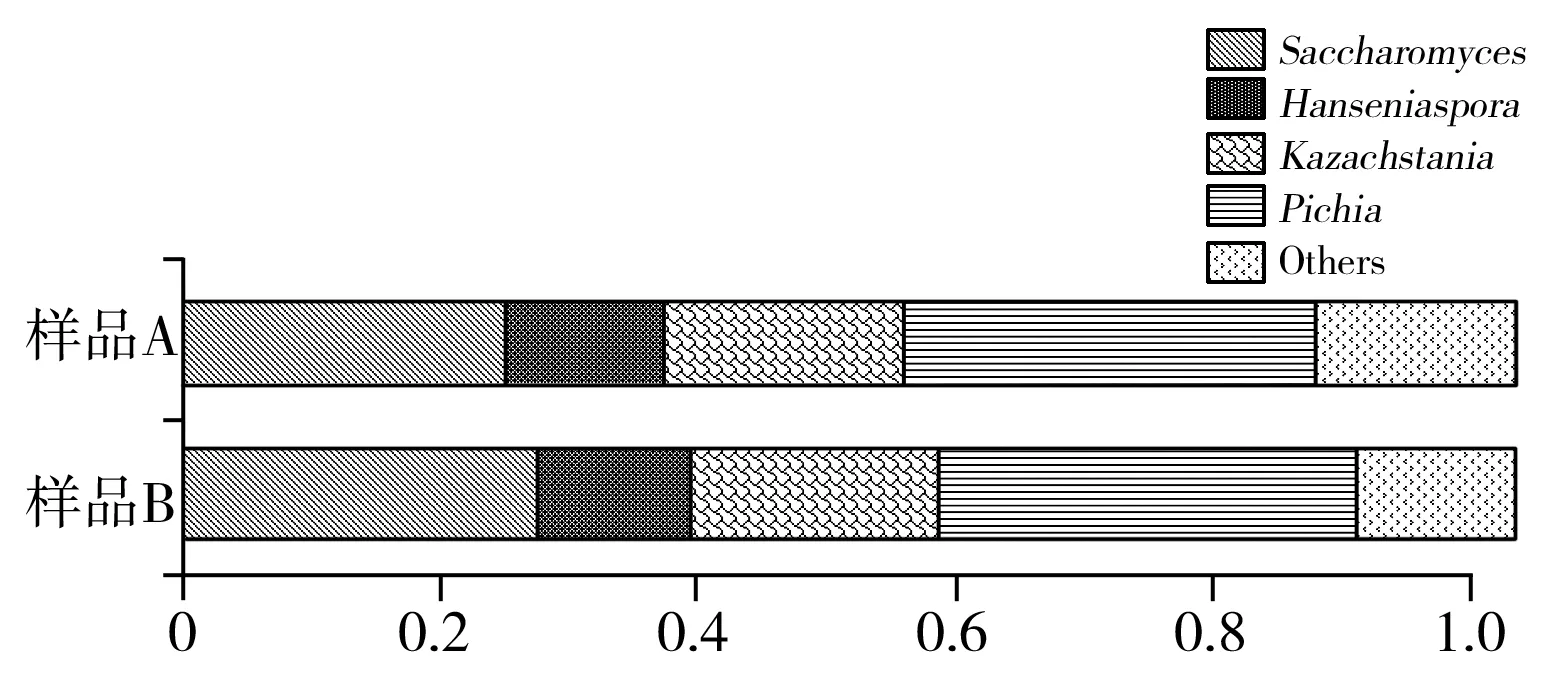
图4 两个样本发酵完成后真菌群落多样性的分析Fig.4 Analysis of fungal community diversity after the fermentation of two samples
2.6 红树莓发酵后分离获得的菌株鉴定结果
将红树莓中的真菌进行分离纯化,分离之后获得菌株,按照试剂盒的要求,提取菌株的DNA,获得DNA之后进行PCR扩增,将PCR产物在电泳的条件下进行质量检测,把质量好的PCR产物送至生工生物工程(上海)股份有限公司进行测序。完成测序后分析并确定分离菌株大致的属范围,从NCBI数据库中下载数据。
下载完成后的数据使用BioEdit进行对齐,将对齐好的数据上传至Cipres (https://www.phylo.org/portal2/login!input.action)平台上,进行系统发育树的建立,分离获得的菌株亲缘关系见图5。
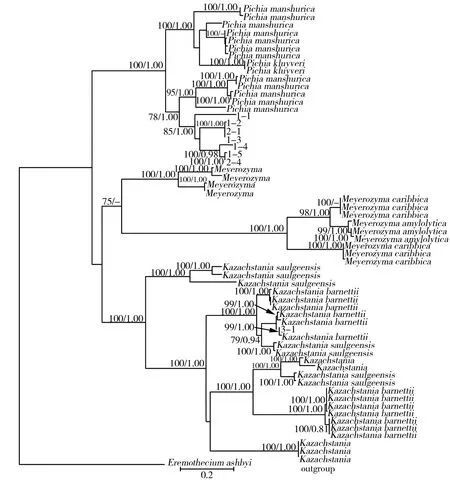
图5 基于ITS分析获得红树莓发酵液中微生物多样性的系统发育树Fig.5 Phylogenetic tree of microbial diversity in Rubus idaeus L. fermentation broth obtained based on ITS analysis注:每个分支上的数值表示支持率:最大简约树和贝叶斯树的支持率,最大简约树的支持率70%被展示,贝叶斯树的支持率大于90%被展示。
由图5可知,分离获得的真菌种类最多的为Pichia(毕赤酵母属),一共有7个菌株,其次为Kazachstania(哈萨克斯坦酵母属),一共有1个菌株。
3 小结
红树莓经过发酵后,能产生有利于身体健康的微生物代谢产物、酶和多糖等多种物质。但是红树莓发酵液的质量不稳定,发酵产品质量受原材料质量、产地和发酵工艺等多种因素的影响。本研究以红树莓作为原料,研究红树莓自然发酵过程中发酵液活性成分和微生物的多样性的改变。
——树莓

