Circ_VANGL1调控miR-493-5p/FXR1影响结直肠癌细胞增殖、迁移和侵袭
朱丽燕,占路娟,卢吉英
朱丽燕,占路娟,浙江衢化医院消化内科 浙江省衢州市 324000
卢吉英,金华市中心医院肛肠科 浙江省金华市 321099
0 引言
结直肠癌(colorectal cancer,CRC)是癌症相关死亡的主要原因之一,预测显示,到2030年CRC年新增病例将超过220万例,年死亡病将超过110万例.CRC患者预后不良与肿瘤转移有关.因此,明确CRC转移机制对于开发新的治疗策略、改善CRC患者预后意义重大.环状RNA(circular RNA,circRNA)是非编码RNA家族成员,具有闭环结构,缺少5’端和3’端.circRNA表达异常与CRC等多种癌症的发生和发展密切相关.资料显示,环状RNA VANGL1(circRNA VANGL1,circ_VANGL1)在膀胱癌中表达升高,其高表达与患者预后不良以及癌细胞异常增殖和侵袭有关.靶基因预测显示,微小RNA(microRNA,miR)-493-5p是circ_VANGL1的潜在靶点.miR-493-5p在CRC中表达水平降低,miR-493-5p的上调可降低CRC细胞恶性增殖和迁移能力.靶基因预测还显示,脆性X相关基因1(fragile X-related gene 1,FXR1)是miR-493-5p的潜在靶点.此前研究表明,FXR1高表达与CRC患者预后差相关,它可增强CRC细胞增殖、侵袭能力,发挥肿瘤启动子作用.基于上述文献,本研究以miR-493-5p、FXR1为切入点,探讨circ_VANGL1在CRC中的作用和分子机制.
1 材料和方法
1.1 材料
1.1.1 组织来源:CRC组织和对应癌旁组织为2017-06/2019-06在我院接受手术治疗的29例CRC患者的组织样本.其中,男性18例,女性11例,年龄45-75岁,中位年龄64岁.入组患者术前均未接受化疗或放疗,且将急性或慢性感染、其他原发恶性肿瘤患者排除在外.本研究经我院伦理委员会批准,并获得每位患者的知情同意.CRC组织样本在液氮中冷冻,并在-80 ℃保存备用.
1.1.2 细胞和试剂:CRC细胞Caco-2购自美国ATCC;SYBR Green PCR Master Mix试剂盒购自大连Takara公司;TaqMan miRNA逆转录试剂盒、M-MLV逆转录酶购自北京百奥莱博生物公司;放射免疫沉淀测定(radio-immunoprecipitation assay,RIPA)裂解液、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、化学发光检测试剂盒购自北京康为世纪生物公司;细胞计数试剂盒(cell counting kit-8,CCK-8)、磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多抗(ab9485)、FXR1兔多抗(ab155124)、山羊抗兔IgG抗体(ab205718)购自中国Abcam公司;Transwell室(24孔)购自美国Corning公司;重组荧光素酶报告载体购自广州锐博生物公司.
1.2 方法
1.2.1 RT-qPCR检测CRC组织circ_VANGL1和miR-493-5p表达:为检测circ_VANGL1表达用M-MLV逆转录酶合成cDNA.为检测miR-493-5p表达用TaqMan miRNA逆转录试剂盒合成cDNA.采用SYBR Green PCR Master Mix试剂盒进行RT-qPCR检测组织样品中circ_VANGL1和miR-493-5p表达.2法计算相对表达量.GAPDH为circ_VANGL1的内参,U6为miR-493-5p的内参.引物序列:circ_VANGL1上游5′-CTACAGCC TGGGACACCTGAG-3′,下游5′-CCTCTGCCGTCTTTATTG-3′;GAPDH上游5′-GGTATCGTGGAAGGACTCATGAC-3′,下游5′-ATGCCAGTGAGCTTCCCGT-3′;miR-493-5p上游5′-TCCTACGGAGAGGCTCAG-3′,下游5′-TCCTCGTAGTCCAACACG-3′;U6上游5′-CTCGCTTC GGCAGCACA-3,下游5′-AACGCTTCACGAATTTGCGT-3′.1.2.2 Western blot检测CRC组织FXR1蛋白表达:RIPA裂解液提取CRC组织和癌旁组织样本中总蛋白.取50 μg变性蛋白上样到10%凝胶上进行聚丙烯酰胺凝胶电泳,随后湿转到PVDF膜上.膜用5%脱脂牛奶封闭后,分别进行一抗反应、二抗反应.向PVDF膜滴加化学发光溶液显影.GAPDH作为内参,应用Image J软件分析FXR1蛋白相对表达量.
1.2.3 细胞培养和实验分组:Caco-2细胞在37 ℃、含95%空气、含5% CO的培养箱中,用含10%胎牛血清和1%青链霉素混合液的DMEM培养基培养.取1×10个第3代对数期Caco-2细胞接种24孔板.将脂质体Lip2000、待转染序列分别溶于50 μL无血清培养,孵育5 min后将Lip2000与待转染序列混匀,并在室温静置20 min.当细胞50%汇合时,弃去培养液,加入100 μL混合物和400 μL无血清培养基,孵育6 h更换为500 μL含10%胎牛血清DMEM培养基.收集转染48 h Caco-2细胞,RT-qPCR检测细胞中circ_VANGL1和/或miR-493-5p相对水平.根据转染序列不同,Caco-2细胞分为si-circ_VANGL1组、si-NC组、miR-NC组、miR-493-5p mimic组、si-circ_VANGL1+miR-493-5p Inhibitor组.1.2.4 CCK-8和克隆形成实验检测细胞增殖:CCK-8实验:每组取5×10个Caco-2细胞接种96孔板,培养48 h后弃去培养基,每孔加入90 μL DMEM培养基和10 μL CCK-8试剂,继续孵育2.5 h.酶标仪测定450 nm处吸光度(A)值.抑制率=(1-A/A)×100%.
克隆形成实验:每组取4×10个Caco-2细胞接种到6孔板,晃动平板使细胞均匀分散.培养箱孵育约2 w直到现细胞克隆.取出6孔板,弃去培养液.磷酸盐缓冲液小心漂洗2次,室温下用甲醇固定20 min,用0.1%结晶紫染色20 min.显微镜下拍照,计数大于50个细胞的克隆数.1.2.5 Transwell实验检测细胞迁移和侵袭:每组取1×10个Caco-2细胞悬浮在200 μL无血清培养基中,并接种到Transwell装置上室.Transwell装置下室加入500 μL含有20%胎牛血清的完全培养基作为Caco-2转移的化学诱导剂.将Transwell装置放入培养箱孵24 h.取出Transwell装置,用棉签将上室擦去上室非迁移细胞,用甲醇固定膜下表面迁移细胞,0.1%结晶紫染色后,置于倒置显微镜下拍照,随机选择5个视野计数染色数,以平均值表示细胞迁移数量.侵袭测定时先用基质胶包被Transwell装置上室膜,其与步骤同迁移检测.
1.2.6 双荧光素酶报告实验:将包含miR-493-5p
结合位点的circ_VANGL1或FXR1-3’-非编码区(3’-untranslated region,3’-UTR)野生型(wild type,WT)序列以及不含miR-493-5p结合位点的circ_VANGL1或FXR1-3’-UTR突变型(mutant type,MUT)序列克隆到双荧光素酶报告基因pmirGLO载体中,构建成重组载体WT-circ_VANGL1、WT-FXR1、MUT-circ_VANGL1、MUT-FXR1.将上述重组载体分别与miR-493-5p mimic或miR-NC共转染Caco-2细胞.转染48 h裂解细胞,双荧光素酶报告物检测系统评估Caco-2细胞相对荧光素酶活性.
用SPSS 20.0进行统计分析,数据以mean±SD表示.两组数据的差异采用独立样本检验分析,多组间的数据差异采用单因素方差分析和-检验.<0.05为差异有统计学意义.
2 结果
2.1 CRC组织中circ_ VANGL1、miR-493-5p和FXR1表达的检测 CRC组织中circ_ VANGL1相对水平、FXR1蛋白表达显著高于癌旁组织(<0.05),miR-493-5p相对水平显著低于癌旁组织(<0.05).见图1和表1.

表1 circ_ VANGL1、miR-493-5p和FXR1表达的检测
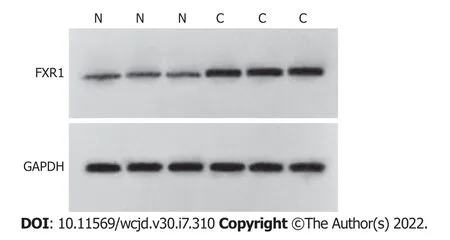
图1 bP<0.01与癌旁组织组相比.CRC组织:结直肠癌组织;FXR1:脆性X相关基因1.
2.2 沉默circ_VANGL1对Caco-2增殖、迁移、侵袭的影响 转染si-circ_VANGL1后Caco-2细胞circ_VANGL1相对水平显著低于si-NC组(<0.05),表明转染si-circ_VANGL1可抑制circ_VANGL1表达.与si-NC组比较,sicirc_VANGL1组Caco-2细胞miR-493-5p相对水平、抑制率显著升高(<0.05),FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著降低(<0.05).见图2和表2.
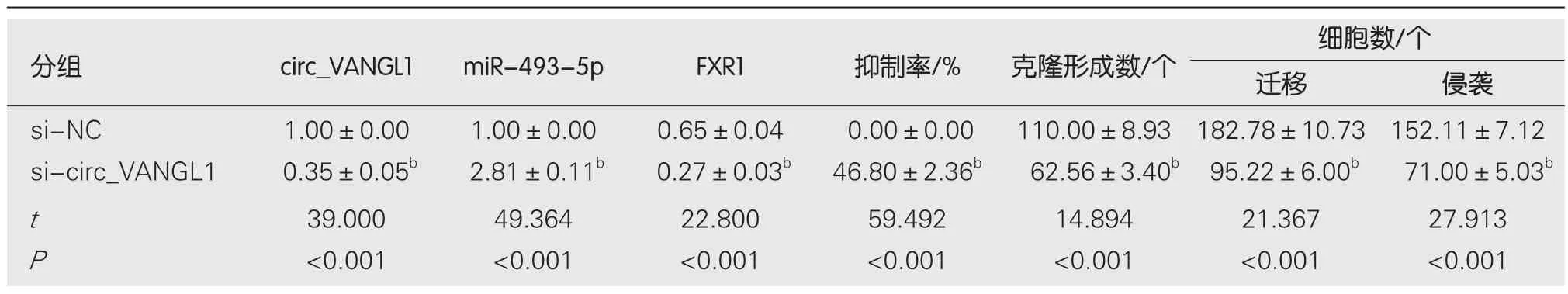
表2 沉默circ_VANGL1抑制Caco-2增殖、迁移、侵袭(mean±SD,n=9)
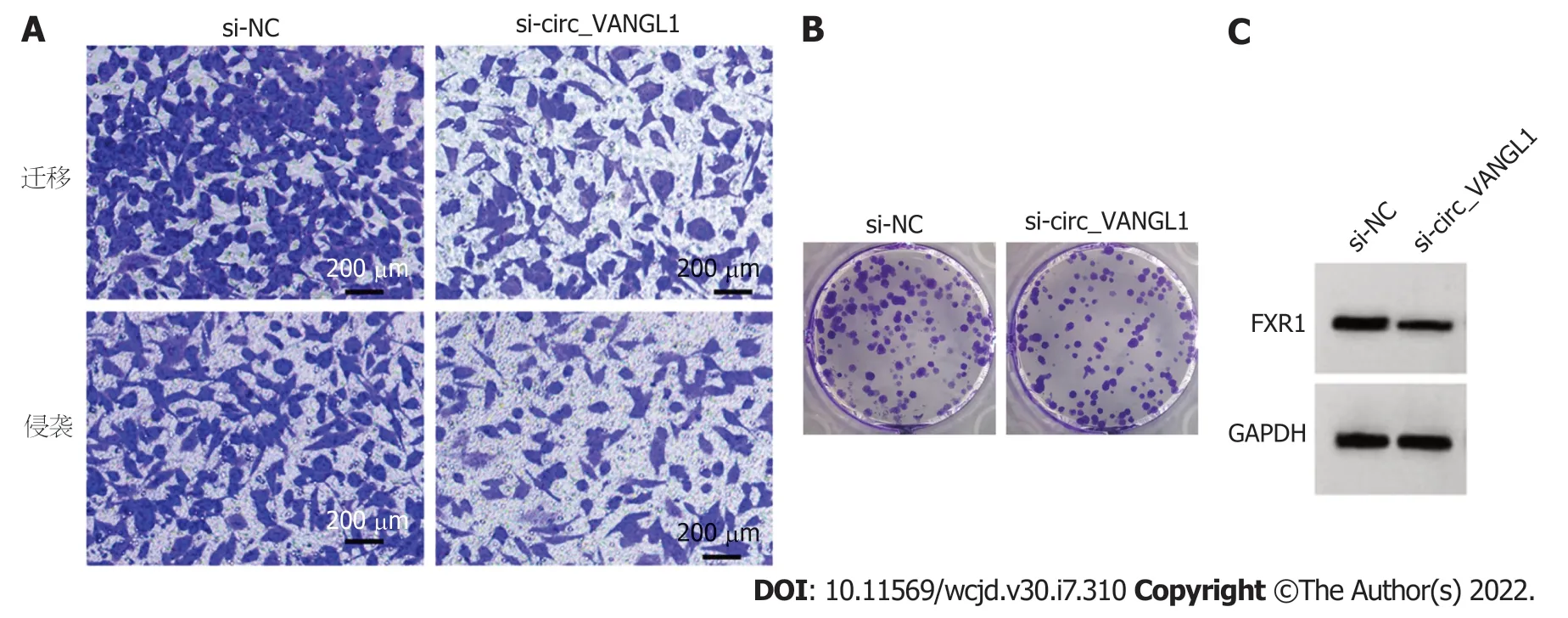
图2 沉默circ_VANGL1抑制Caco-2迁移、侵袭、克隆及细胞FXR1蛋白的表达.A:si-circ_VANGL1组 vs si-NC组Caco-2细胞迁移、侵袭数减少;B:si-circ_VANGL1组 vs si-NC组Caco-2细胞克隆数减少;C:si-circ_VANGL1组 vs si-NC组Caco-2细胞总FXR1蛋白表达降低.FXR1:脆性X相关基因1.
2.3 circ_VANGL1、miR-493-5p靶向关系 Starbase预测到circ_VANGL1和miR-493-5p存在互补序列,见图3.与miR-NC和WT-circ_VANGL1共转染比较,miR-493-5p mimic和WT-circ_VANGL1共转染后细胞相对荧光素酶活性显著降低(<0.05),与miR-NC和MUT-circ_VANGL1共转染比较,miR-493-5p mimic和MUT-circ_VANGL1共转染后细胞相对荧光素酶活性差异不显著,见表3.

图3 circ_VANGL1和miR-493-5p的互补序列.WT-VANGL1:野生型VANGL1;MUT-VANGL1:突变型VANGL1.

表3 双荧光素酶报告实验(mean±SD,n=9)
2.4 miR-493-5p对Caco-2增殖、迁移、侵袭的影响 转染miR-493-5p mimic后Caco-2细胞miR-493-5p相对水平显著高于miR-NC组(<0.05),表明转染miR-493-5p mimic可促进miR-493-5p表达.与miR-NC组比较,miR-493-5p mimic组Caco-2细胞抑制率显著升高(<0.05),FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著降低(<0.05).见图4和表4.
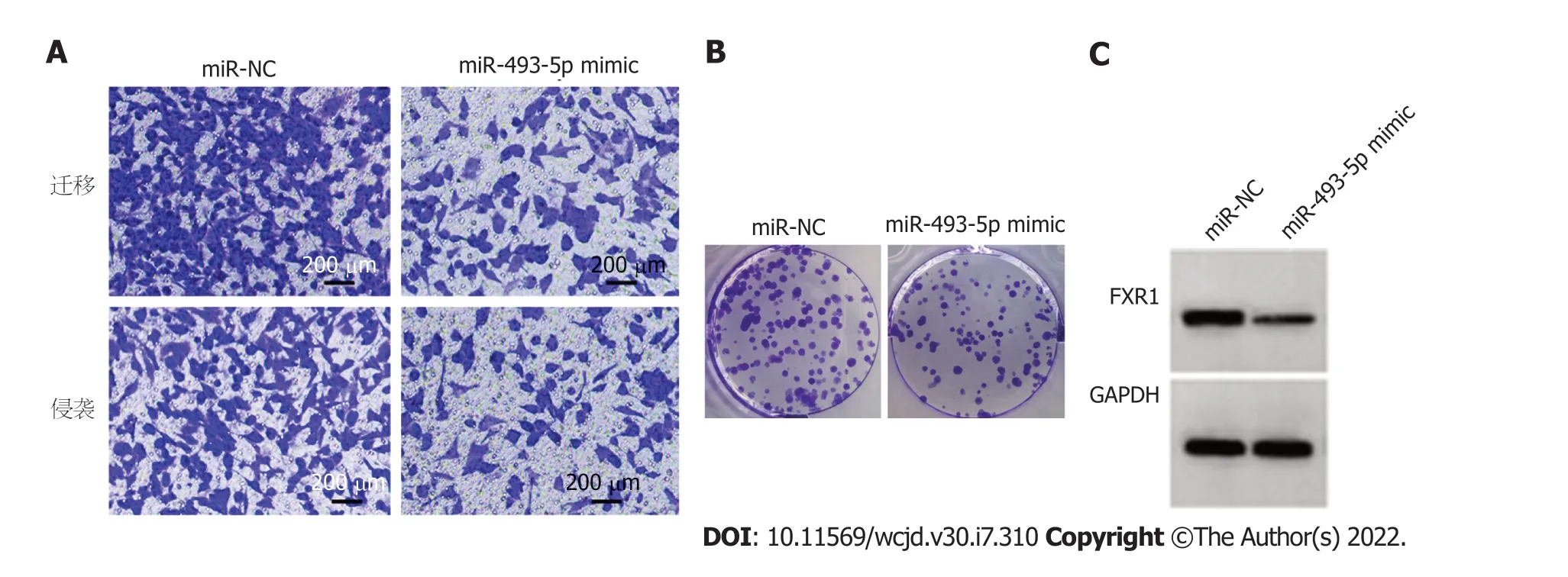
图4 miR-493-5p抑制Caco-2迁移、侵袭、克隆及细胞中FXR1蛋白的表达.A:miR-493-5p mimic组 vs miR-NC组Caco-2细胞迁移、侵袭数减少;B:miR-493-5p mimic组 vs miR-NC组Caco-2细胞克隆数减少;C:miR-493-5p mimic组 vs miR-NC组Caco-2细胞中FXR1蛋白表达减少.FXR1:脆性X相关基因1.
表4 miR-493-5p抑制Caco-2增殖、迁移、侵袭(mean±SD,n=9)
2.5 miR-493-5p和FXR1靶向关系 Targetscan预测到miR-493-5p和FXR1-3’-UTR存在互补序列,见图5.与miR-NC和WT-FXR1共转染比较,miR-493-5p mimic和WT-FXR1共转染后细胞相对荧光素酶活性显著降低(<0.05),与miR-NC和MUT-FXR1共转染比较,miR-493-5p mimic和MUT-circ_FXR1共转染后细胞相对荧光素酶活性差异不显著,见表5.

图5 miR-493-5p和FXR1的互补序列.FXR1:脆性X相关基因1;WT-FXR1:野生型FXR1;MUT-FXR1:突变型FXR1.

表5 双荧光素酶报告实验(mean±SD,n=9)
2.6 抑制miR-493-5p对沉默circ_VANGL1处理的Caco-2增殖、迁移、侵袭的影响 与si-circ_VANGL1组比较,si-circ_VANGL1+miR-493-5p Inhibitor组Caco-2细胞miR-493-5p相对水平、抑制率显著降低,FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著升高(<0.05),见图6和表6.
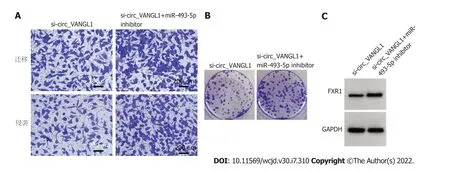
图6 抑制miR-493-5p可逆转沉默circ_VANGL1对Caco-2迁移、侵袭、克隆及细胞中FXR1蛋白表达的抑制作用.A:si-circ_VANGL1+miR-493-5p Inhibitor组 vs si-circ_VANGL1组Caco-2细胞迁移、侵袭数增加;B:si-circ_VANGL1+miR-493-5p Inhibitor组 vs si-circ_VANGL1组Caco-2细胞克隆数增加;C:si-circ_VANGL1+miR-493-5p Inhibitor组 vs si-circ_VANGL1组Caco-2细胞中FXR1蛋白表达增高;FXR1:脆性X相关基因1.
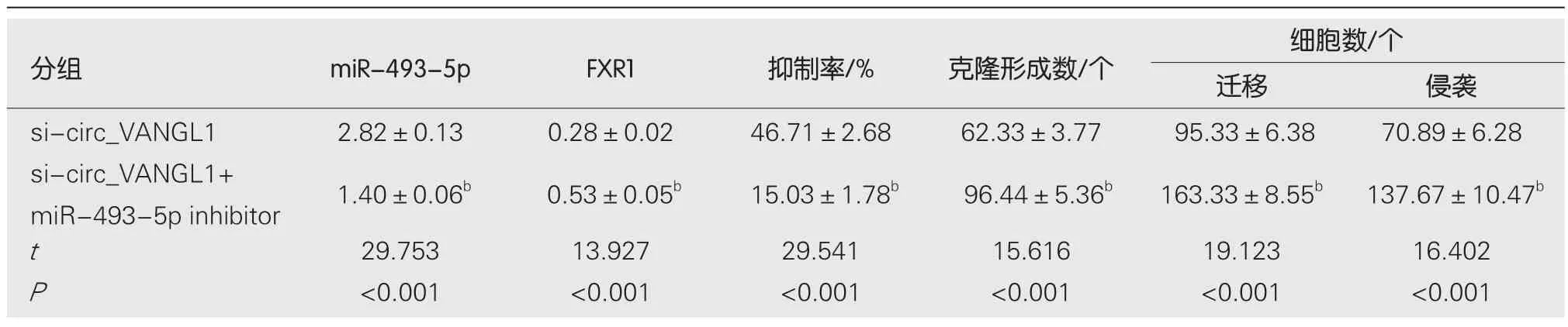
表6 抑制miR-493-5p可逆转沉默circ_VANGL1对Caco-2增殖、迁移、侵袭的抑制作用(mean±SD,n=9)
3 讨论
越来越多的证据表明,circRNA在CRC组织、细胞系和血浆中异常表达,与结直肠癌的临床恶性特征密切相关,如hsa_circ_0005273,circRNA_0000392.然而CRC中circ_VANGL1的表达及潜在功能仍然未知.circ_VANGL1在人非小细胞肺癌(non-small cell lung cancer,NSCLC)中表达增加,其高表达与NSCLC患者总生存期缩短、较差的临床病理特征相关,且circ_VANGL1通过与miR-195相互作用促进NSCLC细胞增殖和其迁移,加速NSCLC进展.circ_VANGL1在膀胱癌中表达上调,circ_VANGL1沉默通过调节miR-1184/胰岛素样生长因子结合蛋白2分子轴抑制膀胱癌细胞恶性生物学行为.胃癌中circ_VANGL1表达增加,慢病毒载体介导的circ_VANGL1下调可激活线粒体凋亡通路,诱导胃癌细胞凋亡.本研究首次揭示了CRC组织中circ_VANGL1相对水平升高,提示circ_VANGL1可能在CRC进展中发挥促癌作用.功能实验显示,沉默circ_VANGL1表达可降低Caco-2细胞增殖、克隆形成、迁移和侵袭能力,表明circ_VANGL1在CRC细胞增殖和转移中具有致癌作用.
目前研究认为circ_VANGL1可作为miRNA“海绵”抑制miRNA对其靶mRNA表达的调节作用,进而参与调控细胞生物学过程和疾病进展,例如circ_VANGL1通过靶向miR-217上调核心结合因子α1表达能够调控成骨分化和骨质疏松进展.本研究证实circ_VANGL1可靶向负调控miR-493-5p.研究表明miR-493-5p靶向DKK2可抑制CRC细胞有氧糖酵解和血管生成.miR-493-5p通过靶向FUT4能够减弱人乳腺癌的侵袭性和致瘤性.长链非编码RNA NR2F1-AS1充当miR-493-5p的“分子海绵”上调整合素β1的表达促进NSCLC发生和转移.本研究发现CRC组织中miR-493-5p表达降低,转染miR-493-5p mimic过表达miR-493-5p可降低Caco-2细胞增殖、克隆形成、迁移和侵袭能力,这与Cui等报道吻合.FXR1是脊椎动物中高度保守的胞浆RNA结合蛋白,其肿瘤发生中作用已被研究.FXR1在胶质瘤中表达增加,下调FXR1可抑制胶质瘤进展.前列腺癌细胞中FXR1表达缺失与细胞增殖、迁移、侵袭能力的减弱有关.FXR1通过与circ_0000079相互作用降低NSCLC细胞的侵袭性和耐药性.本研究发现CRC组织中FXR1蛋白表达增加,并证实FXR1为miR-493-5p的直接靶点.由于沉默circ_VANGL1表达、过表达miR-493-5p均可下调FXR1蛋白表达、抑制CRC细胞恶性生物学行为,本研究推测在CRC中存在circ_VANGL1/miR-493-5p/FXR1调控途径.为证实沉默circ_VANGL1在CRC中的抗癌作用依赖于上调miR-493-5p/FXR1轴,本研究将si-circ_VANGL1和miR-493-5p Inhibitor共转染Caco-2细胞,结果显示,抑制miR-493-5p表达显著减弱沉默circ_VANGL1对FXR1蛋白表达的抑制作用以及对Caco-2细胞的抗增殖、抗迁移和抗侵袭作用,这表明circ_VANGL1至少通过调控miR-493-5p/FXR1轴在CRC中发挥作用.
4 结论
总之,CRC组织中circ_VANGL1和FXR1蛋白表达上调,miR-493-5p表达下调.沉默circ_VANGL1通过调控miR-493-5p/FXR1轴抑制CRC细胞增殖、迁移和侵袭.因此,靶向抑制circ_VANGL1/miR-493-5p/FXR1途径有可能成为CRC治疗的新方向.
结直肠癌(colorectal cancer,CRC)已逐渐成为全球人类健康和生命最致命的威胁之一.尽管有报道表明circRNA与CRC的进展和转移有关,但在这些过程中,circRNA的生物学功能仍然很大程度上未知,包括circ_VANGL1.
探讨circ_VANGL1在CRC中的表达情况,以及是否通过调控miR-493-5p/FXR1轴影响CRC细胞增殖、迁移和侵袭.这对于明确CRC转移机制对于开发新的治疗策略、改善CRC患者预后意义重大.
确定circ_VANGL1在CRC中的表达,并阐明circ_VANGL1是否通过调控miR-493-5p/FXR1轴影响CRC细胞增殖、迁移和侵袭.
采用RT-qPCR检测CRC组织中circ_VANGL1表达,采用细胞计数试剂盒(cell counting kit-8,CCK-8)、克隆形成实验、Transwell实验评估沉默circ_VANGL1对Caco-2增殖能力、迁移和侵袭能力的影响.双荧光素酶报告实验检测miR-493-5p和circ_VANGL1、FXR1之间的靶向关系.
研究达到实验目标,本研究首次发现CRC组织中circ_VANGL1表达增强,而沉默circ_VANGL1表达使CRC Caco-2细胞的增殖、克隆形成、迁移和侵袭能力被抑制.此外,circ_VANGL1通过充当miR-493-5p的分子海绵,调控Caco-2细胞中FXR1的表达.
circ_VANGL1通过靶向miR-493-5p调节CRC细胞中FXR1的表达,来促进细胞增殖和转移,作为致癌circRNA促进CRC进展.
因此,靶向抑制circ_VANGL1/miR-493-5p/FXR1途径有可能成为CRC治疗的新方向.未来将进一步利用动物模型探讨circ_VANGL1/miR-493-5p/FXR1在CRC中的功能.

